對大腸桿菌異源表達乳酸片球菌素包涵體復性方法的研究
檀茜倩,韓 燁,肖華志,周志江
(天津大學化工學院食品科學與工程系,食品生物技術實驗室,天津 300072)
?
對大腸桿菌異源表達乳酸片球菌素包涵體復性方法的研究
檀茜倩,韓燁,肖華志,周志江*
(天津大學化工學院食品科學與工程系,食品生物技術實驗室,天津 300072)
本研究對E.coliBL21(DE3)基因工程菌高效表達的乳酸片球菌素融合蛋白包涵體進行了提取和變性溶解,并采用稀釋復性,反稀釋復性,透析復性,CTAB輔助復性和CTAB和β-CD結合輔助復性五種方法對乳酸片球菌素融合蛋白包涵體的變性溶液進行了復性的研究。結果表明CTAB和β-CD結合輔助復性的復性方法優于其它的復性方法,可以實現以較高濃度的包涵體變性蛋白溶液,較小體積的復性液來獲得較高濃度的復性產物和達到相對穩定的復性率。
包涵體,復性,片球菌素
采用基因工程方法構建大腸桿菌重組表達系統已經成為現代生物技術的一種常用手段。但是由于大腸桿菌表達系統的高效表達,很容易使被表達的蛋白在細胞內形成水不溶性包涵體。包涵體(Inclusion body)是指在某些生長條件下,大腸桿菌積累某種特殊的生物大分子并且致密地集聚在細胞內,或被膜包裹或形成無膜裸露的水不溶性結構,一般含有50%以上的重組蛋白,其余為核糖體元件、RNA聚合酶、外膜蛋白OmpC、OmpF和OmpA等,環狀或缺口的質粒DNA,以及脂體、脂多糖等[1-2]。
大腸桿菌內積聚的包涵體一般通過菌體破碎,配合離心和一定程度的洗滌從菌體中初步分離出來[3-4]。為了獲得有活性的蛋白,通常需要對包涵體進行復性。包涵體的復性方法很多[5],國內外文獻針對包涵體的復性有諸多報道。Wang[6-7]等利用CTAB即十六烷基三甲基溴化胺和β-CD即β環糊精作為分子伴侶輔助重組溶菌酶復性獲得了比傳統的稀釋復性更好的效果。Lu等人[8]提出的利用PNIPAAm聚N-異丙基丙烯酰胺作為分子伴侶輔助復性,此外還有利用離子交換色譜[9]、分子排阻色譜[10-11]等對變性蛋白進行復性。雖然如此,包涵體蛋白復性仍是對大腸桿菌表達系統表達蛋白純化的瓶頸因素,且對不同包涵體蛋白的復性條件也有所不同。
乳酸片球菌素是由乳酸菌產生的一類具有抑菌功能的細菌素,對革蘭氏陽性菌有抑制作用[12]。野生型乳酸片球菌產量較低[13],利用大腸桿菌表達系統可以實現乳酸片球菌素的異源表達并獲得乳酸片球菌素融合蛋白包涵體。為了獲得有活性的片球菌素,本實驗分別采用稀釋復性,透析復性,CTAB輔助復性,CTAB和β-CD輔助復性對乳酸片球菌素融合蛋白包涵體進行了復性,并對這幾種復性方法的復性率進行了比較分析,為乳酸片球菌素融合蛋白包涵體復性方法的選擇提供了依據。
1 材料與方法
1.1材料與儀器
乳酸片球菌素融合蛋白包涵體由含有pedA基因的E.coliBL21(DE3)基因工程菌產生,單核細胞增多癥李氏桿菌CVCC1595中國獸醫藥品監察所。E.coliBL21(DE3)基因工程菌培養采用LB培養基(amp+),單核細胞增多癥李氏桿菌的培養采用LB培養基。基因工程菌生長培養基為MDG培養基(amp+),自動誘導培養基為ZYM-5052(amp+)培養基,各培養基添加的amp+的終濃度均為50 μg/mL。
包涵體溶解液0.1 mol/LTris·HCl,8 mol/L 尿素,30 mmol/L DTT,1 mmol/L EDTA;包涵體復性液100 mmol/L Tris·HCl,100 mmol/L NaCl,0.4 mmol/L/4 mmol/L GSSG/GSH,1 mmol/L EDTA。
SDS-PAGE電泳、Tricine-SDS-PAGE電泳所用試劑Sigma;氨芐青霉素由genview分裝,尿素、氧化型谷胱甘肽、還原型谷胱甘肽、咪唑北京普博欣公司;重組腸激酶(rEK-B)廣州中大南海生物技術有限公司;其他試劑天津大學科威公司均為分析純。
DYCZ-24D雙垂直電泳槽北京市六一儀器廠;GIS-2009紫外凝膠成像儀Tanon公司;JY88-IIN 超聲波細胞破碎儀寧波新芝;UV-1102 紫外可見分光光度計上海天美;D2004W電動攪拌器上海梅穎浦儀器制造有限公司。
1.2實驗方法
1.2.1包涵體的制備采用自動誘導方法誘導大腸桿菌表達系統表達片球菌素融合蛋白,參考Studier方法并做適當改變[14]。挑取甘油凍存E.coliBL21(DE3)基因工程菌于含有amp+的LB平板上劃線,過夜培養。次日挑取平板上茁壯單菌落接入5 mL含amp+的MDG培養基中,37 ℃,170 r/min,過夜培養。次日將菌液按1∶500比例接入含適量amp+的ZYM-5052培養基中在37 ℃,將搖菌速度提升到190 r/min過夜培養,待菌體變渾濁轉移入20 ℃搖床在同樣轉速下繼續培養,每間隔1 h取樣測定菌液的OD600值,當OD600值在1~2 h不發生變化時收集菌液,將菌液離心,棄去上清液,收集菌體沉淀,重懸于PBS緩沖液(pH7.4)中,采用溶菌酶處理,溶菌酶終濃度為2 mg/mL,在20、40、60、80、100、120 min分別取樣500 μL稀釋10倍后使用紫外-可見分光光度計測量其OD280、OD260和OD600值后兩者可以反映內容物的溶出情況。將經溶菌酶處理的菌體溶液在超聲破碎儀上,于200 W,超聲開3 s,關3 s的條件下破碎20 min。在4 ℃,8000 r/min離心20 min。棄去上清液,保留沉淀。
1.2.2包涵體的洗滌和溶解包涵體的洗滌和溶解參考Singh的方法[3]。包涵體用PBS緩沖液(pH=7.4)洗滌兩次,用2 mol/L的尿素溶液洗滌一次,用0.05% Triton100溶液洗滌一次。每次洗滌后保留樣品進行SDS-PAGE凝膠電泳分析以評價洗滌的效果。采用包涵體溶解液溶解洗滌后的包涵體蛋白,將包涵體蛋白沉淀重新懸于溶解液中,在4 ℃下,采用磁力攪拌器進行攪拌12 h后,將溶解液離心,取上清液,采用考馬斯亮藍法測定其蛋白濃度,以牛血清蛋白為標準品。
1.2.3包涵體的復性
1.2.3.1稀釋復性直接稀釋復性:將最終蛋白濃度分別為0.0472、0.0944、0.1415、0.1887 mg/mL的包涵體溶解后的變性溶液5 mL分別逐滴加入25 mL的復性液中,并不斷攪拌,在4 ℃的條件下復性12 h。反稀釋復性:將25 mL復性液逐漸加入到含有5 mL最終蛋白濃度分別0.0472、0.0944、0.1415、0.1887 mg/mL的包涵體溶解后的變性溶液中,并不斷攪拌,在4 ℃的條件下復性12 h。
1.2.3.2透析復性將蛋白濃度為0.2359 mg/mL的包涵體變性蛋白溶液5 mL裝于截留量為8000 ku的透析膜中,在50 mL復性液中于4 ℃下透析24 h復性,中間更換多次復性液。
1.2.3.3CTAB輔助復性參考Wang等方法[6-7]。將CTAB終濃度為10、20、30、40 mmol/L的復性液各25 mL,分別各自逐滴加入5 mL蛋白濃度為0.2539 mg/mL的包涵體變性蛋白溶液中,加入時不斷攪拌,于4 ℃復性12 h。
1.2.3.4CTAB和β-CD結合輔助復性參考Wang等方法[6-7]。將蛋白濃度為0.2359 mg/mL的包涵體變性蛋白溶液5 mL逐滴加入10 mL含有10 mmol/L CTAB的復性液中,加入時不斷攪拌,在室溫復性1 h。逐滴加入β-CD溶液使溶液中的β-CD的濃度值達到15 mmol/L,在室溫并磁力攪拌條件下復性30 min,后于4 ℃磁力攪拌的條件下復性12 h。
1.2.4復性后重組蛋白的純化復性后重組蛋白在緩沖液中做透析處理。采用Ni-IDA柱對重組蛋白進行純化。按照產品使用手冊,純水洗柱,并用緩沖液平衡10個柱體積,蛋白溶液樣品經0.45 μm的濾膜過濾后上樣,保持流速為1 mL/min,用緩沖液平衡10個柱體積,使用含50 mmol/L咪唑的平衡溶液進行第一次洗脫,保持流速為1 mL/min,使用含有500 mmol/L咪唑的平衡液進行第二次洗脫,保持流速為1 mL/min。此時收集目的蛋白。將目的蛋白透析后采用冷凍干燥法縮小樣品體積。將樣品重新溶于腸激酶緩沖液中(20 mmol/L Tris·HCl,100 mmol/L NaCl,pH=7.6),測定樣品的蛋白濃度,加入適量的腸激酶酶切。采用考馬斯亮藍方法測定蛋白濃度。產物采用Tricine-SDS-PAGE電泳分析。
1.2.5復性后蛋白活性分析基因工程片球菌素的活性測定采用牛津杯法,指示菌為單核細胞增多癥李氏桿菌。對野生型乳酸菌產生的片球菌素使用Yang的方法[15]進行粗提,采用考馬斯亮藍的方法測定粗提液的濃度。將粗提液按如下比例:不稀釋,1∶2、1∶4、1∶6、1∶7、1∶8、1∶9、1∶10、1∶11稀釋后,進行牛津杯抑菌實驗,判斷乳酸片球菌素的濃度與抑菌圈與牛津杯直徑之差間的趨勢關系,做出標準曲線。根據復性后的片球菌素的抑菌圈直徑與牛津杯的直徑差在標準曲線上查出復性后的片球菌素的蛋白濃度。
1.2.6數據處理實驗中每次實驗重復三次,采用origin軟件進行作圖和數據分析。
2 結果與討論
2.1包涵體的制備和洗滌溶解
菌體細胞的破碎效果的好壞與細胞內容物釋放的多少有直接關系。大腸桿菌在600 nm處有最大的吸光度值,而在280 nm和260 nm下,蛋白質的色氨酸、酪氨酸和苯丙氨酸以及核酸中的大量堿基在紫外條件下有最大量的吸收。圖1為在室溫下溶菌酶處理后菌體細胞的酶解情況。經溶菌酶處理后的細胞胞壁逐漸溶解,細胞內容物大量釋放。對此菌液進行超聲破碎處理后,菌液的OD600值下降到0.0188,表明此時菌液中的菌體細胞已經被大量降解,包涵體蛋白被很好釋放。使用溶菌酶加超聲破碎處理細胞,可以縮短細胞的破碎時間,改善細胞的破碎效果,缺點是引入了溶菌酶這種雜蛋白。對破碎后的包涵體的洗滌不僅可以除去菌體細胞中除目的包涵體蛋白以外的蛋白,同時還可以較大程度的除去溶菌酶蛋白,為后續的純化提供方便。

圖1 室溫下的酶解過程Fig.1 The process of enzymolysis in room temperature
圖2為包涵體蛋白經多次洗滌后電泳圖譜。21 ku處為乳酸片球菌素融合蛋白包涵體蛋白條帶,14 ku處為溶菌酶條帶。泳道1,2顯示菌體中許多雜蛋白被除去,但溶菌酶蛋白仍然存在。泳道3顯示溶菌酶蛋白大部分被除去,溶液中的其他雜蛋白進一步被除去。泳道4基本呈現單一包涵體條帶,說明包涵體蛋白的洗滌比較徹底,純度較高。
包涵體蛋白在本實驗所采用的溶解液中完全溶解,經離心后只有較少的沉淀產生。
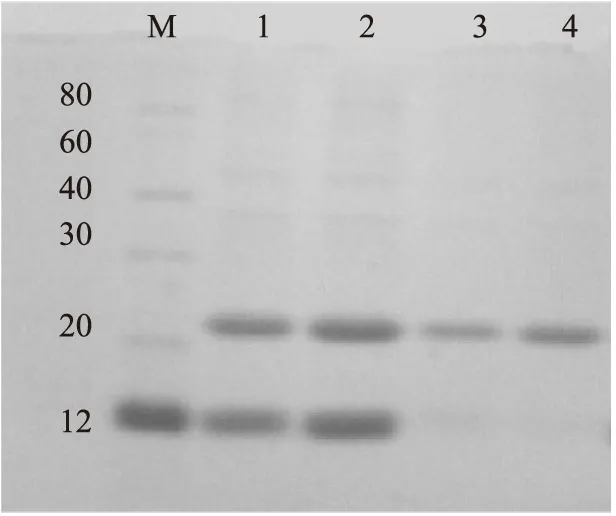
圖2 包涵體蛋白洗滌后電泳圖Fig.2 SDS-PAGE of inclusion body after washing注:M為標準蛋白分子量;泳道1,2為經PBS洗滌以后的蛋白電泳;泳道3為經2 mol/L尿素洗滌后的包涵體蛋白;泳道4為經1% Triton洗滌后的蛋白電泳圖。
2.2包涵體的復性
包涵體的復性是指經變性的包涵體蛋白重新折疊成為正確的形式的過程,這個過程包含有復雜的動力學反應,包涵體蛋白的復性可能需要幾秒種也可能需要幾天的時間,這取決于不同種類的蛋白的復性的難易的程度[16]。稀釋復性的方法是最簡單也是在工業中經常所使用的方法,將包涵體的變性溶液逐漸加入復性液中,蛋白濃度的降低,可以使變性蛋白在復性液中逐漸重新折疊為有活性的結構形式。其他方法都是針對解決稀釋復性后復性液體積過大的缺點產生的。包涵體復性的復性液多為氧化型谷胱甘肽/還原性谷胱甘肽體系溶液。在復性的過程中添加一些多元醇類和其他分子伴侶是為了防止蛋白聚集[17]。
對經過不同的復性方法的復性后產物經過N柱純化并腸激酶酶切后的Tricine-SDS-PAGE電泳的分析圖如圖3所示,可以看出,經過Ni柱純化后的片球菌素基因工程菌的純度較高,且腸激酶酶切的程度也比較完全,可以清楚的看到兩條條帶,雜蛋白含量極低,在電泳圖譜上不可見。產生兩條條帶分別為在16 ku左右的硫氧還蛋白條帶,和在5 ku左右的乳酸片球菌素條帶,與預期的條帶相符。
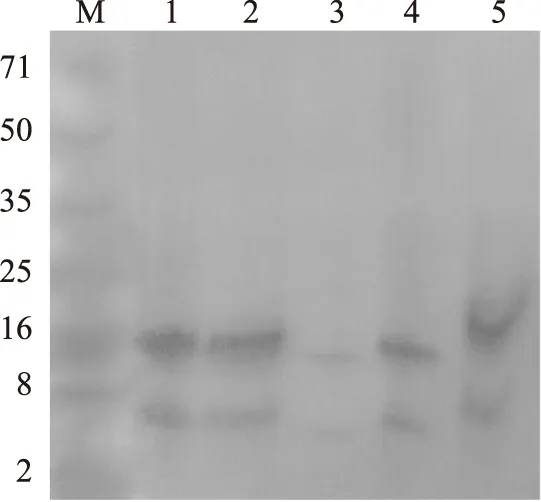
圖3 經不同復性方法并經酶切的復性后蛋白電泳圖Fig.3 SDS-PAGE of the enzyme cleaved refolding protein under different refolding methods注:M為標準蛋白分子量,泳道1~5分別為稀釋復性,反稀釋復性,透析復性,CTAB輔助復性,CTAB和β-CD結合輔助復性。
為了進一步評定復性效果,對不同復性方法復性后并經腸激酶酶切后的產物以單核細胞增多癥李氏桿菌作為指示菌進行抑菌實驗,其抑菌效果如圖4所示。實驗表明未經腸激酶酶切連有硫氧還蛋白的復性后基因工程產物卻不具備抑菌活性,其它幾種復性方法產生的片球菌素的抑菌圈直徑見表1所示。CTAB和β-CD結合輔助復性的效果最優,稀釋復性,反稀釋復性的復性效果次之,而透析復性的復性效果最差,基本無法觀測到明顯的抑菌圈。CTAB的濃度對復性效果影響不大,本文采用的CTAB濃度為10 mmol/L,這個濃度的CTAB對單核細胞增多癥李氏桿菌沒有抑菌作用,充分避免了CTAB對抑菌實驗的干擾。
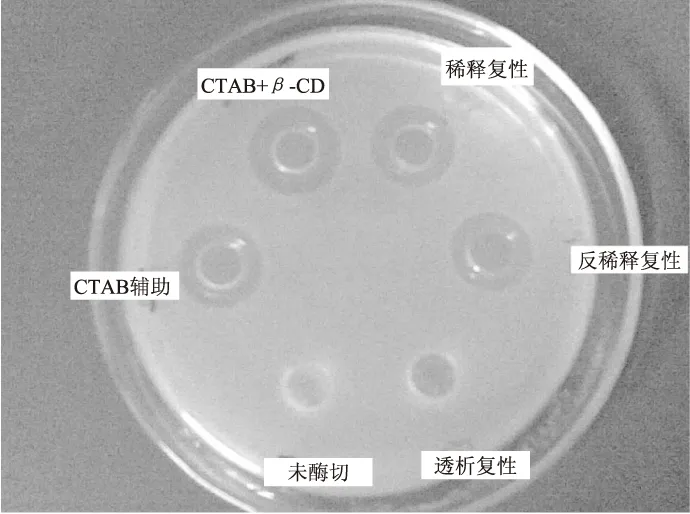
圖4 不同復性方法的酶切后復性產物的抑菌效果Fig.4 The inhibition effect of gene engineering product after enzyme cleavage

復性方法抑菌圈抑菌圈直徑(mm)稀釋復性+15.02±0.12反稀釋復性+14.00±0.04透析復性--CTAB輔助復性+14.36±0.09CTAB和β-CD結合輔助復性+16.42±0.11
注:+有可見抑菌圈,-無可見抑菌圈。
2.3包涵體復性率分析
根據乳酸片球菌素的濃度和抑菌圈與牛津杯的直徑差值之間存在線性的趨勢關系作出乳酸片球菌素濃度和抑菌圈與牛津杯直徑差的標準曲線,如圖5所示,根據此標準曲線并結合經過酶切后的基因工程片球菌素對單核細胞增多癥李氏桿菌產生的抑菌圈的大小,本研究確定了復性并酶切后片球菌素基因工程產物的濃度如圖6所示。
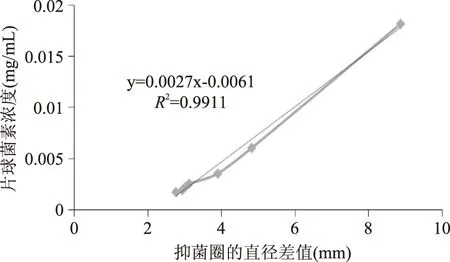
圖5 抑菌圈直徑與片球菌素蛋白濃度的關系Fig.5 The relationship between the diameter of inhibition circle and the concentration of pediocin
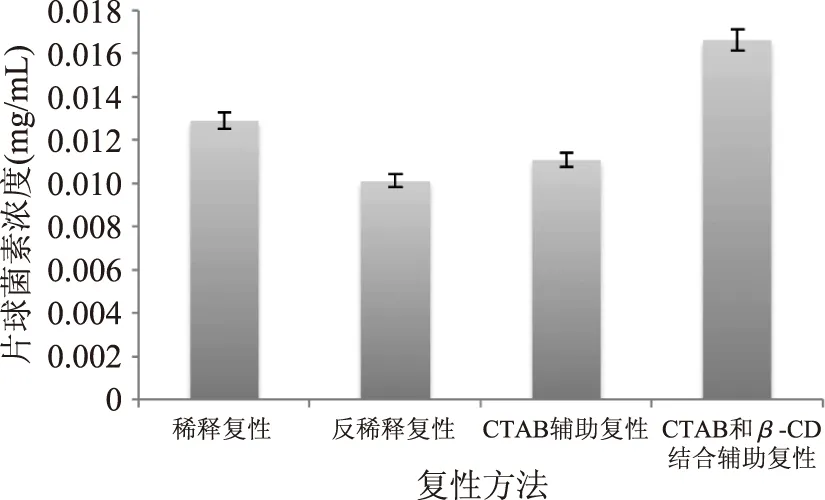
圖6 不同復性方法得到的片球菌素的濃度Fig.6 The concentration of pediocin under different refolding methods
本研究定義復性率的計算公式為:復性率(%)=溶液中復性后有活性的基因工程產物的濃度/溶液的總蛋白濃度。故采用不同復性方法復性基因工程產物后,各自的復性率用在圖7表示出來。因透析復性因復性率極低不在圖中表示。采用稀釋復性方法所包涵體蛋白的復性率最高,采用CTAB輔助復性的復性率最低。但是稀釋復性加入的變性蛋白濃度很低,且復性液體積較大,為復性后蛋白的純化帶來了困難。CTAB輔助復性和CTAB與β-CD結合輔助復性則允許加入初始蛋白濃度較大的變性蛋白溶液,優于稀釋復性。CTAB與β-CD結合輔助復性的復性率為CTAB復性的2倍左右。

圖7 不同復性方法的復性率Fig.7 The refolding rate of different refolding method
3 結論
本研究對由含有pedA基因的大腸桿菌表達系統表達的片球菌素的包涵體蛋白的制備,變性溶解和不同復性方法進行了比較研究。通過研究發現稀釋復性的復性率高于其他復性方法,但是產生的復性產物的濃度很低,復性液體積大不利于后續純化;CTAB與β-CD結合輔助復性可以以較高濃度的包涵體變性蛋白溶液,較小體積的復性液來獲得較高濃度的復性產物和達到相對穩定的復性率,可以用于對乳酸片球菌素包涵體蛋白的大量復性,以便于后續的分離純化。
[1]Singh A,Upadhyay V,Upadhyay A K,et al. Protein recovery from inclusion bodies of Escherichia coli using mild solubilization process[J]. Microbial cell factories,2015,14(1):1-10.
[2]Khan M A,Sadaf S,Sajjad M,et al. Production enhancement and refolding of caprine growth hormone expressed in Escherichia coli[J]. Protein expression and purification,2009,68(1):85-89.
[3]Singh S M,Panda A K. Solubilization and refolding of bacterial inclusion body proteins[J]. Journal of bioscience and bioengineering,2005,99(4):303-310.
[4]Singh S M,Sharma A,Upadhyay A K,et al. Solubilization of inclusion body proteins using n-propanol and its refolding into bioactive form[J]. Protein expression and purification,2012,81(1):75-82.
[5]Yamaguchi H,Miyazaki M. Refolding techniques for recovering biologically active recombinant proteins from inclusion bodies[J]. Biomolecules,2014,4(1):235-251.
[6]Wang J,Lu D,Lin Y,et al. How CTAB assists the refolding of native and recombinant lysozyme[J]. Biochemical engineering journal,2005,24(3):269-277.
[7]Dong X Y,Wu X Y,Sun Y. Refolding of denatured lysozyme assisted by artificial chaperones in reverse micelles[J]. Biochemical engineering journal,2006,31(1):92-95.
[8]Lu D,Liu Z,Zhang M,et al. Dextran-grafted-PNIPAAm as an artificial chaperone for protein refolding[J]. Biochemical engineering journal,2006,27(3):336-343.
[9]Wang C,Geng X. Refolding and purification of recombinant human granulocyte colony-stimulating factor using hydrophobic interaction chromatography at a large scale[J]. Process Biochemistry,2012,47(12):2262-2266.
[10]Guan Y X,Pan H X,Gao Y G,et al. Refolding and purification of recombinant human interferon-γ expressed as inclusion bodies inEscherichia coli using size exclusion chromatography[J]. Biotechnology and Bioprocess Engineering,2005,10(2):122-127.
[11]Chen Y C,Liu H S. Chaperon solvent plug design in size-exclusion chromatography protein refolding process[J]. Enzyme and microbial technology,2011,49(2):203-208.
[12]周志江,韓燁,韓雪,等. 從酸白菜中分離出一株產細菌素的乳酸片球菌[J]. 食品科學,2006,27(4):89-92.
[13]李亞玲,周志江,韓燁,等. 乳酸片球菌細菌素的分離純化及理化性質[J]. 食品工業科技,2007,28(8):94-97.
[14]Studier F W. Protein production by auto-induction in high-density shaking cultures[J]. Protein expression and purification,2005,41(1):207-234.
[15]Yang R,Johnson M C,Ray B. Novel method to extract large amounts of bacteriocins from lactic acid bacteria[J]. Applied and Environmental Microbiology,1992,58(10):3355-3359.
[16]Yu Z,Mao H. Non-B DNA Structures Show Diverse Conformations and Complex Transition Kinetics Comparable to RNA or Proteins—A Perspective from Mechanical Unfolding and Refolding Experiments[J]. The Chemical Record,2013,13(1):102-116.
[17]Yamaguchi S,Yamamoto E,Mannen T,et al. Protein refolding using chemical refolding additives[J]. Biotechnology journal,2013,8(1):17-31.
Research of the refolding of a heterologous pediocin expressed inEscherichiacoli
TAN Xi-qian,HAN Ye,XIAO Hua-zhi,ZHOU Zhi-jiang*
(Department of Food Science and Engineering,School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
The inclusion body of the recombinant pediocin fusion protein was produced by the excess expression of gene engineeringE.coliBL21(DE3). The inclusion body was separated,denatured,and then refolded using direct dilution,reversed dilution,dialysis,CTAB assisted,and CTAB andβ-CD assisted refolding. The results showed that CTAB andβ-CD assisted refolding have advantage over other refolding methods. Through this method,a higher concentration of denatured inclusion protein and a smaller volume renatured solution were used. And a higher concentration of refolding product and a relatively stable refolding rate were achieved.
inclusion body;refolding;pediocin
2015-12-14
檀茜倩(1985-),女,博士研究生,研究方向:食品生物技術,E-mail:xiqiantan@tju.edu.cn。
周志江(1960-),男,博士,教授,研究方向:食品生物技術,E-mail:zzj@tju.edu.cn。
天津科技支撐計劃重點項目(13ZCDNC01900)。
TS201.3
A
1002-0306(2016)13-0173-05
10.13386/j.issn1002-0306.2016.13.026

