產甲殼素酶多粘類芽孢桿菌A1的篩選鑒定及發酵產酶條件研究
杜敬河,王 栩,朱永安,吳鳳英,段 杉,*
(1.華南農業大學食品學院,廣東廣州 510642;2. 廣東省天然活性物工程技術研究中心,廣東廣州 510642;3.廣東永昊食品有限公司,廣東陽江 529536)
?
產甲殼素酶多粘類芽孢桿菌A1的篩選鑒定及發酵產酶條件研究
杜敬河1,2,王栩1,朱永安1,吳鳳英3,段杉1,2,*
(1.華南農業大學食品學院,廣東廣州 510642;2. 廣東省天然活性物工程技術研究中心,廣東廣州 510642;3.廣東永昊食品有限公司,廣東陽江 529536)
從土壤中分離得到一株產甲殼素酶的細菌,經形態學、生理生化及分子生物學鑒定,確定為多粘類芽孢桿菌,命名為A1。研究發現甲殼素、殼聚糖和淀粉可誘導該菌產甲殼素酶;添加尿素可提高甲殼素酶產量。本文研究確定該菌發酵產酶條件如下:培養基采用1%甲殼素(120目),0.05% MgSO4·7H2O,1.2%尿素,0.5% NaCl,0.07% K2HPO4,0.03% KH2PO4,0.3%酵母提取粉,初始pH4.5,接種齡12 h,接種量1%,于37 ℃培養78 h,在此條件下,該菌產甲殼素酶水平達到0.549 U/mL。該菌在對數期,其產酶曲線的上升略滯后于生長曲線變化;而在衰亡期,產酶曲線的降低略早于生長曲線的降低,說明該酶的mRNA的穩定性較差。
甲殼素酶,多粘類芽孢桿菌,發酵條件
甲殼素(chitin)又稱幾丁質,廣泛存在于蝦、蟹等甲殼類動物以及低等生物菌類、藻類細胞中,是自然界中產量僅次于纖維素的第二大生物資源,它是由N-乙酰氨基-D-葡萄糖單體(D-GlcNAc)通過β-1,4糖苷鍵連接而成的直鏈高分子化合物[1-3]。甲殼素酶(chitinase E.C.3.2.1.14)又稱幾丁質酶,可以降解甲殼素生成甲殼寡糖。甲殼寡糖是甲殼素糖鏈β-1,4糖苷鍵斷裂形成的寡聚體,具有抑菌、抗腫瘤、保濕、提高植物防御力等功能[4],已被廣泛應用到各個領域。
1961年,Euniauxc在動物體內發現甲殼素酶,目前已在細菌、真菌和植物中均發現甲殼素酶的存在。已報道產甲殼素酶的細菌主要有弧菌(Vibrio)、粘質沙雷氏菌(Serratiamarcescens)、假單胞菌(Pseudomonas)、類芽孢桿菌(Paenibacillus)和芽孢桿菌(Bacillus)等[5-6]。多數微生物只有在含有甲殼素等誘導物的培養基中才能產生甲殼素酶,所產甲殼素酶多是分泌型的,即胞外酶[7]。
本文從土壤中篩選出一株產甲殼素酶的多粘類芽孢桿菌,并對其發酵產酶條件進行了初步研究。
1 材料和方法
1.1材料與儀器
土壤樣品廣州華南農業大學校園內湖邊、寧波海邊、陽江海邊等地;甲殼素按照文獻[8]的條件制備甲殼素;ZR Fungal/Bacterial DNA KitTMZYMO RESEARCH;27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′通用引物廣州生工生物科技有限公司合成;DNA Marker DL2000NEW GENE BIOTECHNOLOGY;Goldview染料(含量95%)CAT;6×上樣緩沖液WOSLEN;2×Taq PCR Master MixDBI;其他試劑均為市售分析純試劑。
pHS-3CW酸度計上海般特儀器有限公司;LDZX-40B型立式自控電熱蒸汽滅菌器上海申安醫療器械廠;EnSpire酶標儀PerkinElmer公司;PCR儀Bio-Rad公司。
1.2培養基
初篩培養基組成(w/v):1%膠體甲殼素,1%(NH4)2SO4,0.07% K2HPO4,0.03% KH2PO4,0.5% NaCl,0.05% MgS04·7H2O,0.3%酵母提取粉,1.5%瓊脂,pH為6.0。
膠體甲殼素的制備:稱取10 g甲殼素(100目),緩緩加入濃鹽酸200 mL,迅速攪拌,待其全部溶解后用玻璃棉過濾除去雜質,溶液加入1000 mL蒸餾水。離心得到沉淀,用蒸餾水洗至中性,冷凍干燥即得膠體甲殼素[9]。
復篩培養基組成(w/v):1%膠體甲殼素,1%(NH4)2SO4,0.07% K2HPO4,0.03% KH2PO4,0.5% NaCl,0.05% MgS04·7H2O,0.3%酵母提取粉,pH為6.0。
發酵培養基組成(w/v):1%甲殼素,0.05% MgS04·7H2O,1.2%尿素,0.5% NaCl,0.07% K2HPO4,0.03% KH2PO4,0.3%酵母提取粉,pH為4.5。
種子培養基:LB培養基。
1.3實驗方法
1.3.1菌株初篩將土壤用無菌水稀釋后,涂布于初篩培養基平板上,于37 ℃培養箱中培養3~4 d。挑取菌落周圍有明顯透明圈的菌落,再采用平板劃線法分離純化。
1.3.2菌株復篩挑取初篩得到的菌落,接種到100 mL液體復篩培養基中,37 ℃恒溫揺床160 r/min培養72 h,測定發酵上清液中的甲殼素酶活力。
1.3.3甲殼素酶活力的測定參考韓寶芹[10]的測定方法,并改進如下:將發酵液于4 ℃下10000 r/min離心5 min得上清液,取0.1 mL上清液(對照組中的酶液先在100 ℃煮沸5 min滅活),加入1.9 mL 1%膠體甲殼素(將膠體甲殼素溶于0.05 mol/L pH5.0 HAc-NaAc緩沖溶液中),混勻后于50 ℃水浴中反應0.5 h,再加入3 mL DNS溶液,沸水浴反應5 min,冷卻后定容至25 mL,于520 nm處測定吸光值。酶活力單位(U)定義:上述條件下,1 mL酶液1 min轉化甲殼素產生1 μmol N-乙酰氨基葡萄糖所需的酶量為1個酶活力單位,同時以N-乙酰氨基葡萄糖制作標準曲線。
1.3.4菌株鑒定
1.3.4.1形態學鑒定參考《伯杰氏系統細菌學手冊》[11]對菌株進行形態鑒定。
1.3.4.216S rDNA鑒定及系統進化樹的構建提取待鑒定菌株的DNA,采用細菌通用引物27F和1492R擴增細菌的16S rDNA[12]。PCR反應條件為95 ℃預變性3 min;95 ℃變性30 s;55 ℃退火45 s,72 ℃延伸l.5 min,30個循環,最后72 ℃延伸10 min,4 ℃保存。反應結束后,取5 μL PCR反應液,在加Gold View的1%瓊脂糖凝膠電泳液中電泳30 min,用凝膠成像系統檢測擴增結果。將PCR擴增產物送往廣州生工生物科技有限公司進行測序,并將測序結果在NCBI數據庫中查找與之匹配的核苷酸序列。利用MEGA 5.1軟件構建系統進化樹。
1.3.4.3生理生化鑒定細菌的生理生化鑒定參考《伯杰氏系統細菌學手冊》[11]和文獻[13]方法進行。
1.3.5發酵條件研究將5 mL種子液(培養24 h)接種于100 mL復篩培養基中,37 ℃恒溫揺床160 r/min培養72 h。
不同碳源對菌株A1發酵產酶的影響:在培養基中分別以1%蔗糖、1%葡萄糖、1% N-乙酰氨基葡萄糖、1%可溶性淀粉、1%甲殼素(120目)、1%殼聚糖和1%膠體甲殼素作為碳源,培養72 h后測定發酵上清液中的酶活力。
不同氮源對菌株A1發酵產酶的影響:在培養基中分別以1%(NH4)2SO4、1% NaNO3、1% NH4NO2、1%牛肉膏、1%蛋白胨和1%尿素作為氮源,培養72 h后測定發酵上清液中的酶活力。
尿素濃度對菌株A1發酵產酶的影響:調節培養基中的尿素濃度,培養72 h后測定發酵上清液中的酶活力。
不同發酵溫度對菌株A1發酵產酶的影響:培養溫度對微生物的生長及代謝有著重要的影響,在不同的培養溫度下微生物產酶種類和數量各不相同。分別在30、35、37、40、45 ℃條件下,培養72 h后測定發酵上清液中的酶活力。
培養基不同pH對菌株A1發酵產酶的影響:將培養基的初始pH分別調至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,培養72 h后測定發酵上清液中的酶活力。
種齡對菌株A1發酵產酶的影響:在培養基中分別接種12、18、24、36、48 h不同種齡的菌液,培養72 h后測定發酵上清液中的酶活力。

表2 菌株A1生理生化特征
注:“+”.陽性,“-”.陰性 。

表3 碳源對發酵產酶的影響
注:“-”.未檢測到酶活力。
接種量對菌株A1發酵產酶的影響:分別按1%、5%、10%、15%、20%(體積分數)的接種量接種到培養基中,培養72 h后測定發酵上清液中的酶活力。
1.3.6菌株A1的生長曲線及產酶曲線測定在確定了發酵培養基組成和發酵條件后,在此條件下發酵培養菌株A1,每隔6~12 h取樣,采用比濁法于600 nm波長處測定該菌發酵液的光密度,繪制生長曲線;同時測定發酵上清液的甲殼素酶活力,繪制產酶曲線。

圖2 系統發育進化樹Fig.2 Phylogenetic tree of strain A1
2 結果與分析
2.1產甲殼素酶菌株的初篩
在以膠體甲殼素為唯一碳源的初篩培養基上,發現5株產生透明圈的細菌,通過平板劃線法分離純化并進行保存。
2.2產甲殼素酶菌株的復篩
表1為5株細菌發酵上清液中的甲殼素酶活力,發現其中A1的酶活力明顯高于其他菌株。因此,選擇A1菌株作為甲殼素酶的產生菌株。
2.3菌種鑒定
從圖1可以看出,菌株A1在初篩培養基上形成圓形、乳白色菌落,菌落稍凸起,濕潤光滑,邊緣整齊,挑起有黏性。菌株A1經革蘭氏染色實驗觀察為革蘭氏陰性菌。
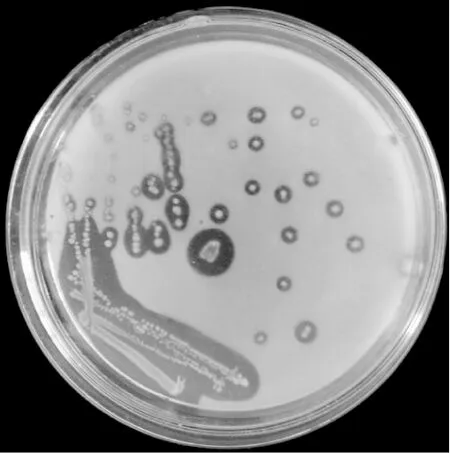
圖1 菌株A1的菌落形態Fig.1 Colony morphology of strain Al
將菌株A1的16S rDNA序列提交到NCBI的GenBank數據庫進行比對,與多粘類芽孢桿菌相似度達到99%。MEGA 5.1軟件系統發育樹分析結果顯示,該菌株的遺傳進化與多粘類芽孢桿菌最近,構成一個分支(圖2)。
菌株A1生理生化特征如表2所示,與《伯杰氏系統細菌學手冊》(第九版)芽孢桿菌目,類芽孢桿菌科,類芽孢桿菌屬,多粘類芽孢桿菌的描述相符。
結合形態學、生理生化特征和16S rDNA序列分析結果,將菌株A1鑒定為多粘類芽孢桿菌(Paenibacillus polymyxa)。
2.4發酵條件
2.4.1碳源對發酵產酶的影響表3顯示,多粘類芽孢桿菌A1以粉末甲殼素作為碳源時,甲殼素酶活力最高;其次是膠體甲殼素、殼聚糖和可溶性淀粉,分別為最高酶活力的53%、24%和17%。該菌以葡萄糖、蔗糖和N-乙酰氨基葡萄糖作為碳源時均可生長,但不能產生甲殼素酶,表明該菌所產甲殼素酶為誘導酶。
2.4.2氮源對發酵產酶的影響由圖3可知,氮源對多粘類芽孢桿菌A1產甲殼素酶影響很大,其中以尿素作為氮源時甲殼素酶最高,其次是硝酸鈉和硫酸銨。在以牛肉膏和蛋白胨作為氮源時,該菌生長繁殖速度快,但產甲殼素酶能力低。
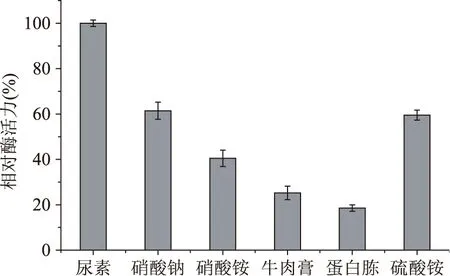
圖3 氮源對多發酵產酶的影響Fig.3 Effects of various nitrogen sources on chitinase production
2.4.3尿素濃度對發酵產酶的影響從圖4可以看出,隨著培養基中尿素濃度的增加,多粘類芽孢桿菌A1產甲殼素酶能力先增高后降低;當尿素濃度為1.2%時,甲殼素酶活力達到最大值。
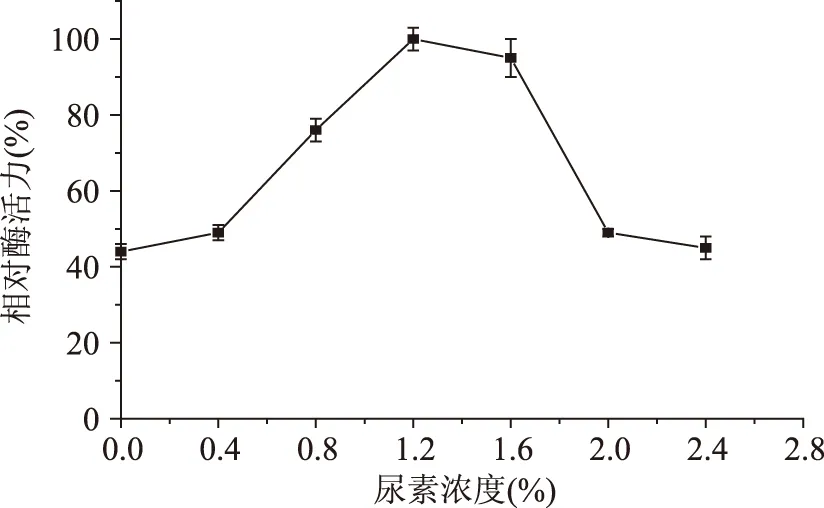
圖4 尿素濃度對發酵產酶的影響Fig.4 Effects of different concentrations of CO(NH2)2 on chitinase production
2.4.4培養溫度對發酵產酶的影響從圖5可以看出,培養溫度在35~40 ℃范圍內,多粘類芽孢桿菌A1產甲殼素酶較高;當培養溫度為37 ℃時,甲殼素酶活力達到最大值。當培養溫度高于40 ℃或低于35 ℃時,甲殼素酶活力均會顯著降低。

圖5 溫度對發酵產酶的影響Fig.5 Effect of temperatures on chitinase production
2.4.5培養基初始pH對發酵產酶的影響從圖6可以看出,培養基初始pH在4.0~5.0之間變動時,pH對多粘類芽孢桿菌A1產甲殼素酶影響不大,都保持在較高水平;當初始pH為4.5時,甲殼素酶活力達到最大值。當初始pH大于5.0時,隨著pH的增大,甲殼素酶活力逐漸降低。
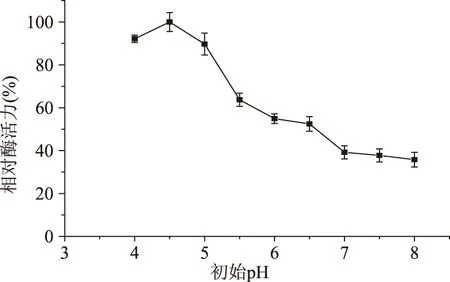
圖6 培養基初始pH對發酵產酶的影響Fig.6 Effect of initial medium pH on chitinase production
2.4.6接種齡對發酵產酶的影響從圖7可以看出,當接種齡為12 h時,多粘類芽孢桿菌A1產甲殼素酶活力最高;12 h后,隨著種齡時間的延長,甲殼素酶活力逐漸降低,在24 h后基本保持不變。12 h左右時該菌種處于對數期,此時細胞的生命力最強,生長至24 h左右時該菌種已進入穩定期,此時細胞的代謝活力開始減弱。
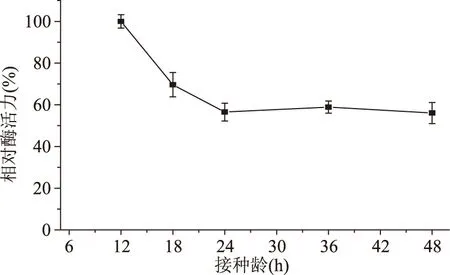
圖7 接種齡對發酵產酶的影響Fig.7 Effect of inoculating age on chitinase production
2.4.7接種量對發酵產酶的影響從圖8可以看出,接種量對多粘類芽孢桿菌A1產甲殼素酶活力影響不大。當接種量為1%時,甲殼素酶活力最高;當接種量為5%~20%時,甲殼素酶活力隨接種量的增加而略有下降,推測這是因為過多的接種量導致裝液量增加,溶氧不足,細菌增殖緩慢,甲殼素酶活力降低。
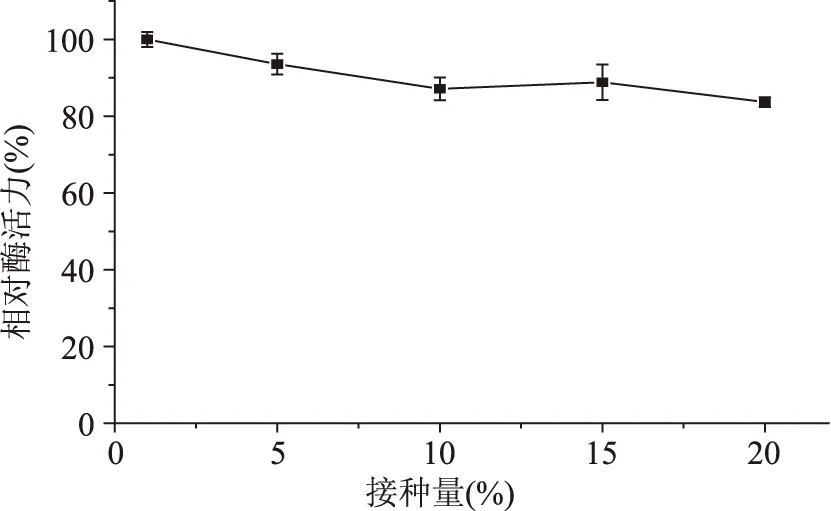
圖8 接種量對發酵產酶的影響Fig.8 Effect of inoculum size on chitinase production
2.5菌株的生長曲線和產酶曲線測定
從圖9可以看出,多粘類芽孢桿菌A1在12 h時開始迅速生長,進入對數生長期;78 h左右進入穩定期,之后菌體密度不再隨培養時間的延長而增加;108 h后菌體密度開始降低,進入衰亡期。12 h左右,甲殼素酶活力開始出現,酶活力的最高峰幾乎與生長曲線的最高峰同時出現,在78 h時達到最大值0.549 U/mL;隨著培養時間延長,甲殼素酶活力不再上升;96 h時,酶活力開始逐漸下降。根據細胞生長與產酶的關系,可以把酶生物合成的模式分為4種類型:同步合成型、延續合成型、中期合成型、滯后合成型。該菌在對數期,其產酶曲線的上升略滯后于生長曲線變化;而在衰亡期,產酶曲線的降低略早于生長曲線的降低,說明甲殼素酶合成模式為中期合成型,該酶的mRNA的穩定性較差[14]。

圖9 菌株A1生長和產酶曲線Fig.9 Time course of growth and enzyme production of strain A1
3 結論與討論
經鑒定產甲殼素酶菌株A1為多粘類芽孢桿菌(Paenibacilluspolymyxa)。通過單因素實驗對多粘類芽孢桿菌A1的發酵條件進行了初步研究,得到其產甲殼素酶的發酵條件為:1%甲殼素,0.05% MgSO4·7H2O,1.2%尿素,0.5% NaCl,0.07% K2HPO4,0.03% KH2PO4,0.3%酵母提取粉,培養基起始pH4.5,于37 ℃培養78 h。在此發酵條件下,該菌產甲殼素酶水平達到0.549 U/mL。該菌所產甲殼素酶為胞外酶,以甲殼素、殼聚糖和淀粉為底物可以誘導該菌產甲殼素酶;葡萄糖、蔗糖和N-乙酰氨基葡萄糖都不能誘導該菌產甲殼素酶。
多粘類芽孢桿菌(Paenibacilluspolymyxa)是一類重要的植物生防細菌和根際促生菌。2002年,美國環保署(EPA)已將其列為可商業上應用的微生物種類之一,對人和動植物沒有致病性[15-16]。目前國內對多粘類芽孢桿菌的研究主要集中在:其對植物病害的防治、所產代謝活性物質的種類及抗菌機理等方面[17-18],對其產甲殼素酶的相關研究未見報道。
[1]伊金玲.產甲殼素酶菌株HD002的篩選鑒定發酵條件優化酶的分離純化及酶學性質研究[D].青島:中國海洋大學,2010.
[2]Gooday GW. The Ecology of Chitin Degradation[M]. New York:Plenum Press,1990:387-430.
[3]Shaikh SA,Deshpande MV. Chitinolytic enzymes:their contribution to basic and applied research[J]. Microbiol Biotechnol,1993,9(4):468-475.
[4]Tzu-Wen Liang,Yue-Yin Chen,Po-Shen Pan,et al. Purification of chitinase/chitosanase from Bacillus cereus and discovery of an enzyme inhibitor[J]. International journal of biological macromolecules,2014,63:8-14.
[5]付星,閆巧娟,江正強,等.高產幾丁質酶巴倫葛茲類芽孢桿菌的篩選和發酵條件優化[J].微生物學通報,2015,42(4):625-633.
[6]于瀟淳.產甲殼素酶菌株HD001的篩選、發酵及酶的分離純化與酶學性質研究[D].青島:中國海洋大學,2008.
[7]許夢秋,鐘增明,龔琰,等.幾丁質酶在植物病害生物防治中的應用[J].現代農業科技,2010,(5):122-123.
[8]Shan Duan,Li Lei,Liu Shi-ya,et al. Improved production of chitin from shrimp waste by fermentation with epiphytic lactic acid bacteria[J]. Carbohydrate Polymers,2012,89:1283-1288
[9]Paraman Ilankovan,San Hein,Chuen-How Ng,et al. Production of N-acetyl chitobiose from various chitin substrates using commercial enzymes[J]. Carbohydrate Polymers,2006,63:245-250.
[10]韓寶芹,伊金玲,蔡文娣,等.產甲殼素酶菌株的發酵條件、酶的分離純化及酶學性質研究[J].中國海洋大學學報,2010,40(10):57-62.
[11]Holt JG. Bergey’s Manual of Determinative Bacteriology[M]. 9th Edition. Baltimore:Williams & Wilkins,1994:190-255.
[12]Yimin Cai,Y Benno,M Ogawa,et al. Effect of Applying Lactic Acid Bacteria Isolated from Forage Crops on Fermentation Characteristics and Aerobic Deterioration of Silage[J]. Journal of Dairy Science,1999,82(3):520-526.
[13]Bloemberg G,Lugtenberg VBJ. Molecular basis of plant growth promotion and biocontrol by Rhizobacteria[J]. Current Opinion in Plant Biology,2001,4(4):343-350.
[14]郭勇.酶學工程[M].北京:科學出版社,2009:35-39.
[15]Choong-min R,Jinwook,Okheec,et al. Improvement of biological control capaeity of E681 by seed pelleting on sesame[J]. Biological Control,2006,39(3):282-289.
[16]韓俊華,陳大歡,黃繼翔.響應面法優化多粘類芽孢桿菌HT16產生抗菌蛋白的培養基[J].食品工業科技,2014,35(13):262-266.
[17]程愛芳,鄧政東,陳文,等.多粘類芽孢桿菌HD-1產纖維素酶的條件優化[J].食品工業科技,2015,36(10):173-177.
[18]蒼桂璐,張付云,楊陽,等.多粘類芽孢桿菌的研究進展[J].安徽農業科學,2013,41(2):487-489.
Screening of a strain of chitinase producingPaenibacilluspolymyxaA1 and investigation on its fermentation conditions for chitinase production
DU Jing-he1,2,WANG Xu1,ZHU Yong-an1,WU Feng-ying3,DUAN Shan1,2,*
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Guangdong Engineering Research Center of Natural Active Substance,Guangzhou 510642,China;3.Guangdong Yonghao Foods Limited,Yangjiang 529536,China)
A strain of chitinase producing bacteria was isolated from soil,and was identified to bePaenibacilluspolymyxabased on its morphological,physiological and biochemical characteristics and 16S rDNA sequencing. The strain was named as A1. Chitin,chitosan and starch can induce A1 to produce chitinase. The adding of urea in medium improved the production of chitinase. The fermentation conditions for chitinase production were determined as follows:the fermentation medium consisting of 1% chitin(120 mesh),0.05% MgSO4·7H2O,1.2% CO(NH2)2,0.5% NaCl,0.03% KH2PO4,0.07% K2HPO4,0.3% yeast extract powder,pH4.5,starter culture age 12 h,inoculum size 1%,fermenting at 37 ℃ for 78 h. Under such conditions,the chitinase activity achieved 0.549 U/mL. At the exponential phase,the rising of chitinase production curve slightly lagged behind the growth curve of A1,at the decline phase,the falling of chitinase production curve was slightly earlier than the falling of growth curve. The results indicated that the mRNA of the chitinase was unstable.
Chitinase;Paenibacilluspolymyxa;fermention condition
2016-01-14
杜敬河(1991-),男,碩士研究生,研究方向:水產品加工與貯藏,E-mail:dujingheyouxiang@163.com 。
段杉(1966-),男,博士,副教授,研究方向:水產品綜合利用,E-mail:duanshan@scau.edu.cn。
廣東省省部產學研合作專項資金項目(2013B090600111);廣東省教育廳科研項目(2013gjhz0003)。
TS201.1
A
1002-0306(2016)13-0157-05
10.13386/j.issn1002-0306.2016.13.023

