介孔TiO2對溶菌酶吸附的動力學和熱力學
洪啟亮 董依慧 莊偉 饒超 劉暢,*
(1南京工業大學,材料化學工程國家重點實驗室,南京210009;2南京工業大學生物與制藥學院,南京211816)
介孔TiO2對溶菌酶吸附的動力學和熱力學
洪啟亮1董依慧1莊偉2饒超1劉暢1,*
(1南京工業大學,材料化學工程國家重點實驗室,南京210009;2南京工業大學生物與制藥學院,南京211816)
773.15K下焙燒二鈦酸(H2Ti2O5)制備了介孔結構TiO2。采用比表面分析儀(BET)、掃描電鏡(SEM)、拉曼(Raman)光譜和X射線衍射(XRD)儀進行表征研究了介孔TiO2對溶菌酶的吸附行為和機理。結果表明,該吸附過程較好地滿足Langmuir吸附模型;隨著溶液pH值的增高,溶菌酶在介孔TiO2上的吸附量先增大后減小。在pH=7.2時,達到最大吸附容量72.5mg?g-1。該介孔TiO2對溶菌酶具有良好的吸附穩定性,經過5次循環后吸附的溶菌酶殘余量仍有81.6%。動力學研究表明,介孔TiO2與溶菌酶間的吸附滿足準二級動力學模型,吸附傳質過程由膜擴散和粒內擴散共同影響與控制。對熱力學參數的計算發現,該過程ΔG0<0,ΔH0>0,ΔS0>0,表明介孔TiO2對溶菌酶的吸附是一個自發的、吸熱的熵增過程。
介孔TiO2;溶菌酶;吸附;動力學;熱力學
1 引言
近年來,對于生物-表面工程的蛋白吸附研究已經取得了一系列的進步1。研究蛋白質與介質的吸附作用對于生物醫用材料、生物傳感器和固定化酶等領域都具有重要的理論意義和實用價值。蛋白質在介質表面上的吸附行為取決于蛋白質的種類、介質的表面結構和溶液性質等因素。蛋白質分子在介質表面的吸附強度不同,可以實現不同領域的應用,例如抗污染表面需要蛋白質與表面幾乎無吸附2、蛋白質固定化則需要蛋白質在表面吸附作用很強3以及蛋白質分離需要不同的蛋白質在表面產生不同的吸附-解吸過程4。蛋白質分子與材料表面間存在著復雜的吸附行為,其本質在于蛋白質與材料間相互作用的不同,因此深入研究蛋白質分子在材料表面的吸附過程十分必要,對實現控制蛋白質在材料表面的吸附更具有重要的基礎研究和實際應用價值。
無機載體成本低、穩定性好、機械強度高、表面性質易調控、耐酸堿,是當前吸附載體的主要研究方向5。而無機介孔材料因具有比表面積大、孔結構規則、孔徑分布集中等優點,日益成為研究吸附蛋白的優異載體6。其中大多數研究者集中于介孔硅材料7-9,但部分介孔硅材料功能化后易產生毒性10,且孔徑調控較為復雜11,12。TiO2由于具有穩定、無毒、抗腐蝕性好及優異的生物相容性等優點,通常被用于醫用植入體材料,作為吸附載體也逐漸引起了廣泛關注13。
然而常規的TiO2無孔,吸附穩定性差,在一定程度上阻礙了TiO2在蛋白質吸附方面的應用。本課題組通過固相分離法合成了一種高比表面積的介孔表面含有豐富的活性羥基16,有利于與蛋白質分子的官能團發生作用,提高與蛋白質分子的結合力。此外,簡單改變前驅體H2Ti2O5的焙燒溫度,即可實現介孔TiO2的孔徑在3-30nm內可調17。目前,該介孔TiO2已在藥物運輸18和蛋白固定化19,20等生物領域得到應用。
研究蛋白質分子在介孔材料中的吸附行為尤為重要。吸附動力學主要用來描述吸附劑吸附溶質的快慢,可通過動力學模型對數據進行擬合,推斷其吸附機理21;吸附熱力學是描述反應平衡性質的基本定律,可以反映吸附的本質。但是,目前對介孔TiO2吸附蛋白分子的動力學和熱力學的研究較少。溶菌酶的分子尺寸較小(3.0nm×3.0nm×4.5nm),結構簡單,不易形變,多應用于蛋白吸附的研究中作為模型蛋白22。鑒于此,本文以溶菌酶為模型蛋白,研究了介孔TiO2對溶菌酶的吸附行為和機理,采用準一級、準二級模型對吸附動力學過程進行擬合;測定了吸附熱力學參數(吸附焓變ΔH0、吸附自由能變ΔG0、吸附熵變ΔS0),為介孔TiO2在藥物運輸和固定化酶領域的應用提供了理論參考。
2 實驗部分
2.1實驗試劑
水合氧化鈦(TiO2?n H2O)購自南京市油脂化學廠,為化學純;碳酸鉀(K2CO3)、鹽酸(HCl)、醋酸(HAc)、醋酸鈉(NaAc)、磷酸氫二鈉(Na2HPO4)、磷酸二氫鉀(KH2PO4)、碳酸鈉(Na2CO3)、碳酸氫鈉(NaHCO3)均購自上海凌峰化學試劑有限公司,均為分析純;溶菌酶購自北京拜耳迪生物科技有限公司;實驗用水為商業可用純凈水。
2.2介孔TiO2粉體的制備
介孔TiO2制備過程使用課題組先前的制備工藝14,15。(1)K2Ti2O5的燒結:將TiO2?n H2O和K2CO3以摩爾比2:1混合,加入適量的水,均勻攪拌,在363.15K下干燥10h后,然后在1153.15K下焙燒4h,得到K2Ti2O5。(2)水合:向K2Ti2O5中緩慢滴加水并攪拌,攪拌成膏狀后,用保鮮膜封裝,靜置7-10d。(3)離子交換:將水合產物中加入大量水,并滴加稀鹽酸,使溶液pH值保持在1.5-2.0間,劇烈攪拌24h,反復過程3-5次;離子交換結束后,收集沉淀物,用水沖洗表面的酸溶液,在363.15K下烘干,獲得H2Ti2O5。(4)二次焙燒:將H2Ti2O5在773.15K下焙燒2 h,得到樣品介孔TiO2。
2.3樣品表征
氮氣吸附-脫附曲線采用美國Micromertics公司的TristarII3020型全自動氮吸附比表面和孔隙分析儀測試,預處理溫度為352 K、預處理時間為8 h,測試溫度為77 K,分別通過BET方程和BJH模型計算得到材料的比表面積、孔容和孔徑數據;材料的形貌采用日本日立公司的HitachiS-4800型掃描電子顯微鏡(SEM)觀察,操作電壓5kV;晶體結構采用德國Bruker公司的D8Adavance型X射線衍射(XRD)儀檢測,管電流30mA,管電壓40kV,掃描范圍5°-60°,掃描步長0.05(°)?step-1,掃描速率0.2 s?step-1;材料的表面組成采用法國Horiba Jobin Yvon公司的HR 800型拉曼光譜儀測定,激發波長為514nm,功率為20mW;不同pH值下的zeta電位使用英國Zetasizer 3000hs型zeta電位分析儀測定;蛋白溶液的吸光度采用上海龍尼柯儀器有限公司UV-2802S型紫外-可見分光光度計測定;吸附性能采用常州諾基儀器有限公司SHZ-88A恒溫水浴振蕩箱測試,振蕩速率為180r?m in-1。
2.4介孔TiO2對溶菌酶的等溫吸附實驗
2.4.1吸附等溫線
稱取0.2 g介孔TiO2于離心管中,加入10m L濃度為0.2-2mg?m L-1的溶菌酶溶液(pH=7.2),分別在283.15、293.15、303.15、313.15K下振蕩吸附72 h。取少量懸浮液,離心分離后(6000r?m in-1,10m in),采用紫外分光光度計在λ=280nm處測定上清液中溶菌酶的質量濃度,按照式(1)求出平衡吸附量,由此繪制吸附等溫線。

式中,qe為平衡吸附量(mg?g-1),Ce為溶菌酶的平衡濃度(mg?m L-1),C0為溶菌酶起始濃度(mg?m L-1),V為溶液體積(m L),m為介孔TiO2的質量(g)。
2.4.2溶液pH值對溶菌酶的吸附量影響
稱取0.2 g介孔TiO2于離心管中,加入10m L濃度為2mg?m L-1的溶菌酶溶液,分別調節pH值為3.6、4.7、5.2、6.6、7.2、7.8、9.2、10.1、11.0,在303.15K恒溫條件下振蕩吸附72 h,研究不同溶液pH值對溶菌酶的吸附量影響。
2.4.3吸附動力學
稱取0.2 g介孔TiO2于離心管中,加入10m L濃度為2mg?m L-1的溶菌酶溶液(pH=7.2),分別在283.15、293.15、303.15、313.15K恒溫條件下振蕩吸附。開始計時,間隔一段時間取少量懸浮液,離心分離后,測定上清液中溶菌酶的質量濃度,按照式(2)求出吸附量。重復上述實驗過程,測試吸附量直至不變,由此繪制吸附動力學曲線。

式中,qt為t時的吸附量(mg?g-1),Ct為溶菌酶在t時刻的濃度(mg?m L-1)。
3 結果與討論
3.1介孔TiO2的表征
圖1為介孔TiO2的氮氣吸附-脫附等溫線和孔徑分布曲線圖。從圖1(A)可以看出樣品的氮氣吸附等溫線是IV型,具有明顯的吸附滯后環,為典型的介孔材料的吸附特征。從圖1(B)中可看出介孔TiO2的孔徑分布集中在9.5nm。樣品的比表面積、平均孔徑和孔體積列于表1中。進一步采用掃描電子顯微鏡觀察介孔TiO2的表面微觀形貌。圖2為介孔TiO2在不同放大倍數下的FESEM圖像。圖2(A)為5千倍下拍攝的FESEM圖,可看出樣品的形貌呈棒狀;圖2(B)為10萬倍下拍攝的FESEM圖,在顆粒的表面有很多納米級孔,平均孔徑為9 nm左右,這與BJH方法分析得到的孔徑數據基本吻合。
圖3(A)為介孔TiO2的XRD圖。在2θ為25.3°、37.8°和48.0°附近的特征衍射峰分別對應銳鈦礦的(101)、(004)和(200)晶面的衍射,為典型的銳鈦礦相。圖中主峰寬度較窄且強度較強,說明樣品中銳鈦礦相的含量較多,結晶度較好。圖3(B)為介孔TiO2的Raman光譜圖。位于145、197、395、515和638 cm-1處的Raman峰分別對應銳鈦礦相Eg、Eg、B1g、B1g/A1g和Eg模式23,即譜圖中出現的主峰均為銳鈦礦相特征峰,證實了XRD表征結果。
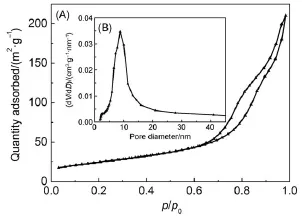
圖1 氮氣吸-脫附等溫線(A)和孔徑分布曲線(B)Fig.1 N2adsorption-desorption isotherm(A)and pore size distribution curve(B)

表1 TiO2的結構參數Table1 Texturalparametersof TiO2
3.2吸附等溫線
吸附等溫線可反映被吸附的分子在平衡時液相和固相間的分布狀況,不同溫度下介孔TiO2對溶菌酶的等溫吸附曲線如圖4。隨著溫度的升高,介孔TiO2對溶菌酶平衡吸附量不斷增加,是因為傳質速度隨溫度的升高而加快,這也表明介孔TiO2吸附溶菌酶是一個吸熱過程。目前有很多模型用來描述吸附等溫線的數據,其中Langmuir和Freundlich模型24由于形式簡單、參數少且容易確定而被廣泛的應用,因此本文采用這兩種模型描述不同溫度下介孔TiO2對溶菌酶的吸附情況。

圖2 TiO2不同放大倍數的FESEM圖像Fig.2 FESEMimagesof TiO2at differentmagnifications
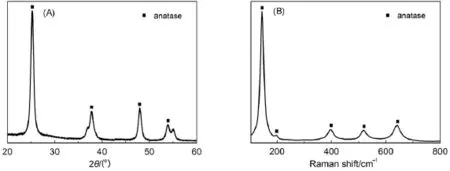
圖3 TiO2的XRD(A)和Raman(B)譜圖Fig.3 XRD pattern(A)and Ram an spectrum(B)of TiO2
Langmuir和Freundlich模型的線性方程分別為:
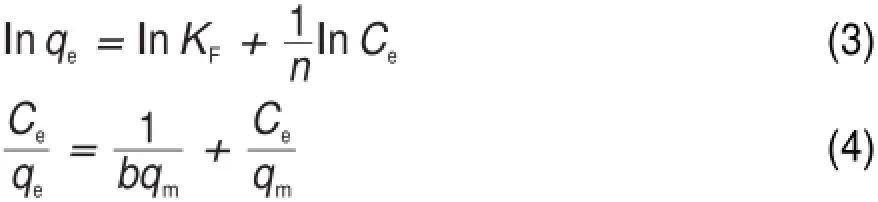
式中,KF為Freundlich吸附常數(m L?g-1),n為表觀常數,b為Langmuir吸附常數(m L?mg-1),qm為理論飽和吸附量(mg?g-1)。
Langmuir和Freundlich方程擬合曲線如圖5所示,回歸參數見表2。Langmuir方程擬合曲線的R2值均大于0.99,表明Langmuir模型較好地描述了介孔TiO2對溶菌酶的吸附。Langmuir公式中的參數qm和b可以從Ce/qe對Ce直線的截距與斜率中獲得。在本文實驗條件下,qm和b均隨著溫度的升高而增大,表明此吸附過程是吸熱的,適當升溫有利于吸附。
3.3溶液pH值對吸附量影響
蛋白質分子在載體上的吸附主要包括范德華力、氫鍵和靜電相互作用,其中靜電相互作用通常起主要的作用,載體表面電荷的變化會影響蛋白質在其表面的吸附量。對介孔TiO2和溶菌酶在不同pH值的水溶液中的zeta電位值進行測試,見圖6,介孔TiO2和溶菌酶的等電點分別為4.4和10.4。當溶液pH<4.4時,介孔TiO2和溶菌酶表面均帶正電,兩者間具有靜電排斥作用,導致低吸附容量;當溶液pH值介于4.4和10.4之間時,介孔TiO2表面帶負電,而溶菌酶分子表面帶正電,根據正負電荷相吸,溶菌酶在介孔TiO2上的吸附量增大;當溶液pH>10.4時,溶菌酶分子的表面電性發生根本性轉變,攜帶了負電荷,與表面帶負電的介孔TiO2產生靜電排斥作用,使得吸附量較低。
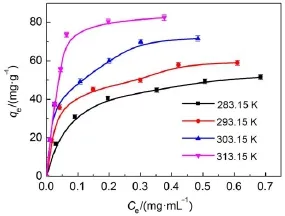
圖4 介孔TiO2對溶菌酶的吸附等溫線Fig.4Adsorp tion isotherm sof lysozymeonto TiO2pH=7.2;qeis theequilibrium adsorption capacity; Ceis the equilibrium concentration.
當溶液pH值接近蛋白的等電點時,蛋白所帶凈電荷為零,蛋白分子內的靜電排斥力及分子間的橫向相互作用力處于最小狀態,蛋白質的溶解度最低,因此蛋白在載體上達到最大吸附量25。對于本研究體系,如圖7所示,隨著pH值的增大,介孔TiO2對溶菌酶的吸附量先增大后減小,在pH=7.2時,有最大吸附量72.5mg?g-1。吸附量最大處的pH值比溶菌酶的等電點偏低,可能是因為在pH值較高時,體系中的小離子吸附至溶菌酶表面,導致溶菌酶等電點的改變26,故該pH值是溶菌酶與吸附分子復合物的等電點27,或者溶菌酶的表觀等電點28。
3.4吸附穩定性
蛋白質的操作穩定性是蛋白固定化領域的重要目標之一,因此進一步測試了介孔TiO2對溶菌酶的吸附穩定性。在pH=7.2下,將充分吸附溶菌酶的介孔TiO2離心分離回收,然后加入10m L pH=7.2磷酸緩沖溶液,在303.15K、180r?m in-1下振蕩4h,測試介孔TiO2上溶菌酶的殘余量。由圖8可見,經過5次振蕩洗滌后,溶菌酶在介孔TiO2上的殘留量仍有57.93mg?g-1,為最初吸附量的81.6%,即表現出良好的吸附穩定性。一方面,在溶液pH=7.2時,介孔TiO2與溶菌酶間存在強烈的靜電相互作用;另一方面,溶菌酶的尺寸為3.0nm×3.0nm×4.5nm,比介孔TiO2的孔徑(9.56nm)要小,使得部分溶菌酶易于吸附在介孔TiO2的孔道內,即孔結構對溶菌酶起到保護作用,防止了溶菌酶的泄漏。
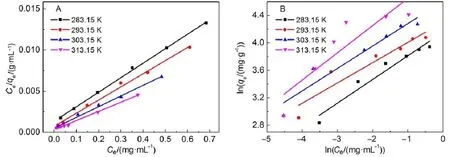
圖5 Langmuir(A)和Freundlich(B)吸附等溫線Fig.5Langmuir(A)and Freundlich(B)adsorption isotherm s
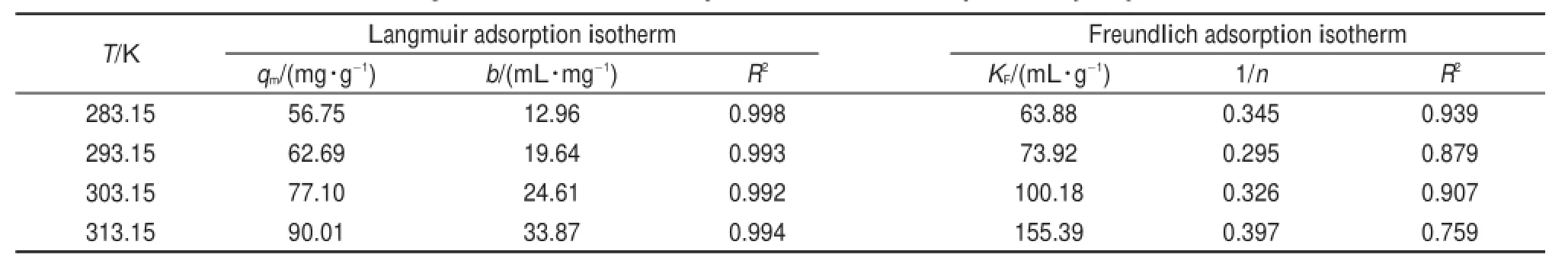
表2 TiO2吸附溶菌酶的Langmuir和Freundlich參數Tab le 2 Langmuir and Freund lich parameters for adsorption of lysozym e on to TiO2
3.5吸附動力學
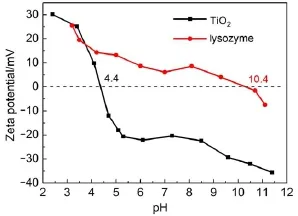
圖6 TiO2和溶菌酶的zeta電位隨pH值的變化曲線Fig.6Curvesof zeta potentialof TiO2and lysozymewith pH value
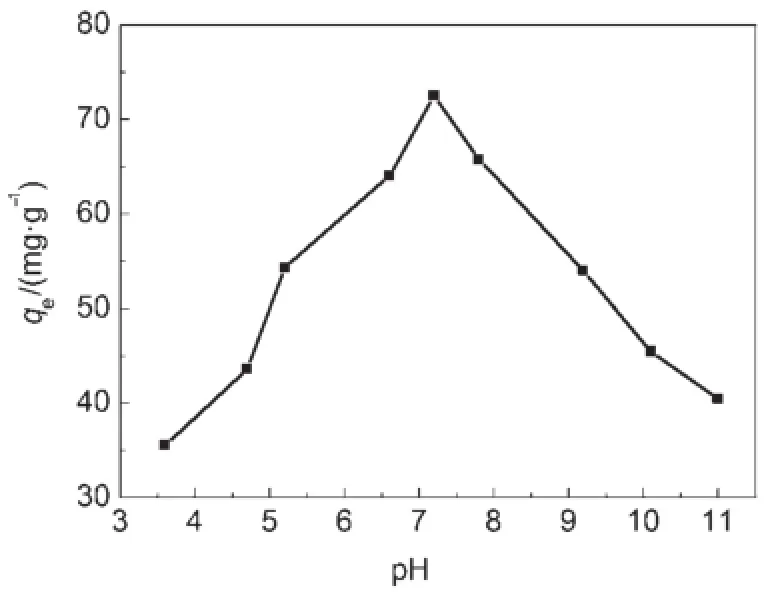
圖7 介質pH值對TiO2吸附溶菌酶性能影響Fig.7 Effectof pH valueson adsorption quantity of lysozym e on to TiO2C0(lysozyme)=2mg?m L-1;T=303.15K
溶液中的吸附是一個較復雜的過程,吸附質從液相中被吸附到吸附劑顆粒中,可以分為吸附劑周圍流體界膜中吸附質的遷移(外擴散)、吸附劑顆粒內擴散和吸附劑內的吸附反應等幾個過程29。圖9(A)為不同溫度下介孔TiO2對溶菌酶的吸附動力學曲線。前24h吸附量迅速增加,主要是介孔TiO2外表面對溶菌酶的吸附;24-48 h吸附量增加變緩,主要是溶菌酶通過孔道向內表面擴散后的吸附;至72 h時吸附已基本達到飽和。曲線中各點的斜率代表瞬時吸附速率(d qt/d t),隨著吸附時間的延長,d qt/d t逐漸減小,且平衡吸附量隨溫度升高而增大。對于固液吸附,常采用準一級、準二級速率方程30,31來描述和分析動力學過程。
準一級和準二級吸附模型分別如下:
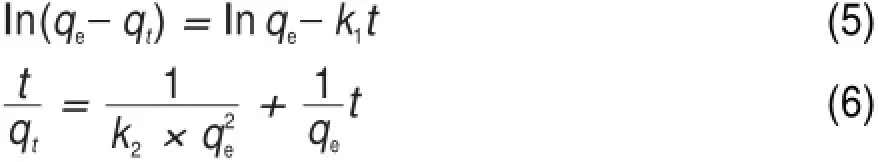
式中,k1為準一級吸附速率常數(h-1),k2為準二級吸附速率常數(g?mg-1?h-1),k2qe2為初始吸附速率(mg?g-1?h-1)。
準一級、準二級模型的擬合曲線如圖9(B)、圖9(C)所示,擬合曲線參數列于表3中,準二級模型的R2值比準一級模型的值大且更接近1,并且平衡吸附量的實驗值qe,exp和準二級模型的計算值qe,cal吻合很好,說明在本實驗溫度范圍內,利用準二級模型能夠更好地預測溶菌酶在介孔TiO2上的吸附動力學行為。隨著溫度的升高,初始吸附速率和準二級吸附速率常數均呈現增大的趨勢。
由于準一級、準二級動力學模型均不適用于解釋擴散機理,因此采用顆粒內擴散模型30,31,其方程式如下:

式中,ki為顆粒內擴散速率常數(mg?g-1?m in-1),xi為曲線截距(與邊界層厚度呈正比)。如圖9(D)所示,曲線分為3個區域,表明吸附過程中存在3個步驟32,分別為顆粒外部擴散(膜擴散)、顆粒內部擴散、吸附反應階段。一般來說,吸附反應速度較快,不會成為吸附過程的控制步驟,所以吸附過程主要考慮膜擴散或顆粒內部擴散。根據Lorenc-Grabowska和Gryglew icz33的研究結果,如果這條線為直線且經過原點,說明該過程是單一的粒內擴散速控步驟。由圖9(D)可知,粒內擴散圖形不經過原點,也不是直線,說明粒內擴散不是唯一的控制步驟,膜擴散也在一定程度上影響吸附過程,即膜擴散和顆粒內擴散交互影響溶菌酶在介孔TiO2的吸附動力學過程。
3.6吸附熱力學
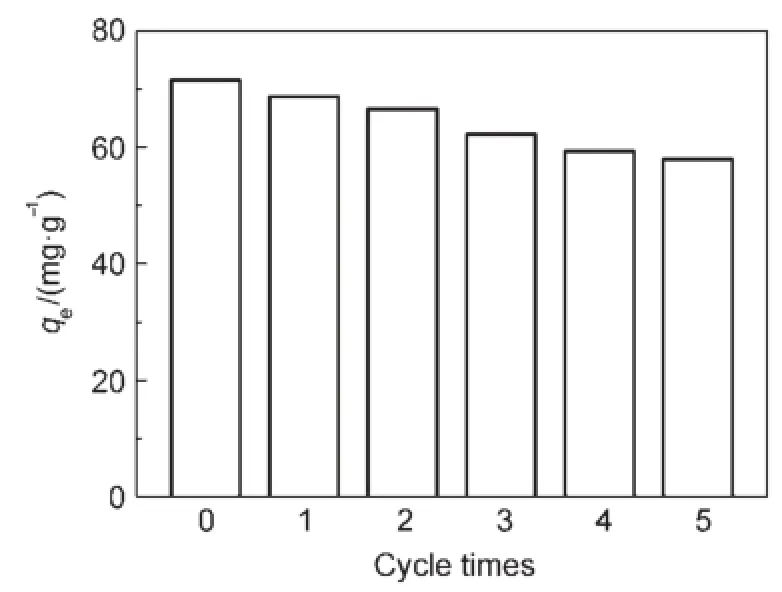
圖8 循環次數對TiO2吸附溶菌酶影響Fig.8 Effectof cycle tim eson the adsorp tion of lysozymeonto TiO2C0(lysozyme)=2mg?m L-1;pH=7.2;T=303.15K
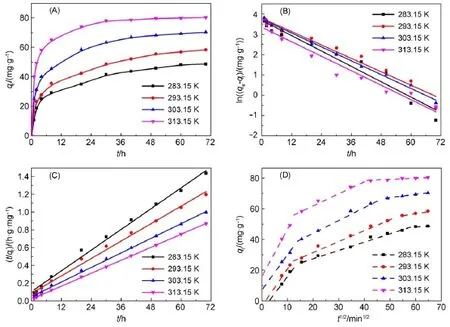
圖9 TiO2吸附溶菌酶的動力學曲線(A)、準一級模型(B)、準二級模型(C)和顆粒內擴散模型(D)的擬合曲線Fig.9 Adsorp tion kinetics curves(A),simulation curvesof pseudo-first-order(B),pseudo-second-order(C),and intraparticle d iffusion(D)m odelsof lysozyme onto TiO2C0(lysozyme)=2mg?m L-1;pH=7.2;qtis the amountof lysozymeadsorbed at time t.
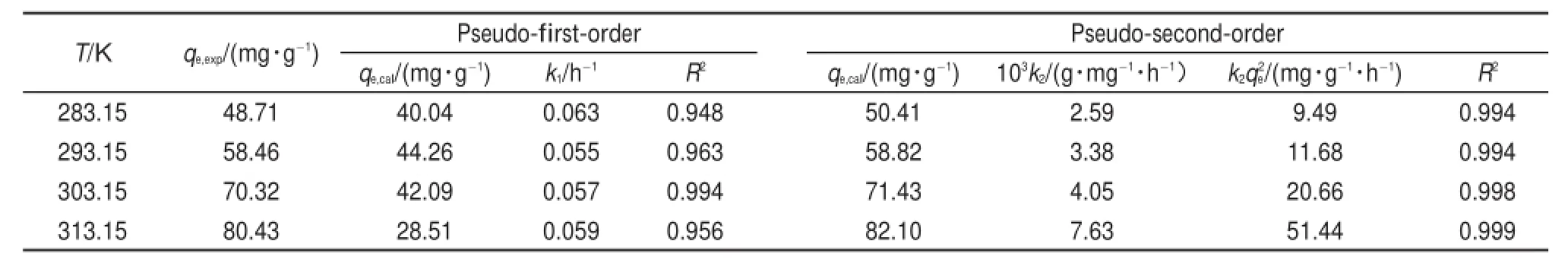
表3 TiO2吸附溶菌酶的動力學參數Tab le3 K inetic parameters for theadsorp tion of lysozymeonto TiO2
吸附熱力學參數反映吸附過程的可行性和自發性。用Van′tHoffs和Gibbs方程34,35可計算出吸附過程的吉布斯自由能變化ΔG0、吸附焓變ΔH0、吸附熵變ΔS0。

式中,R為理想氣體常數(8.314J?mol-1?K-1);T為溫度(K);K為吸附平衡常數。
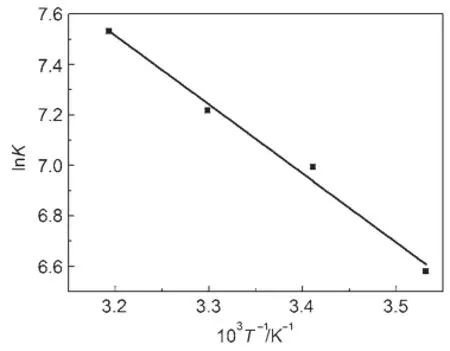
圖10 ln K對1/T的關系曲線Fig.10Relationship curvebetween ln K and 1/T K is theadsorption equilibrium constant.
嚴格地說,在研究溶質在固體吸附劑上吸附的同時,還應考慮溶劑的吸附。則溶菌酶在介孔TiO2上吸附平衡常數K與Langmuir吸附常數b應滿足:
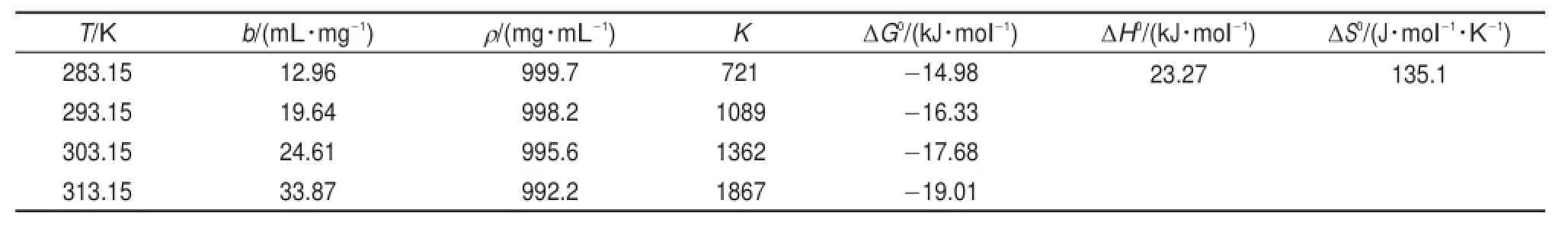
表4 TiO2吸附溶菌酶的熱力學數據Table 4Adsorption therm odynam ics param etersof lysozyme onto TiO2

式中,M與ρ分別是水的摩爾質量與密度。以ln K對1/T作圖(如圖10)所示,由直線斜率和截距可求得ΔH0與ΔS0;ΔG可由式(9)求出。由表4可知,ΔH0>0,表明溶菌酶在介孔TiO2上的吸附為吸熱反應(導致圖4中介孔TiO2對溶菌酶的吸附量隨溫度升高而增大);ΔS0>0,表明吸附是熵增過程,溶質分子由溶液相交換到固液界面會失去一部分自由度36,這是熵減少的過程;而蛋白質是一個大分子,在介孔TiO2吸附一個溶菌酶分子的同時必然有大量水分子被解吸,即水分子在介孔TiO2上整齊、緊密地排列變為解吸后的自由運動,這是熵增過程。由于水分子體積較小,解吸過程的熵變量必然很大,由這兩部分組成總熵變量最終為正值,表現為介孔TiO2吸附溶菌酶是一個熵增過程;ΔG0<0,表明吸附是自發的,且隨著溫度的升高,ΔG0的絕對值增大,表明溫度越高吸附過程自發趨勢越大。
在一定程度上,吸附的類型可以從焓變量加以區分37,物理吸附焓變小于84kJ?mol-1,而化學吸附的焓變在84-420kJ?mol-1,本實驗中ΔH0= 23.27 kJ?mol-1,小于84kJ?mol-1。據此,介孔TiO2對溶菌酶的吸附應是物理吸附過程。但也有文獻認為38,通常物理吸附的自由能在-20到0kJ?mol-1之間,而化學吸附的自由能在-400到-80kJ?mol-1之間,本實驗中ΔG0在-14.98 kJ?mol-1到-19.01 kJ?mol-1間。因此,根據ΔH0、ΔG0的實驗值可認為介孔TiO2吸附溶菌酶基本上是受物理吸附驅動的。
4 結論
(1)將前驅體H2Ti2O5在773.15K下焙燒,得到了介孔結構的TiO2,孔徑分布集中在9.5nm,比表面積和孔容分別為89.9m2?g-1和0.327 cm3?g-1,為典型的銳鈦礦相。
(2)介孔TiO2對溶菌酶吸附過程滿足Langmuir模型。在溶液pH=7.2時,介孔TiO2與溶菌酶間存在強靜電吸引作用,獲得最大吸附量72.5mg?g-1。充分吸附溶菌酶的介孔TiO2經緩沖液五次振蕩洗滌后,溶菌酶在介孔TiO2上的殘留量為最初吸附量的81.6%,表明該介孔TiO2對溶菌酶具有較好的吸附穩定性。
(3)準二級模型更準確地預測介孔TiO2吸附溶菌酶的動力學過程,隨著溫度的升高,初始吸附速率和吸附速率常數均呈現增大的趨勢;吸附傳質過程由外擴散和粒內擴散共同影響與控制。通過對吸附熱力學參數計算發現,介孔TiO2吸附溶菌酶的吸附自由能ΔG0在-14.98到-19.01 kJ?mol-1之間,吸附焓變ΔH0為23.27 kJ?mol-1,ΔS0大于零,表明該吸附為自發的吸熱、熵增過程。
References
(1)Andre,E.;Lutz,M.;Darrell,V.;Tian,X.;Eric,M.;Ponisseril, S.;Fred,K.;Vince,C.;Mike,T.Nat.Mater.2009,8,543.doi: 10.1038/nmat2442
(2)Larson,T.A.;Joshi,P.P.;Sokolov,K.ACSNano 2012,6, 9182.doi:10.1021/nn3035155
(3)Zhen,X.;Wang,X.;Xie,C.;Wu,W.;Jiang,X.Q. Biomaterials2013,34,1372.doi:10.1016/j. biomaterials.2012.10.061
(4)Shao,M.F.;Ning,F.Y.;Zhao,J.W.;Wei,M.;Evans,D.G.; Duan,X.J.Am.Chem.Soc.2012,134,1071.doi:10.1021/ ja2086323
(5)Lv,Y.J.;Lu,G.Z.;Wang,Y.Q.;Guo,Y.L.;Guo,Y.;Zhang, Z.G.;Wang,Y.S.;Liu,X.H.Adv.Funct.Mater.2007,17, 2160.doi:10.1002/adfm.200600505
(6)Wu,Z.X.;Zhao,D.Y.Chem.Commun.2011,47,3332.doi: 10.1039/c0cc04909c
(7)Díaz,J.F.;Balkus,K.J.J.Mol.Catal.B:Enzym.1996,2,115. doi:10.1016/S1381-1177(96)00017-3
(8)Takimoto,A.;Shiomi,T.;Ino,K.MicroporousMesoporous Mat.2008,116,601.doi:10.1016/j.micromeso.2008.05.046
(9)Wang,A.M.;Liu,M.Q.;Wang,H.J.Biosci.Bioeng.2008, 106,286.doi:10.1263/jbb.106.286
(10)Rosenholm,J.M.;Sahlgren,C.;Linden,M.Nanoscale 2010, 2,1870.doi:10.1039/c0nr00156b
(11)Blin,J.L.;Su,B.L.Langmuir2002,18,5303.doi:10.1021/ la020042w
(12)Fuertes,A.B.;Valle-Vigon,P.;Sevilla,M.J.Colloid Interface Sci.2010,349,173.doi:10.1016/j.jcis.2010.05.041
(13)Jiang,Y.J.;Sun,Q.Y.;Jiang,Z.Y.Mater.Sci.Eng.C 2009, 29,328.doi:10.1016/j.msec.2008.07.006
(14)Bao,N.Z.;Shen,L.M.;Feng,X.;Lu,X.H.J.Am.Ceram. Soc.2004,87,326.doi:10.1111/j.1551-2916.2004.00326.x
(15)He,M.;Feng,X.;Lu,X.H.;Ji,X.Y.;Liu,C.;Bao,N.Z.;Xie, J.W.J.Chem.Eng.Jpn.2003,36,1259.doi:10.1252/ jcej.36.1259
(16)Castrillo,P.D.;Olmos,D.;Amador,D.R.J.Colloid Interface Sci.2007,308,318.doi:10.1016/j.jcis.2007.01.022
(17)Yang,Z.H.;Wang,Y.F.;Li,L.C.;Wang,C.S.;Lu,X.H. JournalofNanjing Tech.University2012,34,7.[楊祝紅,王艷芳,李力成,王昌松,陸小華.南京工業大學學報,2012,34, 7.]
(18)Li,Q.N.;Wang,X.M.;Lu,X.H.;Tian,H.E.;Jiang,H.;Lv, G.;Guo,D.D.;Wu,C.H.;Chen,B.A.Biomaterials 2009,30, 4708.doi:10.1016/j.biomaterials.2009.05.015
(19)Wang,H.Q.;Yao,Z.;Sun,Y.;Zhou,Z.;Xiong,Q.;Zhong,Z. X.Biotechnol.Bioprocess Eng.2014,19,304.doi:10.1007/ s12257-013-0675-8
(20)Dong,Y.H.;An,R.;Zhuang,W.;Yao,Z.;Zhu,Y.D.;Liu,C.; Lu,X.H.JournalofChemical Industry and Engineering 2014,65,1750.[董依慧,安蓉,莊偉,姚忠,朱育丹,劉暢,陸小華.化工學報,2014,65,1750.]doi:10.3969/j. issn.0438-1157.2014.05.027
(21)Ravi,S.S.;Monoj,K.M.Korean J.Chem.Eng.2012,29, 1782.doi:10.1007/s11814-012-0092-2
(22)Bhattacharyya,M.S.;Hiwale,P.;Piras,M.;Medda,L.;Steri, D.;Piludu,M.;Salis,A.;Monduzzi,M.J.Phys.Chem.C 2010,114,19928.doi:10.1021/jp1078218
(23)Wang,D.;Zhao,J.;Chen,B.;Zhu,C.J.Phys.:Condens. Matter2008,20,085212.doi:10.1088/0953-8984/20/8/085212
(24)Li,X.N.;Xu,Q.Y.;Han,G.M.;Zhu,W.Q.;Chen,Z.H.;He, X.B.;Tian,X.J.J.Hazard.Mater.2009,165,469.doi: 10.1016/j.jhazmat.2008.10.013
(25)Sham im,N.;Liang,H.;Hidajat,K.;Uddin,M.S.J.Co lloid Interface Sci.2008,320,15.doi:10.1016/j.jcis.2007.08.012
(26)Su,T.J.;Lu,J.R.;Thomas,R.K.;Cui,Z.F.;Penfold,J. J.Colloid Interface Sci.1998,203,419.doi:10.1006/ jcis.1998.5545
(27)Vander,V.M.;Norde,W.;Stuart,M.C.Co lloids Surf.B 2004, 35,33.doi:10.1016/j.colsurfb.2004.02.005
(28)Fu,H.Y.;Gao,B.J.;Niu,Q.Y.Acta Phys.-Chim.Sin.2010, 26,359.[付紅艷,高保嬌,牛慶媛.物理化學學報,2010,26, 359.]doi:10.3866/PKU.WHXB20100207
(29)Kitagawa,H.;Suzuki,I.The Fundamentalsand Design for Adsorption;Chemical Industry Press:Beijing,1983;pp 48-50; translated by Lu,Z.L.[Kitagawa,H.;Suzuki,I.吸附的基礎與設計.鹿政理,譯.北京:化學工業出版社,1983:48-50.]
(30)Sun,Q.;Yang,L.WaterRes.2003,37,1535.doi:10.1016/ S0043-1354(02)00520-1
(31)Karaca,S.;Gurses,A.;Ejder,M.;Acikyildiz,M.J.Colloid Interface Sci.2004,277,257.doi:10.1016/j.jcis.2004.04.042
(32)Yang,X,Y.;Al-Duri,B.J.Colloid Interface Sci.2005,287, 25.doi:10.1016/j.jcis.2005.01.093
(33)Lorenc-Grabowska,E.;Gryglew icz,G.J.Colloid Interface Sci.2005,284,416.doi:10.1016/j.jcis.2004.10.031
(34)Shi,N.;Gao,B.J.;Yang,Q.Acta Phys.-Chim.Sin.2014,30, 2168.[史楠,高保嬌,楊青.物理化學學報,2014,30, 2168.]doi:10.3866/PKU.WHXB201409151
(35)Zhou,L.C.;Meng,X.G.;Li,J.M.;Hu,W.;Liu,B.;Du,J. Acta Phys.-Chim.Sin.2012,28,1615.[周良春,孟祥光,李建梅,胡偉,劉波,杜娟.物理化學學報,2012,28,1615.] doi:10.3866/PKU.WHXB201204282
(36)Wojciech,P.;W ladyslaw,R.;Anita,P.Adv.Colloid Interface Sci.2009,152,2.doi:10.1016/j.cis.2009.07.009
(37)Salama,M.A.;Burk,R.C.Appl.Surf.Sci.2008,255,1975. doi:10.1016/j.apsusc.2008.06.168
(38)Kuo,C.Y.;Wu,C.H.;Wu,J.Y.J.Colloid Interface Sci.2008, 327,308.doi:10.1016/j.jcis.2008.08.038
Kinetics and Thermodynamics of Lysozyme Adsorption on Mesoporous Titanium Dioxide
HONG Qi-Liang1DONG Yi-Hui1ZHUANGWei2RAO Chao1LIU Chang1,*
(1State Key Laboratory ofMaterials-Oriented Chemical Engineering,Nanjing Technology University,Nanjing 210009,P.R.China;2SchoolofBiologicaland Pharmaceutical Engineering,Nanjing Technology University,Nanjing 211816,P.R.China)
Mesoporous TiO2was prepared by calcinating H2Ti2O5at773.15K.The sample was characterized by Brunauer-Emmett-Teller(BET),scanning e lectronm icroscopy(SEM),Raman spectroscopy,and X-ray diffraction(XRD)ana lysis.The adsorption behavior andmechanism o fmesoporous TiO2for lysozyme were investigated by isothermaladsorption experiments.The results show that the equilibrium experimentaldatawere co rre lated w ith the Langmuir iso the rm equation.The adso rption capacity first inc reased and then decreased with increasing pH value.The capacity showed amaximum value of72.5mg?g-1when the pH value was 7.2. Lysozyme adsorbed onmesoporous TiO2was extremely stable,and its amountonmesoporous TiO2maintained 81.6%o f its initia l va lue after five adsorption and regeneration cyc les.Furthermore,kinetic analysis was conducted using pseudo-firstand pseudo-second ordermodels.The adsorption of lysozyme onmesoporous TiO2was described wellby the pseudo-second order rate equation.The rate-determ ining step of the adsorption w as the com bined action o f film diffusion and intrapa rtic le d iffusion.The adsorp tion the rm odynam ic ana lysis suggestedΔG0<0,ΔH0>0,andΔS0>0,which indicated that the adsorption was a spontaneous and endotherm ic processw ith entropy increased.
Mesoporous TiO2;Lysozyme;Adsorption;Kinetics;Thermodynam ics
September14,2015;Revised:December14,2015;Published onWeb:December18,2015.
O647
10.3866/PKU.WHXB201512181
*Corresponding author.Email:changliu@njtech.edu.cn;Tel:+86-13913939041.
The projectwas supported by the NationalKey Basic Research Program of China(2013CB733501),National Natural Science Foundation of China (21136004,21476106,21506090),Natural Science Foundation of Jiangsu Province,China(BK20130929),and Projectof Priority Academic Program Development(PAPD)of Jiangsu Higher Education Institutions,China.
國家重點基礎研究發展計劃項目(2013CB733501),國家自然科學基金(21136004,21476106,21506090),江蘇省自然科學基金(BK 20130929)和江蘇高校優勢學科建設工程項目資助?Editorialofficeof Acta Physico-Chimica Sinica

