綠豆分離蛋白的葡聚糖糖基化改性研究
韓飛飛,李 楊,王中江,隋曉楠,齊寶坤,王 瑞,畢 爽,李秋慧,江連洲,2,*
(1.東北農業(yè)大學食品學院,黑龍江哈爾濱 150030;2.國家大豆工程技術研究中心,黑龍江哈爾濱 150030)
?
綠豆分離蛋白的葡聚糖糖基化改性研究
韓飛飛1,李楊1,王中江1,隋曉楠1,齊寶坤1,王瑞1,畢爽1,李秋慧1,江連洲1,2,*
(1.東北農業(yè)大學食品學院,黑龍江哈爾濱 150030;2.國家大豆工程技術研究中心,黑龍江哈爾濱 150030)
為改善綠豆分離蛋白(MBPI)的理化特性,利用葡聚糖(Dextran)接枝改性MBPI,并對改性后蛋白的溶解性、乳化特性、表面疏水性、亞基結構的變化進行研究。SDS-PAGE凝膠電泳分析結果表明,MBPI和Dextran接枝反應后生成了分子量較大的共價復合物,表面疏水性分析表明,相比于未處理蛋白,MBPI-Dextran共價復合物的表面疏水性含量降低,溶解性和乳化特性的研究表明,改性后的蛋白質溶解性和乳化特性得到不同程度的改善。
綠豆分離蛋白,糖基化,蛋白質改性
綠豆(Vignaradiate(L.))又名青小豆,錄豆、植豆,屬于豆科,蝶花亞科豇豆屬一年生直立草本植物,原產印度、緬甸地區(qū),在我國已有2000多年的種植歷史[1]。綠豆是蛋白質的良好來源,蛋白含量為20%~30%,并且?guī)缀醪缓忻洑庖蜃覽2]。綠豆蛋白的氨基酸組成與大豆和菜豆相當,并且復合FAO/WHO的標準[3]。然而,綠豆的加工應用主要集中在淀粉的利用方面,綠豆蛋白則多作為生產廢料或動物飼料使用,造成了蛋白資源的嚴重浪費。采用適當?shù)母男苑椒ㄌ岣呔G豆蛋白的某些功能性質以滿足食品加工工業(yè)的需求是綠豆高值化利用的基礎。
美拉德反應能夠在加熱過程中進行而不需要添加額外的化學試劑,被廣泛認為是有效和安全的提高蛋白質功能性質的方法,包括提高蛋白質的溶解性[4]、乳化性、熱穩(wěn)定性[5]、抗氧化活性[6]。目前,許多不同的蛋白質例如大豆蛋白[7]、乳清蛋白[8]、大米蛋白[9]等和不同種糖進行糖基化反應以提高其功能性質已經(jīng)被研究。葡聚糖是糖基化反應中應用最多的多糖,研究表明,葡聚糖糖基化對蛋白質的功能性質具有良好的改善效果。Zhang等人[10]研究了葡聚糖糖基化燕麥蛋白的乳化性,結果表明,燕麥蛋白-葡聚糖共價復合物制備的乳液相比于天然燕麥蛋白粒徑更小,并且具有更好的儲存穩(wěn)定性。Laura等人[11]研究了β-乳球蛋白和葡聚糖之間的接枝反應,結果表明,反應產物的溶解性和熱穩(wěn)定性得到顯著提高。
本文以綠豆蛋白為研究對象,利用葡聚糖糖基化改性綠豆分離蛋白,研究了不同反應條件下得到的綠豆分離蛋白-葡聚糖共價復合物的溶解性和乳化特性,并對相關機理進行探究,為綠豆分離蛋白的開發(fā)利用提供理論基礎。
1 材料與方法
1.1材料與儀器
東北綠豆、福臨門牌大豆色拉油市售;1-苯胺基-8-萘磺酸(ANS)Sigma公司;SDS-PAGE凝膠配制試劑盒北京創(chuàng)根勝泰科技有限公司;Lowry法測溶解度試劑盒上海荔達生物科技有限公司;其他試劑均為分析純。
電子分析天平(0.0001 g)北京賽多利斯儀器系統(tǒng)有限公司;FD 5-3型冷凍干燥機美國SIM公司;高速均質機上海昂尼儀器儀表有限公司;722型分光光度計上海菁華科技儀器有限公司;GL-20G-Ⅱ高速冷凍離心機上海安亭科學儀器廠;F-4500熒光分光光度計日本HITACHI公司。
1.2實驗方法
1.2.1綠豆分離蛋白的制備綠豆—浸泡12 h(料液比為1∶10,4 ℃)—去皮—磨漿—用2 mol/L NaOH調節(jié)pH為9—室溫下攪拌20 min—10000×g離心30 min(4 ℃)—上清液用2 mol/L HCl調節(jié)pH為4—10000×g離心30 min(4 ℃)沉淀加水分散—用2 mol/L NaOH調節(jié)pH至中性—真空冷凍干燥(﹣50 ℃)—綠豆分離蛋白[12]。
1.2.2綠豆分離蛋白-葡聚糖接枝物的制備綠豆分離蛋白和葡聚糖(w/w=1∶1)溶解于磷酸鹽緩沖溶液(pH7.8 0.2 mol/L)中,使蛋白濃度為10 mg/mL,室溫攪拌2 h至完全溶解,置于80 ℃水浴鍋中反應1~6 h,反應結束后迅速沖冷水使其冷卻至室溫,離心后上清液置于蒸餾水中透析24 h(4 ℃),凍干成粉后置于冰箱中備用。
1.2.3接枝度測定采用OPA法[13]。配制OPA試劑,此試劑要現(xiàn)配現(xiàn)用。準確稱取40.0 mg的OPA溶解于1.0 mL甲醇中,再加入20%(w/w)的十二烷基硫酸鈉(SDS)2.5 mL,硼砂(0.1 mol/L)25.0 mL,β-巰基乙醇100 μL,最后用蒸餾水定容到50 mL。測定時,取4.0 mL OPA試劑于試管中,加入200 μL樣品,混合均勻,放入35 ℃水浴中反應2 min后在340 nm下測吸光值A340,另取4.0 mL OPA試劑于試管中,加入200 μL水作為空白對照。
接枝度可以用此公式計算:
其中:A0:接枝反應前溶液的吸光值;A1:接枝反應后溶液的吸光值。

1.2.5綠豆分離蛋白-葡聚糖共價復合物乳液的制備將綠豆分離蛋白、綠豆分離蛋白-葡聚糖共價復合物分別溶于磷酸鹽緩沖溶液中(0.01 mol/L,pH7.0),室溫攪拌2 h,在4 ℃過夜使蛋白充分水合。次日10000×g離心20 min,取上清液。測定蛋白濃度并稀釋一定倍數(shù),并添加一定量的大豆油,使最終乳液中含有10%(v/v)的大豆油和0.5%(w/v)的蛋白質。用高速均質機進行均質,轉速20000 r/min,時間為1 min。
1.2.6乳液粒徑的測定利用Malvern Mastersizer 2000 激光粒度儀測定乳液液滴的平均粒徑和粒度分布。乳液液滴的平均粒徑采用體積平均直徑(d43)來表示。所有的測試均在25 ℃條件下進行,并且平行測定三次。
1.2.7表面疏水性測定表面疏水性的測定采用ANS熒光探針法[15]。用0.01 mol/L的磷酸緩沖液(pH7.0)配制不同濃度的蛋白質溶液(0.05、0.1、0.2、0.5、1 mg/mL)和8.0 mmol/L的1-苯胺基-8-萘磺酸(1-anilino-8-naphthalene-sulfonate,ANS)溶液。取20 μL ANS溶液加到4.0 mL蛋白質溶液中,混合均勻,迅速測定混合液的熒光強度,激發(fā)波長和發(fā)射波長分別是390、470 nm,激發(fā)和發(fā)射狹縫寬均為5 nm。以熒光強度對樣品濃度作圖,曲線的初始斜率即為蛋白質的表面疏水性(H0)。
1.2.8SDS-PAGE凝膠電泳的測定本實驗參考Laemmli[16]的方法并稍加修改。分離膠濃度12%(w/v),包括12%凝膠儲備液,0.375 mol/L Tris-HCl(pH 8.8),0.1% SDS,0.1%過硫酸銨,0.1% TEMED;濃縮膠采用5%(w/v),包括5%凝膠儲備液,0.125 mol/L Tris-HCl(pH 6.8),0.1% SDS,0.1%過硫酸銨,0.1% TEMED。蛋白樣品與上樣緩沖液(100 mg SDS,0.25 mLβ-巰基乙醇,2 mg溴酚藍,2 mL pH為8.0,濃度0.05 mol/L Tris-HCl,甘油2.0 mL,定容至10 mL配至濃度為1 mg/mL,然后在95 ℃下進行5 min的加熱,上樣量為10 μL。電泳過程恒壓,濃縮膠電壓80 V,分離膠120 V。染色劑為0.1%考馬斯亮藍R-250(甲醇∶冰乙酸=4∶1∶5)的混合溶液,脫色劑為(甲醇∶冰乙酸∶水=4∶1∶5)混合溶液。
采用標準蛋白:雞蛋清溶菌酶(14.4 ku),牛奶β-乳球蛋白(18.4 ku),大腸桿菌REase Bsp981(25.0 ku),乳酸脫氫酶(35.0 ku),雞蛋乳清蛋白(45.0 ku),牛血清白蛋白(66.2 ku)和β-半乳糖苷酶(116 ku)[17]。
1.3數(shù)據(jù)處理
本實驗所有數(shù)據(jù)均重復實驗三次,采用Origin9.1軟件對實驗數(shù)據(jù)進行作圖及分析。
2 結果與討論
2.1接枝度(DG)和褐變程度(A(420 nm))的分析
接枝度和褐變程度常被用來評價糖基化反應的程度。糖基化反應過程中,蛋白質中的游離氨基可以與多糖的羰基發(fā)生反應,形成共價復合物,使體系中的游離氨基逐漸減少,接枝度升高[18]。MBPI和Dextran反應產物的接枝度隨反應時間的變化如圖1所示。隨著反應時間的延長,產物的接枝度不斷增加。這是由于隨著加熱時間的延長,蛋白質鏈展開,從而暴露出更多的游離氨基參與到反應中,使接枝度不斷增大[10]。

圖1 綠豆分離蛋白-葡聚糖復合物接枝度 和褐變程度的變化Fig.1 DG degree of the glycosylation and browning of mung bean protein isolates-dextran conjugates注:樣品1~6:反應1~6 h后得到的 綠豆分離蛋白-葡聚糖共價復合物,圖3~圖5同。
MBPI-Dextran共價復合物的褐變程度隨反應的時間延長逐漸增強。有報道稱[8],Maillard反應的高級階段,糖類中的還原性羰基和蛋白質中的游離氨基的反應會生成含氮的棕色聚合物或共聚物。褐變程度的增加表明綠豆分離蛋白和葡聚糖在反應過程中生成了Maillard高級反應產物,并隨時間的延長含量逐漸增加。
2.2SDS-PAGE凝膠電泳分析
圖2為反應不同時間后得到的MBPI-Dextran共價復合物的電泳譜圖。反應1 h后,(條帶3),分離膠上端逐漸出現(xiàn)較寬的條帶,這表明綠豆分離蛋白和葡聚糖反應后產生了較大分子量的復合物[14],隨著反應時間的延長,靠近分離膠頂端的條帶顏色逐漸加深,表明有越來越多的大分子量物質的生成。同時,分子量在18.4~66.2 ku之間的條帶隨著反應時間的延長逐漸變淺直至消失,表明這些范圍內的蛋白亞基參與了糖基化反應。MBPI-Dextran共價復合物電泳圖譜的這種變化與接枝度及褐變程度的變化情況相符。

圖2 綠豆分離蛋白-葡聚糖復合物電泳圖譜Fig.2 SDS-PAGE profiles of mung bean protein isolates-dextran conjugates注:條帶M:蛋白質標準品;條帶1:未處理綠豆分離蛋白; 條帶2:綠豆分離蛋白和葡聚糖的混合物;條帶3~8: 反應1~6 h后得到的綠豆分離蛋白-葡聚糖共價復合物。
2.3溶解性分析
圖3為MBPI-Dextran共價復合物溶解性隨反應時間的變化情況,隨反應時間的延長復合物的溶解性逐漸增加后呈現(xiàn)出略微的下降,但糖基化處理組整體上溶解度均高于未處理的綠豆分離蛋白。這是因為反應的開始階段,隨著接枝度逐漸增大,由于糖鏈的引入為綠豆分離蛋白帶來了親水性羥基,使得蛋白質分子表面形成水化層,增加了綠豆分離蛋白的親水性[19],也有研究表明適度的熱處理對蛋白質的溶解性有一定的改善作用。隨著反應時間的繼續(xù)延長,接枝物的溶解性發(fā)生略微的下降,這是由于蛋白質分子進一步交聯(lián)聚合的結果。這個結果與已有報道的研究結果相符[20-22]。
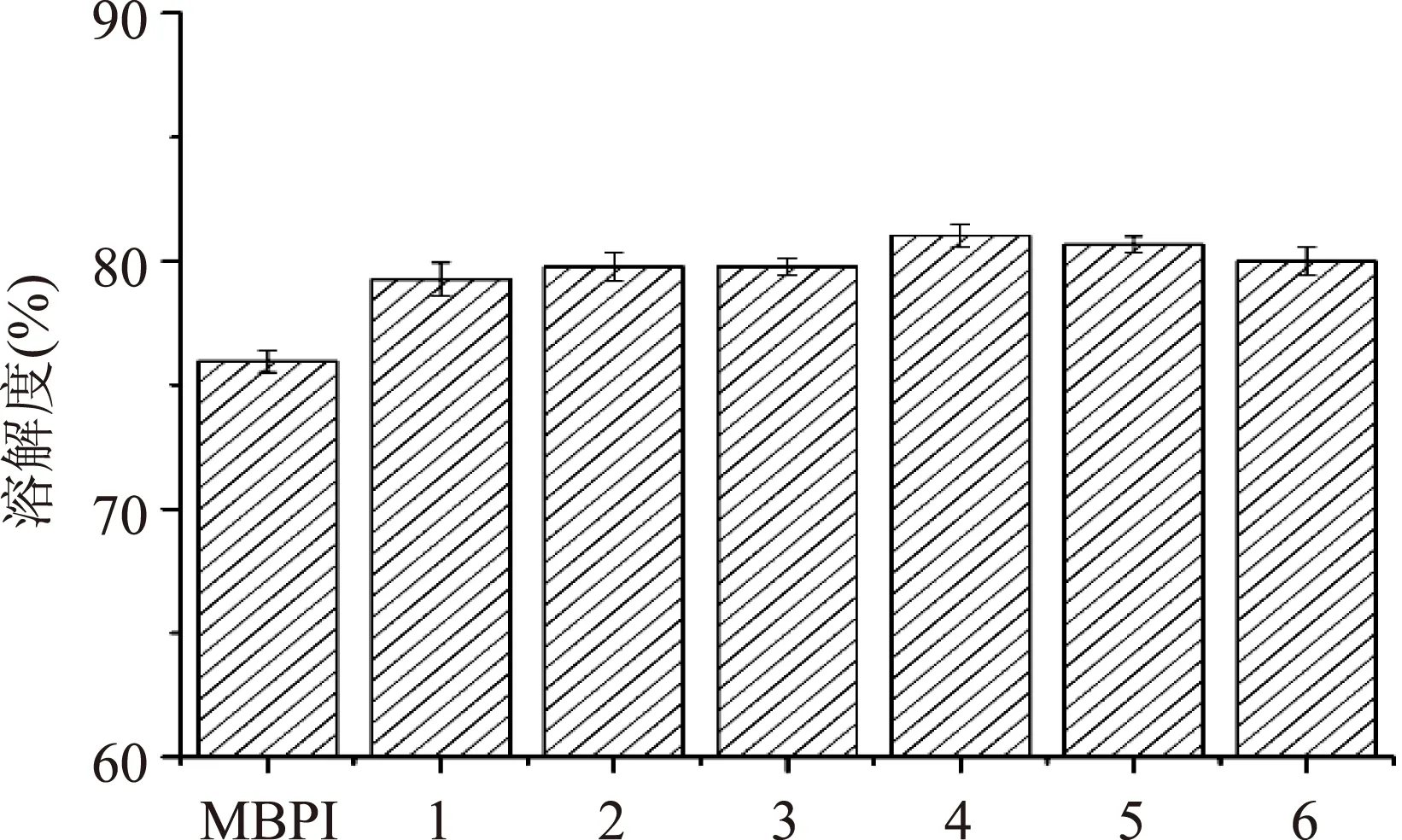
圖3 綠豆分離蛋白-葡聚糖復合物的溶解性Fig.3 Solubility of mung bean protein isolates-dextran conjugates
2.4乳化特性分析

圖4 綠豆分離蛋白-葡聚糖復合物乳液的 平均粒徑及粒徑分布Fig.4 The average particle size and particle size distribution of mung bean protein isolates-dextran conjugates emulsions
圖4顯示了MBPI-Dextran共價復合物制備的乳液的粒徑大小及粒徑分布情況。MBPI-Dextran共價復合物乳液的粒徑比未處理MBPI的乳液粒徑小,這是因為糖基化反應后多糖鏈中的親水基團的引入,使得MBPI更有效的吸附到油-水界面上,界面的張力下降,從而提高蛋白的乳化活性[23],此外,液滴表面吸附的共價復合物分子由于具有較大的分子空間位阻效應,能夠阻止新液滴的形成,從而促進了微小乳液顆粒的形成,使所得到的乳液體系更加穩(wěn)定[24]。隨著反應時間的延長,乳液液滴的粒徑呈現(xiàn)出先減小后增大的趨勢,但糖基化處理組的乳液液滴粒徑整體上均小于未處理組。這是因為隨著反應繼續(xù)進行,接枝度不斷增大,更多的親水基團的引入會對油-水界面的平衡造成破壞,從而降低乳化活性[25]。
2.5表面疏水性分析
MBPI-Dextran共價復合物的表面疏水性(H0)如圖5所示。可以看出,隨著糖基化反應的時間延長,產物的H0不斷下降。這是因為糖基化反應后Dextran和MBPI發(fā)生了共價結合,一方面,糖基化反應能減少蛋白分子內部疏水性基團的暴露,另一方面,具有親水性基團的Dextran的接入增加了分子表面的親水性[26]。結構緊湊的球蛋白內部包埋著大量的疏水性殘基[27],當綠豆分離蛋白與葡聚糖發(fā)生共價復合后,多糖的遮蔽效應使得熒光探針難以進入蛋白質的內部與其發(fā)生結合,從而使H0下降[28]。此外,高溫高濕的極性反應條件處理下,蛋白質分子之間會發(fā)生強烈的疏水相互作用和聚集作用,重新形成內部疏水區(qū)域,從而提高了蛋白質的親水性[29]。研究表明[30],蛋白質的表面疏水性與蛋白質的溶解性、表面性質等功能性質有一定的聯(lián)系,適當?shù)臏p少蛋白分子的表面疏水性有利于蛋白質溶解度的提升,為其功能性的改善提供基礎。

圖5 綠豆分離蛋白-葡聚糖復合物的表面疏水性Fig.5 The surface hydrophobicity of mung bean protein isolates-dextran conjugates
3 結論
隨著糖基化反應時間的延長,MBPI-Dextran接枝反應程度不斷增加,接枝度和褐變程度不斷增大;SDS-PAGE凝膠電泳分析表明,隨著反應時間的延長,分子量較大的共價復合物逐漸形成,表明MBPI和Dextran之間發(fā)生了共價結合;疏水性的分析表明,糖基化處理能顯著降低蛋白質的表面疏水性;經(jīng)過改性后的蛋白質溶解性和乳化特性得到改善,改善效果隨反應時間的延長呈現(xiàn)出先升高后降低的趨勢。本研究表明在適當?shù)姆磻獥l件下,利用Dextran共價修飾MBPI是一種有效的改善MBPI理化性質的途徑。
[1]劉慧.我國綠豆生產現(xiàn)狀和發(fā)展前景[J].農業(yè)展望,2012,8(6):36-39.
[2]Adsule R,Kadam S,Salunkhe D,Luh B.Chemistry and technology of green gram(Vigna radiata[L.]Wilczek)[J].Critical Reviews in Food Science & Nutrition,1986,25(1):73-105.
[3]El Adawy T.Chemical,nutritional and functional properties of mung bean protein isolate and concentrate[J].Menofiya Journal of Agricultural Research,1996.
[4]Saeki H,Inoue K.Improved solubility of carp myofibrillar proteins in low ionic strength medium by glycosylation[J].Journal of Agricultural and Food Chemistry,1997,45(9):3419-3422.
[5]O’Regan J,Mulvihill DM.Heat stability and freeze-thaw stability of oil-in-water emulsions stabilised by sodium caseinate-maltodextrin conjugates[J].Food chemistry,2010,119(1):182-190.
[6]Hattori M,Miyakawa S,Ohama Y,et al.Reduced immunogenicity ofβ-lactoglobulin by conjugation with acidic oligosaccharides[J].Journal of Agricultural and Food Chemistry,2004,52(14):4546-4553.
[7]Qi JR,Yang XQ,Liao JS.Improvement of functional properties of acid-precipitated soy protein by the attachment of dextran through Maillard reaction[J].International Journal of Food Science & Technology,2009,44(11):2296-2302.
[8]Jimenez-Castano L,Villamiel M,López-Fandio R.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J].Food Hydrocolloids,2007,21(3):433-443.
[9]Li Y,Lu F,Luo C,et al.Functional properties of the Maillard reaction products of rice protein with sugar[J].Food Chemistry,2009,117(1):69-74.
[10]Zhang B,Guo X,Zhu K,et al.Improvement of emulsifying properties of oat protein isolate-dextran conjugates by glycation[J].Carbohydrate polymers,2015,127:168-175.
[11]Jiménez-Castao L,López-Fandio R,Olano A,et al.Study onβ-lactoglobulin glycosylation with dextran:effect on solubility and heat stability[J].Food Chemistry,2005,93(4):689-695.
[12]劉冬兒,呂天喜.綠豆分離蛋白的制備及其功能特性的研究[J].糧食與食品工業(yè),2007,14(2):27-30.
[13]Church FC,Swaisgood HE,Porter DH,et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[14]Diftis N,Kiosseoglou V.Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry,2003,81(1):1-6.
[15]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta(BBA)-Protein Structure,1980,624(1):13-20.
[16]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].nature,1970,227(5259):680-685.
[17]李恒.人源 CFI_m 復合物識別 pre-mRNA 的分子機制及酵母 Pub1 蛋白結構的生物學研究[J].中國科學技術大學,2010.
[18]Laroque D,Inisan C,Berger C,et al.Kinetic study on the Maillard reaction.Consideration of sugar reactivity[J].Food Chemistry,2008,111(4):1032-1042.
[19]Bera M,Mukherjee R.Solubility,emulsifying,and foaming properties of rice bran protein concentrates[J].Journal of Food
Science,1989,54(1):142-145.
[20]Katayama S,Shima J,Saeki H.Solubility improvement of shellfish muscle proteins by reaction with glucose and its soluble state in low-ionic-strength medium[J].Journal of Agricultural and Food Chemistry,2002,50(15):4327-4332.
[21]Sato R,Sawabe T,Kishimura H,et al.Preparation of neoglycoprotein from carp myofibrillar protein and alginate oligosaccharide:improved solubility in low ionic strength medium[J].Journal of Agricultural and Food Chemistry,2000,48(1):17-21.
[22]Tanabe M,Saeki H.Effect of Maillard reaction with glucose and ribose on solubility at low ionic strength and filament-forming ability of fish myosin[J].Journal of Agricultural and Food Chemistry,2001,49(7):3403-3407.
[23]Ghosh S,Cramp GL,Coupland JN.Effect of aqueous composition on the freeze-thaw stability of emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,272(1):82-88.
[24]Hall GM.Methods of testing protein functionality[J]. Springer Science & Business Media,1996.
[25]Dickinson E:Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J]. Soft Matter,2008,4(5):932-942.
[26]Seo S,Karboune S,L’Hocine L,et al.Characterization of glycated lysozyme with galactose,galactooligosaccharides and galactan:Effect of glycation on structural and functional properties of conjugates[J].LWT-Food Science and Technology,2013,53(1):44-53.
[27]Hayakawa S,Nakai S.Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J].Journal of Food Science,1985,50(2):486-491.
[28]Xue F,Li C,Zhu X,et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J].Food Research International,2013,51(2):490-495.
[29]林花,于淑娟.牛血清白蛋白-葡聚糖接枝改性及機理研究[J].食品科學,2010(5):18-22.
[30]卓秀英.大分子擁擠環(huán)境下大豆蛋白接枝改性研究[D]. 廣州:華南理工大學,2012.
Study on glycosylation of mung bean protein isolates and dextran
HAN Fei-fei1,LI Yang1,WANG Zhong-jiang1,SUI Xiao-nan1,QI Bao-kun1,WANG Rui1,BI Shuang1,LI Qiu-hui1,JIANG Lian-zhou1,2,*
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.National Research Centre of Soybean Engineering and Technology,Harbin 150030,China)
In order to improve the physicochemical properties of mung bean protein isolates(MBPI),MBPI-dextran covalent conjugates were prepared via Maillard reaction,solubility,emulsifying properties,surface hydrophobicity and subunit structure were studied.SDS-PAGE gel electrophoresis analysis showed that larger molecular weight covalent conjugates were formed,surface hydrophobicity analysis showed that compared to the untreated protein,MBPI-dextran covalent conjugates had a lower surface hydrophobicity,physicochemical properties such as solubility and emulsifying properties were improved after glycosylation.
mung bean protein isolates;glycosylation;protein modification
2015-11-19
韓飛飛(1991-),女,在讀碩士,研究方向:糧食、油脂及植物蛋白工程,E-mail:hffsunshine@163.com。
江連洲(1960-),男,博士,教授,研究方向:糧食、油脂及植物蛋白工程,E-mail:jlzname@163.com。
國家自然科學基金(31571876、31301501);國家科技支撐計劃課題(2014BAD22B00);國家“863”計劃(2013AA102101);黑龍江省自然科學基金項目(ZD201302);高等學校博士學科點專項科研基金(20132325110013);國家“863”計劃(2013AA102104)。
TS214.9
A
1002-0306(2016)09-0049-05
10.13386/j.issn1002-0306.2016.09.001

