利用鯊魚軟骨制備鈣螯合膠原肽及其性質的研究
陳 俊,李 婷,張 萌,翁武銀,3,*
(1.華僑大學化工學院,福建廈門 361021;2.集美大學食品與生物工程學院,福建廈門 361021;3.廈門市海洋功能食品重點實驗室,福建廈門 361021)
?
利用鯊魚軟骨制備鈣螯合膠原肽及其性質的研究
陳俊1,2,3,李婷2,張萌2,翁武銀2,3,*
(1.華僑大學化工學院,福建廈門 361021;2.集美大學食品與生物工程學院,福建廈門 361021;3.廈門市海洋功能食品重點實驗室,福建廈門 361021)
以鯊魚軟骨為原料,通過單因素實驗和正交實驗優化膠原肽螯合鈣的酶解制備工藝。結果發現,當酶解時間、酶添加量、底物濃度分別為1 h,0.25%,25 mg/mL時,制備的鯊魚軟骨膠原肽的鈣螯合能力可達1087.01 mg/100 g蛋白。制備的鈣螯合膠原肽小于5000 u的組分約占84%,天冬氨酸和谷氨酸占總氨基酸的比例為17.07%,疏水性氨基酸占總氨基酸的比例為41.24%,而必需氨基酸占總氨基酸的比例只有22.81%。根據紅外光譜和掃描電鏡結果,發現鯊魚軟骨膠原肽螯合鈣的微觀結構均勻致密,不僅具有膠原蛋白的特征,還含有硫酸軟骨素的特征。
鯊魚軟骨,鈣螯合膠原肽,酶解,氨基酸組成,分子量分布
鈣是人體必需的常量元素,在促進生長發育和維持機體正常生理功能等方面發揮著極為重要的作用[1]。營養調查表明,我國大多數人的鈣攝入水平只達到適宜攝入量的20%~60%[2]。而且,攝入的鈣不一定完全都被人體所吸收,只有在小腸中為離子狀態或與可溶性有機分子結合才容易被吸收[3-4]。因此,鈣營養不足的問題近年來逐漸引起關注。
另一方面,隨著我國魚類加工產業集約化程度不斷提高,魚皮、魚鱗和魚骨等副產物產量也在逐年增加,因此利用魚類加工副產物的蛋白資源制備具有一定生理活性的寡肽,再與鈣進行螯合制備成膠原肽螯合鈣,不僅可以實現魚類資源的綜合利用,還可以為開發補鈣產品提供新的資源。其中,骨膠原肽不僅是一種潛在的鈣源,還可以促進人體吸收膳食中的鈣,提高人體對鈣的生物利用度,增強骨密度和預防骨質疏松[5]。陸劍鋒等[6]利用斑點叉尾鮰魚骨制備了膠原肽螯合鈣,并通過紫外吸收和傅里葉變換紅外光譜掃描證明了骨膠原肽與鈣形成了螯合物。與一般魚骨相比較,鯊魚軟骨脂肪含量低,富含蛋白質、碳水化合物和無機鹽[7],主要被用于提取硫酸軟骨素。然而,有關鯊魚軟骨膠原肽螯合鈣的研究目前還尚未見報道。
因此,本研究利用酶解方法,在單因素實驗的基礎上通過正交實驗優化鯊魚軟骨膠原肽螯合鈣的制備工藝,對鈣螯合膠原肽的氨基酸組成和分子量分布進行了測定,并通過紅外光譜和掃描電鏡分析了鈣螯合膠原肽的二級結構和微觀結構,為鯊魚軟骨的多元化利用提供參考。
1 材料與方法
1.1材料與儀器
鯊魚軟骨龍巖市潤寶生物科技有限公司;堿性蛋白酶(20萬U/g)南寧龐博生物工程有限公司;氫氧化鈉、鹽酸、硫酸、無水乙醇西隴化工股份有限公司;高氯酸、硝酸國藥集團化學試劑有限公司;鈣標準溶液國家有色金屬及電子材料分析測試中心;乙腈、甲醇(色譜純)美國TEDIA公司;三氟乙酸(色譜純)美國Amresco公司。
Avanti J-25高速冷凍離心機美國Beckman公司;Thermo Solaar M6原子吸收光譜儀美國熱電公司;日立L-8900全自動氨基酸分析儀日本日立制造所;安捷倫1200高效液相色譜儀美國Agilent公司;Nicolet 380傅里葉變換紅外分光光度計美國熱電公司;S-4800型掃描電子顯微鏡:日本日立制造所。
1.2實驗方法
1.2.1鯊魚軟骨膠原肽螯合鈣的制備將干燥的鯊魚軟骨研磨成粉,用蒸餾水溶解至一定的質量濃度,加入堿性蛋白酶,在50 ℃、pH9.0條件下進行酶解,酶解結束后利用沸水浴滅酶10 min并冷卻至室溫,將離心(4000 r/min、20 min)獲得上清通過冷凍干燥制備成膠原肽螯合鈣,考察酶解時間、酶添加量以及底物濃度對鈣螯合能力的影響。
1.2.1.1酶解時間的影響在酶添加量為0.5%,底物濃度50 mg/mL的條件下,考察不同酶解時間(1、2、4、6、8 h)對鯊魚軟骨膠原肽鈣螯合能力的影響。底物濃度25 mg/mL,酶添加量0.25%。
1.2.1.2酶添加量的影響在酶解時間2 h,底物濃度50 mg/mL的條件下,考察不同酶添加量(0.25%、0.50%、0.75%、1.00%)對鯊魚軟骨膠原肽鈣螯合能力的影響。
1.2.1.3底物濃度的影響在酶添加量為0.5%,酶解時間2 h的條件下,考察不同底物濃度(25、50、75、100 mg/mL)對鯊魚軟骨膠原肽鈣螯合能力的影響。
1.2.1.4正交實驗以鈣螯合能力為指標,在單因素實驗的基礎上設計了鯊魚軟骨酶解的正交實驗的各因素水平(表1),在最佳條件下獲得的樣品經真空冷凍干燥后,置于-20 ℃保存備用。
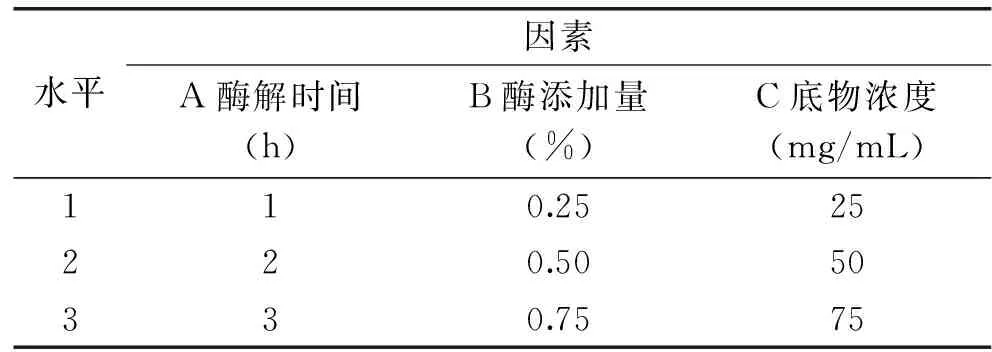
表1 正交因素與水平
1.2.2鈣螯合能力取一定量的鯊魚軟骨膠原肽鈣利用混酸(硝酸∶高氯酸=5∶1)消解2 h以上,冷卻后利用超純水定容,采用火焰原子吸收光譜法測定樣品中的鈣含量,采用凱氏定氮法測定樣品中的蛋白含量,鈣的螯合能力的計算公式如下:
式中,A-樣品中的蛋白含量(g/100 g);B-樣品中的鈣含量(mg/100 g)。
1.2.3氨基酸組成稱取一定量的鯊魚軟骨膠原肽螯合鈣粉末,放入可密封的消化管中,加入1 mL 6 mol/L HCl,抽真空、充氮氣后,在110 ℃的條件下水解22 h,通過旋轉蒸發除去鹽酸,定容稀釋至一定濃度后過0.22 μm濾膜,利用氨基酸分析儀測定螯合物中氨基酸組成。其中羥脯氨酸的含量采用羥脯氨酸試劑盒進行測定。
1.2.4分子量分布鈣螯合膠原肽分子量分布的測定參考Weng等[8]報道的方法。樣品利用0.22 μm濾膜處理后,利用高效液相色譜儀進行測定,并利用GPC軟件對其分子量分布進行分析。其中測定條件:流動相為乙腈/水/三氟乙酸(45∶55∶0.1,v/v/v),柱溫為30 °C,紫外檢測波長為214 nm。標準品為細胞色素C(12500 u)、抑肽酶(6533 u)、氧化型谷胱甘肽(613 u)、Gly-Gly-Gly(189 u)和Gly(75 u)。
1.2.5傅里葉變換紅外光譜將干燥的樣品與KBr按1∶100(w/w)的比例混合并用瑪瑙研缽研磨均勻。用壓片機壓成透明均勻的薄片后,利用傅里葉變換紅外光譜儀進行掃描,波數為4000~400 cm-1,光譜分辨率為0.01 cm-1。
1.2.6掃描電鏡分析取適量的樣品粉末均勻涂在樣品盤的導電膠上,使導電膠表面粘結一層均勻的粉末,經離子濺射儀噴金鍍膜后,利用掃描電子顯微鏡對膠原肽螯合鈣的微觀結構進行觀察,其中加速電壓為5 kv。
2 結果與分析
2. 1酶解工藝的優化
2.1.1酶解時間的影響圖1顯示了酶解時間對鯊魚軟骨膠原肽鈣螯合能力的影響。隨著酶解時間的延長,鯊魚軟骨膠原肽的鈣螯合能力逐漸降低。當酶解時間為2 h時,鯊魚軟骨膠原肽的鈣螯合能力高達898 mg/100 g蛋白。當酶解時間延長至8 h時,膠原肽的鈣螯合能力下降至359 mg/100 g蛋白。據報道,由于肽鏈中的羰基和亞氨基也可能參與金屬離子的配位,故蛋白肽與金屬離子的螯合能力可能會比氨基酸更高[9]。因此,隨著酶解的進行,鯊魚軟骨中的膠原酶解成小分子肽、最后轉變成氨基酸,結果導致酶解物的鈣螯合能力逐漸下降(圖1)。這與劉玉花等[10]人報道的羊骨膠原鈣螯合肽的酶解結果類似。根據圖1的結果,選擇酶解時間為2 h進一步研究酶添加量和底物濃度對鯊魚軟骨膠原肽鈣螯合能力的影響。
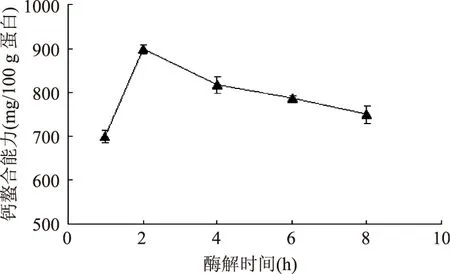
圖1 酶解時間對鯊魚軟骨膠原肽鈣螯合能力的影響Fig.1 Effect of hydrolysis time on the calcium-binding ability of shark cartilage collagen peptides
2.1.2酶添加量的影響伴隨著酶添加量的增加,鯊魚軟骨膠原肽鈣螯合能力呈先上升后下降,逐漸趨于穩定的傾向。當酶添加量為0.50%時,鯊魚軟骨膠原肽的鈣螯合能力最高,100 g蛋白可以螯合898 mg的鈣。然而,進一步提高酶的添加量,膠原肽的鈣螯合能力卻出現下降,這可能是膠原蛋白被過度酶解,導致鈣螯合能力下降。夏松養等[11]也報道了隨著酶解時間的延長,低值魚蛋白的水解度出現上升的趨勢,但鈣螯合能力卻出現了顯著的下降。因此,選取酶添加量為0.50%。
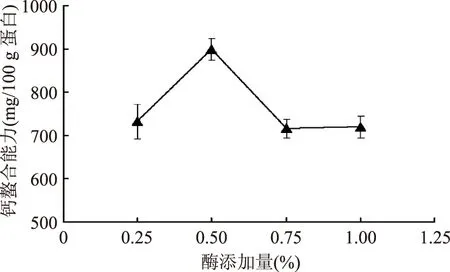
圖2 酶添加量對鯊魚軟骨膠原肽鈣螯合能力的影響Fig.2 Effect of enzyme dosage on the calcium-binding ability of shark cartilage collagen peptides
2.1.3底物濃度的影響當底物濃度為25 mg/mL時,制備的鯊魚軟骨膠原肽的鈣螯合能力為898 mg/100 g蛋白。當進一步提高底物濃度時,鯊魚軟骨膠原肽的鈣螯合能力出現先下降后上升的趨勢。由于鯊魚軟骨中除了膠原蛋白,還含有大量軟骨素等多糖[7]。因此,隨著底物濃度的增加,酶解液中多糖含量也會逐漸增加導致溶液粘度增大,部分鈣以粘附的狀態存在于酶解液中。因此,綜合考慮,選擇底物濃度為25 mg/mL。

圖3 底物濃度對鯊魚軟骨膠原肽鈣螯合能力的影響Fig.3 Effect of substrate concentration on the calcium-binding ability of shark cartilage collagen peptides
2.1.4正交實驗結果與分析由表2可知,影響鯊魚軟骨膠原肽的鈣螯合能力的因素主次為:酶解時間>底物濃度>酶添加量,優化結果為:酶解時間1 h,底物濃度25 mg/mL,酶添加量0.25%。在該條件下制備的鯊魚軟骨膠原肽的鈣螯合能力高達1087.01 mg/100 g 蛋白。

表2 正交實驗結果與分析
2.2鯊魚軟骨膠原肽螯合鈣的性質分析
2.2.1氨基酸組成表3顯示了在最優條件下利用鯊魚軟骨制備的鈣螯合膠原肽的氨基酸組成。在鈣螯合膠原肽中甘氨酸含量最多,其次是谷氨酸和脯氨酸。由表3還可以發現100 g鈣螯合膠原肽中總氨基酸含量為74.22 g,而游離氨基酸含量只有16.00 g,表明酶解制備的鯊魚軟骨提取物主要是由寡肽組成。有研究報道膠原肽的鈣螯合能力與某些氨基酸具有一定的相關性,天冬氨酸和谷氨酸上的羧基可能是鈣離子與肽的結合位點而顯著影響膠原肽的螯合能力[12]。還有研究表明小麥胚芽蛋白酶解物的疏水性氨基酸含量與其鈣螯合能力具有正相關關系[13]。在本研究制備的鈣螯合膠原肽中,天冬氨酸和谷氨酸含量占總氨基酸含量的17.07%,而疏水性氨基酸含量卻高達41.24%,表明鯊魚軟骨可作為制備膠原肽螯合鈣的良好原料。然而,100 g鈣螯合膠原肽中必需氨基酸含量只有16.93 g,約占總氨基酸含量的22.81%,明顯低于聯合國糧農組織/世界衛生組織規定的標準(40%)。

表3 鯊魚軟骨制備的鈣螯合膠原肽的氨基酸組成
注:* 表示氨基酸為疏水性氨基酸。
2.2.2分子量分布為進一步了解鯊魚軟骨膠原肽的鈣結合能力與其分子量的關系,利用高效液相凝膠色譜對最優條件下制備的鈣螯合膠原肽的分子量分布進行分析(圖4)。由圖可知,利用鯊魚軟骨制備的鈣螯合膠原肽的分子量主要分布在1000~5000 u。Jin等[14]研究發現,分子量小于5000 u的牛骨膠原多肽具有較好的鈣結合能力。利用GPC軟件對分子量分布進行分析后,發現本研究制備的鈣螯合膠原肽中小于5000 u的組分高達84%。
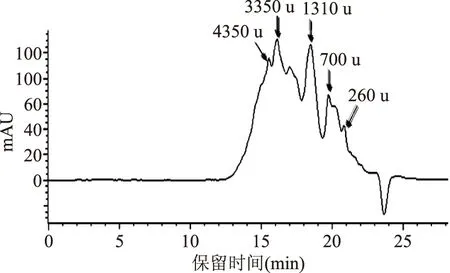
圖4 鯊魚軟骨制備的鈣螯合膠原肽的分子量分布Fig.4 Molecular weight distribution profile of calcium-chelating collagen peptides from shark cartilage
2.2.3傅里葉變換紅外光譜鯊魚軟骨膠原肽螯合鈣在3345.9、1653.8、1397.9 cm-1處出現明顯的特征吸收峰(圖5),分別代表了N-H的伸縮振動、C=O的伸縮振動和-COO-的對稱伸縮振動[15-16];同時在代表C-O伸縮振動的1244.4 cm-1處也出現明顯的吸收峰,這些結果表明鯊魚軟骨膠原肽螯合鈣中含有-NH2和-COOH結構。據報道,中華鱘軟骨中的硫酸軟骨素在1069.1 cm-1處具有吸收峰,為糖環C-O-C和C-O-H的C-O伸縮振動吸收峰[17]。圖5的1070.1 cm-1處觀察到的吸收峰表明了本研究制備的鯊魚軟骨膠原肽螯合鈣中也可能含有硫酸軟骨素。
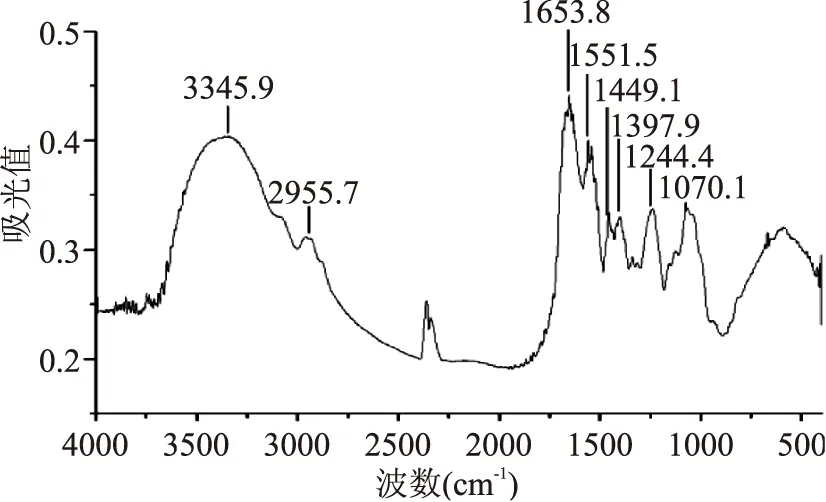
圖5 鯊魚軟骨膠原肽螯合鈣紅外光譜圖Fig.5 FTIR spectra of collagen peptide chelating calcium from shark cartilage
2.2.4微觀結構利用掃描電子顯微鏡對鯊魚軟骨膠原肽螯合鈣的微觀結構進行了觀察(圖6)。鯊魚軟骨經酶解后獲得的膠原肽螯合鈣的結構均致密。劉閃等[18]利用白鰱骨膠原肽與無機鈣進行結合制備膠原肽螯合鈣,電鏡掃描圖譜顯示在膠原肽螯合鈣的表面鑲嵌有CaCl2晶體。然而在本研究中未觀察到附著于膠原肽表面的白色晶體,這可能是鯊魚軟骨在酶解過程中,天然的鈣能夠均勻的螯合在膠原肽上,不容易形成晶體。

圖6 鯊魚軟骨膠原肽螯合鈣電鏡掃描圖譜(×25000)Fig.6 Scanning electron micrographs of collagen peptide chelating calcium from shark cartilage(×25000)
3 結論
以鈣螯合能力為指標,在單因素實驗的基礎上,通過正交實驗獲得鯊魚軟骨膠原肽螯合鈣的最佳制備工藝。制備的鈣螯合膠原肽的分子量主要集中在5000 u以下,氨基酸組成中天冬氨酸和谷氨酸,以及疏水性氨基酸占總氨基酸的比例較高,提示制備的鯊魚軟骨膠原肽具有良好的鈣螯合能力。紅外光譜圖和掃描電鏡圖譜的結果表明鯊魚軟骨通過酶解可以獲得均勻致密的膠原肽鈣螯合物。
[1]Robertson W G,Marshall R W,Bowers G N. Ionized calcium in body fluids[J]. Critical Reviews in Clinical Laboratory Sciences,1981,15(2):85-125.
[2]何宇納,翟鳳英,王志宏,等. 中國居民膳食鈣的攝入狀況[J]. 衛生研究,2007,36(5):600-602.
[3]Barger-Lux M J,Heaney R P,Recker R R. Time course of calcium absorption in humans:Evidence for a colonic component[J]. Calcified Tissue International,1989,44(5):308-311.
[4]Wasserman R H. Vitamin D and the dual processes of intestinal calcium absorption[J]. The Journal of Nutrition,2004,134(11):3137-3139.
[5]Xu Y J,Han X L,Li Y. Effect of marine collagen peptides on long bone development in growing rats[J]. Journal of the Science of Food and Agriculture,2010,90(9):1485-1491.
[6]陸劍鋒,孟昌偉,李進,等. 斑點叉尾鮰魚骨膠原多肽螯合鈣的制備及其特征[J]. 水產學報,2012,36(2):314-320.
[7]鄧必陽,張展霞. 鯊魚軟骨營養成分分析及其評價[J]. 營養學報,1999,21(1):104-108.
[8]Weng W,Tang L,Wang B,et al. Antioxidant properties of fractions isolated from blue shark(Prionaceglauca)skin gelatin hydrolysates[J]. Journal of Functional Foods,2014,11:342-351.
[9]王子懷,胡曉,李來好,等. 肽-金屬離子螯合物的研究進展[J]. 食品工業科技,2014,35(8):359-363.
[10]劉玉花,馬儷珍,孔保華,等. 羊骨膠原鈣螯合肽酶解工藝的研究[J]. 肉類研究,2009,4:25-29.
[11]夏松養,謝超,霍建聰,等. 魚蛋白酶水解物的鈣螯合修飾及其功能活性[J]. 水產學報,2008,32(3):471-477.
[12]Bao X L,Lv Y,Yang B C,et al. A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates[J]. Journal of Food Science,2008,73(3):C117-C121.
[13]Liu F R,Wang L,Wang R,et al. Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptide-calcium complex[J]. Journal of Agricultural and Food Chemistry,2013,61(31):7537-7544.
[14]Jin Y G,Fu W W,Ma M H. Preparation and structure characterization of soluble bone collagen peptide chelating calcium[J]. African Journal of Biotechnology,2013,10(50):10204-10211.
[15]Jackson M,Watson P H,Halliday W C,et al. Beware of connective tissue proteins:assignment and implications of collagen absorptions in infrared spectra of human tissues[J]. Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease,1995,1270(1):1-6.
[16]Doyle B B,Bendit E G,Blout E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers,1975,14(5):937-957.
[17]Zhao T,Zhou Y,Mao G,et al. Extraction,purification and characterisation of chondroitin sulfate in Chinese sturgeon cartilage[J]. Journal of the Science of Food and Agriculture,2013,93(7):1633-1640.
[18]劉閃,劉良忠,李小娜,等. 白鰱魚骨膠原多肽螯合鈣的工藝優化[J]. 食品科學,2014,35(10):76-81.
Preparation and characterization of calcium-chelating collagen peptides from blue shark(Prionaceglauca)cartilage
CHEN Jun1,2,3,LI Ting2,ZHANG Meng2,WENG Wu-yin2,3,*
(1.College of Chemical Engineering,Huaqiao University,Xiamen 361021,China;2.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;3.Xiamen Key Laboratory of Marine Functional Food,Xiamen 361021,China)
The optimum enzymolysis condition of calcium-chelating collagen peptides from blue shark cartilage was investigated by single factor test and orthogonal test. The maximum calcium-chelating ability(1087.01 mg/100 g protein)was obtained at hydrolysis time of 1 h,enzyme dosage of 0.25% and substrate concentration of 25 mg/mL. In the obtained collagen peptides,about 84% component was distributed with molecular weight below 5000 u,the content of glutamic acid and aspartic acid,and the content of hydrophobic amino acids were 17.07% and 41.24%,respectively. However,the ratio of essential amino acids to total amino acids was 22.81%. Based on results of fourier transform infrared spectroscopy(FTIR)and scanning electron microscope(SEM),it was found that the microstructure of calcium-chelating collagen peptides,which not only had the characteristics of collagen but also contained chondroitin sulfate,was uniform compact.
shark cartilage;calcium-chelating collagen peptides;enzymatic hydrolysis;amino acid composition;molecular weight distribution
2015-12-14
陳俊(1977-),男,博士研究生,副教授,主要從事天然產物開發利用研究,E-mail:chenjun@jmu.edu.cn。
翁武銀(1974-),男,博士,教授,主要從事蛋白質化學和水產加工研究,E-mail:wwymail@jmu.edu.cn。
福建省杰出青年科學基金項目(2014J06013);福建省科技重點項目(2014Y0081);廈門市科技計劃項目(3502Z20131152)。
TS254.9
A
1002-0306(2016)11-0053-05
10.13386/j.issn1002-0306.2016.11.002

