接種摩西管柄囊霉(Funneliformis mosseae)對連作大豆根腐病病原菌菌群結構的影響
崔佳琦,范雪露,蔡柏巖(黑龍江大學生命科學學院,哈爾濱50080;黑龍江省普通高等學校微生物重點實驗室,哈爾濱50080)
?
接種摩西管柄囊霉(Funneliformis mosseae)對連作大豆根腐病病原菌菌群結構的影響
崔佳琦1,2,范雪露1,2,蔡柏巖1,2
(1黑龍江大學生命科學學院,哈爾濱150080;
2黑龍江省普通高等學校微生物重點實驗室,哈爾濱150080)
筆者將生物修復方法應用于連作大豆根腐病防治中,旨在降低連作大豆根腐病發生以及提高大豆質量。試驗選擇3個大豆品種作為試驗材料并接種摩西管柄囊霉(Funneliformis mosseae),通過PCRDGGE技術研究F.mosseae對連作大豆根系以及根際土壤根腐病病原菌菌群結構的影響。試驗結果表明:3個大豆品種接種F.mosseae后,試驗組根樣以及根際土樣根腐病病原菌豐度以及多樣性指數顯著低于對照組,并且接種F.mosseae對不同大豆品種防治效果存在差異;聚類分析結果也驗證了接種F. mosseae對連作大豆根樣以及根際土樣根腐病病原菌產生以及分布產生影響。
根腐病;F.mosseae;大豆連作;菌群結構
0 引言
大豆(Glycine max[L.]Merr.)是重要的油料以及經濟作物,為人類提供了豐富的脂質以及蛋白質資源[1-2]。黑龍江地區是中國大豆主要生產基地,大豆種植面積以及產量在中國大豆產業中占有重要地位。農業生產中,作物種植方式是影響土壤微生物菌群結構的關鍵因素[3]。近年來,由于黑龍江地區大豆種植方式的改變,即大豆長期連作,造成了土壤中微生物菌群結構以及土壤理化性質發生了顯著的變化[4],大豆田土壤由高肥力的細菌型逐漸轉變為低肥力的真菌型[5],最終導致大豆根腐病(Root rot)發生頻率顯著提高。因此,探索如何緩解以及防治大豆根腐病發生已成為首要課題。
近年來,高效、低耗以及環保型生物防治方法突顯出極大的研究價值以及應用潛力。科研人員已將植物-微生物共生體應用于植物抗逆性研究中,并取得了豐碩的研究成果。叢枝菌根(Arbuscular Mycorrhizal)真菌是土壤生態系統中同時具有植物根系以及微生物特性的互惠共生體[6]。AM真菌可以與陸生維管植物根系建立共生關系,形成“菌根”結構。AM真菌通過形成龐大的菌絲體結構,可以擴大植物根系對根際土壤中水分以及礦質元素的吸收面積[7-8],進而加快葉綠體的形成,提高植株光合速率以及生物量[9-10]。AM真菌在調節植物抗逆性過程中,通過對植物相關代謝、防御性基因表達的影響,達到對植物防御性蛋白、防御性酶類以及次生代謝產物的調控[11-12],進而增強植株抗病蟲害[13]、抗干旱[14]以及抗重金屬污染能力[15-16]。因此,AM真菌在維持生態系統多樣性以及微生態系統穩定性方面具有重要作用。
鑒于AM真菌在土壤生態系統中的重要作用以及生物修復方法在防治作物病害方面的研究基礎。本試驗通過向黑龍江地區種植面積較大、代表性較強的3個非轉基因大豆品種不同連作年限盆栽土壤中接種篩選自黑龍江地區連作大豆田優勢AM真菌-摩西管柄囊霉(F.mosseae),研究F.mosseae對不同大豆品種根系以及根際土壤中根腐病病原菌菌群結構的影響。旨在為AM菌劑應用于防治大豆根腐病發生做出前期探索以及實踐,并為AM菌劑應用于緩解大豆連作障礙提供理論依據。
1 材料與方法
1.1試驗樣地
本試驗于2014年5—8月在哈爾濱工業大學糖業研究所試驗站進行(46°40′N,130°10′E)。分別選用未種植過大豆土壤(L0)、連作1年大豆田土壤(已種植過2年大豆田土壤,L1)以及連作2年大豆田土壤(已種植過3年大豆田土壤,L2)進行試驗。
試驗土壤初始理化指標:有機質26.13 g/kg,全N 1.69g/kg、全K25.4g/kg、全P5.5g/kg、堿解N133.1mg/kg、速效P 13.14 mg/kg,速效K 206 mg/kg、pH 7.0。
1.2試驗材料以及供試菌種
試驗選用黑龍江地區種植面積較廣、代表性較強的3個非轉基因大豆品種:‘墾豐16'(KF16,中間型,脂肪含量:20.00%,蛋白質含量:40.17%),‘黑農44' (HN44,高脂肪型,脂肪含量:23.01%,蛋白質含量:36.06%),‘黑農48'(HN48,高蛋白型,脂肪含量:19.50%,蛋白質含量:45.23%)。
試驗菌種篩選自黑龍江地區連作大豆田優勢AM真菌-摩西管柄囊霉(F.mosseae),保藏于中國科學院微生物研究所,菌種保藏號:CGMCC No.3012。
1.3試驗方法
1.3.1試驗設計 試驗采用盆栽方式。每盆裝風干土壤4 kg,土壤分別取自L0、L1以及L2。土壤裝好后,向盆體中接種45 g F.mosseae菌劑(試驗組,簡寫:TF),將菌劑與土壤充分混勻,并設置對照組(簡寫:CF,未接種F.mosseae)。每個試驗處理重復6次。2014年5月17日進行播種,每盆留苗3株,生產管理同大豆田。同時在盆體周圍擺放種植大豆、同樣大小的盆體,作為保護行,防止邊際效應。
1.3.2樣品采集及處理 在大豆苗期(簡寫:S,播種后30天)和分枝期(簡寫:B,播種后60天)進行樣品采集。采集土樣時,將盆體土壤表面雜物去除。利用鏟子挖10~20 cm土壤剖面,將大豆根系取出。用手輕輕抖動大豆植株后,附著在大豆根系表面1~3 cm處土壤,即根際土樣。將盆體中3株大豆植株根際土樣混合在一起,記為1個樣品。采集根樣時,利用自來水將大豆根系表面土壤洗凈,利用剪刀將盆體中3株大豆植株根系剪下并混合,記為1個樣品。隨機選擇同一處理、不同盆體,重復上述步驟3次,將不同連作年限根樣分別標記為RL0、RL1以及RL2,不同連作年限土樣分別標記為SL0、SL1以及SL2。樣品收集好后,立即帶回實驗室并保存在4℃冰箱中。
1.3.3PCR-DGGE大豆根樣以及根際土樣總DNA分別利用十六烷基三甲基溴化銨(CTAB)法和土壤基因組提取試劑盒(E.Z.N.A.Soil DNAKit,Omega,USA)進行提取。大豆根樣以及根際土樣總基因組提取完畢后,通過真菌通用性引物:NS1(上游引物):5′-GTAGTCATATGCTTGTCTC-3′和FungGC(下游引物):5′-CGCCCGCCGCGCCCCGCGCCCGGCCCGC CGCCCCCGCCCCATTCCCCGTTACCCGTTG-3′對真菌18S rRNA(V1+V2)區進行特異性擴增。PCR反應體系為(50 μL):10×Ex Taq Buffer(含Mg2+)5.0 μL,2.5 mmol/L dNTP Mixture 4.0 μL,5 U Taq酶0.2 μL,DNA模板1.0 μL,1.0 μmol/L引物各5 μL,ddH2O 29.8 μL。反應程序:94℃變性3 min;94℃30 s,57℃1 min,72℃1 min,共35個循環;72℃延伸10 min;4℃保存。PCR擴增產物進行1%瓊脂糖凝膠電泳檢測,并將擴增產物置于-20℃冰箱保存。
將以不同品種大豆根樣以及根際土樣DNA為模板擴增的18S Rrna(V1+V2)區PCR擴增產物用于DGGE分析。DGGE反應條件為:8%丙烯酰胺為變性劑,電泳溫度為60℃,電壓為130 V,電泳時間為10 h,變性梯度范圍為40%~65%(100%的變性劑為40%甲酰胺,7M尿素),銀染15 min。
1.3.4菌群結構分析 研究菌群結構時,主要通過豐度(S)、優勢度(P)以及Shannon-Winener指數(H)來表征菌群動態變化。豐度以及優勢度主要通過Gel-Pro Analyzer 4.5(Media Cybernetics Company,USA)軟件分析DGGE圖譜得到。H指數的計算公式如下:
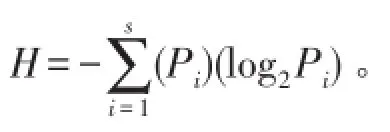
s為DGGE圖譜中,每個泳道中所包含的條帶數。Pi為第i個條帶的面積占該泳道所有條帶總面積的百分數。
1.4基因測序以及數據分析
分析不同大豆品種根樣以及根際土樣DGGE圖譜,選取其共有的和特有的條帶進行割膠以及PCR擴增。擴增產物進行DGGE電泳,驗證條帶單一性。驗證成功后,將膠回收擴增后的PCR產物連接至pGMT Easy(Tiangen,GER)載體,并轉化到E.coli DH5α (AS,CHN)感受態細胞中,吸取符合DGGE電泳檢測要求的陽性克隆菌液1.0 mL,送至上海英駿生物工程有限公司進行序列測定。測序結果提交至GenBank 數 據 庫 ,并 通 過 NCBI(NationalCenterfor Biotechnology Information)數據庫進行BLAST比對,得到相關種屬信息。通過MEGA 5.0(Arizona State University,USA)進行系統發育樹的構建。通過Quantity One 4.6.0(BIO-RAD,Hercules,CA,USA)進行聚類分析。通過SPSS 16.0進行統計學分析。
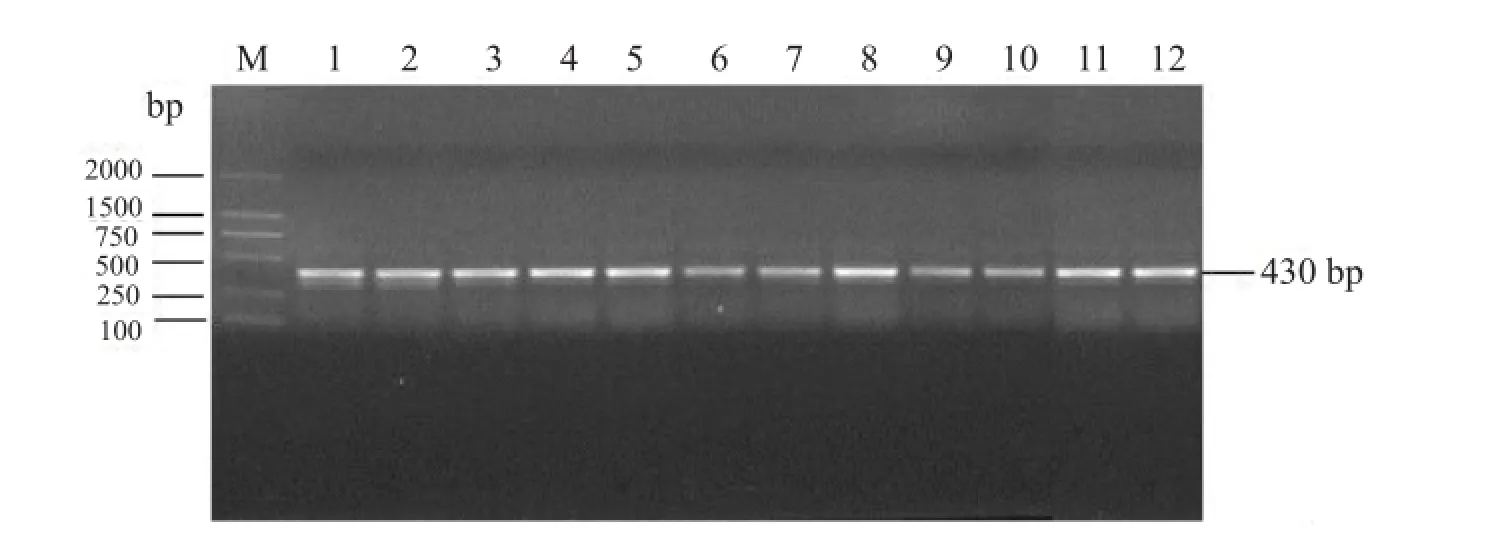
圖1 KF16根樣根腐病病原菌18S rRNA(V1+V2)區擴增結果
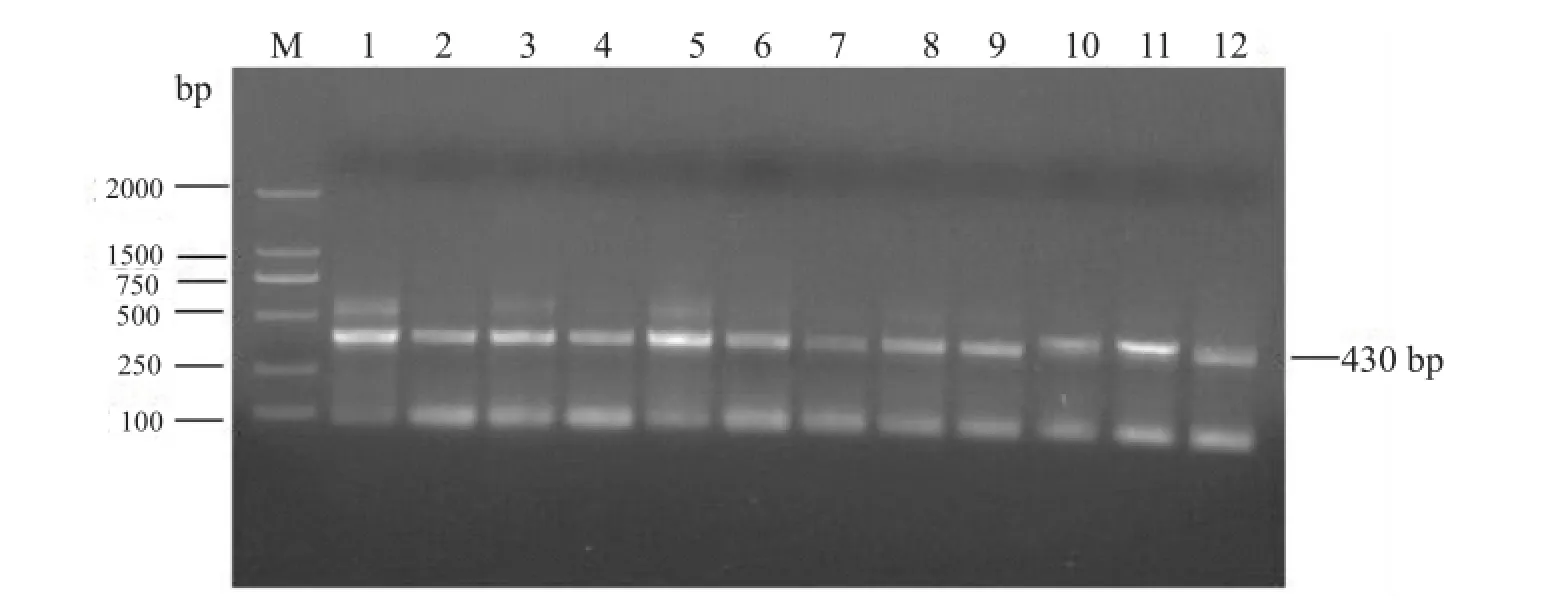
圖2 KF16根際土壤根腐病病原菌18S rRNA(V1+V2)區擴增結果
2 結果與分析
2.1不同品種大豆根樣以及根際土樣真菌18S rRNA (V1+V2)區擴增結果
不同品種大豆根樣以及根際土樣總DNA通過引物序列(NS1/FungGC)進行18S rRNA(V1+V2)區擴增,擴增產物進行1%瓊脂糖凝膠電泳檢測。以KF16為例,擴增產物在430 bp處出現目的條帶(圖1、2)。說明KF16根樣以及根際土樣真菌DNA提取效果較好,可進行下一步分析。
2.2不同品種大豆根樣以及根際土樣根腐病病原菌DGGE圖譜分析
通過分析3個大豆品種不同連作年限、不同生育時期根樣以及根際土樣根腐病病原菌18S rRNA(V1+ V2)進行DGGE后圖譜(圖3、4、5、6、7、8),發現不同試驗樣品根腐病病原菌豐度以及多樣性存在差異(P<0.05),3個大豆品種不同生育時期對照組根腐病病原菌豐度以及多樣性存在顯著差異(P<0.05),并且對照組根腐病病原菌豐度以及多樣性隨著連作年限的延長而升高;試驗組根腐病病原菌豐度以及多樣性顯著低于對照組(P<0.05);根樣與根際土樣根腐病病原菌豐度以及多樣性也存在差異(P<0.05);說明接種F. mosseae、大豆品種、連作年限以及病原菌棲息環境(根系和土壤)均對大豆根腐病病原菌菌群結構產生影響。
通過對不同試驗樣品DGGE圖譜進行分析與比較,選取DGGE圖譜中13條條帶進行割膠測序,測序結果見表1。其中,M3代表終極腐霉菌(Pythium ultimum),相似度 97%;M4代表立枯絲核菌(Rhizoctonia solani),相似度99%;M8代表格孢腔菌屬(Pleosporales sp.),相似度99%;M11代表鐮孢菌屬(Fusarium sp.),相似度99%,M12代表尖孢鐮刀菌(Fusarium oxysporum),其他7條帶均為未培養真菌,相似度均在96%以上。利用Gel-Pro Analyzer 4.5(Media Cybernetics Company,USA)軟件對DGGE圖譜中條帶進行優勢度分析,結果表明大豆根腐病病原菌優勢菌群為Pythium ultimum以及Fusarium sp.。
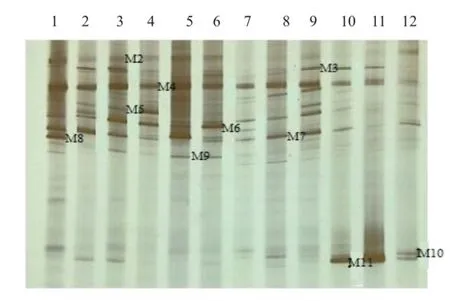
圖3 KF16苗期根樣以及根際土樣根腐病病原菌DGGE圖譜
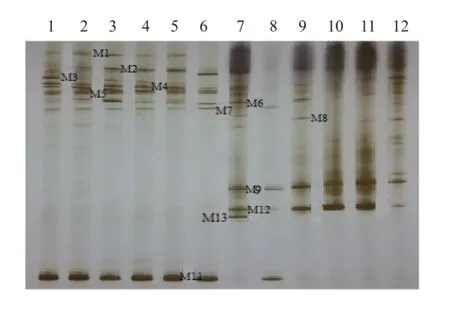
圖4 KF16分枝期根樣以及根際土樣根腐病病原菌DGGE圖譜

圖5 HN44苗期根樣以及根際土樣根腐病病原菌DGGE圖譜
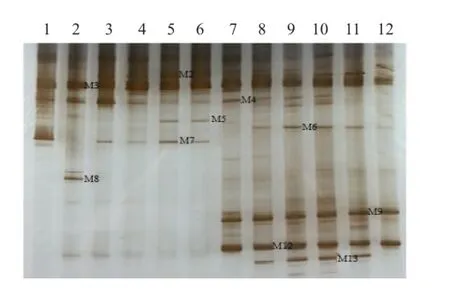
圖6 HN44分枝期根樣以及根際土樣根腐病病原菌DGGE圖譜
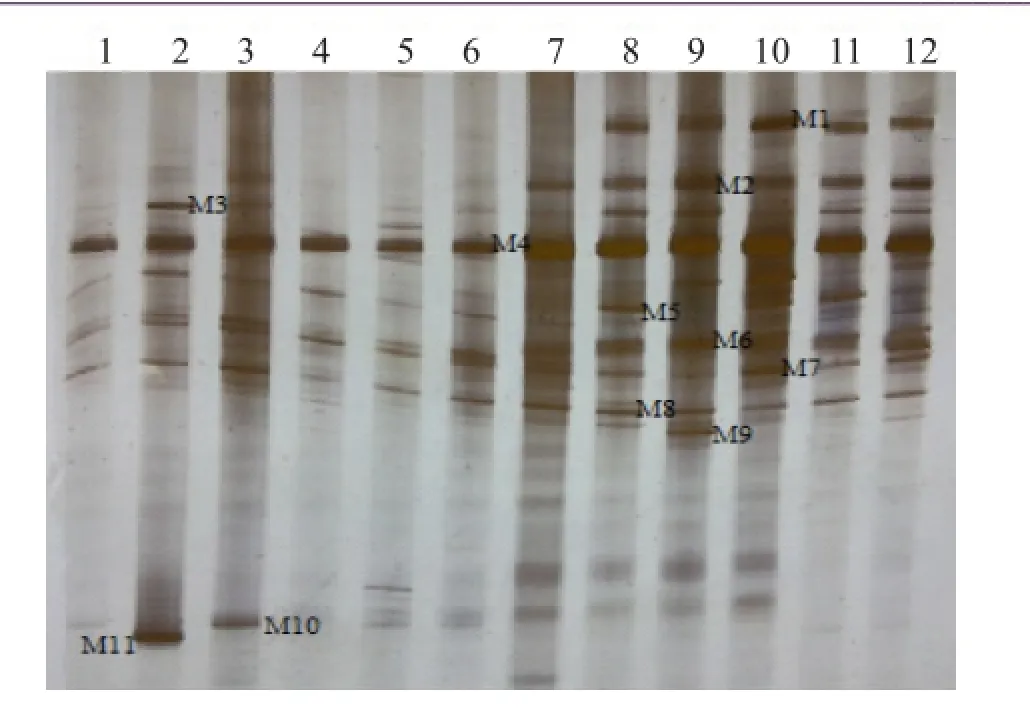
圖7 HN48苗期根樣以及根際土樣根腐病病原菌DGGE圖譜
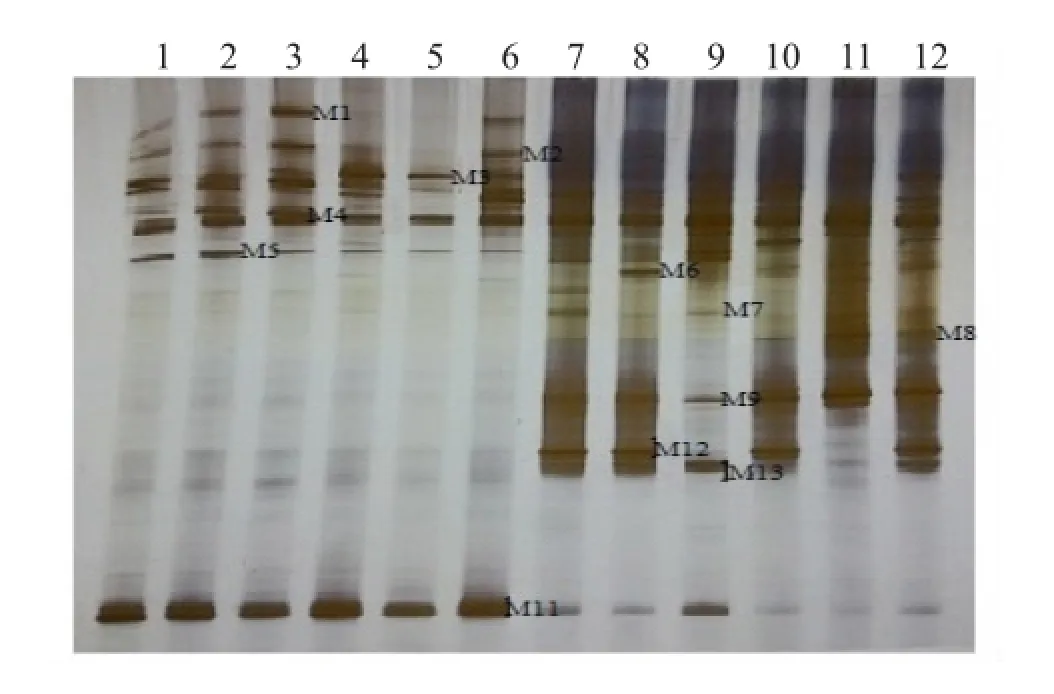
圖8 HN48分枝期根樣以及根際土樣根腐病病原菌DGGE圖譜
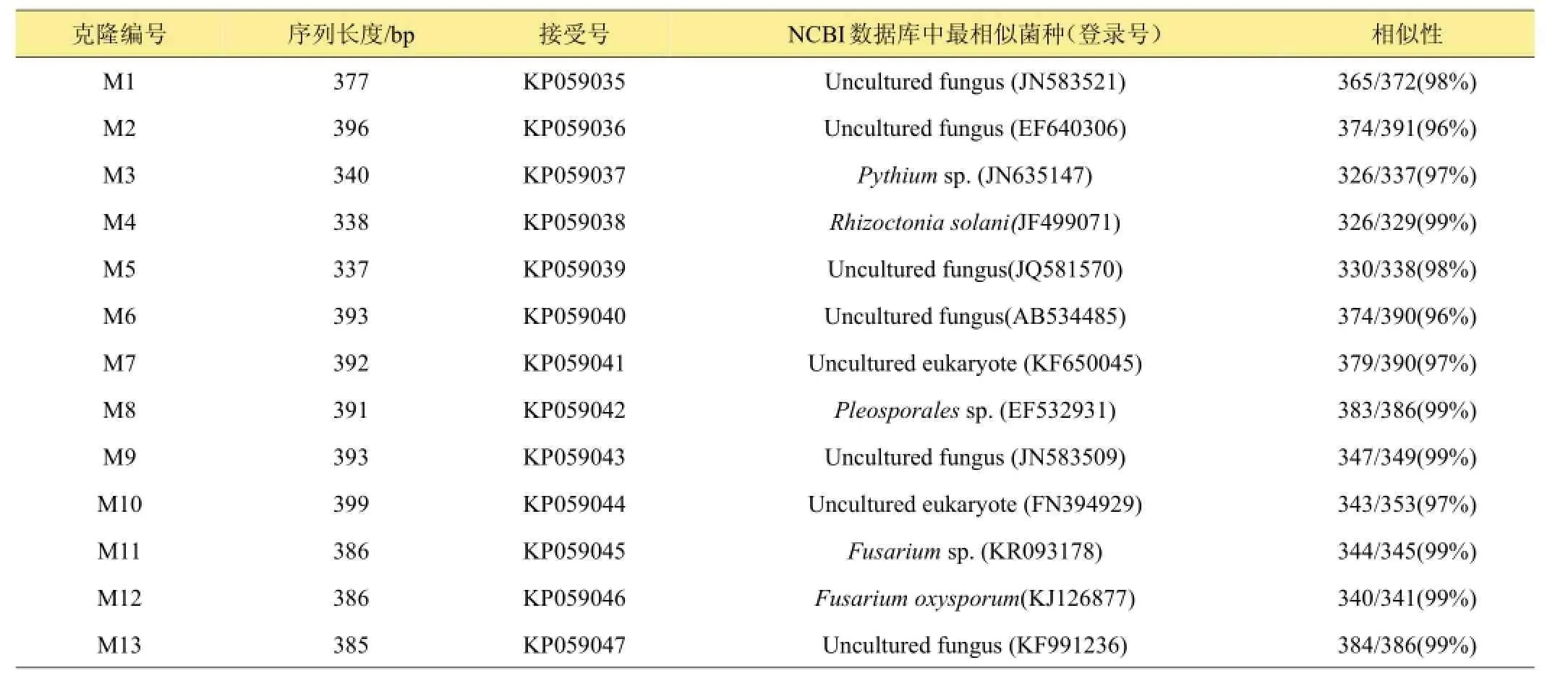
表1 13條序列的BLAST結果
2.3系統發育樹
為了更加直觀地顯示出13條DGGE序列與GenBank數據庫中已知微生物之間的親緣關系以及系統地位,利用MEGA 5.0(Arizona State University,USA)進行系統發育樹構建(圖9)。
從系統發育樹圖可知,13條DGGE序列分為3組菌群:第I組包括尖孢鐮刀菌(Fusarium oxysporum),鐮孢菌屬(Fusarium sp.)、立枯絲核菌(Rhizoctonia solani)以及未培養真菌,第II組包括終極腐霉菌(Pythium ultimum)以及未培養真菌(Uncultured fungus),第III組包括格孢腔菌屬(Pleosporales sp.)以及未培養的真菌(Unculturedfungus)。 其 中 ,Pythiumultimum、 Fusarium oxysporum以及Fusarium sp.為大豆根腐病病原優勢菌群。
2.4接種F.mosseae對連作大豆根樣以及根際土樣根腐病病原菌菌群結構的影響
相同大豆品種、不同生育時期根樣以及根際土樣根腐病病原菌豐度進行統計分析,以HN48為例(其他品種均具有相同規律)。HN48苗期對照組根樣以及根際土樣根腐病病原菌豐度顯著高于分枝期對照組(P<0.05)。同時,根腐病病原菌豐度在根樣以及根際土樣之間也存在差異(P<0.05),并且對照組根腐病病原菌豐度值隨著連作年限的增加而升高。HN48通過接種F.mosseae,試驗組根腐病病原菌豐度顯著低于對照組(P<0.05),并且隨著大豆生育期的延長,分枝期試驗組根腐病病原菌豐度顯著低于苗期試驗組(P<0.05)(表2)。相同生育時期,不同大豆品種根樣以及根際土樣根腐病病原菌豐度進行統計分析(表2)。KF16苗期以及分枝期對照組根樣以及根際土樣根腐病病原菌豐度顯著高于HN44、HN48(P<0.05)。3個大豆品種接種F.mosseae后,HN44苗期以及分枝期試驗組根腐病病原菌豐度顯著低于KF16、HN48(P<0.05)。分析上述結果表明:接種F.mosseae對根腐病病原菌生長以及分布產生影響,并且F.mosseae的防治效果具有品種選擇性。

圖9 13條DGGE序列與其近緣物種的系統發育樹(節點上的數字表示1000自展后的數值)
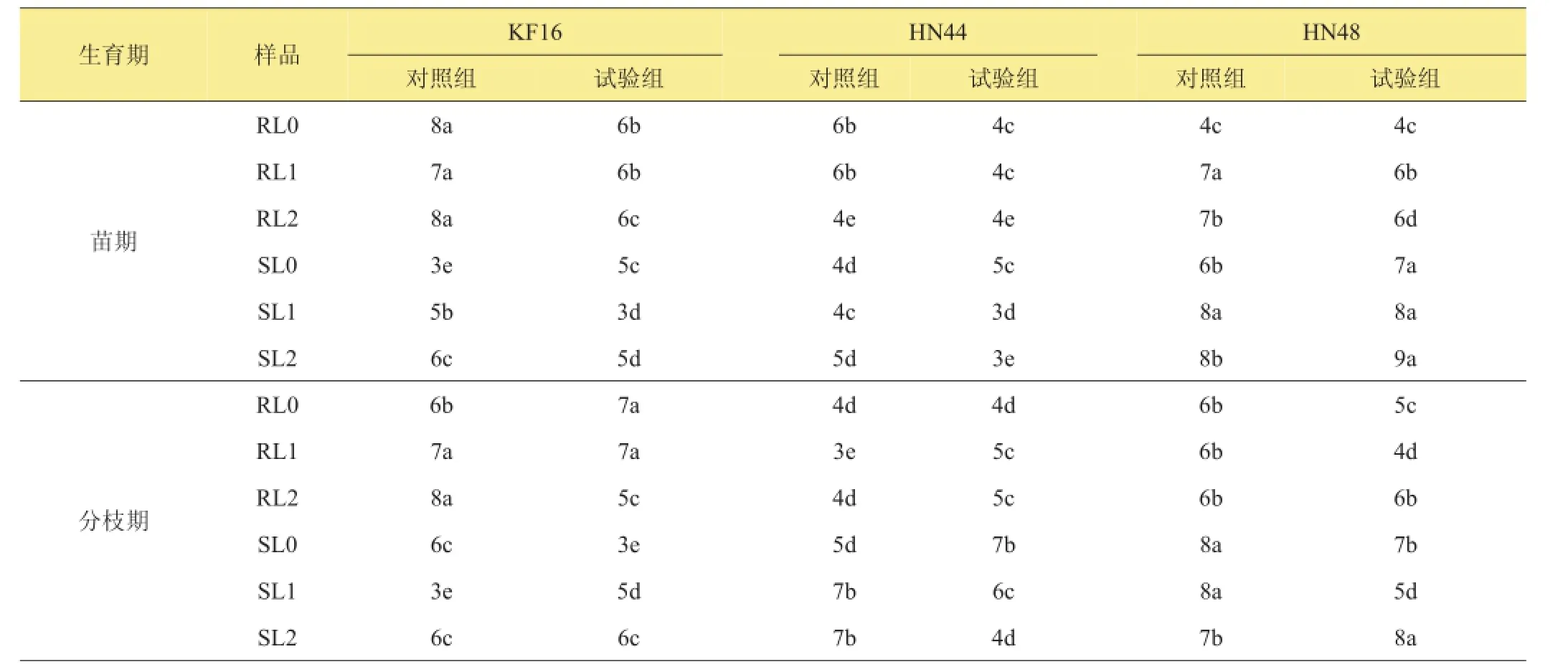
表2 不同大豆品種不同生育時期根腐病病原菌豐度方差分析
相同大豆品種、不同生育時期根樣以及根際土樣根腐病病原菌多樣性進行統計分析,以KF16為例(其他品種均具有此規律)。KF16苗期對照組根樣以及根際土樣根腐病病原菌多樣性指數顯著高于分枝期(P<0.05)。同時,根樣與根際土樣之間根腐病病原菌多樣性指數也存在差異(P<0.05)。并且根腐病病原菌多樣性指數隨著連作年限的增加而升高。KF16試驗組通過接種F.mosseae,試驗組根腐病病原菌多樣性指數顯著低于對照組,并且隨著大豆生育期的延長,分枝期試驗組根腐病病原菌多樣性指數顯著低于苗期試驗組(P<0.05)(表3)。相同生育時期、不同大豆品種根樣以及根際土樣根腐病病原菌多樣性進行統計分析。苗期時,KF16對照組根樣根腐病病原菌多樣性指數顯著高于HN44、HN48(P<0.05)。HN48對照組根際土樣根腐病病原菌多樣性指數顯著高于KF16、HN44(P<0.05)。同時,根樣與根際土樣之間根腐病病原菌多樣性指數也存在差異(P<0.05),并且根腐病病原菌多樣性指數隨著連作年限的增加而升高。3個大豆品種接種F.mosseae后,試驗組根腐病病原菌多樣性指數顯著低于對照組(P<0.05)。KF16試驗組根腐病病原菌多樣性指數顯著低于HN44、HN48(P<0.05)。分枝期時,HN44對照組根樣以及根際土樣根腐病病原菌多樣性顯著高于KE16、HN48(P<0.05)。同時,根樣與根際土樣之間根腐病病原菌多樣性指數也存在差異(P<0.05)。3個大豆品種接種F.mosseae后,試驗組根腐病病原菌多樣性指數顯著低于對照組(P<0.05)。HN48試驗組根腐病病原菌多樣性指數顯著低于KF16、HN44(P<0.05)。分析上述結果表明:接種F.mosseae對根腐病病原菌多樣性產生影響。并且不同品種接種F.mosseae后,根腐病病原菌防治效果具有差異。

表3 不同大豆品種不用生育時期根腐病病原菌多樣性方差分析
通過Quantity One 4.6.0(BIO-RAD,Hercules,CA,USA)對3個大豆品種根樣以及根際土樣根腐病病原菌DGGE圖譜進行聚類分析(圖10a、b、c)。通過分析KF16根樣以及根際土樣聚類分析結果(圖10a),表明根腐病病原菌菌群被分成15組:組I包括分枝期土樣(試驗組SL2),組II包括分枝期土樣(試驗組SL0和SL1),組III包括分枝期土樣(對照組SL0和SL2),組IV包括分枝期根樣(對照組RL1)和分枝期土樣(對照組SL1),組V包括分枝期根樣(對照組RL0),組VI包括分枝期根樣(試驗組RL2),組VII包括分枝期根樣(試驗組RL0),組VIII包括分枝期根樣(試驗組RL1和對照組RL2),組IX包括苗期土樣(試驗組SL1和SL2),組X包括苗期土樣(試驗組SL0),組XI包括苗期土樣(對照組SL2)和苗期根樣(對照組RL1),組XII包括苗期根樣(對照組RL0和RL2),組XIII包括苗期土樣(對照組SL0和SL1),組XIV包括苗期根樣(試驗組RLI),組XV包括苗期根樣(試驗組RL0和RL2)。圖10b、10c分析方法同圖10a,不再進行描述。聚類分析結果表明不同品種、不同樣品間根腐病病原菌菌群結構存在差異,并進一步驗證接種F.mosseae、大豆品種、連作年限以及病原菌棲息環境(根系以及土壤)均對大豆根腐病病原菌產生以及分布產生影響。

圖10 不同大豆品種不同生育時期根腐病病原菌DGGE圖譜聚類分析
3 討論
AM真菌侵染維管植物根系后,通過形成龐大的菌絲結構,促進植物根系對水分、礦質元素吸收以及運輸,進而提高植物對營養物質的吸收,促進植株生長。近年來,AM真菌被廣泛應用于植物-微生物共生體增強植物抗逆性研究中,并取得了豐碩的研究成果[17-19]。但是,國內外研究人員很少報道接種AM菌劑后,其對植物根系以及根際土壤中病原菌菌群結構的影響[20-21]。因此,本試驗通過接種F.mosseae,研究其對3個大豆品種根系以及根際土壤中根腐病病原菌菌群結構的影響。
根腐病是一種世界性作物病害,嚴重威脅農作物產量以及品質。同時,PCR-DGGE技術是目前研究微生物群落結構的常用技術,并且國內外學者已將其應用于根腐病病原菌菌群結構研究中[22-23]。試驗過程中發現隨著連作年限的增加,3個大豆品種對照組根樣以及根際土壤中根腐病病原菌豐富度以及多樣性指數逐年升高,并且每個大豆品種根樣與根際土樣之間根腐病病原菌豐富度以及多樣性指數也存在差異,說明大豆連作造成土壤理化性質改變,導致大豆根腐病病原菌豐富度以及多樣性指數逐年升高[24]。同時也說明根腐病病原菌對棲息環境有一定的選擇性。大豆苗期根腐病病原菌豐富度以及多樣性指數顯著高于分枝期,說明隨著大豆生育進程的延長,大豆防御性蛋白以及次生代謝產物逐漸表達以及分泌,有利于大豆防御性體系的形成以及建立,進而提高大豆抵御根腐病病原菌侵染的能力[25-26]。
試驗通過向3個大豆品種盆栽土壤中接種F.mosseae,研究其對不同大豆品種不同連作年限根腐病病原菌菌群結構的影響。試驗結果表明3個大豆品種試驗組根樣以及根際土樣根腐病病原菌豐富度以及多樣性指數顯著低于對照組。說明接種F.mosseae后,F.mosseae通過侵染大豆根系形成龐大的菌絲體結構,提高大豆根系吸收水分以及礦質營養的面積以及能力,進而促進大豆根系防御性蛋白以及次級代謝產物表達以及分泌,有利于加快大豆防御性體系的形成以及建立,最終提高大豆抵御根腐病病原菌侵染能力[20]。
試驗選擇黑龍江地區較具代表性3個大豆品種進行研究,研究發現3個大豆品種對照組根腐病病原菌豐度值以及多樣性指數存在差異。并且接種F.mosseae后,3個大豆品種根腐病病原菌防治效果也存在差異顯著。說明3個大豆品種遺傳性質對于根腐病防治具有一定影響,同時也說明F.mosseae對于根腐病防治效果具有一定的品種選擇性[27]。聚類分析結果進一步驗證了接種F.mosseae、大豆品種、連作年限以及病原菌棲息環境(根系和土壤)均對連作大豆根腐病病原菌產生以及分布產生影響。
4 結論
不同連作年限不同大豆品種接種F.mosseae后,試驗組根樣以及根際土樣根腐病病原菌豐度以及多樣性指數顯著低于對照組,并且接種F.mosseae對不同大豆品種防治效果存在差異;聚類分析結果進一步驗證了接種F.mosseae對連作大豆根樣以及根際土樣根腐病病原菌產生以及分布產生影響。因此,本項研究對于應用生物防治方法——AM菌劑于連作大豆根腐病防治做出了前期的探索以及實踐,并為AM菌劑應用于緩解大豆連作障礙提供理論依據。
[1]Hartman G L,West E D,Herman T K.Crops that feed the world 2. Soybean-worldwide production,use,and constraints caused by pathogens and pests[J].Food Security,2011,3(1):5-17.
[2]Han J,Jie W G,Cai B Y.Effect of phosphorus on the composition and accumulation of 7S and 11S globulin subunits during seed development of three soybean varieties[J].Journal Soil Science and Plant Nutrition,2014,14(4):769-782.
[3]Chen M N,Li X,Yang Q L.Dynamic succession of soil bacterial communityduringcontinuouscroppingofpeanut (Arachishypogaea L.)[J].PLoS One,2014,9(7):e101355.doi: 10.1371/journal.pone.0101355.
[4] 魏巍,許艷麗,朱琳,等.長期連作對大豆根際土壤鐮孢菌種群的影響[J].應用生態學報,2014,25(2):497-504.
[5] Xiong W,Zhao Q Y,Zhao J,et al.Different continuous cropping spans significantly affect microbial community membership and structureinavanilla-grownsoilasrevealedbydeep pysosequencing[J].Microbial Ecology,2015,70(1):1-10.
[6]Reinhardt D.Programming good relations development of the arbuscular mycorrhial symbiosis[J].Current Opinion in Plant Biology,2007,10(1):98-105.
[7]Walder F,Niemann H,Natarajan M,et al.Mycorrhizal networks: common goods of plants shared under unequal terms of trade[J]. Plant Physiology,2012,159(2):789-797.
[8]Wei Y,Hou H,Li J N,et al.Molecular diversity of arbuscular mycorrhizalfungiassociatedwithanMnhyperaccumulator-PhytolaccaAmericana,inMnminingarea[J]. Applied Soil Ecology,2014,82:11-17.
[9]Lehmann A,Kathryn-Barto E,Powell J R,et al.Mycorrhizal responsiveness trends in annual crop plants and their wild relativesa meta-analysis on studies from 1981 to 2010[J].Plant Soil,2012,355(1-2):231-250.
[10]Zhang H S,Li G,Qin F F,et al.Castor bean growth and rhizosphere soil property response to different proportions of arbuscularmycorrhizalandphosphate-solubilizingfungi[J]. Ecological Research,2014,29(2):181-190.
[11]Zhang F G,Zhu Z,Yang X M,et al.Trichodermaharzianum T-E5 significantly affects cucumber root exudates and fungal community in the cucumber rhizosphere[J].Applied Soil Ecology,2013,72:41-48.
[12]Huang Y M,Srivastava A K,Zou Y N,et al.Mycorrhizal-induced calmodulin mediated changes in antioxidant enzymes and growth response of drought-stressed trifoliate orange[J].Frontiers in Microbiology,2014,5:682-682.
[13]羅巧玉,王曉娟,林雙雙,等.AM真菌在植物病蟲害防治中的作用機制[J].生態學報,2013,33(19):5997-6005.
[14]Ortiz N,Armada E,Duque E,et al.Contribution of arbuscular mycorrhizal fungi and/or bacteria to enhancing plant drought toleranceundernaturalsoilconditions:effectivenessof autochthonous or allochthonous strains[J].Journal of Plant Physiology,2015,174:87-96.
[15]Gomez-Bellot M J,Ortuno M F,Nortes PA,et al.Protective effects of Glomusiranicum var.tenuihypharum on soil and Viburnum tinus plants irrigated with treated wastewater under field conditions[J]. Mycorrhiza,2014,25(5):1-11.
[16]Ei-Faiz A,Duponnois R,Winterton P,et al.Effect of different amendments on growing of Canna indica L.inoculated with AMF on mining substrate[J].International Journal of Phytoremediation,2015,17(5):503-513.
[17]樊宇紅,凌宏文,樸河春.桑樹(Morus alba)與叢枝菌根的共生對重金屬元素吸收的影響[J].生態環境學報,2014,23(3):477-484.
[18]楊海霞,李士美,郭紹霞.叢枝菌根真菌對紫薇耐鹽性的影響[J].植物生理學報,2014,50(9):1379-1386.
[19]周寶利,鄭繼東,畢曉華,等.叢枝菌根真菌對茄子黃萎病的防治效果和茄子植株生長的影響[J].生態學雜志,2015,34(4):1026-1030.
[20]Qian L,Yu W J,Cui J Q,et al.Funnelifomis mosseae affects the root rot pathogen Fusarium oxysporum in soybeans[J].Acta Agriculturae Scandinavica,Section B-Soil&Plant Science,2015,64 (4):321-321.
[21]Jie W G,Bai L,Yu W J,et al.Analysis of interspecific relationships between Funeliformis mosseae and Fusarium oxysporum in the continuous cropping of soybean rhizosphere soil during the branching period[J].Biocontrol Science and Technology,2015,25 (9):1036-1051.
[22]Yergeau E,Filion M A.PCR-denaturing gradient electrophoresis approach to assess Fusarium diversity in asparagus[J].Journal of Microbiological Methods,2005,60:143-154.
[23]范雪露,崔佳琦,蔡柏巖.接種摩西柄囊霉對連作大豆苗期根腐病病原真菌多樣性的影響[J].中國農學通報,2014,30(31):272-279.
[24]魏巍,許艷麗,張思佳,等.大豆根腐病原鐮孢菌種群多樣性DGGE分析及其致病性研究[J].植物病理學報,2013,43(5):500-508.
[25]鞠會艷,韓麗梅,王樹起,等.連作大豆根系分泌物對根腐病病原真菌的化感作用[J].應用生態學報,2002,13(6):723-727.
[26]馬丹煒,王亞男,王煜,等.化感脅迫誘導植物細胞損傷研究進展[J].生態學報,2015,35(5):1640-1645.
[27]Jie W G,Liu X R,Cai B Y.Diversity of rhizosphere soil arbuscular mycorrhizal fungi in various soybean cultivars under different continuous cropping regimes[J].PLoS One,2013,8(8):e72898.
Effect of Inoculated Funneliformis mosseae on Root Rot Pathogen Flora Structure in Soybean Continuous Cropping
Cui Jiaqi1,2,Fan Xuelu1,2,Cai Baiyan1,2
(1College of Life Sciences,Heilongjiang University,Harbin 150080,Heilongjiang,China;
2Key Laboratory of Microbiology of General Institutes of Higher Education,Harbin 150080,Heilongjiang,China)
In this study,the bioremediation method was applied to preventing the root rot in soybean continuous cropping in order to reduce the occurrence of root rot and enhance the quality of soybean.Three soybean varieties were selected and inoculated with Funneliformis mosseae in the trial.The root rot pathogen community structure of the root system and rhizosphere soil in soybean continuous cropping were measured by PCR-DGGE.The results showed that the abundance and diversity index of root rot pathogen of the soybean root system and rhizosphere soil samples in the treatment groups were significantly lower than that in the control groups after inoculated with F.mosseae,and F.mosseae had different effect on different soybean cultivars.The results of cluster analysis also verified that F.mosseae affected the occurrence and distribution of root rot pathogen in soybean continuous cropping.
Root Rot;F.mosseae;Soybean Continuous Cropping;Flora Structure
S435.651
A論文編號:cjas15120018
國家自然科學基金面上項目“摩西管柄囊霉(Funneliformis mosseae)抑制連作大豆根腐病發病機理的研究”(31570487)。
崔佳琦,男,1989年出生,黑龍江綏化人,在讀碩士,研究方向為微生物生態學。通信地址:150080黑龍江省哈爾濱市南崗區學府路74號黑龍江大學生命科學學院,E-mail:cuijiaqi2015@126.com。
蔡柏巖,男,1968年出生,黑龍江哈爾濱人,教授,博士后,研究方向為微生物生態學。通信地址:150080黑龍江省哈爾濱市南崗區學府路74號黑龍江大學生命科學學院,Tel:0451-86626691,E-mail:caibaiyan@126.com。
2015-12-24,
2016-02-24。

