原代小鼠肝細胞培養方法的比較
王 珊,柏 青,王方萍,李慧瑤,陳 燊,何志妮,王 慶,陳 雯,陳麗萍
原代小鼠肝細胞培養方法的比較
王珊,柏青,王方萍,李慧瑤,陳燊,何志妮,王慶,陳雯,陳麗萍*
(中山大學公共衛生學院預防醫學系,廣東廣州510080)
目的: 比較3種不同培養條件下原代小鼠肝細胞的形態以及肝細胞功能,尋找適合于原代小鼠肝細胞體外培養的培養基配方。方法:采用改良Seglen兩步膠原酶灌注法分離原代小鼠肝細胞,糖原染色觀察細胞純度,在貼壁4 h后用基礎培養基、基礎培養基加DMSO(DMSO組)、基礎培養基加DMSO和EGF(DMSO+EGF組)等3種不同的條件培養肝細胞。鏡下觀察肝細胞形態,用MTT法檢測細胞活力,生化分析儀檢測細胞培養上清液中乳酸脫氫酶(LDH)水平以及用ELISA法檢測細胞培養上清液中白蛋白水平。結果:成功分離小鼠原代肝細胞,肝細胞純度達95%以上;原代肝細胞培養至96 h時,DMSO組仍能較好地維持細胞形態,基礎培養基組的細胞活力比DMSO組和DMSO+EGF組分別降低了66.87%和67.16%(P<0.05),且基礎培養基組的LDH水平均高于DMSO組和DMSO+EGF組(P<0.05)。此外DMSO組在96 h時仍能維持較高水平的白蛋白分泌,比基礎培養基組和DMSO+EGF組分別增加了185%和24.2%(P<0.05)。結論:小鼠原代肝細胞培養基中加入DMSO對于維持肝細胞的形態和功能有促進作用,本研究為體外原代肝細胞培養模型的建立和優化提供了實用的方法。
小鼠;原代肝細胞培養;二甲基亞砜;表皮生長因子
【ABSTRACT】OBJECTIVE: To identify a better maintenance medium for primary hepatocyte culture in vitro,wecompare the cellular morphology and function of mouse primary hepatocytes under three different culture conditions.METHODS:Primary hepatocytes were isolated by using a modified two-step collagenase perfusion procedure asdescribed by Seglen. The purity of hepatocytes were determined by PAS staining. After plating for 4 h,the medium wasreplaced with three different maintenance medium (base medium,base medium supplemented with DMSO,base mediumsupplemented with DMSO and EGF). The cellular morphology was observed under an inverted microscope. The cellviability was measured using the MTT assay,the concentrations of lactate dehydrogenase (LDH) was detected by automaticbiochemical analyzer and the albumin level was examined using ELISA. RESULTS:Mouse primary hepatocytes weresuccessfully isolated with purity more than 95%. When primary hepatocytes were cultured for 96 h ,only the DMSO grouphad better cell morphology. Viability of cells in the base medium group was reduced by 66.87% and 67.16% compared withthe DMSO and the DMSO+EGF groups (P<0.05),respectively. The LDH level of the base medium group was higher thanthe DMSO and the DMSO+EGF groups (P<0.05). In addition,cells in the DMSO group had high level of albumin secretionat 96h which was 185% and 24.2% higher than the base medium and the DMSO+EGF group (P<0.05),respectively.CONCLUSION:DMSO addition to maintenance medium supported primary hepatocytes to maintain its morphology andfunction. Our study provides an applicable method for optimization of primary hepatocytes in culture.
【KEY WORDS】mouse;primary hepatocyte culture;dimethyl sulfoxide;epidermal g rowth f actor
原代肝細胞作為一種肝毒性評價體外模型,既能較好地保留肝臟的代謝功能,還可反映外源化學物的刺激,并能排除其他細胞、組織的影響,具有良好的可重復性,被認為是目前體外毒理學和藥物試驗的重要研究模型而得到廣泛應用[1]。然而,原代肝細胞分離后在體外培養過程中很快喪失其正常表型及功能,并迅速進入失分化和衰老狀態。因此,體外原代肝細胞存活時間短、失去正常肝細胞功能,以及不同實驗室由于技術上掌握的熟練程度不同帶來的毒性評價偏倚,大大降低了肝細胞模型在化學物毒性測試中的應用價值。一直以來,研究者們探索不同方法來改善原代肝細胞的微環境,進而維持肝細胞的功能,其主要通過添加促分化因子、細胞外基質或與其他細胞共培養。二甲基亞砜(dimethyl sulfoxide,DMSO)和表皮生長因子(epidermal growth factor,EGF)是兩種能促進肝細胞分化的因子[2-4],本研究通過在細胞培養基中添加DMSO或EGF,以不同培養條件培養小鼠原代肝細胞,通過檢測細胞形態、細胞損傷和白蛋白分泌功能等指標來評估在不同培養條件下肝細胞的形態和功能,尋找最佳的培養條件,延長原代肝細胞的體外分離后的正常功能維持時間,促進其在毒理學或藥理學中的應用。
1 材料與方法
1.1實驗動物
SPF級C57BL/6雄性小鼠,6~8周齡,25~30 g,購于中山大學實驗動物中心,動物合格證號SCXK (粵)2011-0029。
1.2主要試劑和儀器
William’s E培養基、IV型膠原酶、4-羥乙基哌嗪乙磺酸[4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,HEPES]、青霉素/鏈霉素、L-谷氨酰胺均購自美國Gibco公司;胎牛血清購自法國Biowest公司;地塞米松、牛胰島素、表皮生長因子均購自美國Sigma公司;Percol密度分離液購自美國BD公司;DMSO 購自美國Amresco公司;白蛋白檢測試劑盒購自美國Abcam公司;Cell Titer 96?AQueous One Solution 細胞增殖試劑盒購自美國Promega公司。
主要儀器包括:倒置顯微鏡(Nikon,Japan)、酶標儀(Biorad,USA)、全自動生化分析儀(7600-020 HITACH,Japan)。
1.3實驗方法
1.3.1分離小鼠原代肝細胞在Seglen兩步膠原酶灌注法[5]基礎上改進分離小鼠原代肝細胞方法。C57BL/6小鼠經腹腔注射水合氯醛(0.5 mg/g)麻醉,常規消毒皮膚,開腹,肝門靜脈插管固定,用含EGTA的D-Hanks灌流液灌流。然后灌流含1.6 mmol/L CaCl2和0.5 mg/mL IV型膠原酶的D-Hanks液約40 mL至肝臟變軟,剪下肝臟,劃破肝包膜,收集細胞懸液,并用200目篩網過濾,4 ℃、50 g離心,然后用含有2 mmol/L CaCl2的DHanks清洗液清洗3次,再用清洗液重懸并加入預先配置好的Percol密度分離液中,100 g離心20 min。最后用含FBS的William’s E培養基重懸,0.4%臺盼藍檢測細胞存活率需大于90%。
1.3.2小鼠原代肝細胞的培養方法小鼠原代肝細胞以1.0×105/cm2的細胞密度接種于包被有鼠尾膠原的培養板內。使用貼壁培養基(William’s E培養基、體積分數為10%的胎牛血清、1 μmol/L地塞米松、4 μg/mL牛胰島素、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 μg/mL鏈霉素、15 mmol/L HEPES)在37 ℃、體積分數為5%的CO2培養箱中培養4 h后,將培養基吸出,鋪上層膠原,形成三明治結構。2 h后分為3組分別加入不同的無血清培養基來維持肝細胞生長。第1種維持培養基綜合了文獻中常用的培養基成分(William’s E培養基、0.1 μmol/L地塞米松、4 μg/mL牛胰島素、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 μg/mL鏈霉素、15 mmol/L HEPES)(下稱基礎培養基組);第2種培養基在第1種培養基的基礎上添加了2% DMSO(下稱DMSO組);第3種培養基在第1種培養基的基礎上同時添加了2% DMSO和12.5 ng/mL EGF(下稱DMSO+EGF組)。每天更換新鮮培養液。
1.3.3糖原染色法鑒定肝實質細胞小鼠原代肝細胞培養4 h后棄培養液,PBS清洗2~3次,多聚甲醛固定10 min,蒸餾水洗2~3次,加入高碘酸溶液反應10 min,蒸餾水洗2~3次,每次1 min,接著用Shiff液染色30 min,蒸餾水洗2~3次,繼以蘇木素染色液染細胞核1~2 min,酸性乙醇分化液分化2~5 s,用自來水沖洗2~3次,在400倍光學顯微鏡下觀察。
1.3.4MTT法檢測小鼠原代肝細胞的細胞活力小鼠原代肝細胞以每孔3×104個細胞的密度接種在96孔板,每孔設置3個平行樣,分別培養24、48、72、96 h。利用Cell Titer 96?AQueous One Solution 細胞增殖試劑盒檢測肝細胞的細胞活力。每孔加入Cell Titer 96?AQueous One Solution 試劑20 μL,37 ℃孵育4 h,選擇490 nm波長,用空白孔調零,酶標儀讀取各孔吸光度D(490)值。
1.3.5培養細胞上清中乳酸脫氫酶(lactate dehydrogenase, LDH)水平檢測小鼠原代肝細胞培養24、48、72、96 h 時分別收集細胞培養基上清,12 0 00 r/min離心10 m in,全自動生化分析儀檢測LDH的水平。1.3.6 培養細胞上清中白蛋白水平的檢測在小鼠原代肝細胞培養24、48、72、96 h時分別收集培養基上清。采用ELISA法白蛋白檢測試劑盒檢測培養細胞上清中的白蛋白水平。450和570 nm雙波長下檢測吸光度值,調零后用四參數邏輯回歸分析(4-parameter logistic regression)計算白蛋白水平。
1.4統計分析
各組所得計量數據采用x±s表示,用SPSS 20.0軟件處理數據,多組間均數的比較用方差分析,檢驗水準α=0.05。
2 結果
2.1不同培養條件對小鼠原代肝細胞形態的影響
小鼠原代肝細胞分離成功并培養4 h后,用PAS染色法在倒置顯微鏡下觀察貼壁小鼠原代肝細胞。鏡下發現,小鼠原代肝細胞的胞漿內均可見紫紅色糖原顆粒,大部分肝細胞均已貼壁并伸展成圓形或多邊形,純度超過95%(圖1)。原代肝細胞分別培養24、48和96 h后鏡下觀察肝細胞形態。如圖2所示,培養24 h時,3種培養條件下的肝細胞均表現為多邊形,少數呈圓形。大多數肝細胞中可見雙核,細胞間相互接觸,界限清晰,排列成肝索樣結構,呈典型的肝細胞形態。培養48 h后,肝細胞由立體逐漸變成扁平的多邊形結構。培養至96 h,基礎培養組的細胞間的邊界模糊,細胞核增大,細胞形態不能辨認,DMSO+EGF組的細胞間的邊界變模糊,逐漸喪失多邊形結構,只有添加了2% DMSO組的肝細胞還能維持較好的肝細胞的多邊形結構,細胞間的邊界仍較清晰。上述實驗表明在原代肝細胞維持培養基中添加2% DMSO可以更好維持肝細胞的形態。
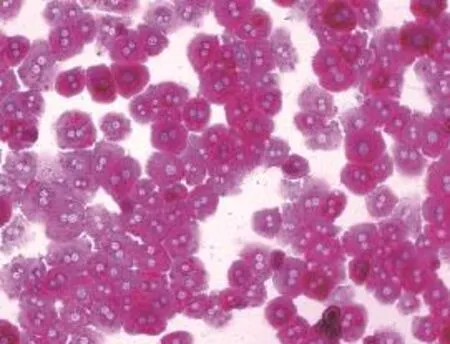
圖1 PAS染色觀察小鼠原代肝細胞貼壁4 h后的形態(×400)
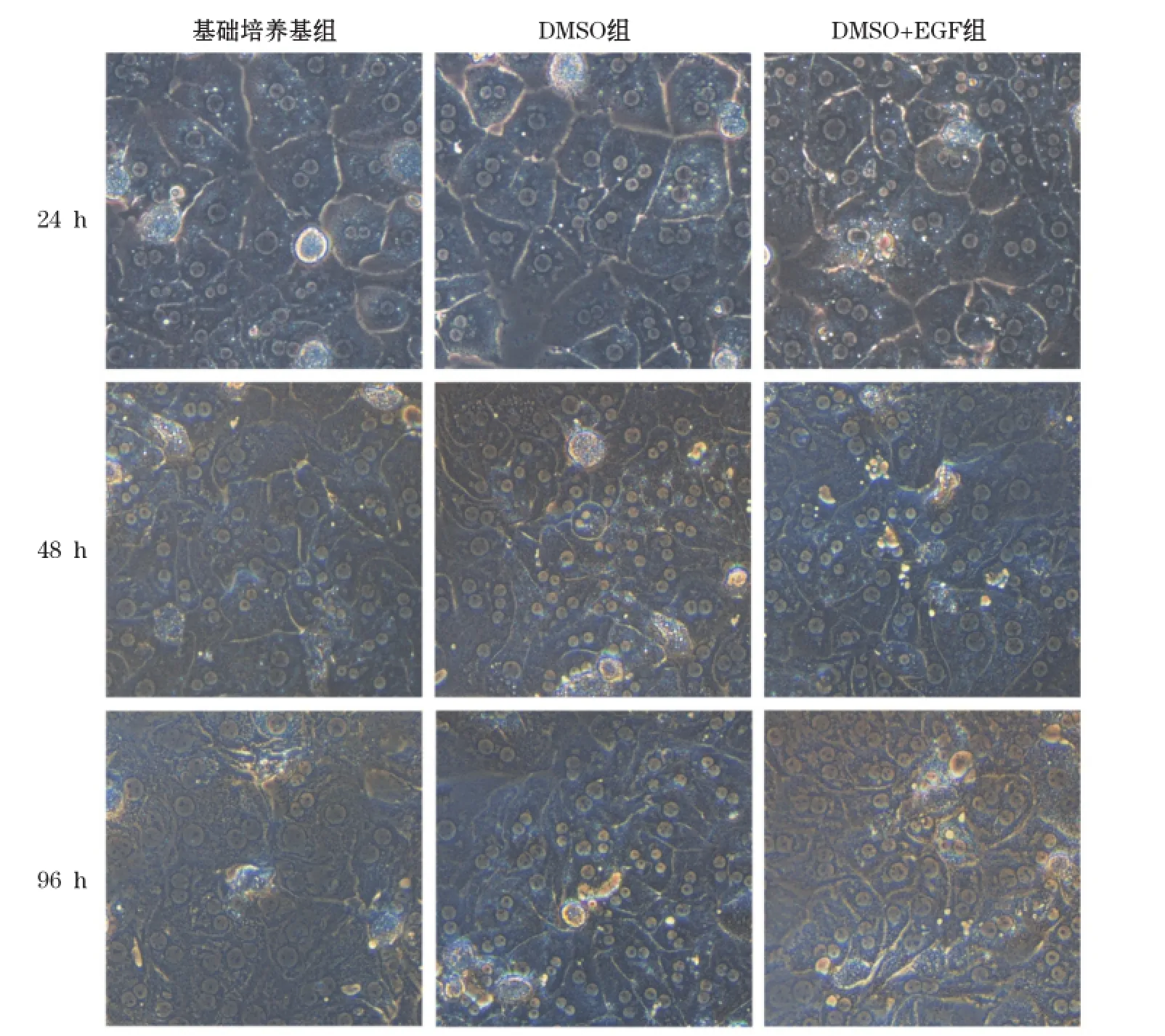
圖2 不同培養條件下各時間點原代小鼠肝細胞形態(×400)
2.2不同培養條件對小鼠原代肝細胞活力的影響
我們進一步采用MTT法檢測細胞活力。如圖3所示,3種不同培養條件下小鼠原代肝細胞的細胞活力的D(490)值在48 h達到峰值,提示細胞活力處于最佳狀態。隨著培養時間延長,3種條件下肝細胞的細胞活力開始逐漸下降,其中基礎培養基組下降最為顯著。在96 h時,基礎培養基組的D(490)值比DMSO組和DMSO +EGF組降低了66.87%和67.16%,而DMSO組和DMSO+EGF組無明顯區別,提示在培養基中添加了DMSO或EGF可以提高原代肝細胞的細胞活力。
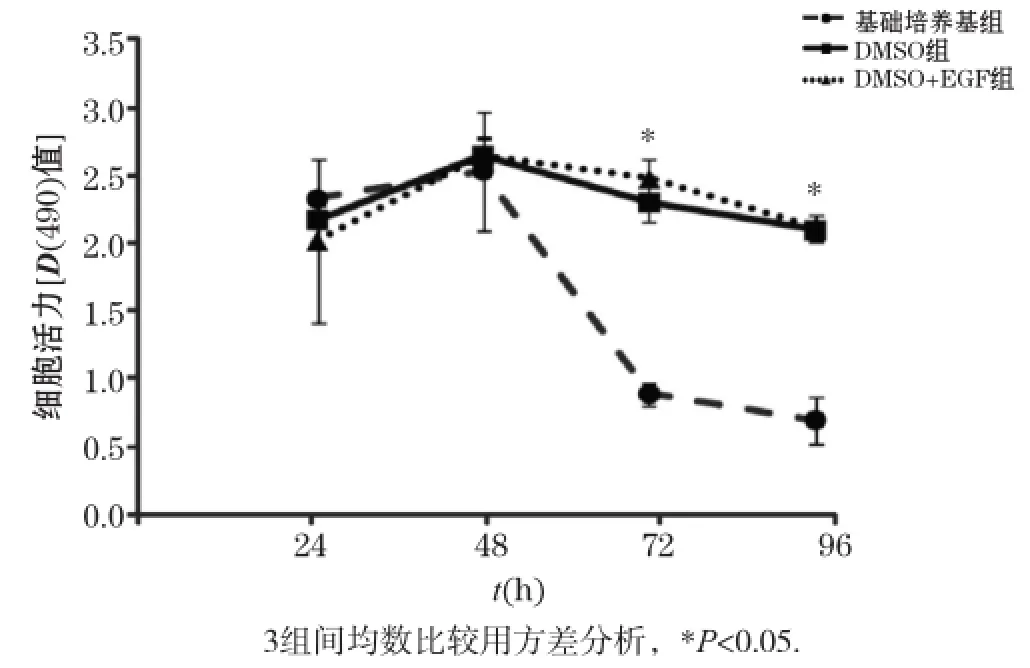
圖3 不同培養條件下小鼠原代肝細胞的細胞活力
2.3不同培養條件對肝細胞培養上清LDH的影響
細胞培養上清中的LDH水平可以作為肝細胞損傷的標志。如圖4所示,3種培養方式肝細胞培養上清的LDH水平隨著培養時間的增加而逐漸下降。但在培養的不同時間點,基礎培養基組的LDH水平均高于DMSO組和DMSO+EGF組。表明培養基中添加DMSO或EGF可以減少肝細胞的損傷。
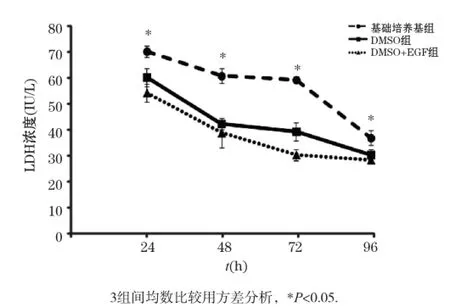
圖4 不同培養條件下肝細胞培養上清中LDH水平
2.4不同培養條件對小鼠原代肝細胞白蛋白分泌的影響
白蛋白分泌能力是評價肝細胞功能的重要指標,因此我們檢測3種培養條件下小鼠原代肝細胞培養基中的白蛋白水平。如圖5所示,基礎培養基組的白蛋白分泌在48 h達到峰值,隨后逐漸下降,而DMSO+ EGF組的白蛋白水平在72 h時達到峰值,之后開始下降。DMSO組的白蛋白分泌在肝細胞分離后逐漸升高,在72 h時達到峰值,并在96 h時仍能維持白蛋白的高水平,且比基礎培養基組和DMSO+EGF組分別增加了185%倍和24.2%,提示培養基中單獨添加DMSO可以更好地維持白蛋白的分泌。綜合上述結果顯示培養基中添加DMSO可更好地維持肝細胞的形態、活力和功能。雖然同時添加DMSO和EGF能促進細胞存活,但在細胞形態和功能維持上與單獨添加DMSO相比沒有優勢。綜合細胞形態、活力、LDH和白蛋白分泌4個指標,我們發現單獨添加DMSO的效果最佳。
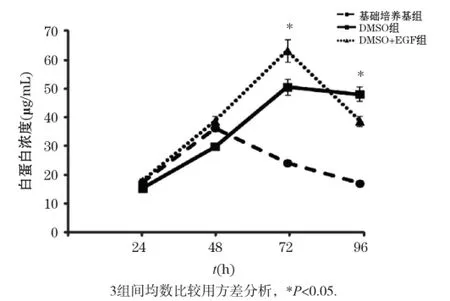
圖5 不同培養條件下小鼠原代肝細胞培養上清中的白蛋白水平
3 討論
肝臟是外源化學物代謝的重要器官,通過肝臟的代謝作用,許多外源化學物質轉化為無毒、低毒或毒性更大的代謝產物,因此肝臟是毒理學和藥理學研究的重要靶器官。目前已有很多體外肝臟模型用于毒物的代謝、代謝機制及毒物間相互作用的研究,如肝組織切片、肝臟灌流、原代肝細胞、肝微粒體和永生化肝細胞系等[1]。其中,原代肝細胞被認為是體外試驗的一個簡單而有效的模型,它能夠維持肝細胞的功能達24~72 h,可用于酶的誘導和抑制試驗,中等通量的外源化學物毒性篩查以及比較物種內和物種間的代謝差異[6-7]。然而,原代肝細胞在體外分離后迅速啟動失分化機制,主要原因是在分離的過程中失去了正常肝細胞的微環境、細胞間相互作用以及細胞膜結構[8-10],限制了其在化學物毒性評價中的應用價值。因此,探索長時間有效維持肝細胞功能的培養條件是目前亟需解決的問題。本研究使用不同的維持培養基培養小鼠原代肝細胞,并通過細胞形態、細胞活力、細胞損傷和白蛋白分泌這4個方面綜合評價其培養效果。我們發現添加2% DMSO的維持培養基能使肝細胞維持良好的形態和細胞活力,減輕肝細胞損傷,且維持白蛋白分泌的時間更長、分泌能力更強。我們的研究結果為完善體外原代肝細胞在藥理學和毒理學中的應用提供了較實用的方法。
本研究發現在基礎培養基中添加了DMSO可以更好維持原代肝細胞的形態和功能。以往Isom等[11]研究也發現大鼠原代肝細胞培養基中添加DMSO可促進肝細胞分化。然而,我們基于其研究的基礎上優化原代肝細胞培養的方法。相比之下,本研究獲得純化的原代肝細胞,且使用三明治結構的培養方法以更好地維持細胞形態[12],并嘗試在DMSO的基礎上添加EGF,以篩查更好的原代肝細胞培養條件。此外,本研究旨在優化原代肝細胞模型以用于毒理學或藥理學評價,毒理學和藥理學評價主要依賴肝細胞的代謝作用,而原代肝細胞的代謝酶在分離出體外后24~72 h則會迅速下降,因此本研究選用96 h為最長觀察時間。DMSO是一種氧自由基清除劑,既往研究發現它能較好地維持肝細胞的形態,CYP酶系和肝特異轉錄因子(如HNF-3,HNF-4和C/EBP)的表達,改進白蛋白分泌的功能[13-14]。然而其作用機制尚不明確,有研究認為這些功能可能與其抑制肝細胞增殖,使細胞停留在細胞G1期相關[15],具體機制仍需進一步研究探討。此外,我們也發現添加表皮生長因子(EGF)能促進培養細胞的存活,但并不能長時間維持肝細胞形態和白蛋白分泌功能,即使添加DMSO也不能恢復,相關機制不清楚。EGF是能促進有絲分裂的激素,在促進原代細胞增殖和存活中起作用,然而研究發現EGF能激活磷脂酶A2,引起原代肝細胞扁平化,導致CYP酶表達降低[16-17]。因此EGF作為原代肝細胞培養的添加因子還需結合具體實驗目的及調整添加劑量,而DMSO作為原代細胞培養基的一個添加成分,價格經濟,且容易獲得,是一個較好的培養基的添加成分。
目前國外關于原代肝細胞的培養更多地關注于將多種抗失分化的手段結合在一起模擬肝細胞在體內的微環境[18-20],以更好地維持肝細胞的形態和功能。例如將微流體系統、3D培養、與其他非實質細胞(纖維細胞、星形膠質細胞、庫否細胞)共培養,以及添加促分化的細胞培養基共同結合在一起,可以使肝細胞的白蛋白和尿素分泌在14 d保持較高水平,用CYP450代謝酶的誘導劑能誘導出較高的代謝酶活性[21]。而本研究主要關注于對促分化培養基成分的改進,旨在為原代肝細胞模型的構建和優化提供基礎數據。
綜上所述,本研究發現在維持培養基中添加DMSO有利于保留其與小鼠體內肝細胞相近的形態與功能,為體外肝細胞模型局限性提供了新的方法。未來體外代謝模型構建的發展方向主要是模擬人源細胞的代謝模式,雖然人源原代肝細胞模型能最大程度的模擬人體細胞對外源化學物刺激的反應,在體外毒性檢測中最具應用價值,但是由于可及性差以及個體差異性而無法全面推廣。基于生物工程的仿真代謝模型的構建將是重要的發展趨勢。
[1] Soldatow VY,LeCluyse EL,Griffith LG,et al. In vitro modelsfor liver toxicity testing[J]. Toxicol Res,2013,2(1):2 3-39.
[2] Eguchi S,Kawazoe Y,Sugiyawa N,et al. Effects ofrecombinant human hepatocyte growth factor on the proliferationand function of porcine hepatocytes[J]. ASAIO J,2000,46(1):5 6-59.
[3] Michalopoulos GK,Bowen WC,Mule K,et al. Histologicalorganization in hepatocyte organoid cultures[J]. Am J Pathol,2001,159(5):1877-1887.
[4] Fraczek J,Bolleyn J,Vanhaecke T,et al. Primary hepatocytecultures for pharmaco-toxicological studies:at the busycrossroad of various anti-dedifferentiation strategies[J]. ArchToxicol,2013,87(4):577-610.
[5] Seglen PO. Preparation of isolated rat liver cells[J]. Methods CellBiol,1976,13:29-83.
[6] LeCluyse EL. Human hepatocyte culture systems for the in vitroevaluation of cytochrome P450 expression and regulation[J]. EurJ Pharm Sci,2001,13(4):343-368.
[7] Sivaraman A,Leach JK,Townsend S,et al. A microscale invitro physiological model of the liver:Predictive screens fordrug metabolism and enzyme induction[J]. Curr Drug Metab,2005,6(6):569-591.
[8] Fraslin JM,Kneip B,Vaulont S,et al. Dependence ofhepatocyte-specific gene expression on cell-cell interactions inprimary culture[J]. EMBO J,1985,4(10):2487-2491.
[9] Ben-Ze'ev A,Robinson GS,Bucher NL,et al. Cell-cell andcell-matrix interactions differentially regulate the expression ofhepatic and cytoskeletal genes in primary cultures of rathepatocytes[J]. Proc Natl Acad Sci USA,1988,85(7):2161-2165.
[10] Oda H,Yoshida Y,Kawamura A,et al. Cell shape,cell-cellcontact,cell-extracellular matrix contact and cell polarity areall required for the maximum induction of CYP2B1 and CYP2B2gene expression by phenobarbital in adult rat culturedhepatocytes[J]. Biochem Pharmacol,2008,75(5):1 209-1217.
[11] Isom HC,Secott T,Georgoff I,et al. Maintenance of differentiated rat hepatocytes in primary culture[J]. Proc Natl Acad Sci U SA,1985,82(10):3252-3256.
[12] Noel G,Le Vee M,Moreau A,et al. Functional expression and regulation of drug transporters in monolayer- and sandwichcultured mouse hepatocytes[J]. Eur J Pharm Sci,2013,49(1):39-50.
[13] Su T,Waxman DJ. Impact of dimethyl sulfoxide on expression of nuclear receptors and drug-inducible cytochromes P450 in primary rat hepatocytes[J]. Arch Biochem Biophys,2004,424(2):226-234.
[14] Vinken M,Papeleu P,Snykers S,et al. Involvement of cell junctions in hepatocyte culture functionality[J]. Crit Rev Toxicol,2006,36(4):299-318.
[15] Elaut G,Henkens T,Papeleu P,et al. Molecular mechanisms underlying the dedifferentiation process of isolated hepatocytes and their cultures[J]. Curr Drug metab,2006,7(6):6 29-660.
[16] Papeleu P,Loyer P,Vanhaecke T,et al. Trichostatin A induces differential cell cycle arrests but does not induce apoptosis in primary cultures of mitogen-stimulated rat hepatocytes[J]. J Hepatol,2003,39(3):374-382.
[17] Papeleu P,Loyer P,Vanhaecke T,et al. Proliferation of epidermal growth factor-stimulated hepatocytes in a hormonally defined serum-free medium[J]. Altern Lab Anim,2004,32 Suppl 1A:57-64.
[18] Ananthanarayanan A,Narmada BC,Mo XJ,et al. Purposedriven biomaterials research in liver-tissue engineering[J]. Trends Biotechnol,2011,29(3):110-118.
[19] Evenou F,Hamon M,Fujii T,et al. Gas-permeable membranes and co-culture with fibroblasts enable high-density hepatocyte culture as multilayered liver tissues[J]. Biotechnol Prog,2011,27(4):1146-1153.
[20] Leite SB,Teixeira AP,Miranda JP,et al. Merging bioreactor technology with 3D hepatocyte-fibroblast culturing approaches:Improved in vitro models for toxicological applications[J]. Toxicol In Vitro,2011,25(4):825-832.
[21] Esch MB,Prot JM,Wang YI,et al. Multi-cellular 3D human primary liver cell culture elevates metabolic activity under fluidic flow[J]. Lab Chip,2015,15(10):2269-2277.
Comparison of different culture methods for mouse primary hepatocyte
WANG Shan,BAI Qing,WANG Fangping,LI Huiyao,CHEN Shen,HE Zhini,WANG Qing,CHEN Wen,CHEN Liping*
(Faculty of Preventive Medicine, School of Public Health, Sun Yat-sen University, Guangzhou 510080, China)
R114
A
1004-616X(2016)02-0125-06
1 0.3969/j.issn.1004-616x.2016.02.009
2016-02-12;
2016-02-27
廣東省自然科學基金重點項目(S2013020012725);國家自然科學基金青年項目(31401213)
作者信息: 王珊,E-mail:274639734@qq.com。*
,陳麗萍,E-mail:chenliping_happy06@163.com

