H PLC測定和胃化滯丸中黃芩苷的含量
林超史敏王永和(濟南市食品藥品檢驗檢測中心,山東濟南500;章丘市中醫醫院,章丘5000)
H PLC測定和胃化滯丸中黃芩苷的含量
林超1史敏1王永和2
(1濟南市食品藥品檢驗檢測中心,山東濟南250102;2章丘市中醫醫院,章丘250200)
【摘要】目的:建立測定和胃化滯丸中黃芩苷含量的高效液相色譜法。方法:采用Thermo C18色譜柱(100 mm×4.6 mm,5 μm),流動相為甲醇-水-磷酸(47∶53∶0.2),流速為1.0 mL/min,檢測波長為280 nm,柱溫為36℃。結果:黃芩苷對照品溶液在12~96 μg/mL(r=0.999 4)濃度范圍內與峰面積呈良好的線性關系,平均回收率為98.8%,RSD=0.59% (n=6)。結論:該法可用于和胃化滯丸中黃芩苷的含量測定。
【關鍵詞】和胃化滯丸;黃芩苷;高效液相色譜法
和胃化滯丸是由黃芩、木香、沉香、焦山楂、清半夏等多味中藥組成的醫院中藥制劑,具有行氣導滯、和胃消痞、通絡止痛的功效,用于脘腹痞悶、脹痛噯氣、食欲不振、大便不暢癥狀者。黃芩苷是方中黃芩的主要有效成分[1],為了有效控制和胃化滯丸的質量,本試驗采用高效液相色譜法(HPLC)測定方中黃芩中黃芩苷的含量,為建立該制劑的質量控制標準提供依據。
1 儀器與材料
Waters 2695高效液相色譜儀(美國Waters公司);AE-240電子天平(梅特勒–托利多儀器公司);黃芩苷對照品(中國食品藥品檢定研究院,批號:110715-201318,含量93.3%);和胃化滯丸(批號:20140123,20140124,20140125,20140126,20140603,20140604,20140605,20140927,20140928,20140929);甲醇為色譜純,水為純化水,其余試劑為分析純。
2 方法與結果
2.1色譜條件[2-3]
色譜柱:Thermo C18色譜柱(100 mm×4.6 mm,5 μm);流動相:甲醇-水-磷酸(47∶53∶0.2);檢測波長為280 nm;流速:1.0 mL/min;柱溫:36℃;進樣量:10 μL。結果見圖1。
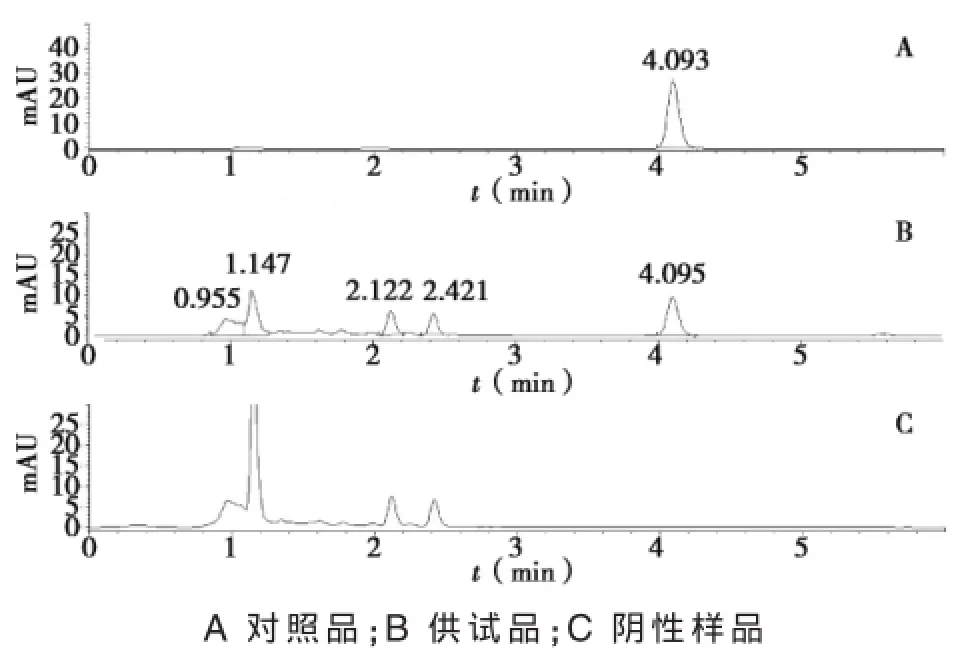
圖1 和胃化滯丸HPLC圖
2.2對照品溶液的制備
精密稱取黃芩苷對照品適量,加甲醇制成1 mL含黃芩苷0.12 mg的溶液,作為對照品儲備液。
2.3供試品溶液的制備
取本品 10 g,剪碎,精密稱定,加 70%乙醇40 mL,加熱回流3 h,放冷,濾過,濾液置100 mL量瓶中,用少量70%乙醇分次洗滌容器和殘渣,洗液濾入同一量瓶中,加70%乙醇至刻度,搖勻。精密量取 1 mL,置 10 mL量瓶中,加甲醇至刻度,搖勻,即得。
2.4陰性樣品溶液的制備
按處方工藝制備不含黃芩的陰性樣品,然后按供試品溶液制備方法制備陰性樣品溶液。
2.5干擾試驗
取陰性樣品溶液10 μL進樣,與供試品溶液和對照品溶液色譜圖對照,陰性樣品溶液在黃芩苷出峰處無干擾。
2.6方法學考察
線性關系:分別精密量取對照品儲備液適量,用甲醇稀釋得不同濃度的標準溶液,精密量取10 μL注入液相色譜儀,記錄色譜圖,以峰面積Y為縱坐標,以濃度X為橫坐標,進行線性回歸,繪制標準曲線,得黃芩苷的回歸方程為:
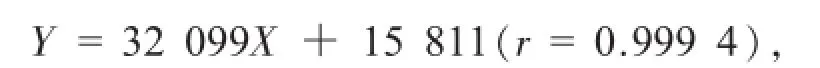
結果表明黃芩苷對照品溶液在12~96 μg/mL濃度范圍內與峰面積呈良好的線性關系。
精密度試驗:取對照品溶液(60 μg/mL),按“2.1”項下色譜條件重復進樣6次。結果黃芩苷的峰面積RSD為0.78%。
重復性試驗:按上述測定方法,對同一批號樣品分別進行6次測定,結果黃芩苷含量平均值為1.37 mg/g,RSD為0.86%,表明方法重復性良好。
穩定性試驗:取同一供試品溶液,分別于0,2,4,8,12,24 h依法測定,結果黃芩苷峰面積RSD為0.22%,表明供試品溶液在24 h內穩定。
回收率試驗:取已知含量的和胃化滯丸6份,每份約5 g,剪碎,精密稱定,分別加入黃芩苷對照品溶液100 mL(用70%乙醇制備,濃度0.7 mg/mL),按“2.3”項下方法制備,并按“2.1”項下色譜條件進行測定,計算回收率,平均回收率為98.8%,RSD= 0.59%。
2.7樣品含量測定
取和胃化滯丸按“2.3”項下方法制備供試品溶液,并按“2.1”項下色譜條件進行測定,計算黃芩苷含量,結果見表1。
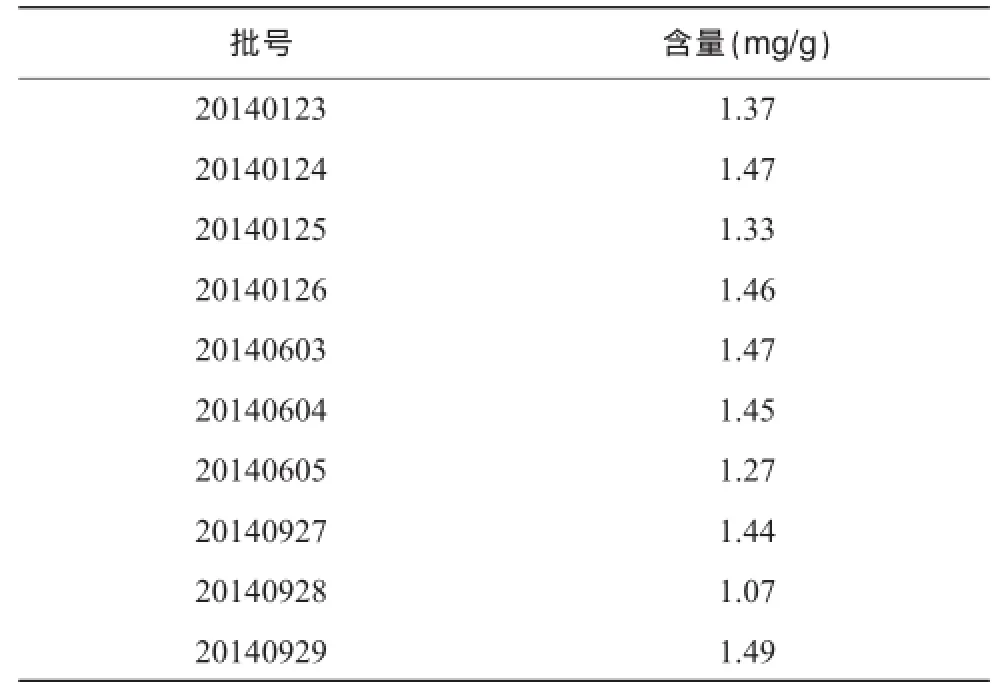
表1 樣品含量測定結果
3 討論
黃芩作為和胃化滯丸的主要組分,發揮著必不可少的作用,本文針對和胃化滯丸質量標準中含量測定項的空白,建立了HPLC測定和胃化滯丸中黃芩的指標性有效成分黃芩苷的方法,為和胃化滯丸的質量控制提供了科學依據。在供試品溶液的制備中,考察了甲醇、乙醇、70%乙醇為溶劑,超聲處理及加熱回流等提取條件,結果表明以70%乙醇為溶劑,加熱回流,待測成分可提取完全,且此方法簡單易行,成本低。
對供試品溶液在190~ 400 nm進行了掃描,最后確定無雜質干擾的 280 nm作為測定波長。應用此方法測定了10批和胃化滯丸的黃芩苷含量,結果表明不同批次樣品中黃芩苷的含量存在差異,本文又核對了這10批制劑投料的黃芩飲片的留樣,證實黃芩苷的含量與投料黃芩飲片的質量相關,投料飲片的質量直接決定著制劑的質量,由此可見黃芩苷的定量分析對和胃化滯丸的質量控制有著不可替代的作用。
與我院和胃化滯丸制劑的情況類似,我國其他很多醫療機構的中藥制劑需求量都很大,但大多數質量標準都遠遠落后于市售成藥的質量標準[4],建議醫院在保證滿足臨床用藥需求,成本合理的條件下,結合現有的分析技術,提高醫院自制制劑的質量標準,嚴格控制制劑的質量,確保其臨床有效性和安全性。
參考文獻:
[1]鄭永鳳,王佳婧,傅超美,等.黃芩的化學成分與藥理作用研究進展[J].中成藥,2016,38(1):141-145.
[2]國家藥典委員會.中華人民共和國藥典(2010年版)一部[S].北京:中國醫藥科技出版社,2010:22-283.
[3]何玲玲,韋國兵,胡奇軍.高效液相色譜法測定銀黃口服液中黃芩苷含量及不確定度分析[J].中國現代醫學雜志,2015,25 (34):15-18.
[4]謝強;王志梅;烏偉魁.溫陽通痹丸質量標準研究[J].中國執業藥師,2015,12(5):28-31.
◆醫藥快訊◆
美國限制氟喹諾酮適應證并警告致殘風險
2016年5月12日美國食品藥品監督管理局(FDA)提示急性鼻竇炎、急性支氣管炎和單純性尿路感染的患者在有其他治療選擇的情況下,使用氟喹諾酮類抗菌藥品治療引發相關嚴重不良反應的風險通常大于效益。針對上述疾病,氟喹諾酮類藥品應該僅用于那些沒有其他方案可供選擇的患者。
FDA安全性審查發現,氟喹諾酮類藥品(包括片劑、膠囊和注射液)全身用藥時,致殘性和潛在的永久性嚴重不良反應可同時發生,這些不良反應累及肌腱、肌肉、關節、神經和中樞神經系統。
因此,FDA要求更新所有氟喹諾酮類藥品標簽和用藥指南以反映最新安全信息。
如果患者在使用氟喹諾酮類藥品期間有任何問題或發生任何嚴重副作用,應立即與醫務人員溝通,部分嚴重副作用的體征和癥狀包括肌腱、關節和肌肉疼痛、針刺感或刺痛感、意識模糊和幻覺。醫務人員在患者發生嚴重不良反應時,應立即停止全身性氟喹諾酮類藥品治療,并改用其他非氟喹諾酮類抗菌藥品以完成患者的療程。
目前FDA批準的全身性治療用的氟喹諾酮類藥品
(來源:http://www.sda.gov.cn)
doi:10.3969/j.issn.1672-5433.2016.08.007
收稿日期:(2016-03-04)
作者簡介:林超,男,主管藥師。研究方向:中藥質量分析和標準研究。通訊作者E-mail:kongk1@163.com
Determination of Baicalin Content in Hewei Huazhi Pills by HPLC
Lin Chao1,Shi Min1,Wang Yonghe2(1 Jinan Center for Food and Drug Control,Shandong Jinan 250102,China;2 Zhangqiu Municipal Hospital of Traditional Chinese Medicine,Zhangqiu 250200)
ABSTRACTObjective:To develop a method for determination of baicalin conteint in hewei huazhi pills.Methods:A Thermo Cl8column(100 mm×4.6 mm,5 μm)was adopted,using methanol-water-phosphoric acid(47∶53∶0.2)as the mobile phase,at a flow rate of 1.0 mL/min,a detection wavelength of 280 nm and a temperature of 36℃.Results:Baicalin at a concentration of 12~96 μg/mL showed good linear relationship to the peak area.The average recovery was 98.8%,with a RSD of 0.59%(n=6).Conclusion:The method may be used for the determination of baicalin content in hewei huazhi pills.
KEY WORDSHewei Huazhi Pills;Baicalin;HPLC

