單增李斯特菌inl A/ inl B雙基因缺失株生長特性觀察及對小鼠致病性研究
任靜靜,楊銘偉,陳云飛,蔣建軍,王鵬雁
?
單增李斯特菌inl A/ inl B雙基因缺失株生長特性觀察及對小鼠致病性研究
任靜靜,楊銘偉,陳云飛,蔣建軍,王鵬雁
目的探究單增李斯特菌inl A/inl B雙基因缺失株的生物學特性。方法通過體外脅迫培養條件下OD600測定以及小鼠感染試驗,對Lm90-△inlAB和Lm90的抗脅迫能力及細菌致病力進行研究。結果低溫(4 ℃、30 ℃)環境下,Lm90和Lm90-△inlAB生長差異無統計學意義(t4 ℃=0.057,P>0.05;t30 ℃=0.441,P>0.05),適溫37 ℃及42 ℃高溫環境下,Lm90-△inlAB較Lm90生長受到抑制,生長差異具有統計學意義(t37 ℃=0.763,P<0.05;t42 ℃=1.147,P<0.05);體外耐酸堿試驗中,Lm90-△inlAB耐酸性未明顯改變,而耐堿能力強于親本株Lm90,生長差異具有統計學意義(pH=9時t=2.837,P<0.05);在含有3.5%酒精的BHI培養基及含5% NaCl高滲BHI培養基中,Lm90-△inlAB增長趨勢明顯低于Lm90,生長差異具有統計學意義(t酒精=1.422,P<0.05;tNaCl=1.382,P<0.05),Lm90-△inlAB對酒精及高鹽的耐受力顯著低于Lm90;小鼠毒力測定結果表明,Lm90-△inlAB與Lm90半數致死量分別為106.94CFU、105.68CFU,Lm90-△inlAB毒力下降明顯,在不同檢測時間點Lm90-△inlAB在小鼠肝臟和脾臟內的載菌量均少于Lm90,載菌量差異具有統計學意義(t肝=2.454,P<0.05;t脾=2.443,P<0.05)。結論Lm的抗脅迫能力可能隨著基因的缺失發生顯著改變,內化素InlA/InlB與單增李斯特菌侵染宿主的能力有一定的調控作用。缺失株生物學特性測定對研究Lm脅迫環境生存及毒力因子的致病機理提供了科學依據。
單核細胞增生性李斯特菌;inlA基因;inlB基因;環境耐受;毒力
Supported by the Program of the National Natural Science Foundation of China (No. 31260606), the Open Fund Project of State Key Laboratory of Veterinary Etiological Biology (No. SKLVEB2011KFKT007) and the High Level Talents Scientific Research Project of Shihezi University (No. RCZX201104 )
單核細胞增生性李斯特菌(Listeriamonocytogenes,Lm)是目前國際公認的重要食源性病原菌之一。自1926年Murray等首次分離到本病原后,李斯特菌病現已呈世界性分布[1]。Lm做為一類重要的人獸共患的條件致病菌,可引起人類和多種畜禽的疾病,人畜感染后主要表現為腦膜炎、敗血癥;家禽感染后主要表現為腦膜炎、壞死性心肌炎及壞死性肝炎[2-3]。致病性李斯特菌為侵襲性胞內菌,其共同特點是可穿越感染宿主的3道屏障,即腸道屏障、血腦屏障和胎盤屏障[4]。內化素A(InlA)與內化素B(InlB)作為Lm特有的與黏附和侵襲相關的毒力因子,位于菌體表面,介導細菌侵襲入宿主細胞并內化至吞噬小體,從而建立感染。在細菌穿越腸道上皮細胞和胎盤屏障中,InlA是必需的[5],由800個氨基酸組成,N端具有亮氨酸重復(LRR)區域,并由中間重復區(IR)與B重復區隔開,該LRR與IR區域為Lm入侵上皮細胞所必需。InlA的C端所包含的LPXTG基元能夠以共價鍵連接肽聚糖,在細菌穿越腸道屏障中發揮重要作用[6]。InlB可介導Lm侵入肝細胞和非上皮細胞等[7],由630個氨基酸組成,其N端到C端分別為信號肽序列、LRR重復區、IR重復區、B重復區和GW區。其中GW區可介導InlB以非共價鍵連接脂磷壁酸吸附至細菌細胞壁表面,LRR重復區及B重復區也參與InlB與靶細胞的互作[6]。肝細胞生長因子受體(Met)為InlB的主要受體,在LRR重復區的凹陷部與InlB結合。而補體分子Clq受體為InlB的另一個受體,該受體同時可抑制不同細胞HIV的生長[8]。
本文以同源重組構建的inl A、inl B雙基因缺失株(Lm90-△inlAB)為研究對象,研究Lm90-△inlAB的抗脅迫能力變化并通過小鼠感染試驗探究缺失株毒力的改變,為探討Lm毒力因子InlA、InlB的致病機理提供科學依據。
1 材料與方法
1.1材料
1.1.1菌株和實驗動物單增李斯特菌Lm90(4b血清型)新疆致綿羊腦炎分離株,由石河子大學動物科技學院預防獸醫學實驗室分離、鑒定并保存,基因缺失株Lm90-△inlAB本實驗室自行構建。8周齡健康昆明系小鼠由石河子大學實驗動物中心提供。
1.1.2主要試劑腦心浸液肉湯BHI,購自BD公司;PBS(pH=7.2)實驗室配制。
1.1.3主要儀器設備生物安全柜(BHC-Ⅱ-A/B3型)購自The Baker Company;HANNA PH211臺式酸度計購自ROMANIA Company;BioTeck Power Wave XS2 連續波長酶標儀購自美國Gene Limited Company。
1.2方法1.2.1Lm 90與Lm 90-△inl AB不同溫度下生長曲線測定將Lm 90和Lm 90-△inlAB按照1∶100的比例分別接種到10 mL的BHI培養基中,37 ℃180 r/min條件下過夜培養至OD600為0.4。后將Lm 90和Lm 90-△inlAB按照1∶100的比例分別接種到20 mL的BHI中,每個菌株接種4管分別置于4 ℃、30 ℃、37 ℃、42 ℃于180 r/min條件下培養;以加入細菌的時刻為時間起點(t=0),在t=1、2、4、6、8、10、12 h 7個不同的時間點取200 μL菌液加入到96孔酶標板中,測定兩株菌的OD600值并記錄。根據不同時間點OD600值繪制Lm 90和Lm 90-△inlAB在4種不同溫度條件下的生長曲線并比較分析。
1.2.2Lm90與Lm90-△inl AB耐酸、耐堿生長曲線測定Lm90和Lm90-△inlAB培養同1.2.1(BHI培養基pH=7.0)。將Lm90和Lm90-△inlAB按照1∶100的比例分別接種到20 mL不同pH(pH=3.0、pH=5.0、pH=7.0、pH=9.0)的BHI液體培養基中進行培養。以加入細菌的時刻為時間起點(t=0),在t=1、2、4、6、8、10、12 h 4個不同的時間點取200 μL菌液加入到96孔酶標板中,測定2株菌的OD600值并記錄。根據不同時間點的OD600值,繪制Lm90和Lm90-△inlAB在4種不同pH條件下的生長曲線并進行分析。
1.2.3Lm90與Lm90-△inl AB高鹽、酒精試驗
Lm90和Lm90-△inlAB培養同1.2.1。將Lm90和Lm90-△inlAB按照1∶100的比例分別接種到20 mL含有3.5%酒精BHI液體培養基、5% NaCl BHI液體培養基中培養。以加入細菌的時刻為時間起點(t=0),在t=1、2、4、6、8、10、12 h 7個不同的時間測定2株菌的OD600值并記錄。根據不同時間點的OD600值,繪制Lm90和Lm90-△inlAB在酒精及高鹽條件下的生長曲線,并進行比較分析。
1.2.4Lm90與Lm90-△inl AB LD50的測定Lm90與Lm90-△inl AB 過夜振蕩培養。當OD600為0.6時,8 000 r/min離心5 min收集細菌。然后將管底的細菌用PBS清洗2遍,用PBS將細菌懸液進行10倍梯度稀釋。用不同稀釋度的菌液對小鼠腹腔注射,確定2株細菌的絕對致死劑量(Absolute lethal dose,LD100)和最小致死劑量(Minimal lethal dose,MLD)。將小鼠分成10組,每組10只,然后將稀釋后的菌液腹腔注射8周齡昆明系小鼠,每個梯度10只,100 μL/只,Lm90與Lm90-△inl AB各分5個梯度,連續觀察14 d,統計死亡數。對照組注射等劑量PBS,100 μL/只。利用寇氏法計算LD50,計算公式:log LD50=[Xm-i(∑P-0.5)]。式中:Xm為最大劑量的對數;P為各組動物的死亡率(以小數表示);∑P為各組動物死亡率的總和(P1+P2+P3……);i為組間距(相鄰兩組對數劑量的差值)。
1.2.5小鼠肝臟、脾臟載菌量的測定8周齡健康昆明系小鼠隨機分2組,每組10只。Lm90與Lm90-△inl AB過夜活化培養,將活化后的菌液按1∶100分別接種到新鮮BHI中,當其OD600值為0.3時,分別給每組中的每只小鼠腹腔注射0.1 mL的菌液(亞致死量)。注射菌液的時刻t=0(day),分別在t=2,4,6,8,10 d時每組取出1只小鼠,無菌條件下剖檢取出肝、脾,加入1 mL的PBS液研磨均勻充分后進行10倍系列稀釋,分別均勻涂布到BHI固體培養基上37 ℃條件下培養24~48 h,進行標準細菌平板計數。
1.2.6統計學分析應用SPSS20.0統計軟件,計量資料分析采用獨立樣本t檢驗。P<0.05表示差異具有統計學意義。
2 結 果
2.1不同溫度Lm90與Lm90-△inl AB的生長曲線將Lm90與Lm90-△inlAB分別置于不同溫度條件下培養,結果發現2株菌在4 ℃生長極其微弱,生長狀態基本相同,生長差異無統計學意義(t=0.057,P>0.05);在30 ℃條件下2株菌均表現出生長適應期延長,6 h左右才達到穩定期,生長差異無統計學意義(t=0.441,P>0.05);37 ℃與42 ℃培養條件下,2株菌生長迅速,Lm90與Lm90-△inlAB在0至2 h時間段內均處于生長適應期, 2至4 h時間段內處于生長對數期,4至8 h時間段內處于生長穩定期,在生長適應期二者生長情況基本一致,而2 h之后Lm90生長趨勢明顯高于Lm90-△inlAB,生長差異具有統計學意義(37 ℃:t=0.763,P<0.05;42 ℃:t=1.147,P<0.05),表明Lm90耐高溫能力顯著強于Lm90-△inlAB(如圖1所示)。
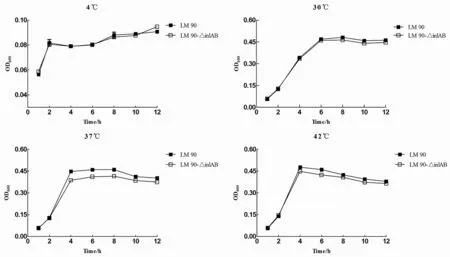
圖1 不同溫度條件下Lm 90與Lm 90-△inl AB生長曲線Fig.1 Growth curve of Lm 90 and Lm 90-△inl AB in different temperature
2.2不同酸度Lm90與Lm90-△inl AB的生長曲線如圖2所示Lm90與Lm90-△inlAB在pH=3.0、pH=5.0條件下培養,兩株菌生長狀態基本相同,均表現出生長停滯,生長差異無統計學意義(pH=3.0時t=1.079,P>0.05;pH=5.0時t=0.333,P>0.05);pH=7.0時,在檢測的12 h內二者生長趨勢基本一致,生長差異無統計學意義(t=0.156,P>0.05);pH=9.0時,在0至2 h時間段內二者均處于生長適應期,而在2 h之后二者均進入對數生長期,Lm90生長趨勢明顯高于Lm90-△inlAB,生長差異具有統計學意義(t=2.837,P<0.05),表明Lm90耐堿能力強于Lm90-△inlAB。
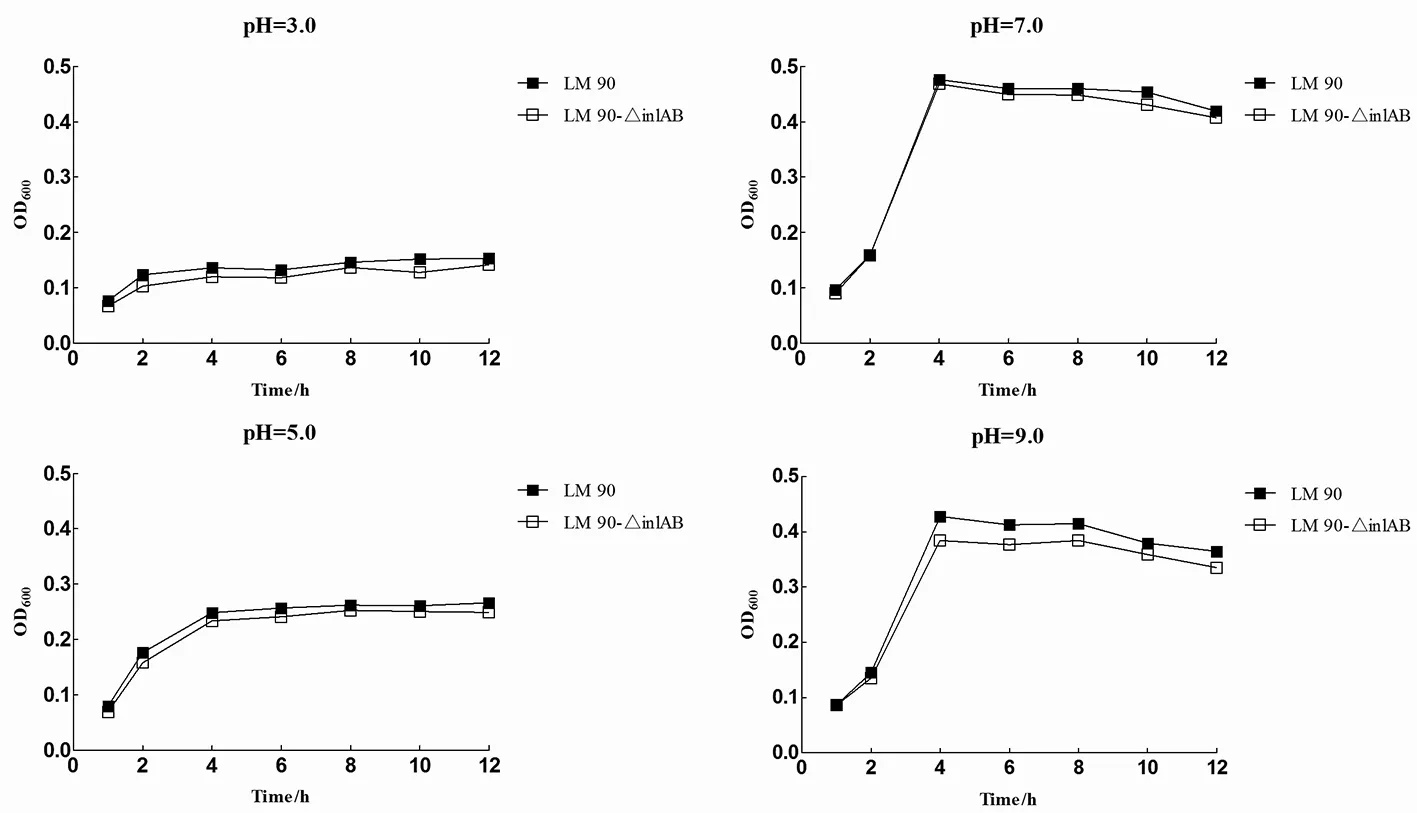
圖2 不同pH條件下Lm 90與Lm 90-△inl AB生長曲線Fig.2 Growth curve of Lm 90 and Lm 90-△inl AB in different pH
2.3Lm90與Lm90-△inl AB酒精、NaCl耐受性結果將Lm90與Lm90-△inlAB分別接種BHI、含3.5%酒精BHI和5.0%NaCl BHI,觀察發現二者在含3.5%酒精BHI和5.0%NaCl BHI中均生長緩慢,生長延滯現象明顯且生長量較低,生長情況與空白BHI培養基相比差異具有統計學意義(Lm90:t酒精=1.157,P<0.05;tNacl=1.169,P<0.05;Lm90-△inl AB:t=0.669,P<0.05;t=1.281,P<0.05)(圖3-A、3-B);分別對比Lm90與Lm90-△inlAB發現,在0至4 h時間段內二者均處于生長適應期,而在4 h之后Lm90增長趨勢明顯高于Lm90-△inlAB,生長差異具有統計學意義(t酒精=1.422,P<0.05;tNaCl=1.382,P<0.05),表明Lm90-△inlAB對酒精及高鹽的耐受力低于Lm90(圖3-C、3-D)。
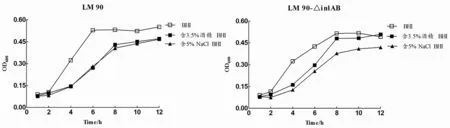
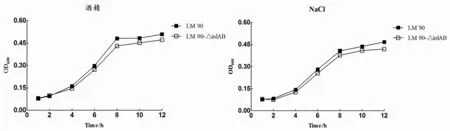
圖3 含3.5%酒精、5.0%NaCl BHI中Lm 90與Lm 90-△inl AB生長曲線Fig.3 Growth curve of Lm 90 and Lm 90-△inl AB in different medium
2.4Lm90與Lm90-△inl AB 的LD50測定結果
試驗小鼠經腹腔注射Lm90與Lm90-△inlAB,12 h后出現精神萎靡、畏寒扎堆、采食量與飲水量下降,24 h后部分小鼠陸續出現死亡現象。連續觀察10 d,統計各組小鼠死亡率并記錄結果。根據寇氏算法計算Lm90與Lm90-△inlAB的LD50分別為105.68CFU和106.94CFU(如表1),Lm90-△inlAB的LD50升高了1.26個對數數量級,表明inl A與inl B缺失后使得Lm毒力下降。
表1Lm 90和Lm 90-△inlAB對小鼠LD50的測定結果
Tab.1LD50measurement of Lm 90 & Lm 90-△inlAB

Lm90Lm90-△inlAB組別Group劑量Dose動物數No.ofanimals死亡數Deathno.死亡率MortalityLD50Medianlethaldose組別Group劑量Dose動物數No.ofanimals死亡數Deathno.死亡率MortalityLD50Medianlethaldose11.9×10910101.0105.6812.2×10910101.0106.9421.9×1081090.922.2×1081080.831.9×1071090.932.2×1071060.641.9×1061080.842.2×1061050.551.9×1051050.552.2×1051000
2.5Lm90與Lm90-△inl AB組織載菌量測定結果兩組小鼠接種Lm90與Lm90-△inlAB后,小鼠出現精神萎靡,雙眼微閉,結膜潮紅有少量分泌物,活動遲緩等現象。病理解剖發現,接種Lm90組的小鼠脾臟和肝臟明顯腫大,腸道黏膜脫落,部分腸道出現充血、出血現象,而Lm90-△inlAB注射組小鼠脾臟與肝臟腫大但相比Lm90注射組不明顯;Lm90組小鼠在第2、4、6、8、10 d的肝臟載菌量結果分別為103.9、104.2、104.7、103.5、102.8CFU,脾臟的細菌計數結果分別為103.7、104.0、104.5、103.1、102.4CFU;Lm90-△inlAB組小鼠在第2、4、6、8、10 d肝臟的細菌計數結果分別為102.8、103.2、103.8、101.8、101.5,脾臟的細菌計數結果分別為102.2、102.9、103.3、101.5、101.2。
分析計數結果可以發現,在各個時間節點注射Lm90組的小鼠肝和脾臟載菌量要高于注射Lm90-△inlAB肝和脾載菌量。計數結果取對數繪制Time-log值的柱狀圖(如圖4所示),發現在第0 d至6 d,肝和脾內的細菌數量呈上升趨勢,并且肝和脾內的細菌含量都較多;在第8 d和第10 d的時候,2組小鼠的肝臟和脾臟內的細菌含量明顯減少,載菌量差異具有統計學意義(t肝=2.454,P<0.05;t脾=2.443,P<0.05)。

圖4 小鼠肝臟和脾臟載菌量計數結果Fig.4 Amount of bacteria in the liver and spleen of mice
3 討 論
Lm作為一種重要的食源性致病菌,在自然界廣泛存在,不僅給畜牧業帶來巨大的經濟損失,同時也嚴重威脅公共衛生安全。作為一種胞內寄生的模式菌,其感染過程包括抵抗外界環境與宿主內環境的應激、黏附并侵入細胞,在細胞內增殖以及在細胞間擴散,每一步均由特定的毒力因子介導[9]。
本試驗重點研究親本株Lm90與缺失株Lm90-△inlAB在低溫、高溫、不同酸度以及高鹽、酒精等壓力環境下Lm的生長狀況并初步對其毒力進行判定。Lm生長溫度范圍為2~42 ℃,最適生長溫度范圍為30~37 ℃,能在普通冰箱冷藏室生長,是一種典型的耐冷性細菌[10]。本研究發現inlA、inlB基因對Lm抵抗低溫逆境不是必需的,但當處于高溫環境時,Lm90-△inlAB生長趨勢明顯低于Lm90,生長差異具有統計學意義,推測可能是由于基因缺失后使其對高溫的耐受力下降。
有研究證實Lm嗜中性,最適pH為6~7[11]。酸堿實驗測定結果表明,于酸性、中性環境下,Lm90與Lm90-△inlAB相比,生長差異無統計學意義;堿性環境中Lm90耐堿能力顯著強于Lm90-△inlAB,生長差異具有統計學意義;有報道指出Lm對鹽有較高的耐受性,在濃度為7%的氯化鈉中都能生長,本試驗中Lm90在5%的鹽溶液中生長良好,表現出一致性,而Lm90-△inlAB對高鹽的耐受力明顯下降,與Lm90相比較,生長差異具有統計學意義。
在肝脾載菌量試驗中Lm90-△inlAB在小鼠肝臟和脾臟中的數量明顯少于Lm90,載菌量差異具有統計學意義,對小鼠的感染能力減弱,推測原因可能是由于InlA參與介導Lm的內化途徑[13-14],當inlA缺失后其介導作用受阻,從而使Lm毒力下降;另外內化素家族成員在侵染宿主的過程中往往具有協同作用,例如在InlB和InlC存在的條件下InlA介導的侵染能力會增強,而在inlB缺失的情況下InlA介導的入侵作用明顯下降[15],本試驗中Lm90-△inlAB毒力的下降與其表現出一致性,推測原因可能是肝臟和脾臟中InlB的受體不同(Met和Clq)所致。
本研究通過體外脅迫培養以及小鼠感染試驗,對Lm90-△inlAB和Lm90的抗脅迫能力及細菌致病力進行了研究,在一定程度上證明了inlA與inlB對Lm毒力有一定的調節作用,為進一步闡明Lm的毒力因子的致病機制提供了一定的科學依據。
[1] Chao GX, Jiao XA, Xu Q, et al. Study on epidemic status and drug resistance ofListeriamonocytogenesin food[J]. Chin J Heal Lab Technol, 2005,15(5): 519-521. DOI:10.3969/j.issn.1004-8685.2005.05.003.(in Chinese)
巢國祥,焦新安,徐勤,等.8類食品單核細胞增生李斯特菌流行特征及耐藥性狀研究[J]. 中國衛生檢驗雜志, 2005,15(5): 519-521.
[2] Birte FV, Hans HH, Bente O, et al. Elucidation ofListeriamonocytongenescontramination routes in cold-smoked salmon processing plants detected by DNA-based typing methods[J]. Appl Envir Mic Robiol, 2001, 67(6): 2586-2595. DOI: 10. 1128/AEM. 67. 6. 2586-2595. 2001
[3] Laemynck GV, Lafarge V, scotter S. Improvement of the detection ofListeriamonocytogenesby the application of ALOA, a diagnostic, chromogenic isolation medium[J]. J Appl Microbiol, 2000, 88: 430-441. DOI: 10. 1046/j. 1365-2672. 2000. 00978. x
[4] Vazquez-Boland JA, Kuhn M, Berche P, et al.Listeriapathogenesis and molecular virulence determinants[J]. Clin Microbiol Rev, 2001, 14(548): 584-640. DOI: 10. 1128/CMR.14. 3. 584-640. 2001
[5] Lecuit M, Nelson DM, Smith SD, et al. Targeting and crossing of the human maternofetal barrier byListeriamonocytogenes: role of internalin interaction with trophoblast E-cadherin[J]. Proc Natl Acad Sci U S A, 2004, 101(16): 6152-6157. DOI: 10. 1073/pnas. 0401434101
[6] Dussurget O, Pizarro-Cerda J,Cossart P. Molecular determinants ofListeriamonocytogenesvirulence[J]. Annu Rev Microbiol, 2004,58:587-610. DOI: 10. 1146/annurev. Micro. 57. 030502. 090934
[7] Hamon M, Bierne H, Cossart P.Listeriamonocytogenes: a multifaceted model[J]. Nat Rev Microbiol, 2006, 4(6): 423-434. DOI: 10. 1038/nrmicro1413
[8] Ghebrehiwet B, Jesty J, Peerschke EI. gClq-R/p33: structure function predicitions from the crystal structure[J]. Immunobiology, 2002, 205(4/5): 421-432. DOI: 10. 1078/0171-2985-00143
[9] Jiang LL, Chen JS, Fang WH. Study on the main virulence factors ofListeriamonocytogenes[J]. Chin J Zoonoses, 2007, 23(7): 733-736. (in Chinese)
江玲麗,陳建舜,方維煥.單核細胞增多性李斯特菌主要毒力因子研究進展[J]. 中國人獸共患病學報, 2007, 23(7): 733-736.
[10] Zhou XH, Li XY, Yang XS, et al. Study the effect of cultural condition on growth state ofListeriamonocytogenes[J]. Sci Technol Food Indus, 2013,15: 140-148.DOI:10.13386/j.issn.1002-0306.2013.15.013. (in Chinese)
周小紅,李學英,楊憲時,等. 培養條件對單增李斯特菌生長的影響[J]. 食品工業科技, 2013,15: 140-148.
[11] Abee T, Wouters JA. Microbial stress response in minimal processing[J]. Int J Food Microbiol, 1999, 50(1/2): 65-91. DOI: 10. 1016/S0168-1605(99)00078-1
[12] Schubert WD, Urbanke C, Ziehm T, et al. Structure of internalin a major invasion protein ofListeriamonocytogenesin complex with its human receptor E-cadherin[J]. Cell, 2002, 111(6): 825-836. DOI: 10. 1016/S0092-8674(02)01136-4
[13] Shen Y, Ujokas M, Park M, et al. Inl B-dependent internalization of listeriais mediated by the met receptor tyrosine kinas[J]. Cell, 2000, 103(3): 501-510. DOI: 10. 1016/S0092-8674(00)00141
[14] Ireton K. Entry of the bacterial pathogenListeriamonocytogenesinto mammalian cells[J]. Cell Microbiol, 2007, 9(6): 1365-1375. DOI: 10.1111/j. 1462-5822. 2007. 00933. x
Biological characters and pathogenicity ofListeriamonocytogenes△inlA/△inlB double gene deletion strains
Ren Jing-jing, Yang Ming-wei, Chen Yun-fei, Jiang Jian-jun, Wang Peng-yan
(CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832000,China)
In order to explore the biological characters of the △inlA/△inlB double gene deletion strains ofListeriamonocytogenes, the ability to resist stress and pathogenicity ofLm90 andLm90-△inlAB were studied byinvitrostress culture and mouse infection experiment. Results showed that there was no significant difference(t4 ℃=0.057,P>0.05;t30 ℃=0.441,P>0.05)betweenLm90 andLm90-△inlAB at low temperature (4-30 ℃) and the growth ofLm90 was better than that ofLm90-△inlAB at 37 ℃ and 42 ℃(t37 ℃=0.763,P<0.05;t42 ℃=1.147,P<0.05). For acid and alkali resistance testinvitro, there was no obvious change of acid resistant ability but a better alkali resistant ability ofLm90-△inlAB than parent strainLm90(pH=9,t=2.837,P<0.05). The growth ofLm90-△inlAB was significantly lower thanLm90 in BHI culture medium containing 3.5% alcohol and 5% NaCl hypertonic BHI medium and the difference was significant(talcohol=1.422,P<0.05;tNaCl=1.382,P<0.05). In other words, the tolerance of alcohol and high salt ofLm90-△inlAB was significantly lower than that ofLm90. Results of mice virulence determination showed that the median lethal dose ofLm90-△inlAB andLm90 were 106.94CFU and 105.68CFU respectively, and the virulence ofLm90-△inlAB decreased significantly. The microbial load ofLm90-△inlAB in mice’s liver and spleen was much less than that ofLm90 at different time points(tliver=2.454,P<0.05;tspleen=2.443,P<0.05). Results reveal that the ability to resist stress ofLm90 could have a significant change as genetic absence. Internalization InlA/InlB had a certain regulation effect on the ability ofListeriamonocytogenesto infect host. Determination of biological characteristics of deletion strains provides a scientific basis for exploringListeriamonocytogenessurvival under stress environment and pathogenic mechanism of virulence factors.
Listeriamonocytogenes; inlA gene; inlB gene; environment tolerance; virulence
Jiang Jian-jun, Email: jiangjianjun@shzu.edu.cn
蔣建軍,Email: jiangjianjun@shzu.edu.cn
石河子大學動物科技學院,石河子832000
R378.99
A
1002-2694(2016)06-0529-06
2015-09-14;
2016-04-03
DOI:10.3969/j.issn.1002-2694.2016.06.005
國家自然科學基金項目(No. 31260606),家畜疫病病原生物學國家重點實驗室開放基金課題項目(No. SKLVEB2011KFKT007),石河子大學高層次人才科研啟動項目(No. RCZX201104)聯合資助

