肉桂內生細菌轉化肉桂醛的研究
劉斌,李子院,韓文,李海云(廣西高校食品安全與檢測重點實驗室,桂林理工大學化學與生物工程學院,廣西桂林541004)
肉桂內生細菌轉化肉桂醛的研究
劉斌,李子院,韓文,李海云*
(廣西高校食品安全與檢測重點實驗室,桂林理工大學化學與生物工程學院,廣西桂林541004)
采用單因素試驗法對肉桂內生細菌Pseudomonas sp.RGEB06轉化肉桂醛合成肉桂醇的反應條件進行了研究。在改良M9液體培養基的基礎上,以肉桂醛轉化率、肉桂醇轉化產率、肉桂醇選擇性等為指標,考察了轉化過程中的肉桂醛底物濃度、初始pH、轉化溫度、接種量、裝液量、搖床轉速、預培養時間、轉化時間等因素對Pseudomonas sp.RGEB06轉化肉桂醛合成肉桂醇的影響。結果表明:在轉化溫度30℃、初始pH 6.5、裝液量100 mL/250 mL三角瓶、接種量20%、搖床轉速150 r/min、預培養時間24 h、底物濃度2.64 mg/mL、轉化時間24 h時,肉桂醇的轉化率達到最大值88.08%,生成肉桂醇的選擇性為94.21%,轉化液中肉桂醇的濃度為2.36 mg/mL。
內生細菌;微生物轉化;肉桂醛;肉桂醇
肉桂醇又稱桂皮醇,β-苯基丙烯醇。作為香料、藥物、食品及其它精細化工產品生產的重要原料和中間體,肉桂醇在有機合成中有著廣泛的應用[1-3]。目前制備肉桂醇的研究主要集中于肉桂醛選擇性加氫合成[4-7],而利用肉桂醛微生物轉化合成肉桂醇的研究較少。馬麗等[8-9]研究了Mucor sp.JX23發酵液直接生物催化肉桂醛選擇加氫制肉桂醇的反應,在最優反應條件下,肉桂醛的轉化率為82.9%,產物肉桂醇的選擇性為90.4%。
近幾年來,植物內生菌的生物轉化性能逐漸受到人們的重視[10-14],但鮮見有肉桂內生菌的分離及其生物轉化性能研報道。本課題組前期從新鮮肉桂皮中分離、篩選出一株可催化肉桂醛加氫生成肉桂醇的內生細菌RGEB06,經鑒定為Pseudomonas sp.,本文對該菌株轉化肉桂醛合成肉桂醇的條件進行研究。
1 材料與方法
1.1材料
1.1.1菌種
肉桂內生細菌Pseudomonas sp.RGEB06:分離自新鮮肉桂皮(2014年10月采自廣西桂平金田林場)。
1.1.2培養基
1.1.3主要試劑
乙酸乙酯:淄博潤沃商貿有限公司;二甲亞砜:西隴化工股份有限公司;無水乙醇:天津市新天科技開發有限公司;肉桂酸、肉桂醛、肉桂醇等:購于上海阿拉丁生化科技有限公司。所用藥品均為AR或生化試劑。1.1.4主要儀器
BS223S電子天平:賽多利斯科學儀器(北京)有限公司;LRH-150-Z振蕩培養箱:廣東省醫療器械廠;HX-I回旋式振蕩器:廣東省環保儀器設備廠;DL-5-B離心機:上海安亭科學儀器廠;LC-20A液相色譜儀:日本島津公司;SW-CJ-IF超凈工作臺:蘇州安泰空氣技術有限公司;LS-B-50L壓力蒸汽滅菌鍋:上海華巖

1.2.2高效液相色譜分析
采用高效液相色譜方法測定轉化體系中的肉桂醛、肉桂醇、肉桂酸含量。測定在日本島津LC-20A色譜儀上進行,色譜柱為Phenomenex Luna C18柱(250 mm× 4.6 mm,5μm),檢測器為SPD-M20A二極陣列管,柱溫室溫(25℃),流動相流速0.8 mL/min,進樣體積5μL。流動相由含0.1%甲酸的乙腈(B)和含0.1%甲酸的H2O(A)兩種溶液組成,二元梯度洗脫,洗脫程序為:0~20 min,流動相B由30%升至50%;20 min~22 min,流動相B恒定為50%;22 min~27 min,流動相由50%降至30%;27 min~30 min,流動相B恒定為30%。
2 結果與討論
2.1初始pH的影響
按1.2.1方法,固定其他條件不變,改變液體培養基初始pH分別為5.5、6.0、6.5、7.0、7.5、8.0,考察初始pH對轉化反應的影響。培養基初始pH對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響如圖1所示。
圖1結果表明,隨著pH值的逐漸增大,肉桂醇的轉化產率先增大后減小。當pH值為6.5時,肉桂醇的轉化產率及選擇性達到最大值。當pH值高于7.0時,儀器設備有限公司。
1.2方法
1.2.1肉桂醛的生物轉化
斜面保存的Pseudomonas sp.RGEB06經平板培養活化24 h后,挑取一環接入100 mL改良M9液體培養基中(250 mL三角瓶),在溫度為30℃,轉速為150 r/min的搖床上振蕩培養24 h,即為種子液。將種子液按照20%的接種量接入到裝有80 mL p H 6.5的改良M9液體培養基的250 mL三角瓶中,在溫度為30℃、轉速為150 r/min的搖床上振蕩培養24 h。無菌條件下,加入1 mL 264 mg/mL肉桂醛二甲亞砜溶液,相同條件下繼續培養24 h。轉化結束后,取轉化液1 mL,在1×104r/min的條件下離心10 min,收集上清液,用2 mL乙酸乙酯萃取3次,收集乙酸乙酯萃取液,減壓旋轉蒸干,加入10 mL甲醇溶解后,進行高效液相色譜分析,測定轉化體系中肉桂醛、肉桂醇及肉桂酸的濃度,按下述各式計算肉桂醇摩爾轉化產率及肉桂醇產物選擇性。轉化產率和選擇性急劇下降,這是由于肉桂醛氧化生成肉桂酸的趨勢增大所致。選擇轉化的初始pH為6.5。
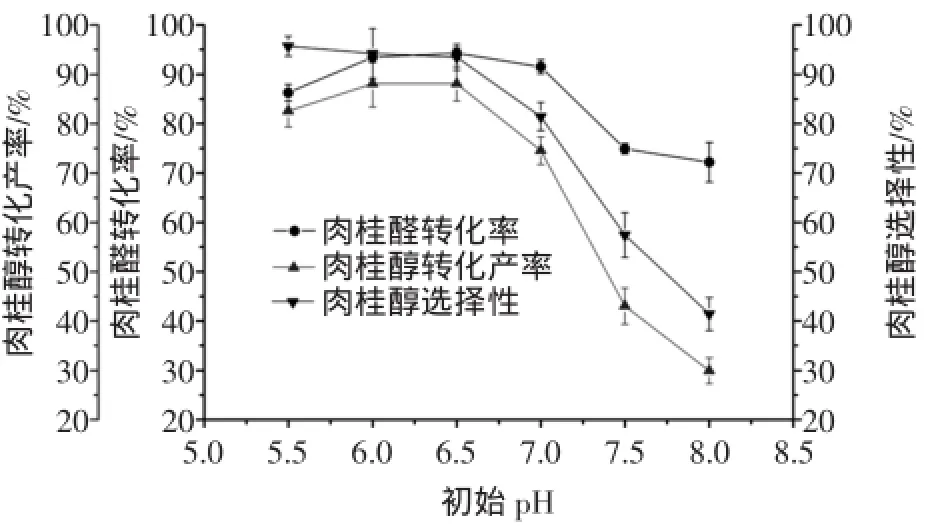
圖1 初始pH對肉桂醛生物轉化生成肉桂醇的影響Fig.1 Effects ofinitialpH on the biotransformation of cinnamaldehyde into cinnamylalcohol
2.2轉化溫度的影響
按1.2.1方法,固定其他條件不變,改變轉化溫度分別為20、25、30、35℃,考察轉化溫度對轉化反應的影響。轉化溫度對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響如圖2所示。
由圖2可知,隨著轉化溫度的逐漸增大,肉桂醇的轉化產率先增大后減小,說明了在肉桂醛轉化為肉桂醇的過程中轉化溫度會影響菌體細胞所產酶的活性、穩定性和選擇性,較高的溫度會使反應體系中的酶受到抑制,甚至失活。同時,偏高的溫度也會加速肉桂醛和肉桂醇的氧化速率,從而導致肉桂醇的轉化產率降低。因此,最適轉化溫度為30℃。
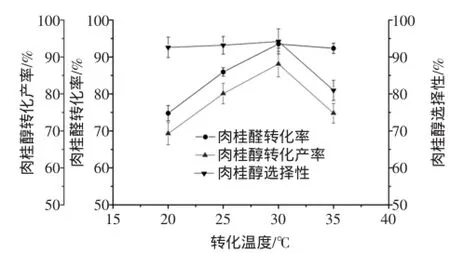
圖2 轉化溫度對肉桂醛生物轉化生成肉桂醇的影響Fig.2 Effects of conversion temperature on the biotransformation ofcinnamaldehyde into cinnamylalcohol
2.3底物濃度的影響
按1.2.1方法,固定其他條件不變,改變加入的肉桂醛濃度,使轉化體系中底物肉桂醛的濃度分別為1.32、1.98、2.64、3.30、3.96 mg/mL,考察底物肉桂醛濃度對轉化反應的影響。底物肉桂醛濃度對肉桂醇摩爾轉化產率及肉桂醇選擇性的影響,結果如圖3所示。
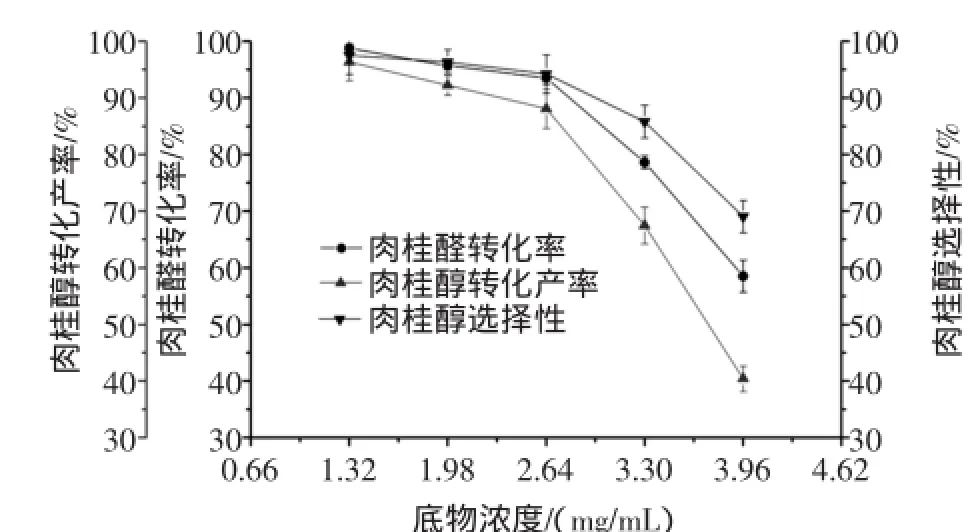
圖3 底物濃度對肉桂醛生物轉化生成肉桂醇的影響Fig.3 Effects ofsubstrate concentration on the biotransformation ofcinnamaldehyde into cinnamylalcohol
圖3結果表明,在試驗的底物濃度范圍內,肉桂醛的轉化率、肉桂醇的轉化產率及選擇性均隨著底物濃度的增大而逐漸減小。肉桂醇轉化產率的降低主要是由于肉桂醛對微生物細胞具有較強的毒害作用,當肉桂醛濃度過高時,會抑制細菌的生長和新陳代謝能力,從而影響菌體細胞的催化能力,導致轉化效率的降低。產物選擇性的降低一方面是由于底物轉化率的降低所致,另一方面則是由于轉化體系中隨著肉桂醛濃度的增大,被空氣中氧氣氧化的產物肉桂酸含量增大所致。當底物濃度為2.64 mg/mL時,轉化體系中的肉桂醇濃度可達到最大值。因此,綜合考慮肉桂醇的產量及其選擇性,選擇底物濃度為2.64 mg/mL。
2.4預培養時間的影響
考慮到底物肉桂醛對微生物的毒害作用較強,本試驗采用預培養再轉化的方法。按1.2.1方法,固定其他條件不變,改變預培養時間分別為0、12、24、36、48 h,考察預培養時間對轉化反應的影響。預培養時間對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響如圖4所示。
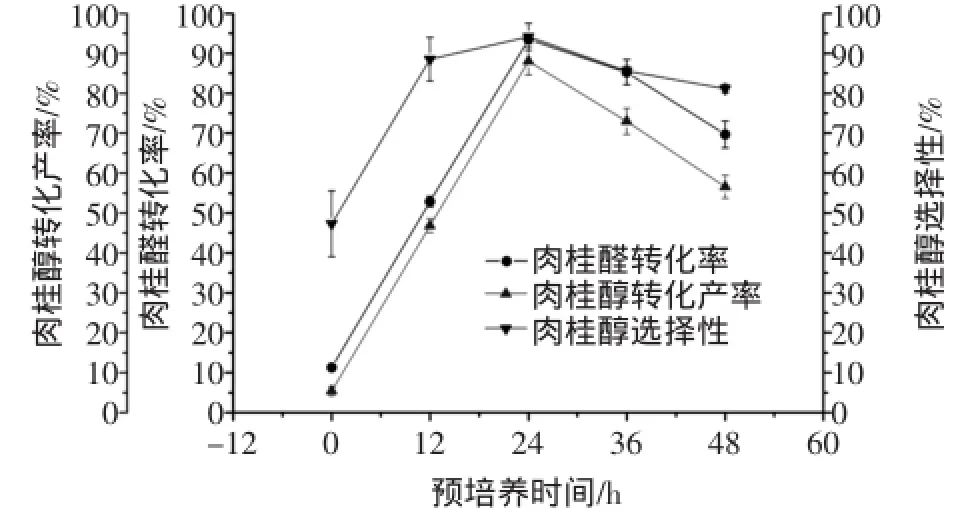
圖4 預培養時間對肉桂醛生物轉化生成肉桂醇的影響Fig.4 Effects of pre-incubation time on the biotransformation of cinnamaldehyde into cinnamylalcohol
從圖4可看出,隨著預培養時間不斷增大,肉桂醇的轉化產率先增大后減小。在預培養時間為24 h時,肉桂醛的轉化率、肉桂醇的轉化產率和選擇性均達最大。當預培養時間過短時,菌體繁殖的時間太短,菌體的數量少,不能滿足后期的轉化反應;預培養時間過長時,菌體數量過多,營養物質消耗大,生長空間不足受到抑制,也促使菌體停止生長甚至死亡,不利于后期轉化反應。故選擇預培養時間為24 h。
2.5接種量的影響
按1.2.1方法,固定其他條件不變,改變接種量分別為5%、10%、15%、20%、25%,考察接種量對轉化反應的影響。接種量對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響如圖5所示。
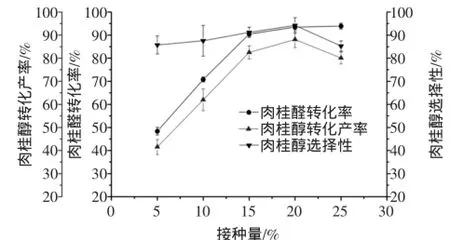
圖5 接種量對肉桂醛生物轉化生成肉桂醇的影響Fig.5 Effects ofinoculum on the biotransformation of cinnamaldehyde into cinnamylalcohol
圖5結果表明,隨著接種量的逐漸增大,肉桂醇的轉化產率先增大后減小,說明了在肉桂醛轉化為肉桂醇的過程中隨著接種量的越大,菌體增多,有利于提高肉桂醛的轉化率。然而過大的接種量又會影響溶解氧以及營養物質的傳遞速率,從而抑制肉桂醛的轉化率,進而導致肉桂醇的轉化產率降低。故最適接種量為20%。
2.6裝液量的影響
按1.2.1方法,固定其他條件不變,改變250 mL三角瓶中的裝液量分別為40、60、80、100、120 mL,考察裝液量對轉化反應的影響。裝液量對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響如圖6所示。
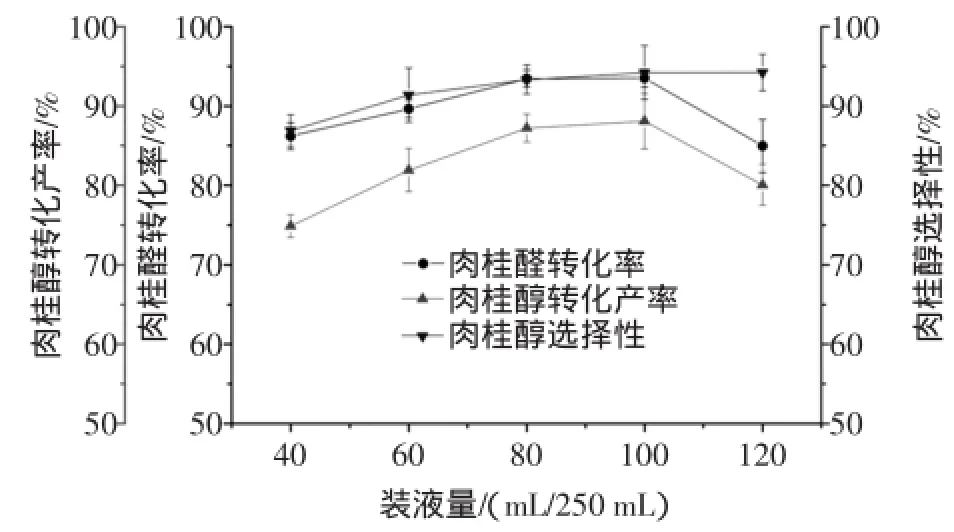
圖6 裝液量對肉桂醛生物轉化生成肉桂醇的影響Fig.6 Effects ofliquid volume on the biotransformation of cinnamaldehyde into cinnamylalcohol
由圖6可知,當裝液量逐漸增大時,肉桂醇的轉化產率先增大后減小,主要原因是在固定體積的三角瓶內,裝液量越大,三角瓶內的的氧氣消耗越快,而缺氧又使得細胞的產酶量少,催化反應進行緩慢,肉桂醛的轉化率也會相對較低,從而導致肉桂醇的轉化產率降低。因此,最佳的裝液量為100 mL/250 mL三角瓶。
2.7轉速的影響
搖床轉速影響到培養液中氧氣的溶解量以及底物、產物的傳質過程。按1.2.1方法,固定其他條件不變,改變搖床轉速分別為90、120、150、180 r/min,考察搖床轉速對轉化反應的影響。搖床轉速對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響如圖7所示。結果表明,最適搖床轉速為150 r/min。

圖7 搖床轉速對肉桂醛生物轉化生成肉桂醇的影響Fig.7 Effects ofshaker speed on the biotransformation of cinnamaldehyde into cinnamylalcohol
2.8轉化時間的影響
按1.2.1方法,固定其他條件不變,改變轉化時間分別為8、12、24、36、48、72 h,考察轉化時間對轉化反應的影響。預培養時間對肉桂醛轉化率、肉桂醇轉化產率及肉桂醇選擇性的影響見圖8。
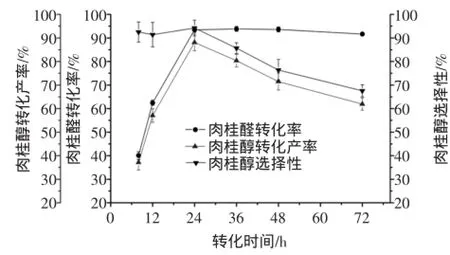
圖8 轉化時間對肉桂醛生物轉化生成肉桂醇的影響Fig.8 Effects of conversion time on the biotransformation of cinnamaldehyde into cinnamylalcohol
由圖8可知,當轉化時間低于24 h時,肉桂醛的轉化率和肉桂醇的轉化產率不斷提高,當轉化時間為24 h時,肉桂醇的轉化產率達到最大值。因為轉化時間越長,轉化液中的菌體越接近衰亡,催化能力降低,有更多的肉桂醛被空氣氧化為肉桂酸,從而導致了肉桂醇的轉化率降低。因此,最適轉化時間為24 h。
在上述最佳轉化條件下,肉桂醇的轉化產率達到最大值88.08%,生成肉桂醇的選擇性為94.21%,轉化液中肉桂醇的濃度可達2.36 mg/mL。
3 結論
肉桂內生細菌Pseudomonas sp.RGEB06具有較好的催化肉桂醛加氫生成肉桂醇的能力。在初始pH 6.5的改良M9液體培養基中,按100 mL/250 mL三角瓶裝液量、20%接種量接種后,在30℃、搖床轉速150 r/min條件下預培養時間24 h后,加入底物肉桂醛使其濃度達2.64 mg/mL,轉化24 h,肉桂醇的轉化產率達到最大值88.08%,生成肉桂醇的選擇性為94.21%,轉化液中肉桂醇的濃度為2.36 mg/mL。如何提高轉化體系中的底物濃度是該生物轉化體系今后應該重點研究的方向。
[1]孫寶國,何堅.香料化學與工藝學[M].北京:化學工業出版社,2004: 89-90
[2]徐克勛.精細有機化工原料及中間體手冊[M].北京:化學工業出版社,1998:151
[3]陳海燕,何春茂.肉桂油的深加工產品及其應用[J].廣西林業科學,2009,38(3):179-182
[4]武文濤,賈穎萍,尹靜梅,等.肉桂醛選擇性加氫合成肉桂醇的研究進展[J].化工中間體,2009,5(4):1-5
[5]Rong Z M,Sun Z H,Wang Y,et al.Selective Hydrogenation of Cinnamaldehyde to cinnamyl alcohol over graphene supported Pt-Co bimetallic catalysts[J].Catalysis Letters,2014,144(6):980-986
[6]Chen H N,Cullen D A,Larese J Z.Highly efficientselective hydrogenation ofcinnamaldehyde to cinnamylalcoholcover gold supported on zinc oxide materials[J].Journalof Physical Chemistry C,2015, 119(52):28885-28894
[7]Yamanaka R,Nakamura K,Murakami M,et al.Selective synthesis ofcinnamylalcoholby cyanobacterialphotobiocatalysts[J].Tetrahedron Letters,2015,56(9):1089-1091
[8] 馬麗,劉雄民,韋一萍.Mucor sp.JX23發酵液生物催化肉桂醛選擇加氫制肉桂醇[J].化工進展,2009,28(8):1431-1434
[9]Ma L,Liu X M,Liang J J,etal.Biotransformations of cinnamaldehyde,cinnamic acid and acetophenone with Mucor[J].World Journal MicrobiolBiotechnol,2011,27(9):2133-2137
[10]Borges K B,Borges WS,Pupo M T,etal.Endophytic fungias models for the stereoselective biotransformation of thioridazine[J].Applied microbiology and biotechnology,2007,77(3):669-674
[11]Pedrini P,GiovanniniP P,Mantovani M,etal.Reduction screening with endophytic fungi:Synthesis ofhomochiralsecondary alcohols[J]. JournalofMolecular Catalysis B:Enzymatic,2009,60(3/4):145-150
[12]Fu S,Yang J,Cui J,etal.Biotransformation of ursolic acid by an endophytic fungus from medicinal plant Huperzia serrata[J].Chemical &Pharmaceutical Bulletin,2011,59(9):1180-1182
[13]李端華,陳祈磊,鄒昆,等.內生真菌SEFl5927對截短側耳素的微生物羥化研究[J].中國抗生素雜志,2011,36(8):590-592
[14]陳峻青,王伊文,馮成亮,等.杜仲內生真菌的分離鑒定及其對異甜菊醇的生物轉化研究[J].東南大學學報:醫學版,2012,30(6): 861-865
Biotransformation of Cinnamaldehyde by Endophytic Bacteria Isolated from Cinnamomum cassia
LIU Bin,LIZi-yuan,HAN Wen,LIHai-yun*
(Guangxi Colleges and Universities Key Laboratory of Food Safety and Detection,College of Chemistry& Bioengineering,Guilin University of Technology,Guilin 541004,Guangxi,China)
Biotransformation conditions of cinnamaldehyde into cinnamic alcohol by an endophytic bacteria Pseudomonas sp.RGEB06 isolated from Cinnamomum cassia were studied by the single factor test method. Based on the modified M9 liquid medium,effects of cultural conditions on cinnamaldehyde conversion rate,yield and production selectivity of cinnamyl alcohol were studied in detail.The results of single factor experiments indicated thatthe suitable biotransformation conditions for the production ofcinnamylalcoholwere as followed:conversion temperature of 30℃,initial pH 6.5,liquid volume 100 mL/250 mL flask,inoculation amount20%,shaker speed 150 r/min,pre-culture time 24 h,substrate concentration 2.64 mg/mL,conversion time of24 h.Under the optimalconditions,the yield and production selectivity ofcinnamylalcoholwere 88.08% and 94.21%,respectively,and the finalconcentration ofcinnamylalcoholin the culture was 2.36 mg/mL.
endophytic bacteria;microbialtransformation;cinnamaldehyde;cinnamylalcohol
10.3969/j.issn.1005-6521.2016.12.035
國家自然科學基金項目(31460409);廣西高校食品安全與檢測重點實驗室資助項目
劉斌(1990—),男(漢),在讀碩士研究生,研究方向:生物化工。
李海云(1975—),男(漢),副教授,主要從事天然活性物質及生物轉化研究。
2016-03-09

