企鵝珍珠貝Creb2基因的克隆及表達分析
于非非,余祥勇,潘珍妮,宋娜娜,王梅芳
(廣東海洋大學 水產學院,廣東 湛江 524088)
?
企鵝珍珠貝Creb2基因的克隆及表達分析
于非非,余祥勇,潘珍妮,宋娜娜,王梅芳
(廣東海洋大學 水產學院,廣東 湛江 524088)
CREB(cAMP response element binding protein)是一種真核生物中廣泛存在的調控因子。為了探討企鵝珍珠貝(Pteria penguin)Creb基因的序列和表達特征,為進一步闡述Creb的生理功能提供科學依據,本研究利用RACE-PCR技術克隆到企鵝珍珠貝一個Creb基因的全長序列,分析其理化性質和進化地位;利用熒光定量PCR分析Creb基因在各組織中的表達特征。結果表明,該企鵝珍珠貝Creb基因的cDNA全長為1484 bp,其中開放閱讀框(ORF)為1071 bp,編碼356個氨基酸,5′非編碼區為218 bp,3′非編碼區為 195 bp,C端包含一個堿性亮氨酸拉鏈結構(basic region leucin zipper,bZIP)。預測其分子質量為39.49 kD,等電點為4.43。序列比對顯示該企鵝珍珠貝Creb基因與歐洲平牡蠣(Ostrea edulis)和太平洋牡蠣(Crassostrea gigas)的Creb2同源性(identity)最高,分別為46.3%和46.1%,故命名為ppCreb2;系統進化樹分析結果與傳統形態學分類結果相吻合。熒光定量PCR分析顯示,ppCreb2在企鵝珍珠貝的各個組織中組成性表達,其中在足中表達量最高,鰓中其次。
企鵝珍珠貝;ppCreb2;基因克隆;表達分析;熒光定量PCR
doi:10.11759/hykx20150824001
CREB(cAMP response element binding protein)即環磷酸腺苷反應元件結合蛋白,是真核生物中廣泛存在的一種細胞核內調控因子,通過自身磷酸化實現轉錄功能的調控[1]。CREB家族蛋白的C端都包含大量堿性氨基酸和一個亮氨酸拉鏈,被稱為堿性亮氨酸拉鏈結構域 (basic region leucin zipper,bZIP)[2],這一結構域的DNA親和力很高,能以二聚體的形式與靶基因啟動子中的CRE(cAMP response element)位點結合,調控下游多個基因的轉錄活性,是CREB家族蛋白最保守的區域。作為一種重要的轉錄調控因子,CREB家族蛋白參與了細胞的增殖[3]、分化[4]和凋亡[5],學習記憶[6],精子發生[7]和膚色決定[8]等多種復雜的生命活動。根據結構和功能的不同,CREB家族被劃分為CREB1、CREB2、CREB3和CREB3L4(CREB3-like4)四個亞族。近年來,已在節肢動物[9]、腔腸動物[10]、魚類[11]、鳥類[12]和哺乳動物[7]等幾十個物種中克隆到Creb基因,但在雙殼類中研究較少[13]。
企鵝珍珠貝(Pteria penguin)屬于軟體動物門(Mollusca),瓣鰓綱(Lamellibranchia),翼形亞綱(Ptermorphia),珍珠貝目(Pterioida),珍珠貝科(Pteriidae)[14]。企鵝珍珠貝個體大、生長快、成活率高,其突出特點是分泌珍珠質機能旺盛、珠層厚、色澤奇異,是我國目前唯一能規模養殖的大型珍珠貝,被認為是最具有“振興南珠”潛能的品種[15]。作為一種調控因子的Creb基因是否也存在于企鵝珍珠貝中,是否參與了企鵝珍珠貝重要生命活動的調控是值得探索的問題。
本研究建立了企鵝珍珠貝全組織的轉錄組數據庫,利用RACE-PCR技術克隆到企鵝珍珠貝Creb2基因的cDNA全長序列,構建系統進化樹分析該基因的進化地位;利用熒光定量PCR技術分析Creb2基因在企鵝珍珠貝各組織中的表達差異,旨在為進一步闡述Creb2在企鵝珍珠貝各種生理過程中的作用提供理論依據。
1 材料與方法
1.1 材料
實驗所用企鵝珍珠貝采自廣東省湛江市雷州市流沙灣養殖群體,體重300~350 g。
1.2 主要試劑
實驗所用主要試劑包括SMARTer?RACE 5′/3′Kit (Clontech)、 UNlQ-10柱式Trizol總RNA抽提試劑盒(上海生工)、 RevertAid First Strand cDNA Synthesis Kit(Thermo)、 E.Z.N.A Gel Extraction Kit試劑盒(Omega)、SYBR Select Master Mix(Life technologies)、LA taq(Takara)、PMD18-T(Takara)、瓊脂糖(Agarose)等。DEPC、氨芐青霉素等其他試劑為國產分析純,DH5α感受態細胞購自全式金。
1.3 企鵝珍珠貝Creb全長cDNA的克隆
分別提取企鵝珍珠貝的外套膜、鰓、閉殼肌、消化盲囊、足、精巢、卵巢的RNA,將各組織RNA混合后應用Illumina測序技術進行轉錄組測序,建立了企鵝珍珠貝全組織的轉錄組數據庫,并進行生物信息學分析。
利用企鵝珍珠貝各組織混合 R N A,按照SMARTer?RACE 5′/3′Kit說明書合成企鵝珍珠貝Creb的3′RACE模板和5′RACE模板。根據企鵝珍珠貝轉錄組數據庫中注釋為Creb的unigene序列設計企鵝珍珠貝Creb基因3′RACE的特異性引物Creb-3-F和5′RACE的特異性引物Creb-5-R(表1),3′RACE和5′RACE PCR反應體系為2×SeqAmp Buffer 25 μL,SeqAmp DNA Polymerase 1 μL,5′RACE或3′RACE cDNA模板(100 ng/μL)2.5 μL,10×UPM(Universal Primer Mix,0.2μmol/L)5 μL(表1),Creb-3-F或Creb-5-R(10μmol/L)1 μL,PCR-Grade H2O 15.5 μL。使用touch-down PCR程序擴增:94℃30 s,72℃2 min,5個循環;94℃30 s,70℃30 s,72℃ 2 min,5個循環;94℃30 s,68℃30 s,72℃2 min,25個循環。PCR產物經電泳分離、純化,與RACE試劑盒中的 Lineareized pRACE vector連接,轉化進DH5α感受態細胞中培養過夜,篩選陽性克隆進行測序。經測序后3′RACE序列和5′RACE序列進行拼接,并利用 VecScreen軟件(http://www.ncbi.nlm.nih.gov/VecScreen/VecScreen.html)去除載體序列,獲得企鵝珍珠貝Creb基因的電子全長。
根據Creb基因的電子全長,設計特異引物Creb-cDNA-F和Creb-cDNA-R(表1),利用LA taq酶克隆Creb基因全長cDNA。PCR產物與PMD18-T載體連接、轉化、培養,篩選陽性克隆測序以驗證電子全長序列的正確性。
1.4 目的基因的生物信息學分析
通過ORF Finder工具,推導企鵝珍珠貝Creb基因編碼的氨基酸序列;通過 Expasy網站(http:// web.expasy.org/compute_pi/)分析其相對分子質量和等電點;經ProtScale軟件分析氨基酸序列的疏水性;經SignalP 4.1、TMHMM和NetOGlyc 4.0分別預測其信號肽、跨膜結構及糖基化位點;經SMART對其進行結構預測和功能分析;利用Clustal X(1.8)軟件將獲得的企鵝珍珠貝Creb基因與其他物種的Creb基因編碼氨基酸進行同源比對,用MEGA6軟件構建系統進化樹。
1.5 熒光定量PCR檢測目的基因的組織表達
分別提取企鵝珍珠貝外套膜、鰓、閉殼肌、消化盲囊、足、精巢和卵巢的RNA,反轉錄合成第一鏈cDNA,進行熒光定量PCR檢測。以β-actin基因作為內參,以企鵝珍珠貝的閉殼肌為對照,采用2-ΔΔCt法計算Creb基因在不同組織中的表達水平,每組設3個重復,組間重復性和差異顯著性用SPSS16.0分析。
2 結果與分析
2.1 企鵝珍珠貝Creb基因的克隆和序列分析
采用5′RACE技術獲得了1169 bp的Creb 5′序列,采用3′RACE技術獲得了678 bp的Creb 3′序列,拼接后獲得1484 bp的Creb全長序列。利用CrebcDNA-F和Creb-cDNA-R引物進行PCR驗證,獲得1328 bp序列,與我們拼接的Creb基因全長序列相吻合。企鵝珍珠貝Creb基因cDNA全長為1484 bp,其中開放閱讀框(ORF)為1071 bp,編碼356個氨基酸,5′非編碼區為218 bp,3′非編碼區為 195 bp,包含30 bp 的polyA尾巴,如圖1所示。登錄號為KT388104。

圖1 企鵝珍珠貝Creb基因序列分析Fig.1 Creb cDNA and deduced amino acid sequences of Pteria penguin小寫字母代表非編碼序列(UTR);大寫字母代表開放閱讀框(ORF),灰色框代表堿性亮氨酸拉鏈結構域(276~341 bp)5′UTR and 3′UTR regions are shown in small letters;open reading fragment is shown in capital letters;basic region leucin zipper(bZIP)is shown in gray box(276-341 bp)
2.2 CREB蛋白理化性質預測和分析
經Expasy預測企鵝珍珠貝CREB蛋白分子質量為39.49 kD,等電點為4.43。ProtScale分析疏水性顯示,該蛋白的疏水指數從-3.678至2.2,屬于親水性蛋白,約在第164位表現出最強的疏水性,第298位表現出較出最強的親水性(圖2)。經TMHMM 2.0進行跨膜結構域預測,顯示沒有跨膜區。SignalP4.1預測其不存在信號肽,屬于非分泌型蛋白。NetOGlyc4.0分析發現其有3個糖基化位點,分別是第22位、第26位和第108位。SMART軟件分析發現,企鵝珍珠貝CREB蛋白的N端富含天冬氨酸(Asp,D)和谷氨酸(Glu,E)等酸性氨基酸,C端富含賴氨酸(Lys,K)和精氨酸(Arg,R)等堿性氨基酸,包含一個典型的堿性亮氨酸拉鏈結構域(basic region leucin zipper,bZIP)(圖1和圖3)。

圖2 企鵝珍珠貝CREB蛋白的疏水性預測Fig.2 Hydrophobicity prediction of CREB in Pteria penguin“+”代表疏水值,“-”代表親水值+hydrophobicity;-hydrophobicity

圖3 企鵝珍珠貝CREB蛋白質結構預測Fig.3 Prediction of CREB structure in Pteria penguin
2.3 CREB氨基酸序列同源性分析
采用Clustal X軟件將企鵝珍珠貝的Creb基因與其他物種的Creb基因編碼氨基酸進行多序列比對,結果顯示,該基因與歐洲平牡蠣(Ostrea edulis,ADG85255.1)和近江牡蠣(Crassostrea ariakensis,BQ59345.1))的Creb2基因同源性(identity)最高,分別為46.3%和46.1%;與人(Homo sapiens,AAA52071.1)、小鼠(Mus musculus,NP_033846.2)和墨西哥脂鯉(Astyanax mexicanus,XP_007231405.1)的Creb2基因同源性其次,分別為為26.3%、25.7%和24.6%。其中,保守位點主要集中在堿性亮氨酸拉鏈結構域(圖4)。因此將該企鵝珍珠貝Creb基因命名為ppCreb2。
分別選取近江牡蠣、歐洲平牡蠣、光滑雙臍螺(Biomphalaria glabrata,ACZ51334.1)creb、靜水椎實螺(Lymnaea stagnalis,BAC21159.1)、海兔(Aplysia californica,NP_001191630.1)和墨西哥脂鯉等物種的Creb2基因編碼的氨基酸進行聚類分析,如圖 5 Neighbor-joining(NJ)樹所示:企鵝珍珠貝、太平洋牡蠣和歐洲平牡蠣都屬于軟體動物瓣鰓綱,其Creb2編碼氨基酸聚為一個小的進化分支;光滑雙臍螺、靜水椎實螺和海兔屬于軟體動物腹足綱,聚為一個小的進化分支;以上所有的軟體動物聚為一個大的進化分支,而墨西哥脂鯉這一外群物種單獨列為一個進化分支。CREB2聚類結果與傳統的進化分類學相吻合,印證了雙殼類瓣鰓綱和腹足綱動物的親緣關系。


圖4 企鵝珍珠貝與其他物種Creb2基因編碼氨基酸比對Fig.4 Amino acid alignment of Creb2 in Pteria penguin and other homologues相同的氨基酸以涂黑表示The amino acids showing100%identity are marked with black box

圖5 企鵝珍珠貝與其他物種Creb2氨基酸序列的系統進化樹(NJ)Fig.5 Phylogenetic tree of Creb2 from Pteria penguin and other homologues
2.4 Creb2基因的組織定量分析
采用熒光定量PCR分析Creb2基因在企鵝珍珠貝各個組織中的表達水平,結果顯示(圖6),從RNA水平看,ppCreb2基因在企鵝珍珠貝各個組織中都有表達,但表達量有所差異。在足中表達量最高,其次是鰓,在外套膜、閉殼肌、精巢和卵巢中的表達量較低。
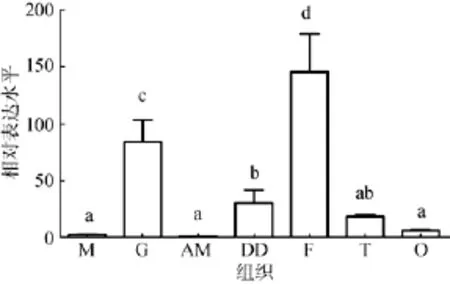
圖6 ppCreb基因在企鵝珍珠貝各組織的表達水平Fig.6 Expression of ppCreb in different tissues of Pteria penguinM.外套膜;G.鰓;AM.閉殼肌;DD.消化盲囊;F.足;T.精巢;O.卵巢M:mantle;G:gill;AM:adductormuscle;DD:digestive diverticulum;F:foot;T:testis;O:ovary
3 討論
1986年,Montrminy等[1]發現許多基因都受cAMP的調控,這些基因的共同特點是啟動子和增強子序列中含有一段高度保守的5′-TGACGTCA-3′序列,并命名為cAMP反應元件(cAMP response element,CRE)。隨后,他們又分離純化到一種特異性結合CRE的核蛋白,命名為cAMP應答元件結合蛋白(cAMP response element binding protein)即CREB蛋白[16]。CREB蛋白家族主要包括CREB1、CREB2、CREB3和CREB3L4四個成員。CREB2(cyclic AMP response element binding protein 2),也稱ATF4(activating transcription factor 4),是內質網應激通路中的信號轉導蛋白,由PERK/elF2α通路中磷酸化的elF2α激活[17]。
本研究從企鵝珍珠貝cDNA文庫中克隆了Creb基因全長序列。同源性分析顯示,企鵝珍珠貝Creb基因與歐洲平牡蠣Creb2基因具有最高的同源性,為46.3%。結構分析發現,企鵝珍珠貝Creb基因編碼氨基酸分為N端和C端兩個結構域,其N端富含酸性氨基酸,為酸性激活區域;C端為保守的堿性亮氨酸結構域。不含KID區(激酶誘導結構域),為非跨膜蛋白,這些特點與大多數動物經典的CREB2蛋白結構相似[18-19]。其中N端主要行使轉錄激活功能,C端主要行使DNA結合和蛋白二聚體化的功能。因此,我們將該企鵝珍珠貝Creb基因鑒定為ppCreb2。這說明Creb2基因在各個物種中是相對保守的,也暗示了ppCreb2基因在貝類的生命活動中起到重要作用。
作為一種重要的轉錄因子,CREB2參與了多種生命過程。對海兔和果蠅的研究發現,CREB2可抑制記憶貯存和突出可塑性,是一種記憶抑制基因[20-21]。CREB2參與了小鼠造骨細胞早期分化和末期分化,對維持造骨細胞的分化和功能至關重要,CREB2缺陷小鼠出現小眼癥狀表型[4]。CREB2也可參與內質網應激反應(endoplasmic reticulum stress),調節內質網內穩態體系[22]。還可與多種病毒蛋白相互作用,調節與之結合的病毒蛋白的表達水平[23]。
與CREB2廣泛的生理功能相一致的,Creb2在各個組織中普遍表達。對豬的研究發現,Creb2在白色脂肪組織、胃、腎肺、小腦、肝臟和淋巴組織中表達量較高,在心臟和肌肉中表達量較低[24]。我們的研究發現,ppCreb2基因在企鵝珍珠貝足中表達量最高,這可能與Creb2在神經系統中大量表達相一致[20]。作為進化地位比較低的軟體動物,其神經系統主要由4對神經節和與之聯絡的神經構成,其中重要的一對神經節足神經節1就位于足的前部[25]。另外,ppCreb2基因在鰓中表達量也很高。貝類通過鰓直接與水環境接觸,營呼吸功能,接觸大量病毒和細菌,在鰓中大量表達印證了CREB2蛋白可與多種病毒蛋白相互作用這一功能。因此,我們推測CREB2在企鵝珍珠貝多種生命活動中起到重要作用。
[1] Montrminy M R,Sevarino K A,Wag-ner J A,et al.Identification of a cyclic-AMP responsive element within the rat somatostatin gene[J].Proceedings of the Natural Academic of Science of the United Stated America,1986,83(18):6682-6686.
[2] Shanware N P,ZhanL,HutchinsonJ A,etal.Conserved and distince modes of CREB/ATF transcription factor regulation by PP2A/B56 gamma and genotoxic stress[J].Plos One,2010,5(8):e12173.
[3] Garcia,G E,Nicole A,Bhasharan S,et al.Akt and CREB-mediated prostate cancer cell proliferation inhibition by Nexrutine,a Phellodendron amurense extract[J].Neoplasia,2006,8(6):523-533.
[4] Yang X, Karsenty G. ATR4, the osteoblast accumulation of which is determined post-translationally,can induce osteoblast-specific gene expression in non-osteoblastic cells[J].The Journal of Biological Chemistry,2004,279(45):47109-47114.
[5] Persengiev S P,Devireddy L R,Green M R.Inhibition of apoptosis by ATFx:a novel role for a member of the ATF/CREB familiy of mammalian bZIP transcription factors[J].Genes&Development,2002,16(14):1806-1814.
[6] Kida S,Serita T.Functional roles of CREB as a positive regulator in the formation and enhancement of memory[J].Brain Research Bulletin,2014,105:17-24.
[7] Gomez M, Manzano A, Figueras A, et al.Sertoli-secreted FGF-2 induces PFKFB4 isozyme expression in mouse spermatogenic cells by activation of the MEK/ERK/CREB pathway[J].American journal of Physiology Endocrinology and Metabolism,2012,303(6):E695-707.
[8] Wan P,Hu Y Q,Li H.Regulation of melanocyte pivotal transcription factor MITF by some other transcription factors[J].Molecular and Cellular Biochemistry,2011,354(1-2):241-246.
[9] Lijima K,Zhao L,Shenton C,et al.Regulation of energy stores and feeding by neuronal and peripheral CREB activity in Drosophila[J].PLoS One,2009,4(12):e8498.
[10]Kaloulis K,Chera S,Hassel M,et al.Reactivation of developmental programs: the cAMP-reponse element-binding protein pathway is involved in hydra head regeneration [J].Proceedings ofthe Natural Academic of Science of the United Stated America,2004,101(8):2363-2368.
[11]Rajan K E,Thangaleela S,Balasundaram C.Spatial learning associated with stimulus response in goldfish Carassius auratus:relationship to activation of CREB signalling[J].Fish Physiology and Biochemistry,2015,41(3):685-694.
[12]Guo F,ZhangY,SuL,etal.Breed-dependent transcriptional regulation of phosphoenolpyruvate carboxylase,cytosolic form,expression in the liver of broiler chickens[J].Poultry Science,2013,92(10):2737-2744.
[13]Zhang S M,Coultas K A.Identification and characterization of five transcription factors that are associated with evolutionarily conserved immune signaling pathway s in the schistosome-transmitting snail Biomphalaria glavrata[J].Molecular Immunology,2011,48(15-16):1868-1881.
[14]蔡英亞,張英,魏若飛.貝類學概論[M].上海:上海科學技術出版社,1995:209-210.
Cai Yingya,Zhang Ying,Wei Ruofei.Malacology[M].Shanghai:Shanghai Science and Technology Press,1995:209-210.
[15]毛勇,梁飛龍,余祥勇,等.企鵝珍珠貝游離珠插核效果的初步觀察[J].海洋科學,2003,27(11):1-4.
Mao Yong,Liang Feilong,Yu Xiangyong,etal.Preliminary observations on implanation efficiency of cultured round pearls with pearl oyster,Pteria (Magnavicula)penguin roding[J].Marine Sciences,2003,27(11):1-4.
[16]Montrminy M R,Bilezikjan L M.Binding of a nuclear protein to the cycli c-AMP response element of the somatost atin gene[J].Nature,1987,328(6126):175-178.
[17]Ameri K,Harris A L.Activating transcription factor 4[J].Int J Biochem Cell Biol,2008,40(1):14-21.
[18]Qi M,Lei T,Zhou L,et al.Cloning,characterization,chromosomal mapping and tissue transcription analysis of porcine CREB2 and CREB3 genes[J].Folia Biologica,2009,55(4):137-144.
[19]Endo M,Su L,Nielsen T O.Activating transcription factor 2 in mesenchymal tumors[J].Human Pathology,2014,45(2):276-284.
[20]Mohamed,H A,Yao W,Fioravante D,et al.cAMP-response elements in Aplysia crebl,creb2,and Ap-uch promoters:implications for feedback long term memory[J].The Journal of Biological Chemistry,2005,280(29):27035-27043.
[21]Dubnau J,Tully T.Gene discovery in Drosophila:new insights for learning and memory[J].Annual review of Neuroscience,1998,21:407-444.
[22]Lu P D,Harding H P,Ron D.Translation reinitiation at alternative open reading frames regulates gene expression in an integrated stress response[J].The Journal of Cell Biology,2004,167(1):27-33.
[23]Lim C,Sohn H,Gwack Y,et al.Latency-associated nuclear antigen of Kaposi's sarcoma-associated herpesvirus(human herpesvirus-8)binds ATF4/CREB2 and inhibits its transcriptional activation activity[J].The Journal of General Virology,2000,81(pt11):2645-2652.
[24]祁艷梅.豬CREB家族基因的克隆及表達研究的初步探討[D].武漢:華中農業大學,2009.
QiYanmei.Cloning and preliminary research of porcine CREBs family[D]. Wuhan: HuaZhong Agricultural University,2009.
[25]李霞.水產動物組織胚胎學[M].北京:中國農業出版社,2005:82-83.
LiXia.AquaticAnimalEmbryology[M].Beijing:China Agriculture Press,2005:82-83.
(本文編輯:康亦兼)
Molecular cloning and expression analysis of Creb2 gene from Pteria penguin
YU Fei-fei,YU Xiang-yong,PAN Zhen-ni,SONG Na-na,WANG Mei-fang
(Fisheries College,Guangdong Ocean University,Zhanjiang 524088,China)
Aug.22,2015
Pteria penguin;ppCreb2;Gene cloning;expression analysis;real-time PCR
In this study,in order to analyze the sequence and expression characteristics of the cAMP response element binding protein(Creb)gene in the Pteria penguin,we characterized the full-length cDNA of the Creb gene from the Pteria penguin by the rapid amplification of cDNA ends(RACE)-polymerase chain reaction(PCR).We then used real-time PCR to examine the expression of Creb in different tissues.The results show that the full-length cDNA of Creb was 1484 bp,including a 5'UTR of 218 bp,a 3'UTR of 195 bp,and an open-reading frame of 1071 bp,which encodes a deduced protein of 356 amino acids.The C-terminal region contained a conserved basic region leucin zipper(bZIP).The predicted molecular weight was 39.49 kD,and the isoelectric point was 4.43.The sequence comparison showed that Creb in the Pteria penguin(ppCreb2)shares 46.3%and 46.1%sequence identities with Creb2 in Ostrea edulis and Crassostrea gigas,respectively.The phylogenetic analysis results were consistent with traditional taxonomic analysis.The real-time PCR showed that ppCreb2 was constitutively expressed in all studied tissues(mantle,gill,adductor muscle,digestive diverticulum,foot,testis,and ovary),with higher levels in the foot and gill.
Q341
A
1000-3096(2016)05-0029-07
2015-08-22;
2015-10-20
廣東海洋大學優秀青年骨干教師培養項目(20140040);廣東海洋大學博士啟動基金(E15041);廣東省海洋漁業科技推廣專項項目(A201308A11)
[Foundation:the Outstanding Young Teacher Foundation of Guangdong Ocean University,No.20140040;Doctoral research project of Guangdong Ocean University,No.E15041;the Technology Extension Foundation of Marine Fishery in Guangdong Province,No.A201308A11]
于非非(1980-),女,山東威海人,講師,博士,從事貝類分子遺傳育種的研究,電話:0759-2383504,E-mail:yufeifei2000@163.com;王梅芳,通信作者,教授,E-mail:pearlang@126.com

