組蛋白去乙酰化酶在酒精致小鼠肝細胞損傷中表達的實驗研究
李 星 ,黃 成,孟曉明,李 俊
組蛋白去乙酰化酶在酒精致小鼠肝細胞損傷中表達的實驗研究
李星1,2,3,黃成1,2,3,孟曉明1,2,3,李俊1,2,3
目的 研究組蛋白去乙酰化酶(HDACs)在酒精致小鼠肝細胞損傷中的表達情況。方法 以體外培養(yǎng)的小鼠正常肝細胞株AML12為研究對象,MTT法測定不同濃度和時間點酒精對AML12細胞的抑制作用;流式細胞術(shù)檢測酒精對AML12細胞凋亡的影響;實時定量PCR法檢測酒精致AML12細胞損傷中HDACs的mRNA表達水平。結(jié)果 酒精濃度100 mmol/L刺激24 h,AML12細胞的存活率為84%,可以明顯抑制小鼠正常肝細胞AML12的增殖(P<0.05);酒精濃度100 mmol/L刺激24 h,AML12細胞的凋亡率為16%,可以增加AML12細胞的凋亡(P<0.05)。在酒精致AML12細胞損傷中,HDAC1、2、3、4、5、6、7、8的 mRNA表達水平均下降(P<0.05),HDAC9的mRNA表達水平上升(P<0.05),HDAC10的mRNA表達變化差異無統(tǒng)計學(xué)意義。結(jié)論 在酒精致肝細胞損傷中,HDACs的表達水平發(fā)生不同程度的變化,提示和HDACs相關(guān)的表觀修飾可能參與酒精性肝損傷的發(fā)生發(fā)展。
組蛋白去乙酰化酶;酒精性肝損傷;表觀修飾
網(wǎng)絡(luò)出版時間:2016-3-8 8:29:01 網(wǎng)絡(luò)出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.008.htm l
過量飲酒尤其是短期內(nèi)大量酗酒可導(dǎo)致酒精在肝內(nèi)蓄積,使肝細胞發(fā)生不同程度的損傷和凋亡,最終導(dǎo)致酒精性肝病的發(fā)生發(fā)展[1-2]。文獻[3]顯示,酒精可以改變包括組蛋白和DNA變化的染色質(zhì)修飾以及轉(zhuǎn)錄后變化的表觀修飾內(nèi)容,提示表觀遺傳學(xué)在酒精性肝損傷的發(fā)生發(fā)展中充當(dāng)了十分重要的角色。組蛋白乙酰化是重要的表觀修飾形式,由組蛋白乙酰化酶(histone acetyltransferases,HATs)和組蛋白去乙酰化酶(histone deacetylases,HDACs)這兩個功能相互拮抗的蛋白酶家族共同調(diào)節(jié)。其中,HDACs有4大類[4],分別是ClassⅠHDACs(HDAC1、2、3、8),ClassⅡHDACs(HDAC 4、5、6、7、9、10),ClassⅢ HDACs(SIRT 1~7),ClassⅣHDACs (HDAC11),目前實驗研究大多集中在第一和第二家族。該研究旨在探索HDACs第一和第二家族在酒精致小鼠肝細胞(AML12)損傷中的 mRNA表達情況,為后續(xù)研究提供思路。
1 材料與方法
1.1材料 小鼠正常肝細胞來源的AML12細胞系購自美國ATCC細胞庫;DMEM培養(yǎng)基購自美國Gibco公司;無水乙醇(分析純)購自上海蘇懿化學(xué)試劑公司;MTT粉、DMSO均購自美國Sigma公司;凋亡試劑盒購自上海貝博生物;TRIzol、寡核苷酸引物購自美國Invitrogen公司;SYBR Green Real-time PCR Master Mix購自日本TaKaRa公司。
1.2儀器 NAPCO-6100型細胞培養(yǎng)箱(美國杜邦公司);MK3型酶標(biāo)儀(荷蘭雷勃公司);Coultzer epics XL-MCL型流式細胞儀(美國Beck-man Counter公司);ND2000超微量核酸蛋白測定儀、實時定量PCR儀(美國Thermo Scientific公司)。
1.3方法
1.3.1細胞培養(yǎng) 小鼠正常肝細胞株AML12,由DMEM/F-12培養(yǎng)基(含10%胎牛血清、100 U/m l青霉素、100μg/m l鏈霉素)于37℃、5%CO2培養(yǎng)箱中進行培養(yǎng),2 d換液1次。實驗中所用細胞均處于對數(shù)生長期。
1.3.2MTT法檢測AML12細胞存活率,選擇損傷AML12細胞的乙醇濃度 取對數(shù)生長期AML12細胞,經(jīng)胰酶消化后,用DMEM/F-12培養(yǎng)基吹打配成1×105/ml單細胞懸液,加入96孔培養(yǎng)板,每孔100 μl。待細胞完全貼壁后,實驗孔分別加入100μl含乙醇的完全DMEM培養(yǎng)液,致乙醇終濃度分別為50、100、200、300、400、500 mmol/L,正常對照孔則加入100μl不含乙醇的完全DMEM培養(yǎng)液,空白對照孔(不含細胞)加入由100μl DMEM/F-12培養(yǎng)基和100μl完全DMEM培養(yǎng)液組成的復(fù)合液,用于MTT測定調(diào)零。每組設(shè)置至少5個復(fù)孔。培養(yǎng)箱中分別孵育12、24、48 h后,加入20μl MTT(5 g/L),繼續(xù)培養(yǎng)4 h后,去上清液,加入150μl DMSO,在搖床上振動搖勻,在酶標(biāo)儀490 nm波長下測定各孔的吸光度(absorbance,A)值。實驗重復(fù)3次。按下式計算肝細胞的存活率:存活率(%)=(實驗組A490 nm-空白 對 照組A490 nm)/(對照組A490 nm-空白對照組A490 nm)×100%。以此來確定損傷AML12細胞的乙醇濃度。
1.3.3流式細胞術(shù)檢測酒精對小鼠正常肝細胞AML12凋亡的影響 對處于對數(shù)生長期的AML12細胞,實驗組給予100 mmol/L酒精刺激24 h,對照組則不加任何刺激,24 h后,用胰酶消化細胞,并離心收集細胞(2~8℃,2 000 r/min離心5 min),用冷PBS洗滌細胞兩次(2~8℃,2 000 r/min離心5 min),最后一次洗滌應(yīng)將PBS盡量吸干。用400μl 1×Annexin V結(jié)合液懸浮細胞,在細胞懸浮液中加入5μl Annexin V-FITC染色液,輕輕混勻后于2~8℃避光條件下孵育15 min。15 min后加入10μl PI染色液后輕輕混勻于2~8℃避光條件下孵育5 min。立即用流式細胞儀檢測。實驗重復(fù)3次。
1.3.4實時熒光定量PCR檢測HDACs第一和第二家族目的基因mRNA的表達 在上述篩選出的濃度點和時間點下,用乙醇刺激AML12細胞,分別稱為對照組和實驗組,TRIzol一步法抽提上述各組細胞總RNA,采用ND2000超微量核酸測定儀測定RNA 260 nm及280 nm處A值,以檢測所提取RNA樣品的純度和濃度。將提取的總RNA按照TaKaRa逆轉(zhuǎn)錄試劑盒說明書逆轉(zhuǎn)錄成cDNA,產(chǎn)物于-20℃保存。采用熒光定量PCR儀,以β-actin為內(nèi)參照進行PCR擴增,各基因引物序列見表1。反應(yīng)條件:95℃預(yù)變性30 s,95℃變性5 s、60℃退火30 s、60℃延伸30 s,40個循環(huán),60℃延伸10 min。利用計算機軟件(PikoReal Software 2.2)分析各反應(yīng)的熒光強度。目的基因mRNA相對表達量=目的基因相對定量/內(nèi)參相對定量,實驗重復(fù)3次。
1.4統(tǒng)計學(xué)處理 所有結(jié)果以誤差線表示,采用SPSS 17.0軟件進行分析,多組間比較采用單因素方差分析,組間比較采用LSD檢驗。
2 結(jié)果
2.1乙醇對小鼠正常肝細胞AM L12增殖的影響
取對數(shù)生長期的AML12細胞,分別于不同的時間點加入不同濃度的乙醇,以空白對照孔為調(diào)零孔,MTT法測定A490 nm值。當(dāng)乙醇濃度較低 (<50 mmol/L),作用時間12、24、48 h時對AML12細胞均不表現(xiàn)出明顯的抑制作用;隨著濃度的升高和作用時間的不斷延長,酒精對AML12細胞表現(xiàn)出明顯的抑制作用(F12h=113.165、F24h=137.203、F48h= 266.997,P<0.05),在酒精濃度為100 mmol/L,刺激時間為 24 h時,AML12細胞的存活率為84%。見圖1。

表1 實時定量 PCR m RNA引物序列
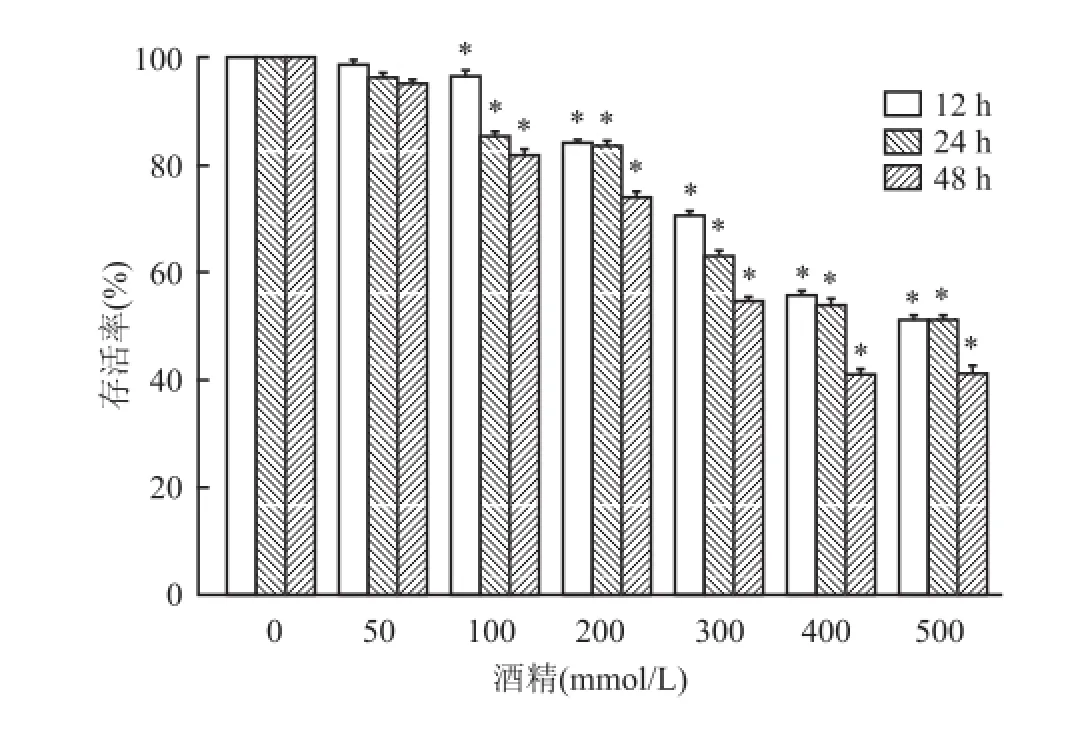
圖1 乙醇對小鼠正常肝細胞 AM L12增殖的影響與0 mmol/L比較:*P<0.05
2.2乙醇對小鼠正常肝細胞AM L12凋亡的影響
取對數(shù)生長期的AML12細胞,實驗組給予酒精(100 mmol/L、24 h)刺激,對照組不加任何刺激。與對照組比較,實驗組AML12細胞的凋亡率明顯大于對照組,因此,本研究采用乙醇100 mmol/L、刺激時間24 h來模擬體外損傷AML12細胞模型(P<0.05),見圖2。
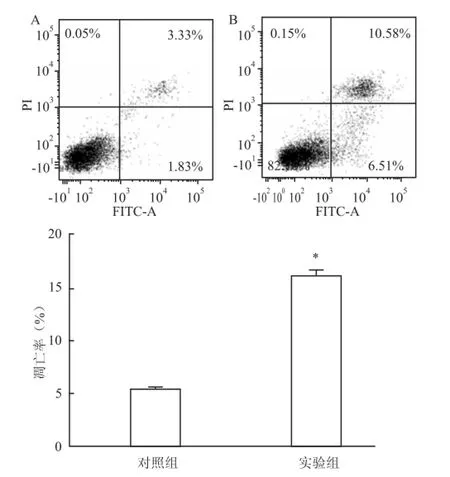
圖2 乙醇對小鼠正常肝細胞 AM L12凋亡的影響A:對照組;B:實驗組;與對照組比較:*P<0.05
2.3酒精性肝損傷細胞模型中HDACs目的基因m RNA的表達水平變化 在酒精性肝損傷細胞模型中,HDAC1、2、3、4、5、6、7、8的mRNA表達水平均下降(P<0.05),HDAC9的mRNA表達水平上升(P<0.05),HDAC10的mRNA表達與對照組比較無明顯變化,見圖3。
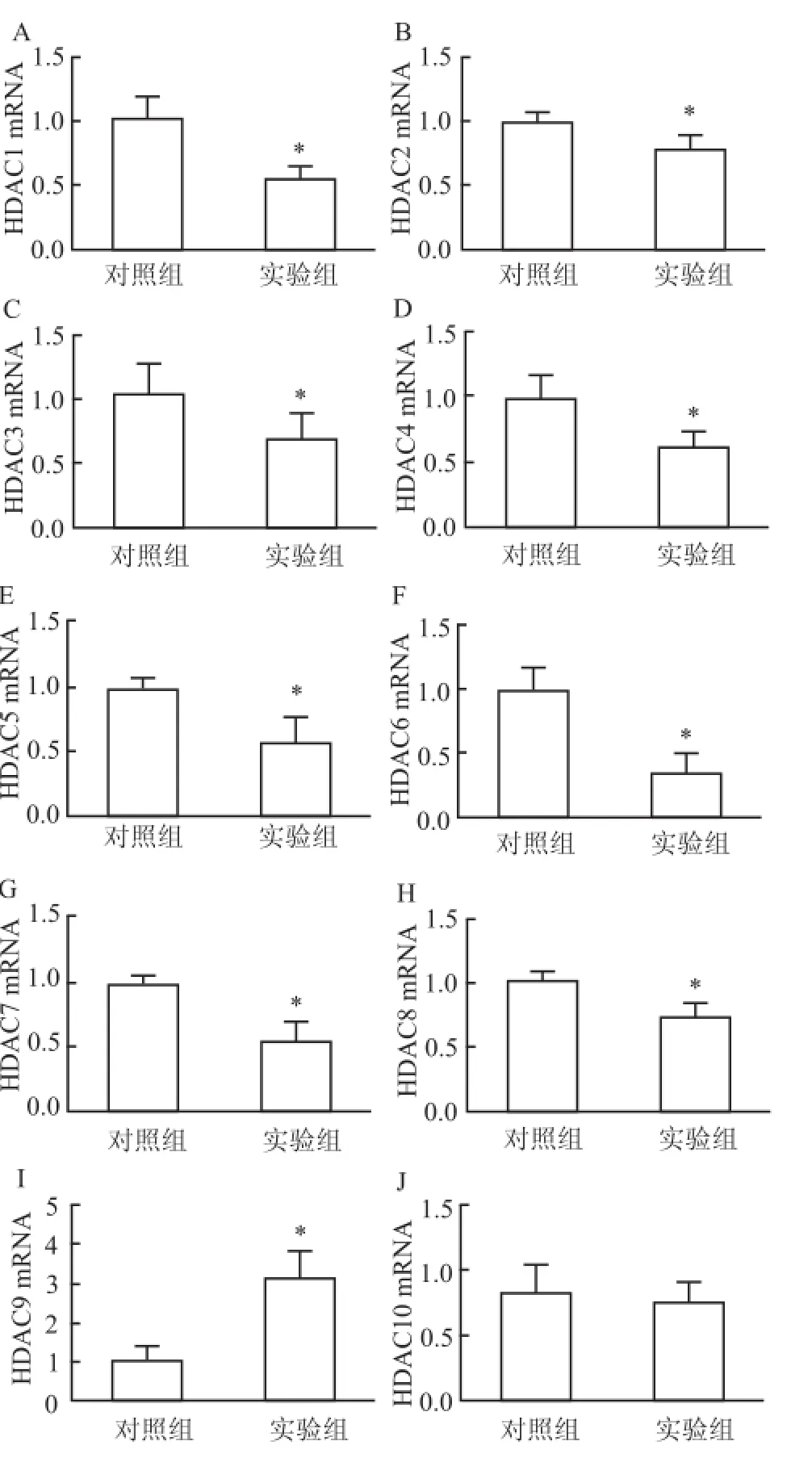
圖3 酒精性肝損傷細胞模型中HDACs目的基因mRNA表達水平變化A~J:HDAC1、2、3、4、5、6、7、8、9、10;與對照組比較:*P<0.05
3 討論
肝臟是乙醇代謝最主要的器官,大量的乙醇攝入可導(dǎo)致肝臟脂質(zhì)過氧化增加,進而導(dǎo)致肝細胞損傷。同時,乙醇進入機體后,被乙醇脫氫酶等酶類進一步氧化代謝為乙醛和乙酸鹽,進而導(dǎo)致三羧酸循環(huán)障礙和脂肪酸氧化減弱而影響脂肪代謝,最終可導(dǎo)致肝細胞空泡變形[5]。此外,進入機體的乙醇可間接激活枯否細胞,使其分泌大量細胞因子,如腫瘤壞死因子-α、白介素-1和白介素-6等。這些細胞因子的產(chǎn)生也對酒精性肝損傷的形成有重要的意義,可引起肝細胞進一步凋亡、壞死和炎癥加重[6]。
對于含有組蛋白或不含組蛋白的基因可逆的脫乙酰化作用是表觀修飾中的一種,對于基因表達的調(diào)控有十分重要的作用。而這一過程是在HATs和HDACs的共同調(diào)節(jié)下完成。在近些年的研究[7]中,HDACs對酒精引起的肝損傷以及酒精性肝病的影響越來越矚目。研究[8-10]表明,酒精的攝入可引起眾多肝核和非肝核蛋白的高乙酰化,提示和組蛋白乙酰化相關(guān)的表觀修飾可能參與了酒精性肝損傷的發(fā)生發(fā)展。本研究通過構(gòu)建體外酒精性肝損傷模型,運用實時熒光定量PCR法檢測酒精性肝損傷細胞模型中HDACs的mRNA表達情況。實驗結(jié)果顯示,乙醇的攝入可導(dǎo)致HDAC ClassⅠ(HDAC1、HDAC2、HDAC3、HDAC8),HDAC ClassⅡ(HDAC4、HDAC5、HDAC6、HDAC7)的mRNA表達抑制,HDAC ClassⅡ(HDAC9)的mRNA表達增加,提示酒精可擾亂肝內(nèi)HDACs的正常調(diào)節(jié)機制。這一過程可能是由于酒精代謝引起的肝臟炎癥和氧化應(yīng)激從而導(dǎo)致“轉(zhuǎn)錄機器復(fù)合物”的結(jié)合改變以及不正常的基因表達。
綜上所述,在酒精致肝細胞損傷中,HDACs的表達水平發(fā)生不同程度的變化,提示HDACs的調(diào)節(jié)失衡可能參與酒精性肝損傷的發(fā)生發(fā)展,但具體機制仍不清楚。進一步研究針對各個HDACs的具體功能和特定靶點,而選擇性基因敲除小鼠的運用將對于鑒別各個HDACs的功能有很大益處。
[1] 肖鳳霞,林勵,馬艷艷,等.毛橘紅總黃酮對酒精性肝損傷大鼠炎性細胞因子的影響[J].廣州中醫(yī)藥大學(xué)學(xué)報,2011,28(4):396-401.
[2] Zhang Y,Venugopal SK,He S,etal.Ethanol inducesapoptosis in hepatocytes by a pathway involving novel protein kinase C isoforms[J].Cell Signal,2007,19(11):2339-50.
[3] Mandrekar P.Epigenetic regulation in alcoholic liver disease[J]. World JGastroenterol,2011,17(20):2456-64.
[4] Martin T A,Jayanthi S,McCoy M T,et al.Methamphetamine causes differential alterations in gene expression and patterns of histone acetylation/hypoacetylation in the rat nucleus accumbens [J].PLoSOne,2012,7(3):e34236.
[5] Choi JS,Yoon T J,Kang K R,etal.Glycoprotein isolated from Acanthopanax senticosus protects against hepatotoxicity induced by acute and chronic alcohol treatment[J].Biol Pharm Bull,2006,29(2):306-14.
[6] 陳 震,呂雄文,李 俊,等.咖啡因?qū)π∈蠹毙跃凭愿螕p傷的保護作用[J].安徽醫(yī)科大學(xué)學(xué)報,2009,44(3):359-62.
[7] Kirpich I,Ghare S,Zhang J,et al.Binge alcohol-induced microvesicular liver steatosis and injury are associated with down-regulation ofhepatic Hdac 1,7,9,10,11 and up-regulation of Hdac 3[J].Alcohol Clin Exp Res,2012,36(9):1578-86.
[8] Shepard B D,Tuma P L.Alcohol-induced protein hyperacetylation:mechanisms and consequences[J].World JGastroenterol,2009,15(10):1219-30.
[9] Kim JS,Shukla SD.Acute in vivo effectofethanol(binge drinking)on histone H3 modifications in rat tissues[J].Alcohol Alcohol,2006,41(2):126-32.
[10]Park P H,Miller R,Shukla SD.Acetylation of histone H3 at lysine 9 by ethanol in rat hepatocytes[J].Biochem Biophys Res Commun,2003,306(2):501-4.
Experim ental study of histone deacetylases in alcohol-induced liver cell injury in m ice
Li Xing1,2,3,Huang Cheng1,2,3,Meng Xiaoming1,2,3,et al
(1School of Pharmacy,AnhuiMedical University,2AnhuiMedical University Institute of Liver Disease,3Anhui Institute of Innovative Drugs,Hefei 230032)
Objective To investigate the expression changes of histone deacetylases(HDACs)levels in alcohol-induced liver cell injury in mice.Methods Mice liver cell line(AML12)was used as the research object in vitro,to determine alcohol inhibitory effect on AML12 cells at different concentrations and time points by using MTT method;flow cytometry anlaysis was used to determine alcohol induced apoptosis effect on AML12 cells.Real-time quantitative PCR analysis was used to detectmRNA expression levels of HDACs in alcohol-induced liver cell injury model.Results Upon the stimulation of alcohol concentration at100 mmol/L for24 h,the survival rate of AML12 cellwas84%,indicating its significant role in inhibiting the proliferation of liver cell line(AML12)(P<0.05);furthermore,the apoptosis rate of AML12 cellswas16%,showing it could increase the AML12 cell apoptosis(P<0.05).Binge alcohol exposure induced liver cell injury and eventually resulted in deregulation of hepatic HDACs mRNA expressions.It could be observed visually that HDAC1,2,3,4,5,6,7,8 mRNA expressions were significantly down-regulated and HDAC9 mRNA expression was up-regulated(P<0.05).However,there was no significant difference in HDAC10 mRNA expression than control.Conclusion In alcohol-induced liver cell injurymodel,alcohol consumption affects HDACsmRNA levels and therefore,we speculate that histone deacetylases-mediated epigenetic modificationsmay play an important role in the pathogenesis of alcohol-induced hepatic injury.
histone deacetylases;alcohol-induced liver injury;epigenetic modific-ation
R 96
A
1000-1492(2016)04-0477-04
2015-12-28接收
國家自然科學(xué)基金(編號:81473268、81273526);安徽省科技攻關(guān)計劃項目(編號:1301042212);安徽省自然科學(xué)基金(編號:1308085MH145)
安徽醫(yī)科大學(xué)1藥學(xué)院、2肝病研究所,合肥 230032
3安徽省創(chuàng)新藥物產(chǎn)業(yè)共性研究院,合肥 230032
李 星,女,碩士研究生;
李 俊,男,教授,博士生導(dǎo)師,責(zé)任作者,E-mail:lj@ahmu.edu.cn

