利用改良電融合法制備雜交瘤細(xì)胞的試驗(yàn)探索
吳 夢(mèng),劉作華,3,羅 林,丁玉春,葛良鵬*,3(.重慶市畜牧科學(xué)院,重慶 榮昌 402460;2.農(nóng)業(yè)部養(yǎng)豬科學(xué)重點(diǎn)實(shí)驗(yàn)室,重慶 榮昌 402460;3.養(yǎng)豬科學(xué)重慶市市級(jí)重點(diǎn)實(shí)驗(yàn)室,重慶 榮昌 402460)
利用改良電融合法制備雜交瘤細(xì)胞的試驗(yàn)探索
吳夢(mèng)1,2,劉作華1,2,3,羅林1,丁玉春1,2,葛良鵬*1,2,3
(1.重慶市畜牧科學(xué)院,重慶 榮昌 402460;2.農(nóng)業(yè)部養(yǎng)豬科學(xué)重點(diǎn)實(shí)驗(yàn)室,重慶 榮昌 402460;3.養(yǎng)豬科學(xué)重慶市市級(jí)重點(diǎn)實(shí)驗(yàn)室,重慶 榮昌 402460)
摘要:目的:運(yùn)用改良電融合法提高雜交瘤的融合效率,以獲得更多的雜交瘤克隆。方法:將SP2/0細(xì)胞和脾細(xì)胞分別用NHS_d_PEG24_biotin孵育30min,再將脾細(xì)胞用avidin孵育30min,然后將SP2/0細(xì)胞和脾細(xì)胞按1:5混合孵育15min后進(jìn)行電融合,融合后的細(xì)胞用半固體培養(yǎng)基篩選單克隆。結(jié)果顯示:用2×105個(gè)SP2/0細(xì)胞和1×106個(gè)脾細(xì)胞進(jìn)行正常電融合,經(jīng)半固體培養(yǎng)基篩選共獲得6個(gè)單克隆,而用改良電融合法獲得了20個(gè)單克隆。結(jié)論:利用改良電融合法能夠增加異種細(xì)胞相互配對(duì)的幾率,從而提高雜交瘤的融合效率,最終獲得更多的雜交瘤細(xì)胞。
關(guān)鍵詞:電融合;半固體培養(yǎng)基;雜交瘤
細(xì)胞融合產(chǎn)生雜交瘤細(xì)胞在生物技術(shù)和生物醫(yī)藥中扮演著重要的角色,并且已經(jīng)廣泛用于各個(gè)領(lǐng)域,其中最成功的就是利用雜交瘤生產(chǎn)單克隆抗體。近年來,融合技術(shù)的最新應(yīng)用是將樹突狀細(xì)胞(DCs)與腫瘤細(xì)胞融合用于癌癥的免疫治療[1_2]。目前細(xì)胞融合主要有三種方法:病毒誘導(dǎo)細(xì)胞融合、聚乙二醇(PEG)誘導(dǎo)細(xì)胞融合和電脈沖誘導(dǎo)細(xì)胞融合。雖然病毒誘導(dǎo)的細(xì)胞融合通常能夠得到較高的融合率,但由于病毒不穩(wěn)定,容易污染雜交瘤細(xì)胞,因而在治療應(yīng)用中受到了很大限制。PEG誘導(dǎo)細(xì)胞融合由于操作過程簡單而被廣泛應(yīng)用,但該方法通常生產(chǎn)雜交瘤細(xì)胞較少,甚至還有化學(xué)結(jié)合。近年來,細(xì)胞電融合也被廣泛使用,主要原因是電融合法克服了以上兩種方法的缺點(diǎn),采用物理方法的電融合,避免了病毒和化學(xué)試劑的污染,但電融合法生產(chǎn)雜交瘤的效率仍然較低,其原因在于兩種細(xì)胞在融合前的排序是隨機(jī)結(jié)合,尤其是當(dāng)兩種細(xì)胞大小有較大差異時(shí),排序電壓更容易讓大細(xì)胞與大細(xì)胞接觸,而需要融合的兩種細(xì)胞接觸機(jī)會(huì)減少,導(dǎo)致融合效率降低[3_5]。因此,本試驗(yàn)利用生物素_鏈霉親和素能特異性、高親和性結(jié)合的原理,將SP2/0細(xì)胞和脾細(xì)胞分別包裹NHS_dPEG24_biotin(biotin),再將脾細(xì)胞包裹avidin,然后將SP2/0細(xì)胞和脾細(xì)胞按比例混合孵育,使兩種細(xì)胞相互配對(duì),增加接觸機(jī)會(huì),經(jīng)電融合后用半固體培養(yǎng)基篩選克隆。希望通過改良后的電融合法能夠增加兩種細(xì)胞配對(duì)的幾率,提高融合效率,最終獲得更多的雜交瘤克隆。
1 材料和方法
1.1材料
1.1.1試劑SP2/0細(xì)胞由重慶市畜牧科學(xué)院畜牧工程研究所提供,OVA(A7641,Sigma)、CpG(tlrl_1826,InvivoGen)、FBS(10091_148,Gibco)、RPMI1640基礎(chǔ)培養(yǎng)基(A10491_01,Gibco)、50×HT Media Supplement (H0137,Sigma)、Anti_Mouse IgG_Peroxidase antibody produced in goat(A4416,Sigma)、半固體培養(yǎng)基(03804,Stemcell)、NHS_dPEG24_biotin(10774,Quanta Bio Design)、Avidin(H0137,Sigma),常規(guī)試劑如無注明均購自Sigma公司。
1.1.2儀器多功能電融合儀(4308,Eppendorf),倒置顯微鏡(Eclipse_Ti,Nikon),CO2培養(yǎng)箱(371,Thermo),微孔板分光光度計(jì)(Epoch,BioTek),低速醫(yī)用離心機(jī)(400C,北京白洋)。
1.1.3試驗(yàn)動(dòng)物試驗(yàn)用6~8周齡BALB/c小鼠由重慶市畜牧科學(xué)院實(shí)驗(yàn)動(dòng)物中心提供。
1.2方法
1.2.1溶液配制等滲融合液:280mM葡萄糖、0.1mM (CH3COO)2Ca·H2O、0.5mM(CH3COO)2Mg·4H2O、0.1% BSA;低滲融合液:90mM葡萄糖、0.1mM(CH3COO)2Ca· H2O、0.5mM(CH3COO)2Mg·4H2O、0.1%BSA;RPMI1640完全培養(yǎng)基:10%FBS、1%青_鏈霉素、1%丙酮酸鈉、1%L_谷氨酰胺、87%RPMI1640基礎(chǔ)培養(yǎng)基。
1.2.2小鼠免疫及抗體效價(jià)檢測按照常規(guī)免疫小鼠的方法[6],對(duì)小鼠進(jìn)行3次免疫,經(jīng)ELISA檢測效價(jià)合格后用于后續(xù)融合實(shí)驗(yàn),具體免疫方案如下:首免用DPBS稀釋OVA抗原,濃度為5 mg/mL;加入50μg CpG和等體積的2%氫氧化鋁,混合均勻后再加入等體積的弗氏完全佐劑(CFA),渦旋使之乳化,按200μL/只劑量進(jìn)行皮下分點(diǎn)注射;首免第14d后進(jìn)行二免,OVA抗原濃度為2.5 mg/mL,加入25 μg CpG和等體積的2%氫氧化鋁,混合均勻后再加入等體積的弗氏不完全佐劑(IFA),渦旋使之乳化,以200μL/只腹腔分點(diǎn)注射;二免第14d后進(jìn)行三免,OVA抗原濃度為1.25mg/mL,加入12.5μg CpG和等體積的2%氫氧化鋁,混合均勻后以200μL/只腹腔分點(diǎn)注射。第三次免疫3d后眼眶采血,分離血清用間接ELISA法檢測血清效價(jià),用OVA(10 μg/mL)包被,將抗血清進(jìn)行10、100、1000倍稀釋,用間接法檢測抗體。可作為后續(xù)雜交瘤融合試驗(yàn)小鼠的判定標(biāo)準(zhǔn)為:稀釋1000倍后的樣品OD450/(陰性對(duì)照OD450_空白OD450)≥2。
1.2.3正常電融合法篩選雜交瘤使用頸椎脫臼法處死小鼠,用75%酒精浸泡5 min,取出脾臟分離脾臟淋巴細(xì)胞,并用血球計(jì)數(shù)板計(jì)數(shù)。取適量脾細(xì)胞與SP2/0細(xì)胞按1:5混合均勻,用10mL RPMI1640基礎(chǔ)培養(yǎng)基洗滌細(xì)胞,1200r/min離心3min,棄上清;將等滲融合液與低滲融合液按1:1混合均勻,洗滌細(xì)胞2次,每次10mL,1200r/min離心3min,棄上清;將細(xì)胞用200μL融合液重懸,加入到融合槽內(nèi),設(shè)定融合參數(shù),按下Start鍵,進(jìn)行細(xì)胞融合,融合后放置30 min;將融合細(xì)胞用RPMI1640完全培養(yǎng)基洗滌2次,1200r/min離心3min,加入3mL RPMI培養(yǎng)基重懸細(xì)胞并加入6孔板中,37℃、5%CO2條件下培養(yǎng)過夜。將融合細(xì)胞以1200r/min離心5min,棄上清,用RPMI1640完全培養(yǎng)基重懸融合細(xì)胞,與半固體培養(yǎng)基按1:10混合均勻,加入6孔板中(2mL/孔),使培養(yǎng)基平鋪于平板中,37℃、5%CO2條件下培養(yǎng)10~14 d;用10 μL槍頭在顯微鏡下挑取單個(gè)克隆,加入到200μL含HT的RPMI1640完全培養(yǎng)基中,每隔一天換液培養(yǎng)。待克隆長到80%左右吸出150μL上清,然后用間接ELISA法檢測抗體效價(jià)(參照1.2.2 ELISA檢測步驟)。
1.2.4改良電融合法篩選雜交瘤取適量SP2/0細(xì)胞和脾細(xì)胞,分別加入10mL DPBS,混勻,加入NHS_ dPEG24_biotin(以下簡稱 biotin)50 μg,4℃孵育30min,1200r/min離心3min,棄上清;細(xì)胞用10mL DPBS洗滌2次,再用2mL DPBS重懸細(xì)胞,備用。加入200 μg avidin于脾細(xì)胞重懸液里,輕輕旋轉(zhuǎn)離心管,混勻,4℃放置30min,1200r/min離心3min,棄上清;將SP2/0細(xì)胞與脾細(xì)胞按1:5輕輕混合均勻,室溫放置30min,按照1.2.3的電融合步驟進(jìn)行融合及篩選。
2 結(jié)果
2.1脾細(xì)胞和SP2/0細(xì)胞相互配對(duì)用SP2/0細(xì)胞孵育biotin,脾細(xì)胞先后孵育biotin和avidin,然后將SP2/0細(xì)胞與脾細(xì)胞按1:5混合孵育。從圖1結(jié)果得知,脾細(xì)胞和SP2/0細(xì)胞配對(duì)情況良好,由于兩種細(xì)胞大小差異較大,還會(huì)出現(xiàn)一個(gè)SP2/0細(xì)胞配對(duì)多個(gè)脾細(xì)胞的情況。
2.2正常電融合法與改良電融合法的融合效率比較通過半固體培養(yǎng)基的篩選培養(yǎng),用正常電融合法制備的雜交瘤細(xì)胞共獲得了6個(gè)克隆,經(jīng)ELISA鑒定能夠表達(dá)特異性抗體的克隆有2個(gè);而用改良電融合法制備的雜交瘤細(xì)胞共獲得了20個(gè)克隆,經(jīng)ELISA鑒定能夠表達(dá)特異性抗體的克隆有12個(gè)。因此,改良電融合法比正常電融合法的融合效率高,獲得了更多表達(dá)特異性抗體的雜交瘤克隆。圖2表示電融合法的融合過程。
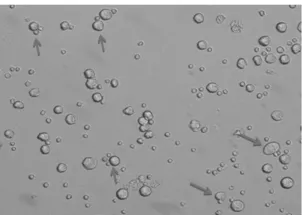
圖1 SP2/0細(xì)胞和脾細(xì)胞配對(duì)(200×)
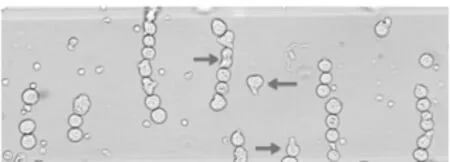
圖2 SP2/0細(xì)胞和脾細(xì)胞的電融合(200×)
3 討論
生物素_親合素系統(tǒng)(Biotin_Avidin_System,BAS)是20世紀(jì)70年代末發(fā)展起來的一種新型生物反應(yīng)放大系統(tǒng)。隨著各種生物素衍生物的問世,BAS很快被廣泛應(yīng)用于醫(yī)學(xué)各領(lǐng)域。本試驗(yàn)基于BAS系統(tǒng)的研究基礎(chǔ),在電融合前采用biotin、avidin分別包裹脾細(xì)胞和SP2/0細(xì)胞,然后對(duì)兩種細(xì)胞進(jìn)行相互配對(duì)。結(jié)果表明,脾細(xì)胞和SP2/0細(xì)胞經(jīng)過biotin、avidin處理后,增加了兩種細(xì)胞的接觸機(jī)會(huì),減少了相同細(xì)胞融合的幾率。因此,用改良電融合法制備雜交瘤的數(shù)量明顯高于正常電融合法,大大提高了融合效率。
雖然biotin、avidin的使用能夠增加異種細(xì)胞的相互配對(duì)幾率,提高融合效率,但從試驗(yàn)過程中得知,biotin、avidin對(duì)細(xì)胞仍然有一定毒性,造成細(xì)胞狀態(tài)較差,最終導(dǎo)致融合效率提高不明顯或者降低。因此,對(duì)于biotin、avidin的最佳使用濃度、結(jié)合時(shí)間等重要指標(biāo)還有待進(jìn)一步研究。總的來說,與正常電融合法相比,使用改良電融合法制備雜交瘤細(xì)胞能夠明顯提升融合效率,獲得更多有效的雜交瘤克隆。■
參考文獻(xiàn):
[1] Kanduser M,Usaj M.Cell electrofusion:past and future perspectives for antibody production and can_ cer cell vaccines[J].Expert Opinion on Drug Deliv_ ery,2014,11(12):1885_1898.
[2]Usaj M,F(xiàn)lisar K,Miklavcic D,et al.Electrofusion of B16_F1 and CHO cells:the comparison of the pulse first and contact firstprotocols[J].Bioelectro_ chemistry,2013,89:34_41.
[3]TomitaM,Tsumoto K.Hybridoma technologies for antibodyproduction[J].Immunotherapy,2011,3(3):371_380.
[4]Yu X,Mcgraw P A,House F S,et al.An optimized electrofusion_based protocol for generating virus_spe_ cific human monoclonal antibodies[J].Journal of Im_ munological Methods,2008,336(2):142_151.
[5]Li J,Yu X,Wagner T E,et al.A biotin_streptavidin _biotin bridge dramatically enhances cell fusion[J]. Oncology Letters,2014,8(1):198_202.
[6] Lee E C,Liang Q,Ali H,et al.Complete hu_ manization of the mouse immunoglobulin loci enables efficient therapeutic antibodydiscovery[J].Nature Biotechnology,2014,32(4):356_363.
中圖分類號(hào):S818.9
文獻(xiàn)標(biāo)識(shí)碼:B
文章編號(hào):1001_8964(2016)07_0026_03
收稿日期:2016_04_26
基金項(xiàng)目:重慶市基本科研業(yè)務(wù)費(fèi)項(xiàng)目 (2015cstc_jbky_00120,2014cstc_jbky_00111);國家國際科技合作專項(xiàng)(2013DFA31820);863項(xiàng)目(2014AA021602);重慶市國際合作項(xiàng)目(CSTC2013gjhz80002);重慶市基礎(chǔ)與前沿研究重大項(xiàng)目(cstc2013jcyjC80001);重慶市農(nóng)發(fā)資金項(xiàng)目(12402)。
作者簡介:吳夢(mèng)(1987_),男,重慶人,碩士,主要從事抗體工程研究。
*通訊作者:葛良鵬,副研究員,E_mail:geliangpeng1982@163.com
The Study of Modified Electrofusion Method to Prepare Hybridoma Cell
WU Meng1,2,LIU Zuohua1,2,3,LUO Lin1,et al.
(1.Chongqing Academy of Animal Sciences,Chongqing Rongchang 402460;2.Key Laboratory of Pig Industry Sciences of Agriculture Ministry,Chongqing Rongchang 402460;3.Key Laboratory of Pig Industry Sciences of Chongqing City,Chongqing Rongchang 402460,China)
Abstract:By using the method of modified electrofusion to improve the hybridoma fusion efficiency and obtain more hybridoma clones.SP2/0 cells and spleen cells were incubated with NHS_d_PEG24_biotin for 30min,then spleen cells were incubated with avidin for 30min respectively,and the SP2/0 cells and spleen cells were incubatedby ration of 1:5 in 15 min,the fused cells used semi_solid medium for screening monoclonal.Using 2×105SP2/0 cells and 1×106spleen cells for normal electrofusion,the semi_solid medium screening obtained a total of 6 monoclonals,while modified electrofusion obtained 20 clones.The result showed that modified electrofusion could obviously increase the matching probability of heterogeneous cells,so as to improve the efficiency of hybridoma fusion and obtain more hybridoma cells.
Key words:Electrofusion;Semi_solid medium;Hybridoma

