甲殼素酰化改性的研究進展
施文濤,陳鵬(中國科學院寧波材料技術與工程研究所,中國科學院海洋新材料與應用技術重點實驗室,浙江省海洋材料與防護技術重點實驗室,寧波市高分子材料重點實驗室,浙江 寧波 315201)
?
綜述與專論
甲殼素酰化改性的研究進展
施文濤,陳鵬
(中國科學院寧波材料技術與工程研究所,中國科學院海洋新材料與應用技術重點實驗室,浙江省海洋材料與防護技術重點實驗室,寧波市高分子材料重點實驗室,浙江 寧波 315201)
摘要:甲殼素作為一種來源廣泛的生物質材料,具有良好的生物相容性和抑菌性,可用于藥物緩釋、傷口包覆、組織植入、生物分離、重金屬吸附等高附加值領域,但強烈的氫鍵作用使其不熔難溶,需經改性以促進其加工和應用。本文簡要回顧了甲殼素酰化改性的發展歷程,重點介紹均相條件下甲殼素的各種酰化方法,如在甲磺酸、氯化鋰/二甲基乙酰胺、離子液體、三氟乙酸酐中進行反應,以及在非均相條件下提高酰化效率的各種方法,如優選催化劑、結構活化等,比較了各種方法的優缺點,并簡述了甲殼素酰化產物的性能特點和應用。目前甲殼素非均相酰化工藝較成熟,已實現工業化,但仍有一定的局限性和缺點。最后展望了均相和非均相酰化可能的改進方向。
關鍵詞:甲殼素;酰化;均相;非均相
甲殼素是產量僅次于纖維素的天然生物質材料。目前甲殼素主要取自食品加工業產生的蝦、蟹等甲殼。甲殼素及其衍生物具有良好的生物相容性、抑菌性和促進傷口愈合等功能,廣泛用于藥物緩釋、傷口包覆、組織植入、生物分離、重金屬吸附等高附加值領域[1]。但甲殼素富含氫鍵且高度結晶,導致不熔難溶、加工困難等難題,必須加以改性。目前主流的改性方法均以削弱氫鍵為要旨,如酰化、烷基化、醚化、酯化(無機酸酯化)、接枝等[2-4]。
傳統上甲殼素酰化多采用甲磺酸或高氯酸催化,或將堿甲殼素酰化[5],存在反應效率低、產物均一性差等不足。近年來,甲殼素酰化改性研究出現新的趨勢:一是開發均相酰化體系以提高反應效率和產物均一性,二是探索新的活化方法以提高非均相酰化效率。就均相酰化而言,已篩選出多個體系,如氯化鋰/二甲基乙酰胺(LiCl/DMAc)、六氟異丙醇、離子液體等。最近報道[6-7]的三氟乙酸酐催化羧酸酰化甲殼素,使反應時間大幅縮短,凸顯了均相酰化的優勢。
文獻[8-9]已對酸催化甲殼素酰化進行了專門的綜述。本文側重介紹和對比均相、非均相條件下甲殼素酰化的主要方法和產物種類、結構等,以期對甲殼素的改性、加工和應用提供參考。
1 甲殼素的結構和酰化因素
根據甲殼素的單元結構(圖1,C2處含少量未被乙酰化的氨基)和酰化位置不同,其酰化可分為N酰化(C2殘留氨基酰化及其二酰化)和O酰化(C3、C6羥基)。N酰化較難進行,在總酰化度較高時才發生;而O酰化較易進行,此時由于空間位阻效應,C6比C3上的羥基更易酰化。羥基的完全酰化需在苛刻條件下進行,如較高摩爾倍率的酰化劑、高效的催化劑和較長的反應時間等。酰化劑一般為酸酐、酰氯或羧酸。當取代基相同時,酰化效率排序為羧酸<酸酐<酰氯。隨酰化劑含量增加和反應時間延長,酰化程度上升,但有極限值。

圖1 甲殼素單元結構
根據在晶格中的分子排列不同,原生甲殼素主要有α和β型(圖2)。其中,α型甲殼素分子間氫鍵作用強,只能溶于強酸、LiCl/DMAc、含氟極性溶劑、二水氯化鈣/甲醇、濃堿、離子液體等[10-11],而后方可酰化;β型甲殼素無分子間氫鍵,更易溶脹和酰化。有趣的是,β型甲殼素可在酸、堿條件下轉變為α型甲殼素[12-13],而α、β型甲殼素在適當的條件下可再生為半α型甲殼素(圖2)[14],這也為甲殼素改性提供了可能的調控途徑,但目前這方面的研究尚不多見。
以下分均相和非均相體系詳述各種因素(酰化體系、酰化劑、催化劑、時間、溫度等)對甲殼素酰化的影響。
2 均相體系
所謂“均相”,是指甲殼素或其酰化產物在反應前或反應中溶解形成均相體系。此時,體系分散均勻,酰化度高,產物均一性好。但均相反應的發生和效率取決于溶劑和溶解性,目前多見于實驗研究。
均相酰化可分兩類:①甲殼素反應前不溶解,但隨酰化反應的進行,酰化產物逐漸溶解形成均相,如在甲磺酸中;②甲殼素反應前即溶解,如在LiCl/DMAc和離子液體中。表1總結了多個均相體系的反應條件與產物。
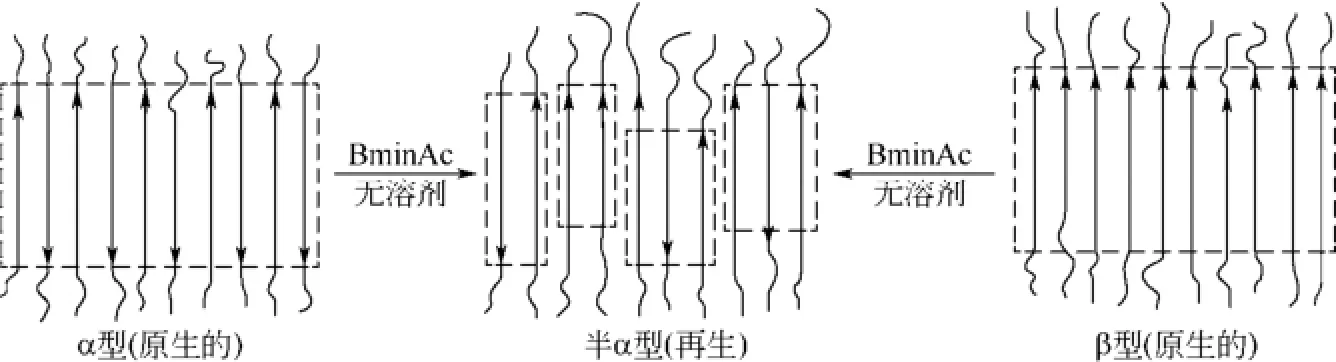
圖2 α、β甲殼素溶解再生中的轉變[14]
2.1 甲磺酸體系
甲磺酸催化酸酐酰化是常用的甲殼素均相酰化體系,其中甲磺酸兼作溶劑和催化劑[5,10]。典型體系如表1所示,將甲殼素、甲磺酸和乙酸酐按比例混合,反應后靜置過夜,可達到均相[5]。此反應要嚴格控制溫度,以免反應溫度過高導致甲殼素過度降解(圖3)[15]。
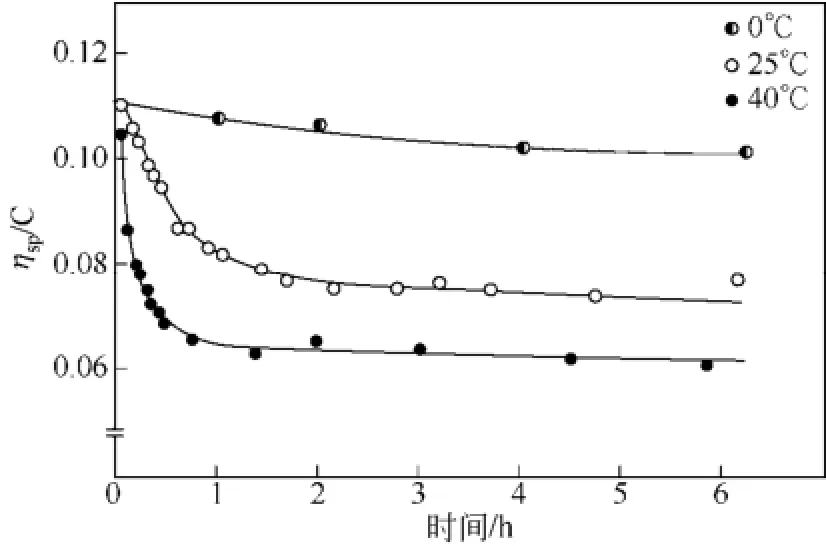
圖3 甲殼素溶解在甲磺酸中的增比黏度變化[15]
相同酰化度下,酰化插入的基團越大,對甲殼素致密結構的破壞程度越大,使其結晶度降低、溶解性提升。但隨著酰化基團增大,其插入難度也增加,需選用更強的酰化劑(如酰氯)。KAIFU等[16]將甲殼素溶于甲磺酸,與酰氯反應分別生成了己酰化、癸酰化和十二烷基酰化甲殼素。
羧酸也可用于甲磺酸催化酰化甲殼素,但其酰化效率低于酰氯和酸酐,且隨加入量增大所能達到的酰化度極值也偏低[15](表1)。
2.2 氯化鋰/二甲基乙酰胺(LiCl/DMAc)體系
甲殼素溶解在LiCl/DMAc中基本無降解,分子量可保持數周不變,在其中進行酰化時聚合度的降低幅度較小(表1)。但由于溶液黏度較高,酰化反應通常在較低的濃度下進行。
用酰氯作酰化劑時,反應生成 HCl,誘發甲殼素降解,需添加三乙基胺、吡啶等進行中和。三乙基胺與HCl成鹽而沉淀析出[17],吡啶除作為中和劑外,還有催化作用[18]。由于溶液中的 Li+對吡啶的親核效應產生屏蔽,需加入過量吡啶,中和 Li+后方可發揮催化作用。反應要在低溫進行,防止發生氯化,此外還可控制低酰化度時的反應選擇性,利于在C6上的酰化反應[17]。
酰氯酰化效率高,在均相條件下很容易達到完全酰化。SUGIMOTO等[19]使用C2~C6的脂肪族酰氯酰化甲殼素(表1),產物酰化度極值可超過2.0,說明發生了N酰化,使C2氨基上的乙酰基個數大于1。
此外,也可用羧酸在吡啶、對甲苯磺酰氯催化下對甲殼素進行均相酰化[20]。
2.3 離子液體體系

表1 均相體系甲殼素酰化的反應條件與產物性質
甲殼素在離子液體中的溶解性較優,質量分數可達2%~10%,但溶解和酰化均需較長時間。可用的離子液體大多含 N,N′-二烷基咪唑型陽離子,如1-烯丙基-3-甲基咪唑溴鹽[Amim][Br][21-24]、1-丁基-3-甲基咪唑乙酸鹽[Bmim][Ac][14,25]、1-烯丙基-3-甲基咪唑乙酸鹽[Amim][Ac][26]等。MINE等[21]研究了[Amim][Br]中甲殼素的酰化反應(表1),產物可溶于二甲基亞砜。
2.4 三氟乙酸酐體系
2.4.1 純三氟乙酸酐體系
與其他均相體系相比,純三氟乙酸酐體系中甲殼素的溶解和酰化更快,且酰化度高(表1)。該反應中溫度和三氟乙酸酐含量尤為重要:若溫度過低,則反應時間延長;三氟乙酸酐含量不足時反應不充分。
YANG等[6]在三氟乙酸酐體系中進行了甲殼素的脂肪族酰化,酰化度可高達2.3(表1),部分酰化發生在原甲殼素C2的氨基上,使氨基上的酰基個數大于 1,其產物可根據溶解性差異而分離成不同相對分子質量(4萬~20萬)的組分(表1),均可溶于二甲基甲酰胺。BHATT等[7]也用該方法進行了甲殼素的環烷酰化,產物可溶于二甲基甲酰胺、甲醇、乙醇和四氫呋喃。
2.4.2 三氟乙酸酐/磷酸體系
也可在三氟乙酸酐/磷酸體系中對甲殼素進行芳香族和脂肪族酰化。相比純三氟乙酸酐體系,磷酸可減少酰化劑羧酸和催化劑三氟乙酸酐的用量[27]。
KANKANALA等[28]最先采用此體系來酰化芳香族化合物。BHATT等將該方法用于甲殼素,分別生成丁酰化[27]和苯甲酰化甲殼素[29],產物可溶于二甲基亞砜、二甲基甲酰胺等溶劑。如圖4所示,反應中酰化劑羧酸下先后和三氟乙酸酐、磷酸生成酯類,該酯類再與甲殼素的羥基反應生成酰化產物[27,29]。
3 非均相體系
傳統上甲殼素酰化多在非均相體系中進行,一般為固-液反應。與均相酰化相比,非均相酰化較易導致原料降解,酰化度較低,均一性較差[17,20]。如甲殼素被高氯酸催化丁酰化時,其相對分子質量從45.5萬降至13.2萬[30]。但非均相體系成本低、反應量大,為工業界所采用。
3.1 催化劑
固-液非均相酰化多使用高氯酸等強酸催化劑[8-9],其成本較低,已實現工業化。除了強酸,還可采用吡啶、二烷基氨基吡啶等作為催化劑。其中,4-二甲氨基吡啶(DMAP)催化效率高,可提高產物的酰化程度,使其完全酰化[31]。
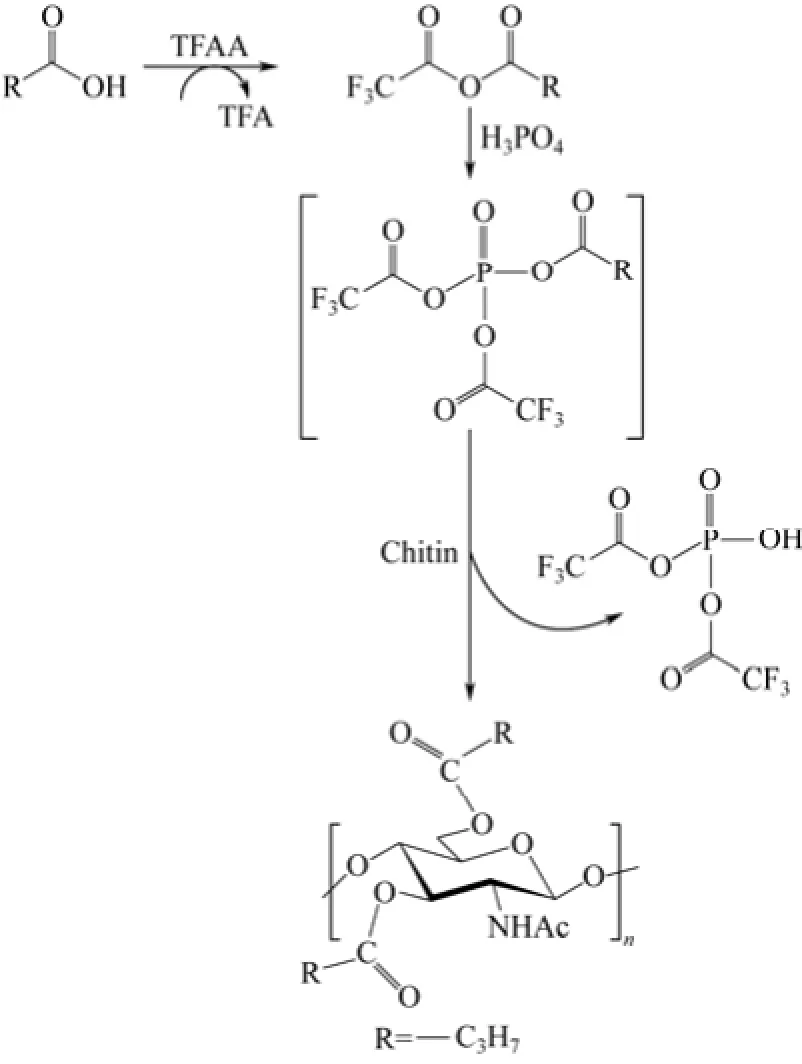
圖4 甲殼素在三氟乙酸酐/磷酸催化下的酰化示意圖[27]
3.2 活化
通過對甲殼素原料進行活化以提高非均相體系的酰化效率具有重要的應用價值,近年來廣受關注。VASNEV 等[18]將甲殼素、酰氯溶于六氟異丙醇(HFIP),再蒸去HFIP,得到疏松多孔、比表面積增大的活化甲殼素,繼而添加過量吡啶作為酰氯的溶劑,并催化酰化反應,使酰化溫度由80℃降至室溫、時間由6h縮短到2h、酰化度由0.10提高到0.22。顯然,該方法需使用揮發性溶劑如HFIP。但HFIP價格較高,且甲殼素分子量較高時溶解性差,限制了該方法的應用。
β型甲殼素無分子鏈間氫鍵,小分子較易插入從而形成插層復合物。YOSHIFUJI等[32]根據該原理對甲殼素進行活化,將β型甲殼素依次在水、二甲基亞砜、乙酸酐中浸泡,使β型甲殼素依次與相應試劑形成插層復合物,再與過量乙酸酐發生酰化反應。與直接酰化相比,該方法不使用催化劑,酰化時間縮短,酰化度提升,唯一缺點是復合物的形成需額外時間。
3.3 堿化處理
堿化甲殼素可直接與酸酐反應,但酰化度達到0.3~0.4后不再隨酸酐加入量的增加而上升[5,15]。采用酰氯可有效提高酰化效率,KURITA等[33]先將甲殼素加入氫氧化鈉水溶液,反應生成堿化甲殼素并溶解,再將含對甲苯磺酰氯的氯仿加入,在氫氧化鈉水溶液和氯仿兩種互不相溶的液體之間進行液-液界面反應,使酰化度提高到0.95。
相對于常見的固-液反應、液-液界面反應所得產物均一性較好。但酰氯酰化時界面反應劇烈,尤其是酰氯量較大時可能引起溫度飆升,使實驗重現性較差、產物酰化度較低[33]。
4 酰化產物種類
甲殼素酰化產物主要包括脂肪族、環烷族和芳香族等,對應于不同的加工工藝性和應用性能。
4.1 脂肪族
TERAMOTO等[20]研究了C4~C20的脂肪族酰化甲殼素。在LiCl/DMAc中,采用吡啶、對甲苯磺酰氯為催化劑、羧酸為酰化劑,制得具有半剛性主鏈、柔性側鏈的脂肪族酰化甲殼素(如圖5)。隨著取代基碳個數的增加,柔性側鏈變長,直至足夠長時互相交錯[如圖 5(b)],使得玻璃化程度增強。當取代基碳個數大于12后,在DSC曲線上出現玻璃化轉變。
甲殼素在甲、乙酰化后可溶于LiCl/DMAc、甲酸、三氯乙酸等溶劑,進而加工成各種制品,應用于醫療等領域。例如:甲、乙酰化甲殼素可促進傷口愈合[10],而二乙酰化甲殼素具有抗凝血性[15]。
隨著脂肪族酰化基團增大和酰化度增加,產物溶解性進一步提升,至二丁酰化甲殼素時出現顯著變化,其雖不溶于水性溶劑,但溶于大部分有機溶劑[34]。二丁酰化甲殼素被廣泛用于濕法[30,35-38]、干法紡絲[38],所得纖維在堿液中水解還原即可得到甲殼素纖維。如圖6所示,水解150min后得到的還原甲殼素纖維的結晶性與不經酰化直接制得的纖維類似,而二丁酰化甲殼素的高溶解性使其加工工藝性更優[37-38]。
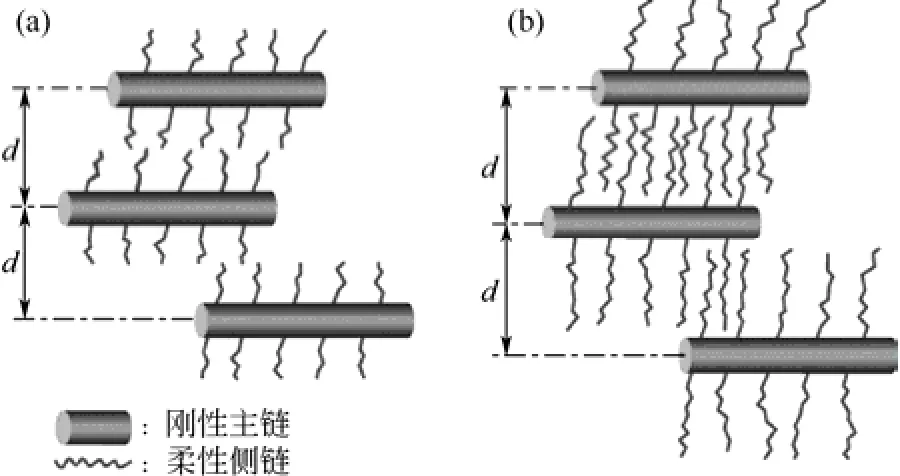
圖5 酰化甲殼素結構示意圖[20]
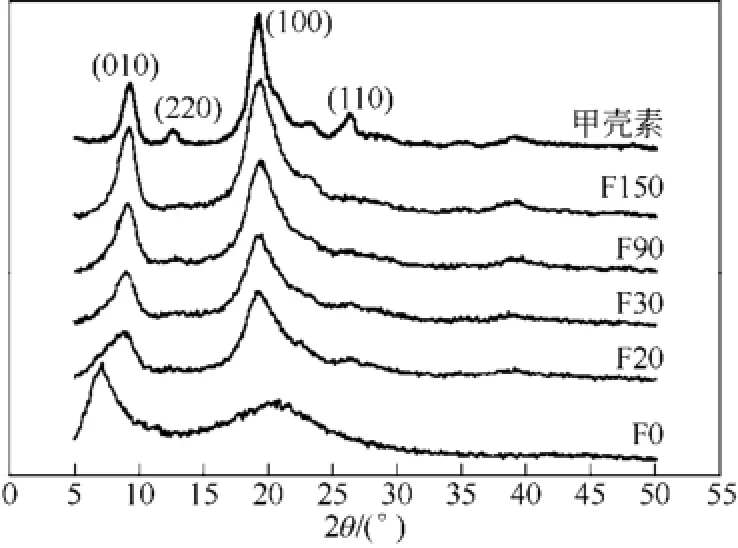
圖6 甲殼素、二丁酰化甲殼素纖維(F0)和被堿水解的二丁酰化甲殼素纖維[37]
二丁酰化甲殼素已用于傷口敷料,可促進傷口愈合[30]。本文作者所在課題組采用類似方法對甲殼素進行酰化改性和濕法紡絲,通過在紡絲液中添加適量的碳納米管、石墨烯等納米填料,發現在納米填料和酰化甲殼素之間可發生特定相互作用,促進紡絲液濃度提高和纖維性能改善,并保持其良好的抗菌等功能,相關機理正在深入研究中。
更多碳個數的脂肪族酰化甲殼素可直接溶于苯、四氫呋喃、二氯甲烷等有機溶劑[16]。隨著脂肪族酰化碳個數的增長,產物開始具有較長的疏水鏈,其親水性減弱。
4.2 環烷族
環烷族酰化通常采用三氟乙酸酐催化羧酸酰化甲殼素。隨著插入環的增大,對甲殼素致密結構的破壞隨之增大,使其表面從密實變為疏松(圖7),結晶度更低,溶解性更好[7]。
4.3 芳香族
由于芳香基團體積龐大,反應較為困難,須采用強酰化劑如酰氯。芳香族酰化使甲殼素分子間氫鍵顯著減弱,從而溶解性更優。例如:苯甲酰化產物可溶于苯甲醇、二甲基亞砜、二甲基甲酰胺、甲酸等溶劑[39];甲苯磺酰化時,酰化度0.4以上的產物可溶于二甲基亞砜、二甲基乙酰胺、甲基吡咯烷酮等溶劑,是一種良好的反應中間體[33]。
5 結 語
甲殼素經酰化改性可有效削弱其氫鍵和結晶,從而獲得良好的溶解性和加工性。目前廣泛使用的甲磺酸或高氯酸催化酰化法仍有一定的局限性和缺點,如需要較長的反應時間,并在冰浴中反應以避免降解。酰化方法的改進大致可分為均相和非均相兩方面。對于均相體系,需進一步提高溶液濃度和反應規模,離子液體是值得進一步研究的溶劑。三氟乙酸酐體系在保證產物酰化度的同時可大幅縮短反應時間,且反應條件溫和、產物均一性較好,可作為一種方便快捷的實驗級酰化方法。非均相反應則在研究新的活化方法方面仍有較大提升空間。

圖7 甲殼素和環烷基酰化甲殼素掃描電鏡圖[7]
參考文獻
[1] FELSE PA,PANDA T.Studies on applications of chitin and its derivatives[J].Bioprocess Engineering,1999,20(6):505-512.
[2] 馬寧,汪琴,孫勝玲,等.甲殼素和殼聚糖化學改性研究進展[J].化學進展,2004(4):643-653.
[3] 楊安樂,陳長春,孫康,等.甲殼素的改性研究及其在功能材料上的應用[J].現代化工,1999(4):52-54.
[4] 汪玉庭,劉玉紅,張淑琴.甲殼素、殼聚糖的化學改性及其衍生物應用研究進展[J].功能高分子學報,2002(1):107-114.
[5] NISHI N,NOGUCHI J,TOKURA S,et al.Studies on chitin.1.Acetylation of chitin[J].Polymer Journal,1979,11(1):27-32.
[6] YANG B Y,DING Q,MONTGOMERY R.Preparation and physical properties of chitin fatty acids esters[J].Carbohydrate Research,2009,344(3):336-342.
[7] BHATT L R,KIM B M,AN C Y,et al.Synthesis of chitin cycloalkyl ester derivatives and their physical properties[J].Carbohydrate Research,2010,345(14):2102-2106.
[8] 吳文忠.用酸催化法制備乙酰化甲殼質的研究進展[J].合成技術及應用,1999(2):29-31.
[9] 陳長春,吳人潔,孫康.甲殼素的酰基化及其在生物材料上的應用[J].功能高分子學報,1997(2):148-152.
[10] 王愛勤.甲殼素化學[M].北京:科學出版社,2008:221-226.
[11] PILLAI C K S,PAUL W,SHARMA C P.Chitin and chitosan polymers:chemistry,solubility and fiber formation[J].Progress in Polymer Science,2009,34(7):641-678.
[12] SAITO Y,PUTAUX JL,OKANO T,et al.Structural aspects of the swelling of beta chitin in HCl and its conversion into alpha chitin[J].Macromolecules,1997,30(13):3867-3873.
[13] NOISHIKI Y,TAKAMI H,NISHIYAMA Y,et al.Alkali-induced conversion of beta-chitin to alpha-chitin[J].Biomacromolecules,2003,4(4):896-899.
[14] WU Y,SASAKI T,IRIE S,et al.A novel biomass-ionic liquid platform for the utilization of native chitin[J].Polymer,2008,49(9):2321-2327.
[15] KAIFU K,NISHI N,KOMAI T,et al.Studies on chitin.5.formylation,propionylation,and butyrylation of chitin[J].Polymer Journal,1981,13(3):241-245.
[16] KAIFU K,NISHI N,KOMAI T.Preparation of hexanoyl,decanoyl,and dodecanoylchitin[J].Journal of Polymer Science,Part A:Polymer Chemistry,1981,19(9):2361-2363.
[17] ZOU YQ,KHOR E.Preparation of c-6 substituted chitin derivatives under homogeneous conditions[J].Biomacromolecules,2005,6(1):80-87.
[18] VASNEV V A,TARASOV A I,MARKOVA G D,et al.Synthesis and properties of acylated chitin and chitosan derivatives[J].Carbohydrate Polymers,2006,64(2):184-189.
[19] SUGIMOTO M,KAWAHARA M,TERAMOTO Y,et al.Synthesis of acyl chitin derivatives and miscibility characterization of their blends with poly(epsilon-caprolactone)[J].Carbohydrate Polymers,2010,79(4):948-954.
[20] TERAMOTO Y,MIYATA T,NISHIO Y.Mesomorphic assemblage of chitin normal acylates and rapid enthalpy relaxation of their side chains[J].Biomacromolecules,2006,7(1):190-198.
[21] MINE S,IZAWA H,KANEKO Y,et al.Acetylation of alpha-chitinin ionic liquids[J].Carbohydrate Research,2009,344(16):2263-2265.
[22] PRASAD K,MURAKAMI M,KANEKO Y,et al.Weak gel of chitin with ionic liquid, 1-allyl-3-methylimidazolium bromide[J].International Journal of Biological Macromolecules,2009,45(3):221-225.
[23] YAMAZAKI S,TAKEGAWA A,KANEKO Y,et al.An acidic cellulose-chitin hybrid gel as novel electrolyte for an electric double layer capacitor[J].Electrochemistry Communications,2009,11(1):68-70.
[24] TAKEGAWA A,MURAKAMI M,KANEKO Y,et al.Preparation of chitin/cellulose composite gels and films with ionic liquids[J].Carbohydrate Polymers,2010,79(1):85-90.
[25] SETOYAMA M,KATO T,YAMAMOTO K,et al.Preparation of chitin/cellulose films compatibilized with polymeric ionic liquids[J].Journal of Polymers and the Environment,2013,21(3):795-801.
[26] WANG W-T,ZHU J,WANG X-L,et al.Dissolution behavior of chitin in ionic liquids[J].Journal of Macromolecular Science,Part B:Physics,2010,49(3):528-541.
[27] BHATT LR,KIM BM,HYUN K,et al.Preparation of chitin butyrate by using phosphoryl mixed anhydride system[J].Carbohydrate Research,2011,346(5):691-694.
[28] KANKANALA K,REDDY VR,MUKKANTI K,et al.A TFAA-H3PO4-mediated direct,metal-free and high-speed synthesis of aryl carboxylate esters from phenols[J].Journal of Fluorine Chemistry,2009,130(5):505-508.
[29] BHATT LR,KIM BM,HYUN K,et al.Preparation and characterization of chitin benzoic acid esters[J].Molecules,2011,16 (4):3029-3036.
[30] CHILARSKI A,KRUCINSKA I,KIEKENS P,et al.Novel dressing materials accelerating wound healing made from dibutyrylchitin[J].Fibres & Textiles In Eastern Europe,2007,15(4):77-81.
[31] 李英.介紹一類高效酰化催化劑——二烷基氨基吡啶[J].化學試劑,1982(2):88-94,129.
[32] YOSHIFUJI A,NOISHIKI Y,WADA M,et al.Esterification of beta-chitin via intercalation by carboxylic anhydrides[J].Biomacromolecules,2006,7(10):2878-2881.
[33] KURITA K,YOSHINO H,YOKOTA K,et al.Preparation of tosylchitins as precursors for facile chemical modifications of chitin[J].Macromolecules,1992,25(14):3786-3790.
[34] 馬健巖,許峰,冷兵.丁酰甲殼素的制備及表征[J].遼寧化工,2008 (6):365-368.
[35] MUZZARELLI RAA,GUERRIERI M,GOTERI G,et al.The biocompatibility of dibutyryl chitin in the context of wound dressings[J].Biomaterials,2005,26(29):5844-5854.
[36] WAWRO D,STEPLEWSKI W,CIECHANSKA D,et al.The effect of solvent type on the mechanical properties of dibutyrylchitin (DBC) fibres[J].Fibres & Textiles In Eastern Europe,2007,15(3):14-18.[37] WLOCHOWICZ A,SZOSLAND L,BINIAS D,et al.Crystalline structure and mechanical properties of wet-spun dibutyrylchitin fibers and products of their alkaline treatment[J].Journal of Applied Polymer Science,2004,94(5):1861-1868.
[38] SZOSLAND L,駱為林.甲殼質和二丁酰甲殼質纖維[J].國外紡織技術,1999(6):9-10.
[39] SOMORIN O,NISHI N,TOKURA S,et al.Studies on chitin 2.Preparation of benzyl and benzoylchitins[J].Polymer Journal,1979,11(5):391-396.
第一作者:施文濤(1983—),男,工程師,從事甲殼素改性及其濕法紡絲研究。E-mail swt596@163.com。聯系人:陳鵬,研究員,從事高分子改性與加工工藝研究。E-mail pchen@nimte.ac.cn。
中圖分類號:O 636.1
文獻標志碼:A
文章編號:1000-6613(2016)07-2166-07
DOI:10.16085/j.issn.1000-6613.2016.07.033
收稿日期:2015-09-09;修改稿日期:2016-03-04。
基金項目:國家自然科學基金(51273207)及寧波市國際科技合作項目(2013D10002)。
Advances in acylation of chitin
SHI Wentao,CHEN Peng
(Ningbo Institute of Materials Technology and Engineering,Chinese academy of Sciences,Key Laboratory of Marine Materials and Related Technologies,Zhejiang Key Laboratory of Marine Materials and Protective Technologies,Ningbo Key Laboratory of Polymer Materials,Ningbo 315201,Zhejiang,China)
Abstract:As one of the major bio-based materials,chitin shows excellent bio-compatibility and anti-bacterial properties and finds applications in many high value-added areas,such as drug release,wound healing,tissue implantation,bio-separation engineering and heavy metal absorption,etc.However,chitin is featured by extensive hydrogen bonding,making it unable to melt and difficult to be dissolved.Therefore,modification is important to facilitate the processing and application of chitin.In this article,the current state of acylation of chitin is reviewed by comparing different acylation methods under both homogeneous and heterogeneous conditions.Focus is on the homogeneous reactions in methanesulfonic acid,lithium chloride/dimethylacetamide,ionic liquids and trifluoroacetic anhydride.Methods for improving acylation efficiency under heterogeneous conditions are described,such as optimizing the catalyst and structural activation.The properties and applications of acylated chitin are also introduced.Although the acylation of chitin under heterogeneous conditions has been well developed,there are still some limits and shortcomings.This paper highlights the significant advantages of trifluoroacetic anhydride method under homogeneous conditions,as well as strategies for improving the heterogeneous acylation of chitin.
Key words:chitin;acylation;homogeneous;heterogeneous

