礦化海水淡化水在鍍鋅管中的化學穩定性研究
張 凱,韓 旭,朱金亮,周潮洪
(天津市水利科學研究院,天津 300061)
?
礦化海水淡化水在鍍鋅管中的化學穩定性研究
張凱,韓旭,朱金亮,周潮洪
(天津市水利科學研究院,天津300061)
摘 要:未經合理礦化處理的海水淡化水進入既有市政管網,會與舊管壁上沉積的物質發生反應,影響出水水質。分析了含有不同氯化鈣濃度的海水淡化水流經曾經用于輸送自來水的鍍鋅管后管道出水中鈣離子、鐵離子、總鐵、堿度、pH值、濁度以及LSI指數的變化,研究了海水淡化水對鍍鋅管管壁的腐蝕機理。研究結果表明,當海水淡化水中離子濃度很低時,在管壁上主要發生的是對碳酸鈣垢的溶解侵蝕反應,這一反應隨著水中鈣離子濃度的增加而減弱,當水中鈣離子濃度達到28 mg/L時,水中的鈣離子與管壁上的鈣垢達到溶解平衡;同時,隨著水中氯離子濃度增加,淡化海水與管壁的作用逐漸轉化為化學腐蝕作用,建議增加入水的堿度,并減少其中的氯離子濃度。
關鍵詞:海水淡化水;鍍鋅管;化學穩定性
海水淡化水是一種新型的非常規淡水資源,近年來發展迅速,目前全世界已經有150多個國家建立了海水淡化廠,近3億人的飲水與海水淡化水有關。海水淡化已經成為解決全球沿海地區水資源緊缺的重要措施之一。
截至2014年,全國海水淡化水產能已達85.86 萬m3/d,主要分布在沿海地區,其中天津的淡化海水產能達到32.6萬m3/d,成為全國海水淡化水產能最大的區域。但是,目前我國的海水淡化水主要用作工業用水和海島上的生活用水,鮮有向市政供水的成功案例。導致這個結果的主要技術問題之一就是未經合理處理的海水淡化水一旦進入供應自來水的市政管網,會與管壁上的沉積物發生反應,導致管壁上的鐵和其他不溶性物質進入水中,用戶端出水呈現紅色或者黃色,也就是常說的“紅水”“黃水”現象[1]。
針對管道中水化學的穩定性問題,Taylor等人的文獻中廣泛使用朗格列爾指數(Langelier Index,LSI)作為水質穩定性的評價[2];而Birnhack等人的文獻中借鑒以色列的海水淡化水廣泛使用的碳酸鈣沉積勢(CCPP)作為水質穩定性評價的指標[3]。LSI和
上述指標在國際上被廣泛用于判斷海水淡化水廠的出水水質是否達到所需標準,但是各受水區域的供水管網材質不同、地表水水源水質不同,導致各水廠的海水淡化水出廠水質指標也不相同[4];此外淡化海水進入管道后,會與管道中的自來水混合,導致水質的各項參數發生變化,所以單純依靠出廠水的各項指標,也不能確切地保證淡化海水進入市政供水管網后依舊是安全的。基于這些原因,有必要深入研究淡化海水對管壁的腐蝕機理,并針對進入管道的水體提出合理的水質判據。
盡管新建的建筑物中已經普遍采用PPR材質的入戶供水管,但是鍍鋅管作為傳統的供水入戶管道,在老城區中還廣泛使用,并且在市政供水中往往是“紅水”“黃水”的主要鐵源。此次以市政供水的鍍鋅管為對象,研究礦化后的海水淡化水對鍍鋅管道的腐蝕機理。
1 實驗方法和實驗裝置
1.1實驗方法
研究中通過向海水淡化水中添加不同含量的氯化鈣,以改變淡化水中鈣離子濃度和氯離子濃度;研究不同鈣離子和氯離子濃度的淡化海水進入做舊的鍍鋅管后不同停留時間下出水中鈣離子濃度、鐵離子濃度、總鐵、堿度、濁度、pH等指標的變化規律,以及LSI指數的變化規律;分析海水淡化水在鍍鋅管內的反應機理。
1.2海水淡化水和自來水水質指標
實驗中所使用的海水淡化水采用天津市北疆電廠低溫多效蒸餾法的出水,鍍鋅管做舊時使用的自來水為市政自來水。所用自來水和海水淡化水的相關水質指標,見表1。

表1 實驗用水水質
1.3海水淡化水在鍍鋅管道中的循環實驗
淡化海水在鍍鋅管中循環的實驗裝置,如圖1所示。含有不同濃度的CaCl2的海水淡化水存儲于補水桶1中,實驗開始前先分別用自來水和實驗用水對實驗管道進行沖洗,沖洗水經放空閥7排出;實驗開始后,關閉放空閥7,水體在管道內進行內循環;取樣后管道中水量的損失由位于高位的補水桶1中的水體予以補充。由于每次取樣量不超過100mL,僅占管道水量的不足0.3%,因此補水水質導致的水質差異可以忽略。
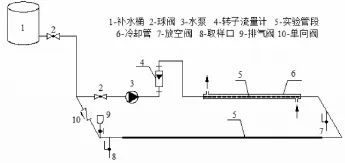
圖1 水質穩定性的實驗裝置示意
裝置中所使用的鍍鋅管道在開展實驗前先用市政自來水循環沖洗1年,以保證管道內壁沉積足夠的水垢并出現銹蝕,可以模擬現實中的供水管道。
該裝置中鍍鋅管總長3 m,輔助管路長度不超過1.5 m,為PVC材質;為了避免循環過程中因水泵散熱導致管道內水體溫度升高,對實驗管段中的一段鍍鋅管加裝了冷卻管,采用水冷的方式以恒定管道中的水溫。
不同鈣離子濃度的海水淡化水進入實驗管段后,每個工況連續運行30 h,取樣時間點設為實驗啟動后10 min、20 min、40 min、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、11 h、24 h、27 h和30 h。檢測水樣的鈣離子、溶解性鐵離子、總鐵、堿度、濁度、pH值,計算朗格利爾飽和指數(LSI),分析各水質指標的變化規律。
1.4海水淡化水礦化濃度
研究中用CaCl2調節海水淡化水的鈣離子濃度,濃度分別為0、8、12、20和28 mg/L。
2 實驗結果及分析
2.1出水中鈣離子濃度的變化
不同初始鈣離子濃度的海水淡化水進入管道后,出水的鈣離子濃度變化如圖2所示。由圖2可以看出,所有濃度鈣離子的水體進入管道之后都需要經過2~6 h才能使水體中的鈣離子含量穩定下來達到平衡;當鈣離子的初始濃度分別為0、8、12和20 mg/L時,穩定后鈣離子的平衡濃度都會有所升高;當鈣離子初始濃度為28 mg/L時,鈣離子的平衡濃度與初始濃度基本相等。

圖2 不同初始鈣離子濃度下出水中鈣離子變化曲線
為了使鈣離子濃度變化趨勢更加直觀,計算出各時間點水中鈣離子濃度的增加速率,其計算公式為:

式中:ν為t2時刻的鈣離子濃度增加的速率[mg/(L· h)];C2為t2時刻鈣離子的濃度(mg/L);C1為t1時刻鈣離子的濃度(mg/L);t2,t1為相鄰的兩個取樣時刻(h)。
初始鈣離子濃度為12 mg/L時海水淡化水中鈣離子的增加速率,如圖3所示。
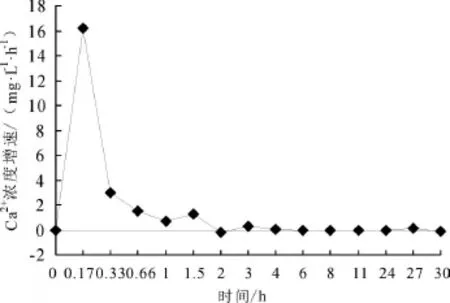
圖3 鈣離子初始濃度為12 mg/L時鈣離子濃度增加速率
從圖3可以看出,水體中鈣離子濃度的增速呈現阻尼震蕩的形式,在迅速增加后又迅速降低,而后小幅增加和降低,并且在局部時段呈現負值,說明這一時期是鈣離子沉積過程,而不是釋放過程;一定時間以后,鈣離子濃度增速為0,說明水中的鈣離子濃度不再發生變化,建立起了新的平衡。
這一現象可解釋為:在鍍鋅管做舊過程中使用的自來水的LSI>0,具有碳酸鈣沉積的趨勢,因此舊的實驗管路的內壁上除了鐵的氧化物成分,還存在鈣的沉積物,以碳酸鈣為主。海水淡化水進入這一管道后,會與管壁上的鈣垢發生反應并形成新的化學平衡:反應初期由于水中的鈣離子濃度低,管壁上的鈣離子會溶解到水中,使得水中的鈣離子濃度迅速增加;而隨著海水淡化水中鈣離子濃度的增加,水中的鈣離子也會沉積到管壁上;實驗運行一段時間后,鈣離子的溶解和沉積達到了一個動態平衡的狀態,此時鈣離子濃度基本上保持不變。
不同鈣離子初始濃度的水體進入管道后,出水鈣離子濃度達到平衡的時間和平衡濃度見表2。

表2 不同初始鈣離子濃度的水體達到鈣離子平衡的時間和濃度
從實驗結果可以看出,當鈣離子初始濃度為0 mg/L時,鈣離子在水中基本就是一個純溶出、再沉淀的過程;當鈣離子初始濃度為8、12和20 mg/L時,水體中鈣離子的濃度逐漸出現類似阻尼運動的震蕩過程,最終達到平衡,并且隨著水中初始鈣離子濃度的增加,達到平衡的時間逐漸推后;當鈣離子初始濃度為28 mg/L時,除了初始階段水體中的鈣離子有一個溶出導致的升高過程,在后續環節中只有單一的沉淀過程,其平衡濃度為28.29 mg/L,溶解和沉積量基本相等。
2.2出水中鐵離子濃度和總鐵的變化
圖4所示為不同初始鈣離子濃度條件下出水中鐵離子的濃度、總鐵平均值的曲線以及總鐵中鐵離子所占的比例。由于不同采樣時間下水樣中的鐵離子、總鐵濃度變幅很大且有一定的隨機性,因此研究中是對采樣序列過程中樣品中鐵離子、總鐵的算術平均值進行分析,主要研究鐵離子和總鐵的變化趨勢以及二者之間的關系。
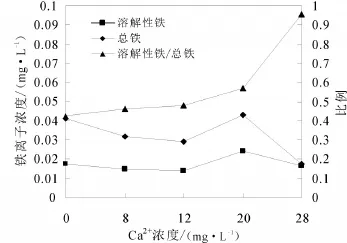
圖4 不同初始鈣離子濃度條件下出水中鐵離子、總鐵的變化曲線
由圖4可以看出,隨著初始鈣離子濃度的增加,出水中溶解性鐵占總鐵的比例也在增加。當鈣離子初始濃度分別為0、8和12 mg/L時,溶解性鐵占總鐵的比例不足50%,說明出水中的鐵以不溶性鐵為主,包括從管壁上脫落的鐵氧化物顆粒;當鈣離子初始濃度為20 mg/L時,這一比例為56.9%,水體中溶解性鐵所占比例逐漸升高;當鈣離子初始濃度為28 mg/L時,這個比例升高為95.5%,水體中的鐵基本以溶解性鐵離子形式存在。
導致這一結果的機理可以解釋為:當初始水體中鈣離子濃度很低時,水體與管壁上的沉積物發生的主要是溶解作用,大量碳酸鈣進入水中,導致鈣垢以塊狀脫落,混合于鈣垢中的鐵的氧化物也隨之脫落,以難溶于水的顆粒物形式存在于水體中;而隨著鈣離子濃度的升高,管壁上鈣離子溶解的速率減慢,同時由于摻入的是CaCl2,水體中氯離子濃度也隨之升高,其自由電荷加速了管壁上的氧化還原反應,加速了管壁上鐵的腐蝕,大量鐵以離子形式進入水中,因此水中溶解性的鐵占據主導地位。
基于這一結論,可以把不同礦化濃度的海水淡化水對鍍鋅管的腐蝕分為2個階段:當淡化水中鈣離子、氯離子含量低的時候,海水淡化水對管壁上的鈣垢起到溶解侵蝕作用,并導致鐵的氧化物以固體顆粒形式進入水體;而當海水淡化水中腐蝕性陰離子濃度增加之后,即便增加水體中的鈣離子可以避免其對管壁上的鈣垢造成破壞,但是仍會加速管壁上鐵的腐蝕速度,導致大量鐵離子進入水體。
2.3堿度的變化情況
不同初始鈣離子濃度下出水中的堿度變化曲線,如圖5所示。由圖5可以看出,出水的堿度也是在大約6 h之后達到平衡,這與出水中的鈣離子變化規律是一致的;而實驗所使用的水中的鈣離子是海水淡化水加CaCl2配制的,不含碳酸氫鹽,因此所有實驗中的初始堿度都接近于0;堿度增加的過程反映水體中的HCO3-含量在不斷增加,其唯一來源是管壁上碳酸鈣的溶出,這也從側面反映了海水淡化水對管壁鈣垢的溶解過程。
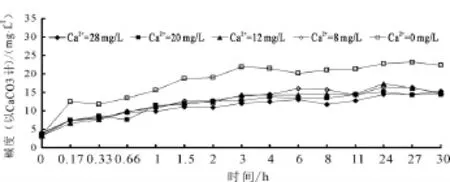
圖5 不同初始鈣離子濃度下出水中堿度變化曲線
2.4pH值的變化情況
不同初始鈣離子濃度下的出水中的pH值變化曲線,如圖6所示。由圖6可以看出,不論海水淡化水中初始鈣離子濃度是多少,在其進入管網之后,pH值迅速升高,隨著時間的增加,pH值增加的速度變慢,最終都會穩定在9.4左右。也就是說,管道中水體最終的pH值與初始水體中鈣離子含量無關。
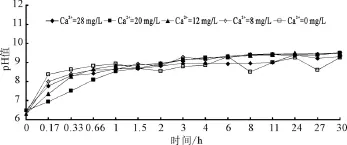
圖6 不同初始鈣離子濃度下出水中pH值變化曲線
導致這一結果的主要原因是實驗中添加氯化鈣的海水淡化水堿度低,不具有對pH變化緩沖的能力;而當管壁和水體達到平衡以后,水體的堿度接近于一個常數,此時對應的pH也是一個相對穩定的數值,并且由于碳酸鈣的溶出,使得水體呈弱堿性。值得注意的是,我國的生活飲用水標準中規定的pH值范圍是6.5~8.5,按照此標準,沒有pH緩沖能力的海水淡化水進入管網后的1 h之內,水體的pH值全部超標。為了避免這一現象的發生,在海水淡化水礦化過程中,應當通過添加碳酸氫鹽的方式保證水體有一定的堿度。
2.5朗格利爾飽和指數(LSI)的變化情況
朗格利爾飽和指數(LSI)經常被用于判斷管道中固液界面上碳酸鈣是沉積還是溶出[5]。如果LSI<0,則碳酸鈣從管壁溶出;反之LSI>0,碳酸鈣從水中沉積到管壁上[6]。圖7所示為不同初始鈣離子濃度下出水中朗格利爾飽和指數(LSI)的變化曲線,當鈣離子濃度為0 mg/L時,朗格利爾飽和指數(LSI)一直小于0,此時的水具有很強的侵蝕性;當鈣離子濃度超過8 mg/L時,經過一段時間之后出水中的LSI最終會大于0,說明在海水淡化水中添加鈣離子,可以降低其對管壁的侵蝕性;而且隨著初始鈣離子濃度的增加,系統達到LSI>0的時間越短,當鈣離子濃度為8 mg/L時6 h后LSI>0,而當鈣離子濃度為20和28 mg/L時3 h后LSI>0,進一步說明了鈣離子濃度的升高有助于管道中的系統達到穩定狀態。
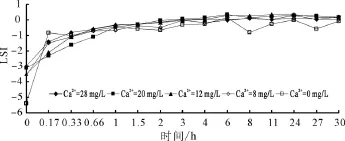
圖7 不同初始鈣離子濃度下出水中LSI變化曲線
2.6濁度的變化情況
我國生活飲用水衛生標準對濁度的規定值為1NTU。圖8是不同初始鈣離子濃度下出水的濁度變化曲線。由圖8可知,在海水淡化水剛進入管網后短時間內水中的濁度變化較大,40 min以后濁度值波動性變小,水質基本上達到穩定。當入水的鈣離子濃度為小于12 mg/L時,系統穩定后水中的濁度值部分時間會超過1NTU;當鈣離子濃度大于20 mg/L時,系統穩定后水中的濁度值全部達標。
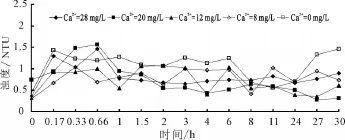
圖8 不同初始鈣離子濃度下出水中濁度變化曲線
這一結論與前文提到的兩段式腐蝕機理相吻合,即入水中鈣離子濃度低,會導致管壁的固體物脫落,導致水中濁度增加;而增加入水中的鈣離子有助于降低出水的濁度。
3 結論
通過上述研究,可以得出以下結論:
(1)當海水淡化水進入鍍鋅管時,在淡化水中加入一定濃度的鈣離子有助于增強管道系統的化學穩定性,綜合考慮建議在海水淡化水中加入的鈣離子含量不少于28 mg/L。
(2)提出了海水淡化水對管道內部腐蝕的兩段式理論,即當水中鈣離子濃度較低時水體對管壁的影響主要是侵蝕作用,而隨著鈣離子以及腐蝕性陰離子濃度的增加,水體對管壁腐蝕作用成為影響水質和管道系統穩定性主要因素。為了降低出水的pH和總鐵,建議在礦化過程中增加水中的堿度,并盡可能降低氯離子濃度。
參考文獻
[1]王春,王長平,劉旭輝.深圳梅沙片區供水管網黃水成因分析及控制對策[J].中國給水排水,2012,28(9):44-47.
[2]Zhi Jian Tang,Seunqk Wan Hong,Wei Zhong Xiao,et al. Characteristics of iron corrosion scales established under blending of ground surface and saline waters and their im?pacts on iron release intlepipe distribution system[J].Corro?sion Science,2006,48:322-342.
[3]Liat Birnhack,Nikolay Voutchkov,Ori Lahaw.Fundamental chemistry and engineering aspects of post-treatment process?es for desalinated water-A Review[J].Desalination,2011,273:6-22.
[4]周韜,鐵質給水管道內壁腐蝕對管網水質影響研究[D].長沙:湖南大學,2006.
[5]Rushing J C,L S McNeill,M Edwards.Some effects of aque?ous silica on corrosion of iron[J].Water Research,2003,37 (5):1080-1090.
[6]駱碧君,劉志強,鄭毅,等.海水淡化水在既有管網中的水質變化研究[J].中國給水排水,2009,25(23):57-60.
中圖分類號:TV213.9;P746
文獻標識碼:A
文章編號:1004-7328(2016)03-0060-05
DOI:10.3969/j.issn.1004-7328.2016.03.019
收稿日期:2016—02—25
作者簡介:張凱(1976—),男,高級工程師,主要從事水資源研究與保護工作。CCPP都只反映了碳酸鈣在管壁上沉積形成鈣垢的過程,盡管目前公認管壁上沉積的碳酸鈣薄層可以減緩水體對管壁的腐蝕,但是并沒有闡述腐蝕的機理。Larson和Skold于1957年提出了拉森比率(LR)作為水質穩定性的判別指標,該指標描述了碳酸氫根離子對管壁的保護作用以及氯離子和硫酸根離子對管壁的腐蝕作用之間的平衡關系。

