籽用西瓜SCoT-PCR反應體系優(yōu)化及引物篩選
楊 靜,王 萍,石 磊
(內(nèi)蒙古農(nóng)業(yè)大學 農(nóng)學院,內(nèi)蒙古野生蔬菜種質(zhì)資源與創(chuàng)新重點實驗室,呼和浩特 010019)
籽用西瓜SCoT-PCR反應體系優(yōu)化及引物篩選
楊靜,王萍,石磊
(內(nèi)蒙古農(nóng)業(yè)大學 農(nóng)學院,內(nèi)蒙古野生蔬菜種質(zhì)資源與創(chuàng)新重點實驗室,呼和浩特010019)
摘要采用L25(56)正交試驗設計,對影響目標起始密碼子多態(tài)性-聚合酶鏈式反應(SCoT-PCR)的5個因素(Taq酶用量、Mg2+濃度、模板 DNA 用量、dNTPs 濃度和引物濃度) 進行優(yōu)化試驗,建立了籽用西瓜SCoT-PCR反應體系:Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.5 μmol·L-1、模板DNA 20 ng,總體積20 μL。比較各因素對擴增反應的結(jié)果,其中以Mg2+濃度的影響最大,Taq酶用量的影響最小。應用22個籽用西瓜品種驗證該體系穩(wěn)定可靠,并從 41個 SCoT 引物中篩選出擴增條帶清晰、多態(tài)性豐富的22個引物,并逐一篩選出最適退火溫度。該反應體系的建立為今后利用SCoT標記技術對籽用西瓜種質(zhì)遺傳多樣性評價、指紋圖譜構建、種質(zhì)鑒定、分子標記輔助選擇育種等研究提供了新的技術手段。
關鍵詞籽用西瓜;SCoT-PCR;體系優(yōu)化;正交設計
籽用西瓜(Citrulluslanatusvar.megulasnemusLin et Chao)[1],屬于葫蘆科普通西瓜亞種中的籽瓜變種,俗稱“打瓜”“瓜籽瓜”,主要以種子為食用器官。籽用西瓜在植物學上有不同分類,依其種子顏色可以分為紅籽瓜和黑籽瓜2種,依其板型則分為大板、中板、小板[2]。籽瓜的分布較廣, 主要分布在甘肅、新疆、內(nèi)蒙古、寧夏、廣西等10省(區(qū)),呈現(xiàn)南“紅”(紅瓜子)北“黑”(黑瓜子)的種植格局,每年播種面積在10萬hm2以上,已成為南方和西北地區(qū)重要的經(jīng)濟作物之一。
目標起始密碼子多態(tài)性(Start codon targeted polymorphism, SCoT) 分子標記是Collard等[3]在水稻上提出的基于單引物擴增反應(Single primer amplification reaction,SPAR) 的新型分子標記,是一種新的目的基因分子標記。其原理是根據(jù)植物基因中的 ATG 翻譯起始位點側(cè)翼序列的保守性,設計單引物并對基因組進行擴增,產(chǎn)生偏向候選功能基因區(qū)顯性多態(tài)性標記。具有操作簡單、引物通用性強、成本低、多態(tài)性高、遺傳信息豐富、能有效產(chǎn)生與性狀聯(lián)系標記、有利于輔助育種等優(yōu)點。該標記兼具RAPD和ISSR的優(yōu)點,除可作為對ISSR和RAPD的有效補充之外,更能利用該分子標記有效跟蹤性狀[4]。該分子標記目前已成功應用于柑橘[5]、芒果[6]、草莓[7]、葡萄[8]、牡丹[9]、鐵皮石斛[10]、枇杷[11]和番木瓜[12]等多種植物,但在籽用西瓜遺傳多樣性上以及種質(zhì)鑒定等方面未見報道。由于籽用西瓜是西瓜的變種,本身資源缺乏,育種材料親緣關系過分單一,造成籽用西瓜育種工作很難取得突破。籽用西瓜育種要取得突破關鍵在于優(yōu)質(zhì)種質(zhì)資源的開發(fā)和利用,本研究旨在較全面地建立并優(yōu)化籽用西瓜的 SCoT 反應體系,篩選出最適SCoT引物,為應用 SCoT 分子標記技術進一步研究籽用西瓜種質(zhì)資源的起源、進化及遺傳多樣性奠定基礎。為此,本試驗以籽用西瓜為材料,利用正交設計優(yōu)化籽用西瓜的 SCoT-PCR 反應體系,并篩選適用于籽用西瓜的 SCoT 引物,為其在籽用西瓜種質(zhì)資源的遺傳多樣性分析、遺傳資源評價分析、圖譜構建與種質(zhì)鑒定以及分子標記輔助育種等領域的應用提供技術支撐及理論依據(jù)。
1材料與方法
1.1材料及試劑
供試材料取自萌發(fā)6 d后的種子(表1),經(jīng)冷凍干燥機干燥24 h后充分研磨。其中‘內(nèi)蒙黑中片’‘道縣紅籽瓜’和‘蘭州大板一號’分別用于SCoT-PCR反應體系的優(yōu)化、退火溫度的篩選及引物的篩選,所列22個試材均用于優(yōu)化體系的驗證。
SCoT 引物序列來自于 Collard 等[3],由上海生工生物工程技術服務有限公司合成。DL2000 Marker、dNTPs、TaqDNA 聚合酶、10×Buffer 等均購自全式金生物工程有限公司。
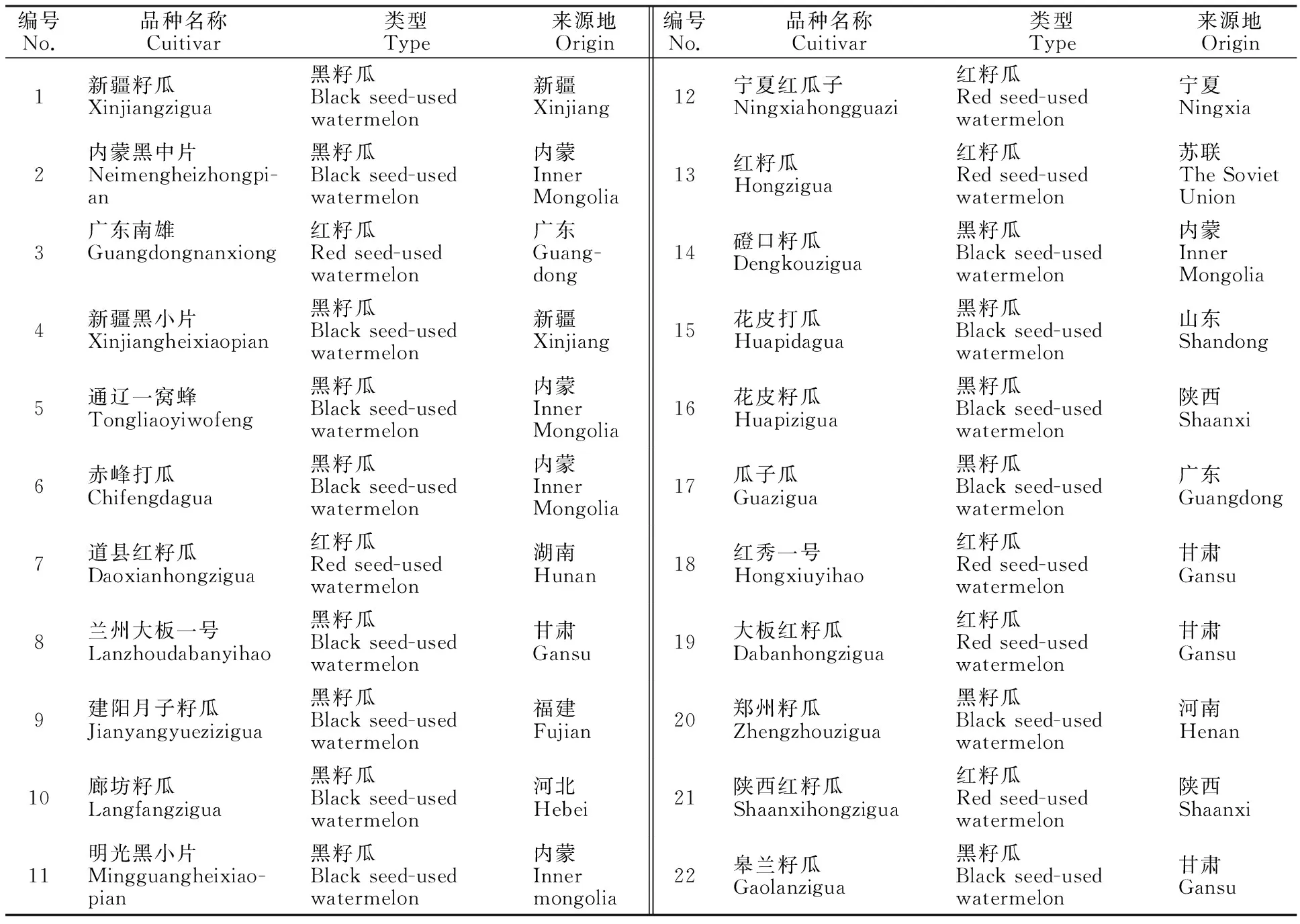
表1 供試材料信息
注:6~22號籽用西瓜品種均由國家西瓜與甜瓜中期庫提供。
Note:All of 6-22 seed-used watermelon were provided by watermelon and melon middle library of countries.
1.2基因組DNA的提取與檢測
籽用西瓜基因組DNA提取采用改良的十六烷基三甲基溴化銨法(CTAB)[13],所得DNA用紫外分光光度法和10 g·L-1瓊脂糖凝膠電泳法檢測其質(zhì)量及完整性。根據(jù)檢測結(jié)果將DNA稀釋至所需濃度后,-20 ℃保存待用。
1.3SCoT-PCR擴增程序
PCR擴增反應在BYQ6031E-505型PCR擴增儀上進行。初始擴增程序參考 Collard 等[3]和韓國輝等[14]的方法,具體反應程序為:94 ℃預變性4 min,94 ℃變性30 s,47.7 ℃復性退火30 s,72 ℃延伸1 min,循環(huán) 35次,最后72 ℃延伸5 min,擴增產(chǎn)物于4 ℃下保存。擴增反應結(jié)束后,加入2 μL 6×loading buffer,取4~6 μL擴增產(chǎn)物在10 g·L-1瓊脂糖凝膠中電泳,電極緩沖液為0.5×TBE,經(jīng)Gelview核酸染料染色后,電壓120 V電泳1 h,最后紫外燈下照相保存。
1.4SCoT-PCR體系的正交優(yōu)化設計
采用 L25(56)正交表設計,對反應體系中的Mg2+、dNTPs、引物、Taq酶和DNA模板5種影響因素設置5個水平(表2)共25個組合。試驗以‘內(nèi)蒙黑中片’基因組DNA為模板,S19為擴增引物,每個處理重復2次。各處理的PCR擴增體系為20 μL,每個處理10× Buffer用量均為2.0 μL,不足部分用ddH2O補足。對擴增結(jié)果進行人工評分后,利用正交設計助手 3.1軟件進行直觀分析。

表2 L25(56)正交試驗的因素及水平
1.5SCoT引物和退火溫度的篩選
根據(jù)正交試驗結(jié)果,選擇‘蘭州大板一號’和‘道縣紅籽瓜’,運用最佳反應體系進行引物篩選和退火溫度的確定試驗(表3)。

表3 籽用西瓜SCoT引物篩選及最適退火溫度
1.6數(shù)據(jù)統(tǒng)計與處理
參照何正文等[15]和姜小鳳等[16]的方法對電泳結(jié)果打分,主要依據(jù)PCR擴增結(jié)果電泳條帶的多少、清晰度、雜帶的多少以及背景顏色對正交試驗各個處理依次打分:1~25(最差的擴增結(jié)果記“1”分; 條帶多態(tài)性最高、清晰度最好、分散性強和背景顏色少的最佳擴增結(jié)果記“25”分)。根據(jù)打分結(jié)果進行直觀分析,在假設不存在交互作用情況下,試驗每一因素下各水平的平均值能夠反映影響因素各水平對反應體系的影響情況,因此本試驗首先根據(jù)電泳平均得分求出每一因素下各水平的均值Ki用以反映因素各水平的影響大小; 最后求出同一因素不同水平間平均值的極差R,用最大平均值減去最小平均值即為同因素不同水平間的極差R,R大小反應該因素對試驗結(jié)果影響的程度,R越大說明該因素對試驗結(jié)果影響越大。
1.7反應體系穩(wěn)定性的驗證
根據(jù)所確定的SCoT-PCR最佳反應體系,選用多個引物對22個籽用西瓜品種進行PCR擴增,以驗證該SCoT-PCR最適反應體系的可靠性及穩(wěn)定性。
2結(jié)果與分析
2.1籽用西瓜DNA濃度的檢測
對提取的籽瓜DNA純度進行瓊脂糖凝膠電泳檢測。檢測結(jié)果顯示所得的DNA條帶清晰完整,無拖尾現(xiàn)象。用Biophotometre型核酸蛋白儀檢測DNA濃度,OD260/OD280為1.9~2.0,說明所提取的籽瓜DNA較純凈,無雜質(zhì)污染,可用于試驗研究進行PCR擴增。
2.2籽用西瓜SCoT反應體系的正交優(yōu)化分析結(jié)果
正交試驗采用‘內(nèi)蒙黑中片’基因組DNA為模板,S19為擴增引物進行擴增,并對擴增產(chǎn)物進行電泳檢測(圖1)。由正交試驗結(jié)果可以看出,不同的處理組合,由于Mg2+、dNTPs、Taq聚合酶、引物和模板DNA用量搭配組合的不同,擴增結(jié)果存在著明顯的差異。其中,處理1、2、3無擴增結(jié)果,處理4、6、9、10、20、21、25條帶弱,處理5、7、8、11、12、13、14、15、16、22、23、24條帶亮但不清晰,擴增效果以組合17、18、19為最好,條帶亮且清晰。依據(jù)PCR擴增結(jié)果電泳條帶的多少、清晰度、雜帶的多少以及背景顏色對正交試驗各個處理依次打分,最好的記為25分,最差的記為1分,對試驗結(jié)果進行直觀分析(表4)。
根據(jù)直觀分析結(jié)果,各因素極差R大小依次為 Mg2+>模板DNA>引物>dNTPs>Taq酶,表明各因素對反應體系的影響程度大小亦以此排序。根據(jù)直觀分析中各因素水平下的得分數(shù)據(jù)平均值Ki可以確定各個因素的最適濃度(得分最高),由表4中的Ki值可以初步確定各因素單一最佳水平分別為:Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.7 μmol·L-1、模板DNA 60 ng。但相應組合在正交設計表中并未出現(xiàn),該體系與組合17最為接近,只是引物與模板DNA含量有所不同,根據(jù)組合 17 的擴增效果并結(jié)合經(jīng)濟角度考慮,選擇0.5 μmol·L-1、20 ng 作為引物與模板DNA最佳用量,所以確定最佳組合為 17。因此,籽用西瓜SCoT-PCR的最佳反應體系為總體積20 μL中含Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.5 μ mol·L-1、模板DNA 20 ng。Mg2+對PCR擴增的特異性和產(chǎn)量有顯著的影響,Mg2+濃度過高,反應特異性降低,出現(xiàn)非特異擴增,濃度過低會降低TaqDNA聚合酶的活性,使反應產(chǎn)物減少。在17、18、19組合中Mg2+的濃度相對較高,均為2.5 mmol·L-1,是最佳水平,而1~5組合Mg2+濃度最低,表明籽用西瓜在SCoT-PCR擴增上需要較高濃度的Mg2+,并且Mg2+的影響最大。而其他組合在Mg2+濃度適當?shù)姆秶鷥?nèi)均有條帶,說明其他因素對PCR擴增反應體系的影響較小。
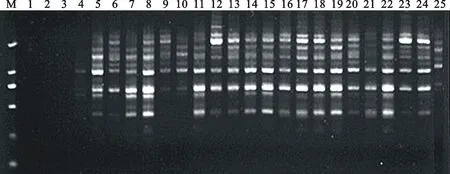
M.DL2000 marker;1~25.處理編號,同表4 Code is the same as table 4
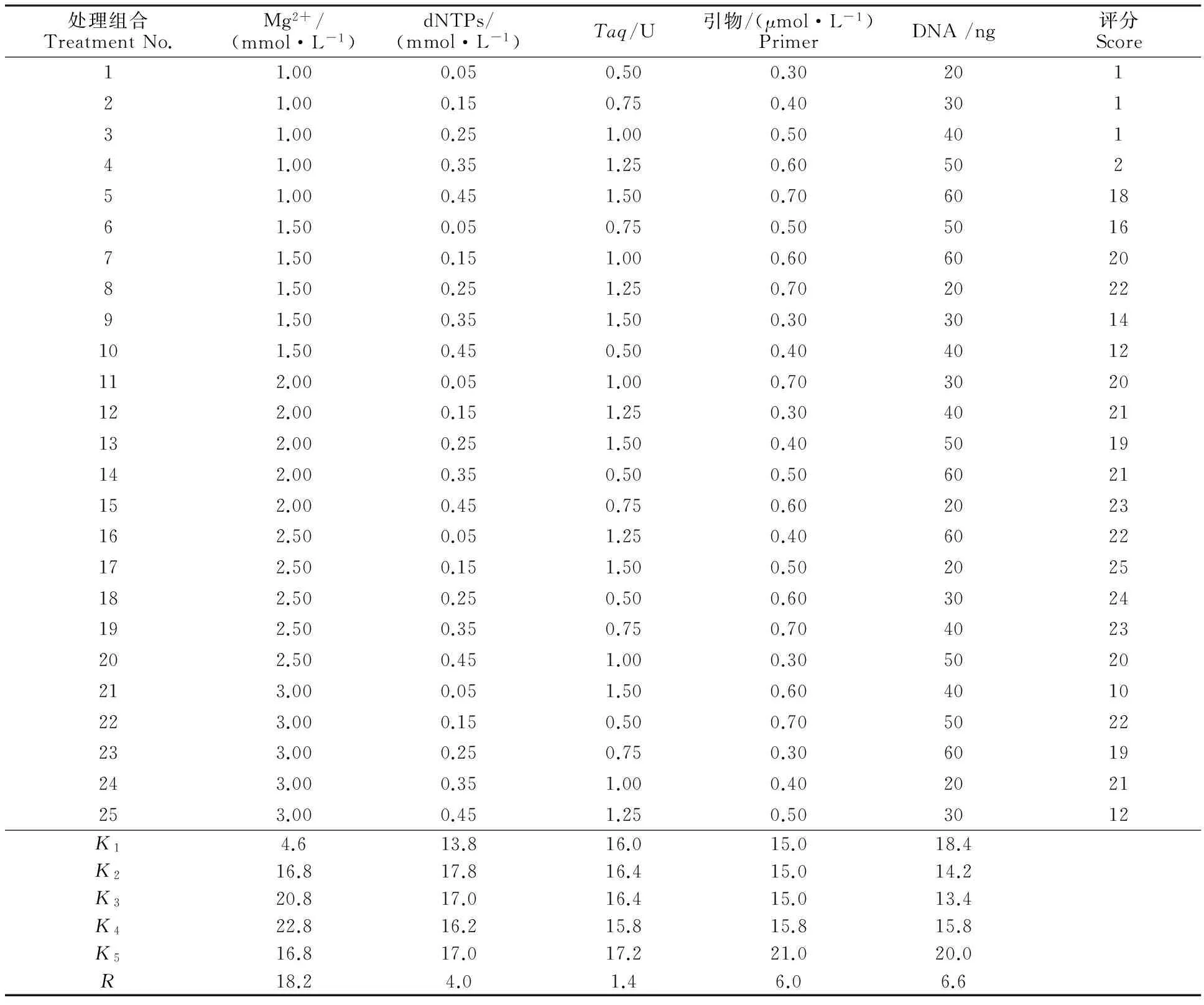
處理組合TreatmentNo.Mg2+/(mmol·L-1)dNTPs/(mmol·L-1)Taq/U引物/(μmol·L-1)PrimerDNA/ng評分Score11.000.050.500.3020121.000.150.750.4030131.000.251.000.5040141.000.351.250.6050251.000.451.500.70601861.500.050.750.50501671.500.151.000.60602081.500.251.250.70202291.500.351.500.303014101.500.450.500.404012112.000.051.000.703020122.000.151.250.304021132.000.251.500.405019142.000.350.500.506021152.000.450.750.602023162.500.051.250.406022172.500.151.500.502025182.500.250.500.603024192.500.350.750.704023202.500.451.000.305020213.000.051.500.604010223.000.150.500.705022233.000.250.750.306019243.000.351.000.402021253.000.451.250.503012K14.613.816.015.018.4K216.817.816.415.014.2K320.817.016.415.013.4K422.816.215.815.815.8K516.817.017.221.020.0R18.24.01.46.06.6
2.3引物篩選
根據(jù)正交試驗結(jié)果確定的籽用西瓜SCoT-PCR 最佳反應體系,以‘蘭州大板一號’基因組 DNA為模板,對41個引物進行篩選,篩選出條帶清晰、種間差異明顯、多態(tài)性好的 22個引物用于后續(xù)籽用西瓜的SCoT分析。22個引物擴增效果如圖2。
2.4最適退火溫度的篩選
利用優(yōu)化的 SCoT 體系對篩選出的每一個引物逐一進行退火溫度的篩選,根據(jù)(50±5) ℃的溫度設定范圍,PCR儀自動生成10個溫度梯度,分別為45.0 ℃、45.7 ℃、46.6 ℃、47.7 ℃、49.0 ℃、50.4 ℃、51.8 ℃、53.0 ℃、54.1 ℃、55.0 ℃。退火溫度的高低直接影響引物與模板DNA的特異性結(jié)合,當退火溫度過低時,非特異性擴增條帶的數(shù)目增加,當退火溫度過高時,引物與DNA模板的結(jié)合能力差,電泳條帶弱從而導致擴增失敗,而不同的引物退火溫度可能不同。根據(jù)電泳檢測結(jié)果,選擇擴增條帶數(shù)量多、條帶清晰的作為最適退火溫度,擴增效果相同的情況下選擇溫度高的作為最適退火溫度,以確保 PCR產(chǎn)物的特異性。其中引物S8和S26的擴增結(jié)果見圖3。由S8擴增結(jié)果可以看出,當退火溫度低于 47.7 ℃時,非特異性條帶較多,溫度為 47.7 ℃時條帶多且清晰,此后隨著退火溫度的升高特異性增強,條帶減少,由于 SCoT 的引物較短,溫度過高可能會影響其擴增效果,所以確定引物 S8 的最適退火溫度為47.7 ℃。由S26擴增結(jié)果可以看出,當退火溫度低于 49.0 ℃時,條帶弱且少,溫度為 49.0 ℃時條帶多且清晰,大于49.0 ℃時條帶減少,所以引物 S26 的最適退火溫度為49.0 ℃。各引物最適退火溫度見表3。
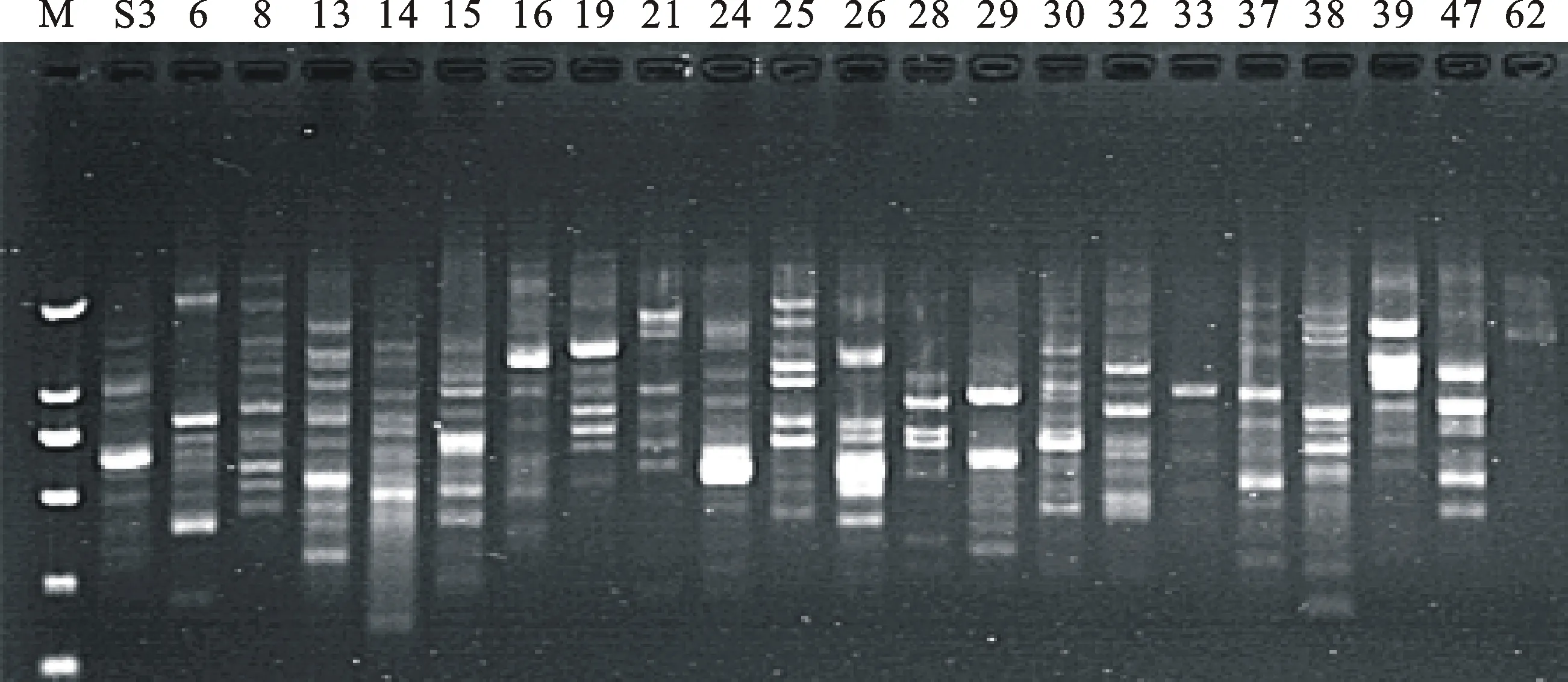
M.DL2000 marker;S3~S62.引物同表3 SCoT primers as table 3
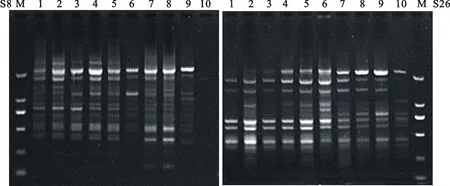
M.DL2000 marker;1~10:退火溫度 Annealing temperatures 45.0, 45.7, 46.6, 47.7, 49.0, 50.4, 51.8, 53.0, 54.1,55.0 ℃
2.5籽用西瓜SCoT-PCR反應體系的驗證
選用S8、S19、S21等多個引物及其最適退火溫度,對已優(yōu)化的籽用西瓜SCoT-PCR反應體系進行多次重復驗證,結(jié)果表明,所用引物均能在供試材料中擴增出清晰度高、分散性好、多態(tài)性高、亮度適中、重復性好的條帶。如引物S8在22份供試材料中能擴增出清晰可見、分散性好、重復性高的條帶(圖4)。由此可見,優(yōu)化的反應體系穩(wěn)定性好、多態(tài)性好、重復性高、擴增效果良好,適用于籽用西瓜的多方面研究,能滿足諸如遺傳多樣性分析、種質(zhì)鑒定、指紋圖譜構建等方面的需要,為SCoT標記在籽用西瓜中的應用奠定基礎。
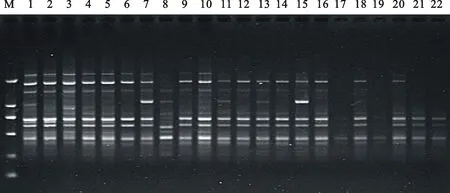
M.DL2000 marker;1~22.處理編號,同表1 Code is the same as table 1
3討論與結(jié)論
隨著功能基因組學和生物信息學的發(fā)展,目的基因分子標記越來越受到研究者重視,因其本身可能是目的基因的一部分或與目的基因緊密連鎖,這樣通過對某個分子標記篩選即能對性狀進行篩選,從而加速育種進程。為此,建立一種簡單、有效和實用的目的基因分子標記技術對籽用西瓜遺傳育種研究等方面有著重要意義。SCoT 標記作為一種基于 PCR 技術的新型分子標記具有諸多優(yōu)點,能更好地反應物種的遺傳多樣性和親緣關系。
SCoT 標記作為一種新型的目的基因分子標記,雖然在多種植物上證明具有操作簡單、重復性好、引物通用性強的優(yōu)點,但對于不同材料所適用的反應體系仍有很大不同,因此,采用 SCoT 分子標記時應首先對其反應體系進行優(yōu)化。本試驗利用正交設計方法,對籽用西瓜SCoT-PCR 反應體系中的Mg2+、dNTPs、Taq酶、引物及模板 DNA 等主要因素的影響進行了研究,發(fā)現(xiàn)各因素對反應體系的影響程度大小為 Mg2+>模板DNA>引物>dNTPs>Taq酶,且各因素下不同水平間及各因素間差異均未達顯著水平,而且經(jīng)過比較此標記下不同的試驗材料均有較為明顯的差異。侯小改等[9]、龍治堅等[17]、王玉等[18]和姜小風等[16]對牡丹、芥菜、玫瑰和葡萄的研究中,均認為Mg2+是影響SCoT-PCR反應體系最主要的因素,這與本研究結(jié)果相一致。研究認為Mg2+濃度對TaqDNA聚合酶的活性起決定作用,當其濃度過低時,酶活力明顯降低,濃度過高則催化非特異片段的擴增[19]。本試驗結(jié)果與該結(jié)論相符,并表明籽用西瓜在SCoT-PCR擴增上需要較高濃度的Mg2+。
目前,SCoT分子標記在瓜類上的應用僅局限于絲瓜,在有關籽用西瓜SCoT-PCR反應優(yōu)化體系建立上還未見報道。蔣雅琴等[20]建立的絲瓜SCoT-PCR的反應體系為總體積20 μL中含Mg2+2.0 mmol·L-1、dNTPs 0.5 mmol·L-1、引物 0.5 μmol·L-1、模板DNA 50 ng、Taq酶 1.0 U。本體系的成分含量與其相比,引物濃度相同,Mg2+、Taq酶濃度略高,dNTPs和模板DNA濃度是其含量的近1/3,說明在籽用西瓜SCoT-PCR體系中,用較低濃度的dNTPs和模板DNA就能起到相同的效果。由此可知,本試驗得出的反應體系從經(jīng)濟角度和實驗操作等方面均達到了最優(yōu)效果,從而降低試驗成本并且證實了本試驗的成功。
SCoT分子標記的引物在不同植物中具有一定的通用性。侯小改等[9]、趙瑞強等[10]、楊祥燕等[12]及陳虎等[13]已驗證Collard等[3]開發(fā)的SCoT-PCR引物在牡丹、石斛、番木瓜及龍眼中的通用性。本試驗利用 ‘蘭州大板一號’基因組DNA為模板,從Collard等[3]報道的一部分SCoT引物中篩選 22 個適于籽用西瓜 SCoT 分析的引物,驗證了SCoT分子標記的引物具有一定的通用性。本試驗對篩選出的引物逐一進行退火溫度的優(yōu)化,發(fā)現(xiàn)不同的引物最適退火溫度不同,范圍從 46.6 ℃ 到 55.0 ℃,而不同于其他植物的引物均采用單一退火溫度。
綜上所述,該試驗建立并優(yōu)化了籽用西瓜SCoT-PCR的最佳反應體系為總體積20 μL中含Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.5 μ mol·L-1、模板DNA 20 ng。從41條引物中初步篩選出22條符合多態(tài)性要求的SCoT引物,并利用不同的籽用西瓜品種和引物對優(yōu)化出的籽用西瓜SCoT-PCR的最佳反應體系進行了驗證,得到多態(tài)性高、重復性好的條帶,大小為250~2 500 bp,驗證了其穩(wěn)定性及可靠性。為后期籽用西瓜種質(zhì)資源的遺傳多樣性分析、遺傳資源評價分析、圖譜構建與種質(zhì)鑒定以及分子標記輔助育種等領域的應用提供技術支撐及理論依據(jù),也為此標記應用于其他植物的研究提供了借鑒。
參考文獻Reference:
[1]魏大釗,吳大康.西北的瓜[M].西安:陜西科學技術出版社,1985.
WEI D ZH,WU D K. The Melon in Northwest[M].Xi’an:Shaanxi Science and Technology Press,1985(in Chinese).
[2]張桂芬,張建農(nóng).西瓜種子大小的遺傳規(guī)律[J].江蘇農(nóng)業(yè)科學,2011,39(4):216-217.
ZHANG G F,ZHANG J N. Genetic patterns of the size of a watermelon seed [J].JiangsuAgriculturalScience,2011,39(4):216-217(inChinese).
[3]COLLARD B C Y,MACKILL D J. Start codon targeted ( SCOT) polymorphism: a simple,novel DNA marker technique for generating gene-targeted markers in plants[J].PlantMolecularBiologyReporter,2009,27(1):86-93.
[4]熊發(fā)前,唐榮華,陳忠良,等.目標起始密碼子多態(tài)性(SCoT):一種基于翻譯起始位點目的基因標記技術[J].分子植物育種,2009,7(3):635-638.
XIONG F Q,TANG R H,CHEN ZH L,etal.SCoT: anovel gene targeted marker technique based on the translation start codon[J].MolecularPlantBreeding,2009,7(3):635-638(in Chinese with English abstract).
[5]韓國輝.基于EST-SSR、Genomic-SSR和SCoT標記的柑橘連鎖圖譜構建及雜種和多倍體遺傳分析[D].重慶:西南大學,2012.
HAN G H.Construction of molecular linkage map and genetic analysis of hybrids and polyploidy of citrus based on EST-SSR,genomic-SSR and SCoT markers[D].Chongqing:Southwest University,2012(in Chinese with English abstract).
[6]LUO C,HE X H,CHEN H,etal. Genetic diversity of mango cultivars estimated using SCoT and ISSR markers[J].BiochemicalSystematicsandEcology,2011,39(4):676-684.
[7]秦國新,何橋,梁國魯,等.草莓屬植物SCoT分析體系的建立及優(yōu)化[J].果樹學報,2012,29(3):393-397.
QIN G X,HE Q,LIANG G L,etal. Establishment and optimization of SCoT-PCR system inFragaria[J].JournalofFruitScience,2012,29(3):393-397(in Chinese with English abstract).
[8]張君玉,郭大龍,龔瑩,等.葡萄目標起始密碼子多態(tài)性反應體系的優(yōu)化[J].果樹學報,2011,28(2):209-214.
ZHANG J Y,GUO D L,GONG Y,etal. Optimization of start codon targeted polymorphism PCR(SCoT-PCR) system inVitisvinifera[J].JournalofFruitScience,2011,28(2):209-214(in Chinese with English abstract).
[9]侯小改,王娟,賈甜,等.牡丹SCoT 分子標記正交優(yōu)化及引物篩選[J].華北農(nóng)學報,2011,26(5):92-96.
HOU X G,WANG J,JIA T,etal.Orthogonal optimization of SCoT- PCR system and primer screening of tree peony[J].ActaAgriculturaeBoreali-Sinica,2011,26(5):92-96(in Chinese with English abstract).
[10]趙瑞強,高燕會,章曉玲,等.鐵皮石斛 SCoT-PCR 反應體系構建及優(yōu)化[J].核農(nóng)學報,2012,26(4):648-655.
ZHAO R Q,GAO Y H,ZHANG X L,etal. Establishment and optimization of SCoT-PCR reaction system for Dendrobium officinale[J].JournalofNuclearAgriculturalSciences,2012,26(4):648-655(in Chinese with English abstract).
[11]龍治堅.枇杷屬植物的遺傳多樣性分析和指紋圖譜初步構建[D].重慶:西南大學,2013.
LONG ZH J.Genetic diversity analysis and fingerprint construction ofEriobotryabased on SSR and SCoT markers[D].Chongqing: Southwest University,2013(in Chinese with English abstract).
[12]楊祥燕,蔡元保,郭凌飛,等.番木瓜SCoT反應體系建立及引物篩選[J].熱帶亞熱帶植物學報,2012,20(6):578-584.
YANG X Y,CAI Y B,GUO L F,etal.Establishment of SCoT amplification system and primer selection forCaricapapaya[J].JournalofTropicalandSubtropicalBotany,2012,20(6):578-584(in Chinese with English abstract).
[13]陳虎,何新華,羅聰,等.龍眼24個品種的SCoT遺傳多樣性分析[J].園藝學報,2010,37(10):1651-1654.
CHEN H,HE X H,LUO C,etal.Analysis on the genetic diversity of 24 longan(Dimocarpuslongan)accessions by SCoT markers[J].ActaHorticulturaeSinica,2010,37(10):1651-1654(in Chinese with English abstract).
[14]韓國輝,汪衛(wèi)星,向素瓊,等.多倍體枇杷 SCoT分析體系的建立與優(yōu)化[J].果樹學報,2011,28(3):433-437.
HAN G H,WANG W X,XIANG S Q,etal.Establishment and optimization of SCoT system in polyploidy loquats[J].JournalofFruitScience,2011,28(3):433-437(in Chinese with English abstract).
[15]何正文,劉運生,陳立華,等.正交設計直觀分析法優(yōu)化PCR條件[J].湖南醫(yī)科大學學報,1998,23(4):403-404.
HE ZH W,LIU Y SH,CHEN L H,etal.Orthogonal design-direct analysis for PCR optimization[J].BulletinofHunanMedicalUniversity,1998,23(4):403-404(in Chinese with English abstract).
[16]姜小鳳,高燕會,童再康,等.石蒜屬植物SCoT-PCR反應體系構建及優(yōu)化[J].浙江農(nóng)林大學學報,2013,30(3):444-452.
JIANG X F,GAO Y H,TONG Z K,etal.Establishing and optimizing a SCoT-PCR system forLycoris[J].JournalofZhejiangA&FUniversity,2013,30(3):444-452(in Chinese with English abstract).
[17]龍治堅,王瑩,韓國輝,等.芥菜SCoT分析體系的建立與優(yōu)化[J].西南大學學報(自然科學版),2013,35(4):20-25.
LONG ZH J,WANG Y,HAN G H,etal.Establishment and optimization of SCoT system of mustard[J].JournalofSouthwestUniversity(NaturalScienceEdition),2013,35(4):20-25 (in Chinese with English abstract).
[18]王玉,趙蘭勇,申宏偉,等.玫瑰SCoT-PCR反應體系優(yōu)化及引物篩選[J].北方園藝,2014(23):91-96.
WANG Y,ZHAO L Y,SHEN H W,etal.Optimization for SCoT-PCR systemand primer selection ofRosarugosa[J].NorthernHorticulture,2014(23):91-96(in Chinese with English abstract).
[19]周靜,陳書霞,程智慧,等.大蒜SSR體系的建立與優(yōu)化[J].西北農(nóng)業(yè)學報,2011,20(11):117-122.
ZHOU J,CHEN SH X,CHENG ZH H,etal.Establishment and optimization of SSR reaction system in garlic[J].ActaAgriculturaeBoreali-occidentalisSinica,2011,20(11):117-122(in Chinese with English abstract).
[20]蔣雅琴,黎炎,李文嘉,等.SCoT分子標記技術在絲瓜上的應用[J].南方農(nóng)業(yè)學報,2014,45(12):2117-2122.
JIANG Y Q,LI Y,LI W J,etal.Application of SCoT markers on genetic diversity analysis ofLuffaMill[J].JournalofSouthernAgriculture,2014,45(12):2117-2122(in Chinese with English abstract).
Received 2015-09-29Returned2015-10-09
First authorYANG Jing,female,master student.Research area: germplasm resources and germplasm innovation.E-mail:964054378@qq.com
(責任編輯:潘學燕Responsible editor:PAN Xueyan)
Optimization for SCoT-PCR System and Primer Selection of Seed-used Watermelon
YANG Jing, WANG Ping and SHI Lei
(Key Laboratory of Wild Vegetable Germplasm Resources and Innovation,College of Agronomy,Inner Mongolia Agricultural University, Huhhot010019,China)
AbstractAn orthogonal design L25(56) was used to optimize SCoT-PCR (start codon targeted polymorphism) amplification system of seed-used watermelon in five factors such as Taq DNA polymerase, Mg2+, DNA template, dNTPs and primer concentrations).The results showed that the optimized system was 2.5 mmol·L-1Mg2+, 0.15 mmol·L-1dNTPs, 1.5 U Taq polymerase, 0.5 μmol·L-1primer, 20 ng DNA template in 20 μL mixture.Each factor had different effect on the results.The concentration of Mg2+was the key factor affecting the SCoT-PCR system.The optimized SCoT-PCR system was tested on 22 seed-used watermelons,and the result was stable and reliable.From the 41 primer combinations tested, 22 were selected with clear band patterns and abundant polymorphism.The most suitable annealing temperature of primers was selected.The optional reaction system provide a new technology for evaluation of genetic diversity, construction of fingerprinting, germplasm identification and molecular marker assisted breeding on seed-used watermelon.
Key wordsSeed-used watermelon; SCoT-PCR; Reaction optimization; Orthogonal design
收稿日期:2015-09-29修回日期:2016-10-09
基金項目:內(nèi)蒙古自然科學基金(2016MS0356);內(nèi)蒙古科技計劃項目(20090707,2010704,20110711,20120212);內(nèi)蒙古高寒地區(qū)高產(chǎn)安全蔬菜生產(chǎn)的研究與創(chuàng)新項目(NDPYTD2013-3)。
通信作者:王萍,女,副教授,碩士生導師,主要從事種質(zhì)資源與種質(zhì)創(chuàng)新研究。E-mail: wangping@imau.edu.cn
中圖分類號S651
文獻標志碼A
文章編號1004-1389(2016)06-0889-08
Foundation itemInner Mongolia Natural Science(No.2016MS0356);Science and Technology Plan Projects in Inner Mongolia(No.20090707,2010704,20110711,20120212);Alpine Region of Inner Mongolia High Security Research and Innovation of Vegetable Production(No.NDPYTD2013-3). WANG Ping, female, associate professor,master’s supervisor.Research area:germplasm resources and germplasm innovation.E-mail: wangping@imau.edu.cn
網(wǎng)絡出版日期:2016-06-01
網(wǎng)絡出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0919.030.html
第一作者:楊靜,女,碩士研究生,從事蔬菜種質(zhì)資源與種質(zhì)創(chuàng)新研究。E-mail:964054378@qq.com

