海岸鹽沼濕地可培養硫酸鹽還原菌多樣性及其時空變化規律
公丕賢+幸穎+薛雅蓉+劉常宏

摘要:為了揭示鹽沼濕地生態系統中可培養硫酸鹽還原菌(sulfate-reducing bacteria,SRB)的多樣性及其時空變化規律,探討大米草與互花米草定植對SRB多樣性及種群數量的影響,采用選擇性培養基培養方法及16S rRNA基因序列分析技術,定性、定量分析江蘇射陽海岸鹽沼濕地可培養SRB的多樣性及種群數量。結果共獲得210株硫酸鹽還原菌,歸屬于變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、放線菌門(Actinobacteria)的17個屬,其中假單胞菌屬(Pseudomonas)為優勢類群;發現了一些未見報道的新SRB種屬,如Agromyces、Brachybacterium、Oceanimonas、Microbulbifer、Photobacterium、Sporosarcina和Tetrathiobacter等;鹽沼濕地可培養SRB多樣性及種群數量受季節變化而改變;定植米草直接或通過改變土壤性質而間接影響鹽沼濕地可培養SRB多樣性及種群數量。SRB是鹽沼生態系統的重要組成部分,其種群多樣性、數量及分布受生物、非生物因素的影響。
關鍵詞:鹽沼濕地;硫酸鹽還原菌;種群;米草;互花米草
中圖分類號:Q938.1;S182
文獻標志碼: A
文章編號:1002-1302(2016)04-0457-06
硫酸鹽還原菌(sulphate-reducing bacteria,SRB)是一類厭氧原核微生物,具有利用惰性硫酸鹽作為呼吸代謝的最終電子受體、氧化有機物或無機物而獲得能量、異化產生具有化學性質活潑的H2S的能力。SRB是生物圈中起源較早的生物類群,在硫元素的生物地球化學循環、有機物質降解、溫室氣體釋放(與甲烷產生菌共同作用)、金屬離子還原、含氯化合物生物處理等方面發揮作用[1-7]。
鹽沼濕地(salt marsh)是世界上生產力最高的生態系統,其初級生產力為460~3 700 g/(cm2·年)。米草,特別是互花米草(Spartina alterniflora)是鹽沼濕地生態系統中的先鋒植物,除少量的米草及其代謝產物進入海水外,絕大部分則留在了濕地的沉積物中,并通過發酵、厭氧呼吸而分解。與有氧呼吸、反硝化作用和金屬還原途徑相比,目前認為由SRB介導的硫酸鹽還原是鹽沼濕地土壤的主要呼吸途徑,占鹽沼濕地土壤總呼吸的67%~80%[8]。
SRB是鹽沼濕地生態系統中的優勢功能類群,它在鹽沼濕地物質循環過程中扮演重要角色[9]。目前有關鹽沼濕地SRB多樣性的研究多基于對16S rRNA基因序列或異化的亞硫酸鹽還原酶(dissimilatory sulfite reductase,Dsr)基因序列分析結果,對于可培養的SRB多樣性研究報道較少,而可培養SRB的獲得是認知生態系統中SRB多樣性及功能的關鍵。為此,本研究以江蘇射陽海岸鹽沼濕地為對象,采用選擇性培養基培養的方法研究不同季節、不同米草定植以及不同土壤深度SRB的多樣性及種群數量分布規律,為深入了解鹽沼濕地生態系統中硫循環生物驅動機理提供新的參考依據。
1 材料與方法
1.1 選擇培養基組成
選擇性培養基[10-13]組成:0.33 g乙酸鈉,230 μL無水乙醇,0.12 g苯甲酸鈉,0.45 g乳酸鈉,0.19 g丙酸鈉,15 g NaCl,6.8 g MgSO4·7H2O,5.7 g MgCl2·6H2O,0.09 g KBr,0.7 g KCl,0.25 g NH4Cl,0.2 g KH2PO4,1.5 g CaCl2·2H2O,2.52 g NaHCO3,0.1 g酵母膏,1.66 g Fe(NH4)2(SO4)2·6H2O,20 g瓊脂,定容至1 L,調節pH值為7.0,1×105 Pa滅菌30 min。
1.2 樣品采集
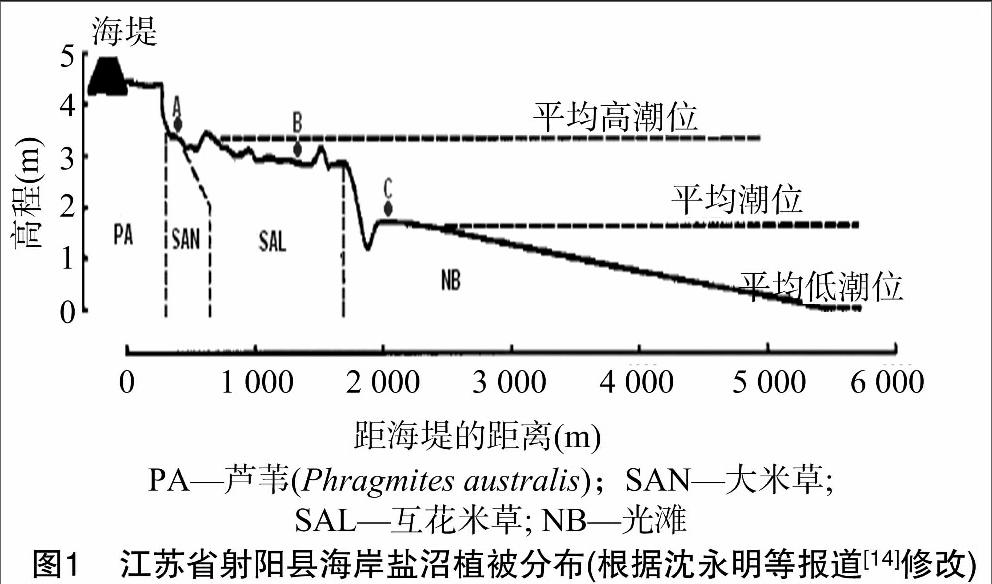
如圖1,樣點A為大米草(Spartina anglica)地,B為互花米草地,C為無植被光灘(naked beach)。A、B、C樣地沿著潮汐溝,垂直于海岸線呈地帶性分布。取樣時間分別為米草生長初期(5月)、揚花期(9月)、成熟期(11月)。每個樣點隨機選取3個1 m ×1 m的樣方,樣方間距10 m以上。樣方內分別取0~5 cm、5~10 cm 2個深度的土壤樣品各100 g左右,置于聚丙烯塑料樣品袋中,立即帶回實驗室,在超凈工作臺中將每個樣地的3個樣方土壤樣品充分混勻,即每個樣地最終得到2個深度共2份土樣,于4 ℃保存。
1.3 土壤理化性質的測定
按照GB 7833-1987《森林土壤含水量的測定》,分別測定土壤含水量、pH值[15]。采用鉻酸鋇光度法測定土壤SO42-濃度[16-17]。土壤樣品中碳、氮元素含量用德國Heraeus公司的CHN-O-Rapid型元素分析儀測定;硫元素含量用ZCL自動定硫儀測定。
1.4 可培養SRB種群數量的測定
土壤樣品經系列稀釋后,涂布于選擇培養基上,然后置于密閉的干燥器中,采用燃燒蠟燭耗氧法去除干燥器中的氧氣,于30 ℃培養箱中培養24 h,菌落及其周圍變黑的即為硫酸鹽還原菌。統計各平板SRB菌落數,換算為單位質量土壤中的菌落數,單位CFU/g,。同時,根據菌落形態及生長差異純化SRB菌株。
1.5 16S rRNA基因序列分析
根據徐曉宇等方法[18],提取各SRB菌株的基因組DNA,并進行16S rRNA基因的PCR擴增。PCR擴增引物為8f[19]、907r[8]。反應條件為:95 ℃ 5 min;94 ℃ 30 s,57 ℃ 1 min,72 ℃ 1 min,25個循環;72 ℃ 10 min;4 ℃保存。PCR產物經1%瓊脂糖凝膠電泳檢測和膠回收后測序。采用序列圖譜軟件Chromas對所得序列進行核對,將序列相同的菌株合并為1個種,并選擇1個菌株的序列作為代表序列,使用BLASTN在GenBank+EMBL+DDBJ+PDB基因庫中對每株菌的16S rDNA序列進行同源性分析,同時選擇相似性較高的序列作為參比,用MEGA 5.0進行系統進化樹構建。
2 結果與分析
2.1 土壤理化性質
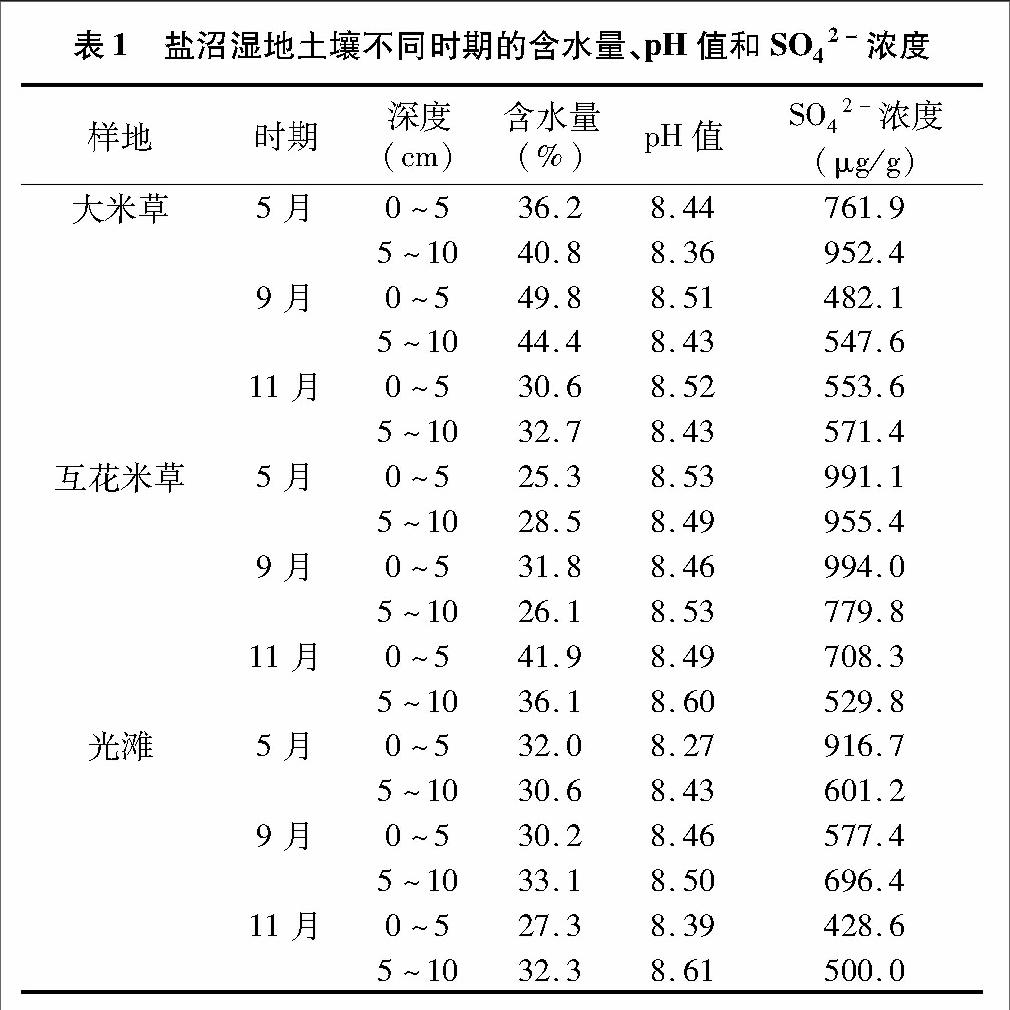
鹽沼濕地土壤含水量因季節、是否種植植物以及植物品種而異(表1)。大米草、互花米草種植土壤最大含水量分別發生在9月(44.4%~49.8%)、11月(36.1%~41.9%);而光灘土壤含水量隨季節變化不大(27.3%~33.1%)。相同季節不同土壤含水量有較大差異。5月、9月大米草土壤含水量(36.2%~49.8%)明顯高于互花米草土壤(25.3%~31.8%)、光灘土壤(30.2%~33.1%),而互花米草土壤在此期間含水量與光灘土壤相比偏低。11月,互花米草土壤含水量(36.1%~41.9%)明顯高于大米草土壤(30.6%~32.7%)、光灘土壤(27.3%~32.3%)。
雖然種植米草及季節變化對鹽沼濕地土壤pH值影響不大(表1),但是與光灘相比(5~10 cm>0~5 cm),互花米草定植土壤pH值的變化具有類似趨勢(5~10 cm>0~5 cm),而大米草定植土壤的pH值則隨深度加深而略有降低(5~10 cm<0~5 cm)。
鹽沼濕地土壤SO42-濃度隨季節變化而逐漸降低,而種植米草則能夠明顯提高鹽沼濕地土壤中的SO42-濃度(表1)。在相同月份,種植互花米草土壤SO42-濃度基本明顯高于種植大米草、光灘土壤。不同深度土壤中的SO42-濃度因定植植物品種而異:定植大米草土壤中的SO42-濃度隨深度加深而增加,而互花米草土壤則正好相反。
對9月份各土壤樣品的碳、氮、硫元素含量檢測結果顯示,與光灘土壤相比,定植米草可明顯提高表層土壤(0~5 cm)中這些營養元素的含量,而對深層土壤(5~10 cm)中的含量無明顯影響(表2)。
2.2 SRB種群結構
由于硫酸鹽還原菌還原SO42-的產物H2S可與培養基中Fe2+形成黑色沉淀FeS,因此平板上出現黑色菌落或菌落周圍變黑的即為SRB菌株。從大米草、互花米草和光灘土壤樣品中共分離獲得210株SRB。經基因序列同源性(>98%)比對和系統發育分析可知,這些菌株分布于17個屬,其中20株(R14、R15、R24、R27、R29)屬于厚壁菌門的2個屬Bacillus、Sporosarcina(相似性均達100%),27株(R6、R16、R18、R19、R21、R25、R30)屬于放線菌門的5個屬Agromyces、Brachybacterium、Dietzia、Micrococcus和Rhodococcus(相似性均達100%)。其他163株屬于變形菌門細菌,其中39株(R11、R13、R23、R28、R31)屬于α-變形菌綱的3個屬Paracoccus、Rhizobium、Rhodobacter(相似性均達100%),5株(R20)為β-變形菌綱的Tetrathiobacter屬(相似性達100%),119株屬于γ-變形菌綱6個屬Aeromonas(相似性100%)、Halomonas(相似性達100%)、Microbulbifer(相似性達99%)、Oceanimonas(相似性99%)、Photobacterium(相似性100%)和Pseudomonas(相似性達99%~100%)(圖2)。Pseudomonas屬細菌在3種土壤及不同季節中所占比例(28.90%~ 43.40%)明顯高于其他屬,為優勢種群(表3)。從大米草與互花米草定植土壤以及光灘土壤中分別分離到屬于11、16、12屬SRB,其中Agromyces、Bacillus、Halomonas、Oceanimonas、Microbulbifer、Pseudomonas、Photobacterium、Rhizobium和Rhodobacter為3種土壤共有。從各土壤樣品SRB的香農-威納指數分析結果(表3)來看,SRB多樣性大小為:大米草土壤>互花米草土壤>光灘,但是各取樣點土壤中香農-威納指數在不同季節變化不大。
2.3 SRB種群數量及結構的時空分布規律
鹽沼濕地土壤SRB種群數量因定植植物品種、季節變化以及深度而改變,定植米草土壤的SRB種群數量明顯高于光灘土壤(圖3)。在大米草、互花米草定植的淺層土壤(0~5 cm)中,SRB種群數量分別在9、11月到達最高值,而在深層土壤(5~10 cm)中均于11月到達最高值,其中5—9月,大米草定植土壤中SRB種群數量明顯高于互花米草定植土壤。
雖然Pseudomonas為3個樣地的優勢SRB類群,但不同采樣地點土壤樣品的亞優勢SRB仍有一定差異,如大米草定植土壤、互花米草定植土壤、光灘土壤的亞優勢種所屬屬別分別為Bacillus、Agromyces,Halomonas、Rhizobium,Rhizobium、Paracoccus(圖4)。
同一季節、同一SRB類群在不同土壤樣品中的分布比例也存在差異(圖4)。例如在5月,優勢類群Pseudomonas占互花米草定植土壤中總SRB的32.30%,較在大米草定植土壤、光灘土壤(約42%)約低10%;而Halomonas在互花米草定植土壤中的比例(26.70%)遠高于大米草定值土壤(5.30%)、光灘土壤(5.30%)。9月的結果與5月類似,Pseudomonas在大米草定植土壤中的比例(43.40%)高于互花米草定植土壤(28.90%)、光灘土壤(34.00%);Halomonas在互花米草定植土壤中的比例(22.60%)遠高于大米草定植土壤(5.90%)、光灘土壤(1.90%)。而到了11月,優勢種群Pseudomonas在光灘土壤中的比例明顯提高(38.60%),高于互花米草(31.70%)、大米草(31.8%)定植土壤中的比例。
SRB類群在不同土壤樣品中的分布也存在一定的專化性,只存在于某一種或某幾種土壤中(圖4)。例如,Tetrathiobacter只分布于大米草定植土壤,而Aeromonas、Dietzia、Sporosarcina則只分布于互花米草定植土壤中。此外,Rhodococcus只分布于米草定植土壤中,Brachybacterium、Micrococcus、Paracoccus分布于互花米草定植土壤、光灘土壤中,但在大米草定植土壤中沒有發現。
相同類型的SRB種群在同一土壤樣地中分布比例隨季節變化而改變(圖4)。例如Pseudomonas屬在5—9月是大米草定植土壤中的絕對優勢種群,但其種群數量到11月明顯降低,而Agromyces、Microbulbifer屬則不斷提高;在互花米草定植土壤中,Agromyces屬細菌數量隨季節變化而增加,而Rhodobacter則不斷下降,作為優勢種群的Pseudomonas在5、11月所占比例很高,在9月略有下降;在光灘土壤中,Agromyces、Pseudomonas在9月的比例低于5、11月,而Paracoccus、Rhizobium在9月的比例高于5、11月。上述結果顯示,鹽沼濕地SRB種群結構與數量隨季節而呈動態變化,米草的定植顯著改變了鹽沼濕地生態系統中SRB的種群結構及數量。
3 討論與結論
本研究利用選擇性培養基以及16S rRNA基因序列分析,從米草定植以及光灘土壤中共分離獲得210株可培養SRB,主要分屬于變形菌門、厚壁菌門、放線菌門的17個屬,其中Aeromonas、Bacillus、Dietzia、Halomonas、Micrococcus、Paracoccus、Pseudomonas、Rhizobium、Rhodobacter、Rhodococcus等屬已有報道[20-27],且都在兼性厭氧條件下有硫酸鹽還原活性,但Agromyces、Brachybacterium、Oceanimonas、Microbulbifer、Photobacterium、Sporosarcina、Tetrathiobacter等屬未見報道,但經本試驗研究表明,其可在培養基平板上產生H2S,具有硫酸鹽還原活性,可能為新的SRB類群。
Pseudomonas為優勢種群,這與房琳在十紅灘鈾礦床中分離的SRB優勢種群[28]一致,該研究采用燃燒蠟燭法,不能完全去除容器中的氧,分離到一些兼性厭氧和微好氧SRB菌株,沒有分離到如脫硫弧菌科(Desulfovibrionaceae)[4]、降硫細菌科(Desulfobacteriaceae)[29]等嚴格厭氧SRB。由美國材料實驗協會(ATSM)標準D2863-2000(石蠟)可知,蠟燭燃燒的臨界氧濃度為1.42~8.52 mg/L;張小里等研究表明,降硫弧菌屬SRB能夠耐受 4.5 mg/L的環境溶解氧濃度,而氧濃度到9.0 mg/L時不能存活[30],因此蠟燭燃燒法可以滿足SRB生長的氧化還原電位要求。Desulfovibrio的比較基因組結果顯示,該菌含有編碼還原酶Cyd的基因,因此可以產生抗分子氧的保護酶,可以在微好氧條件下生長[31]。本研究分離到的Bacillus、Pseudomonas、Rhizobium、Paracoccus、Rhodobacter等屬SRB中也檢測到了相應分子氧的還原酶[32-36]。房琳在有大量含氧水的氧化帶鈾礦中也分離到厭氧SRB菌株[28]。這些結果表明,耐氧或微好氧SRB可能是鹽沼濕地生態系統的重要成員,在驅動硫的化學循環中扮演著重要角色。
影響鹽沼濕地土壤中SRB種群數量及分布的因素很多,如溫度、土壤基質、植被等。Edgcomb等發現,SRB的種群數量、硫酸鹽還原速率在8月以后達到峰值[37];Nie等發現,揚子江河口三角洲鹽沼濕地硫酸鹽還原菌種群多樣性及數量在互花米草的生長后期(秋冬季)達到最高[38]。本研究進一步證明了鹽沼濕地可培養SRB種群數量隨季節變化較大,但季節對各個取樣點中SRB的種群多樣性影響不大。
通過比較不同深度土壤SRB數量,發現淺層土壤(0~5 cm)的SRB種群數量高于深層土壤(5~10 cm)。此外,土壤基質的性質也會對土壤中SRB種群產生一定的影響,例如土壤含水量、pH值、離子濃度、有機質含量等。大米草、互花米草定植土壤中的碳、氮、硫含量及SO42-濃度均明顯高于光灘,這些營養元素及底物濃度的增加可能是導致米草定植土壤SRB種群結構和數量顯著高于光灘土壤的主要原因。Wang等也報道了類似的現象,認為互花米草通過提高土壤中有機碳含量而促進SRB種群數量的增加[39]。土壤性質對硫酸鹽還原菌的種群構成也有一定影響,大米草土壤含水量高于互花米草、光灘土壤,對應的Pseudomonas、Agromyces、Bacillus屬的比例也較高;互花米草土壤中SO42-濃度明顯高于大米草、光灘土壤,對應的Halomonas、Oceanimonas、Rhizobium屬的比例也較高,這與不同種類微生物生長所需理化條件不同有關。據報道,海水及海岸鹽沼濕地中典型SRB的最適pH值為7.0~7.8[40],而取樣點土壤pH值為8.4左右,這就可能造成當地土壤酸堿度不適宜典型厭氧SRB生長,因此在本研究中未分離到。總之,射陽鹽沼濕地土壤理化性質的特殊可能造成了該地SRB種群結構的特異性。
土壤微生物種群結構及數量還受到定植植物品種影響[41]。米草的定植一方面提高了SRB的種群數量,另一方面又使土壤SRB的種群多樣性提高。不同種類米草定植對土壤中SRB種群結構影響不同,如互花米草定植后Aeromonas、Dietzia、Sporosarcina屬才在土壤中出現,而Tetrathiobacter只存在于大米草土壤。又如,大米草定植使Bacillus屬比例明顯升高,而使Rhizobium屬比例明顯降低,互花米草定植使Halomonas屬比例明顯升高而使Micrococcus屬比例明顯降低。可見不同植物定植對不同的SRB種群有影響。不同植物的定植會影響土壤理化性質,從而形成特定的生境系統,進而影響微生物種群結構[42],因此不同類型米草的定植就形成了當地植物-土壤系統的特異性,從而綜合影響SRB種群。
總之,鹽沼濕地土壤中SRB種群數量及分布受多種因素的影響,植物種類、季節變化以及深度等都會影響其動態變化規律。今后有必要針對優勢SRB類群,通過定量PCR技術和酶活檢測技術,進一步評估鹽沼濕地SRB在元素硫循環中的作用,探討SRB的生態學效應。
參考文獻:
[1]Castro H F,Williams N H,Ogram A. Phylogeny of sulfate-reducing bacteria1[J]. FEMS Microbiology Ecology,2000,31(1):1-9.
[2]Holmer M,Storkholm P.Sulphate reduction and sulphur cycling in lake sediments :a review[J].Freshwater Biology,2001,46(4):431-451.
[3]陳 效,孫立蘋,徐 盈,等. 硫酸鹽還原菌的分離和生理特性研究[J]. 環境科學與技術,2006,29(9):38-40.
[4]陳 濤,曹 毅,伊芬芬,等. 一株耐酸硫酸鹽還原菌的分離篩選及生理特性研究[J]. 四川大學學報:自然科學版,2006,43(2):451-457.
[5]李新榮,沈德中. 硫酸鹽還原菌的生態特性及其應用[J]. 應用與環境生物學報,1999(增刊1):10-13.
[6]呂 琴,陳中云,閔 航. 重金屬污染對水稻田土壤硫酸鹽還原菌種群數量及其活性的影響[J]. 植物營養與肥料學報,2005,11(3):399-405.
[7]孫翠霞,弓愛君,邱麗娜,等. 硫酸鹽還原菌對環境的影響及其應用[J]. 腐蝕科學與防護技術,2006,18(3):196-198.
[8]Klepac-Ceraj V,Bahr M,Crump B C,et al. High overall diversity and dominance of microdiverse relationships in salt marsh sulphate-reducing bacteria[J]. Environmental Microbiology,2004,6(7):686-698.
[9]Teske A,Dhillon A,Sogin M L. Genomic markers of ancient anaerobic microbial pathways:sulfate reduction,methanogenesis,and methane oxidation[J]. The Biological Bulletin,2003,204(2):186-191.
[10]Widdel F,Bak F. Gram-negative mesophilic sulfate-reducing bacteria[M]//Balows A,Truper H G,Dworkin M,et al. The Prokaryotes. New York:Springer,1992:3352-3378.
[11]So C M,Young L Y. Isolation and characterization of a sulfate-reducing bacterium that anaerobically degrades alkanes[J]. Applied and Environmental Microbiology,1999,65(7):2969-2976.
[12]Hines M E,Evans R S,Genthner B R,et al. Molecular phylogenetic and biogeochemical studies of sulfate-reducing bacteria in the rhizosphere of Spartina alterniflora[J]. Applied and Environmental Microbiology,1999,65(5):2209-2216.
[13]Sigalevich P,Meshorer E,Helman Y,et al. Transition from anaerobic to aerobic growth conditions for the sulfate-reducing bacterium Desulfovibrio oxyclinae results in flocculation[J]. Applied and Environmental Microbiology,2000,66(11):5005-5012.
[14]沈永明,劉詠梅,陳全站. 江蘇沿海互花米草(Spartina alterniflora Loisel)鹽沼擴展過程的遙感分析[J]. 植物資源與環境學報,2002,11(2):33-38.
[15]劉光崧. 中國生態系統研究網絡觀測與分析標準方法[M]. 北京:中國標準出版社,1996.
[16]邱勛鵬,黃承玲,鄢建平. 間接光度法測定水和廢水中硫酸鹽[J]. 理化檢驗:化學分冊,2003,39(12):711-712.
[17]孫智敏,張德強,孫漢文. 火焰原子吸收光譜法間接測定水中硫酸鹽[J]. 理化檢驗:化學分冊,2005,41(8):573-574.
[18]徐曉宇,閔 航,劉 和,等. 土壤微生物總DNA提取方法的比較[J]. 農業生物技術學報,2005,13(3):36.
[19]Blazejak A,Erséus C,Amann R,et al. Coexistence of bacterial sulfide oxidizers,sulfate reducers,and spirochetes in a gutless worm (Oligochaeta) from the Peru margin[J]. Applied and Environmental Microbiology,2005,71(3):1553-1561.
[20]Asaulenko L H,Abdulina D R,Purish L M. Taxonomic position of certain representatives of sulphate-reducing corrosive microbial community[J]. Mikrobiolohichnyǐ Zhurnal,2010,72(4):3-10.
[21]Nazina T N,Grigorian A A,Sue K F,et al. Phylogenetic diversity of aerobic saprotrophic bacteria isolated from the Daqing oil field[J]. Microbiology,2002,71(1):103-110.
[22]Zhou J M,Song Z Y,Yan D J,et al. Performance of a haloalkaliphilic bioreactor under different NO-3/SO2-4 ratios[J]. Bioresource Technology,2014,153(2):216-222.
[23]Vogel H,Bruschi M,Le Gall J. Phylogenetic studies of two rubredoxins from sulfate reducing bacteria[J]. Journal of Molecular Evolution,1977,9(2):111-119.
[24]Chen C,Ren N,Wang A,et al. Microbial community of granules in expanded granular sludge bed reactor for simultaneous biological removal of sulfate,nitrate and lactate[J]. Applied Microbiology and Biotechnology,2008,79(6):1071-1077.
[25]Kopriva S,Büchert T,Fritz G,et al. The presence of an iron-sulfur cluster in adenosine 5′-phosphosulfate reductase separates organisms utilizing adenosine 5′-phosphosulfate and phosphoadenosine 5′-phosphosulfate for sulfate assimilation[J]. The Journal of Biological Chemistry,2002,277(24):21786-21791.
[26]Medihala P G,Lawrence J R,Swerhone G D,et al. Effect of pumping on the spatio-temporal distribution of microbial communities in a water well field[J]. Water Research,2012,46(4):1286-1300.
[27]Koronelli T V,Komarova T I,Porshneva O V,et al. Extracellular metabolites of hydrocarbon-oxidizing bacteria as a substrate for sulfate reduction[J]. Prikladnaia Biokhimiia i Mikrobiologiia,2001,37(5):549-553.
[28]房 琳. 砂巖型鈾礦不同礦帶中可培養硫酸鹽還原菌類群及其分布[D]. 西安:西北大學,2009.
[29]Jackson K L,Whitcraft C R,Dillon J G. Diversity of desulfobacteriaceae and overall activity of sulfate-reducing microorganisms in and around a salt pan in a southern California coastal wetland[J]. Wetlands,2014,34(5):969-977.
[30]張小里,劉海洪,陳開勛,等. 硫酸鹽還原菌生長規律的研究[J]. 西北大學學報:自然科學版,1999,29(5):397-402.
[31]Ravcheev D A,Thiele I. Systematic genomic analysis reveals the complementary aerobic and anaerobic respiration capacities of the human gut microbiota[J]. Frontiers in Microbiology,2014,5:674.
[32]Larsson J T,Rogstam A,Von Wachenfeldt C. Coordinated patterns of cytochrome bd and lactate dehydrogenase expression in Bacillus subtilis[J]. Microbiology,2005,151(10):3323-3335.
[33]Cooper M,Tavankar G R,Williams H D. Regulation of expression of the cyanide-insensitive terminal oxidase in Pseudomonas aeruginosa[J]. Microbiology,2003,149(5):1275-1284.
[34]Lopez O,Morera C,Miranda-Rios J,et al. Regulation of gene expression in response to oxygen in Rhizobium etli:role of FnrN in fixNOQP expression and in symbiotic nitrogen fixation[J]. Journal of Bacteriology,2001,183(24):6999-7006.
[35]Otten M F,Stork D M,Reijnders W N,et al. Regulation of expression of terminal oxidases in Paracoccus denitrificans[J]. European Journal of Biochemistry/FEBS,2001,268(8):2486-2497.
[36]Roh J H,Kaplan S. Interdependent expression of the ccoNOQP-rdxBHIS loci in Rhodobacter sphaeroides 2.4.1[J]. Journal of Bacteriology,2002,184(19):5330-5338.
[37]Edgcomb V P,Mcdonald J H,Devereux R,et al. Estimation of bacterial cell numbers in humic acid-rich salt marsh sediments with probes directed to 16S ribosomal DNA[J]. Applied and Environmental Microbiology,1999,65(4):1516-1523.
[38]Nie M,Wang M,Li B. Effects of salt marsh invasion by Spartina alterniflora on sulfate-reducing bacteria in the Yangtze River estuary,China[J]. Ecological Engineering,2009,35(12):1804-1808.
[39]Wang M,Chen J K,Li B. Characterization of bacterial community structure and diversity in rhizosphere soils of three plants in rapidly changing salt marshes using 16S rDNA[J]. Pedosphere,2007,17(5):545-556.
[40]Vallero M V G,Lettinga G,Lens P N L. High rate sulfate reduction in a submerged anaerobic membrane bioreactor (SAMBaR) at high salinity[J]. Journal of Membrane Science,2005,253(1):217-232.
[41]Wardle D A,Bardgett R D,Klironomos J N,et al. Ecological linkages between aboveground and belowground biota[J]. Science,2004,304(5677):1629-1633.
[42]Kourtev P S,Ehrenfeld J G,Hggblom M. Exotic plant species alter themicrobial community structure and function in the soil[J]. Ecology,2002,83(11):3152-3166.張慶輝,劉興旺,賀曉慧,等. 包頭市南郊污灌區農田表層土壤鐠的平面空間分布特征[J]. 江蘇農業科學,2016,44(4):463-466.

