玉米Argoanute基因家族的全長cDNA克隆與表達分析
翟立紅+周蘭庭+韓鵬+騰峰
摘要:Argonaute(AGO)蛋白是小RNA分子誘導(dǎo)的沉默復(fù)合體(RISC)的核心因子,以玉米自交系B73為材料,利用RLM-RACE技術(shù),克隆得到玉米17個AGO基因的全長cDNA序列,發(fā)現(xiàn)6個成員具有5′非翻譯外顯子,可能其表達受此機制調(diào)控。同時,利用半定量RT-PCR對其在玉米幼苗不同根系組織(包括初生胚根、冠根、次生胚根和側(cè)根)進行表達分析,結(jié)果表明:未檢測到ZmAGO5b、ZmAGO18b表達,ZmAGO1a/b、ZmAGO2a、ZmAGO10在各類根系中高水平表達,其他11個ZmAGOs表達水平較低,因此揭示選擇性表達不同的ZmAGOs可能是不同類型的根系分化及其功能的精細調(diào)控所必需的。
關(guān)鍵詞:Argonaute基因;克隆;5′非翻譯外顯子;表達
中圖分類號: S513.01;Q785
文獻標(biāo)志碼: A
文章編號:1002-1302(2016)04-0041-04
在真核生物中,小RNA(small RNA:sRNA)介導(dǎo)轉(zhuǎn)錄水平、轉(zhuǎn)錄后水平以及染色質(zhì)水平的基因沉默。植物內(nèi)源 sRNA 包括microRNA (miRNA)和各類小干擾RNA(short interfering RNA,siRNA)[1]。在已知的由sRNA介導(dǎo)的基因表達調(diào)控途徑中,sRNA必須與Argonaute(AGO)蛋白形成沉默復(fù)合體(RNA-induced silencing complex:RISC)引導(dǎo)sRNA通過序列互補與靶標(biāo)(RNA或DNA)結(jié)合,進而降解mRNA、抑制翻譯或修飾染色質(zhì)[1]。由此可見,AGO蛋白是sRNA行使其功能的重要因子。Argonaute蛋白最初是在植物中發(fā)現(xiàn)的[2],是一類分子量較大、含有可變的N端、PAZ、MID和PIWI結(jié)構(gòu)域的蛋白質(zhì)[3-4],其中PAZ和PIWI屬于保守結(jié)構(gòu)域。在細菌和人類中的研究揭示了PAZ、MID、PIWI結(jié)構(gòu)域在小RNA調(diào)控途徑中的作用[5-6]。其中,MID結(jié)合小RNA的5′-磷酸端,使小RNA錨定在AGO蛋白上;PAZ識別小RNA突出的3′ 端[3-4];PIWI會形成一種類似于RNase H酶的折疊結(jié)構(gòu),具有內(nèi)源核酸酶的活性。有研究發(fā)現(xiàn),PIWI內(nèi)存在保守的活性位點Asp-Asp-His(DDH motif)[7],但DDH motif存在與否并不能完全代表AGO蛋白是否具有催化功能[8]。在擬南芥中,證實有催化功能的AGO蛋白有AtAGO1、AtAGO4、AtAGO7 和AtAGO10[9-13]。
不同物種中,AGO蛋白的數(shù)目不同。擬南芥基因組中注釋有10個AGO蛋白,水稻中有19個AGO蛋白,玉米中有17個AGO蛋白。擬南芥的AGO蛋白大致可分為三大類,AGO1、AGO5 和AGO10為第1類,AGO2、AGO3、AGO7為第2類,AGO4、AGO6、AGO8和AGO9為第3類[14]。Kapoor等把水稻和擬南芥AGO蛋白劃分為四大類,分別為AGO1、MEL1/AGO5、ZIPPY/AGO7和AGO4[15]。Zhai等將玉米中的AGO蛋白劃分為五大類,將與OsAGO18同源性較高的2個蛋白單獨劃為一類[16]。目前證實,植物中的AGO1主要參與miRNA通路,在植物的各個生長發(fā)育階段均起著重要的調(diào)控作用[9,17]。在擬南芥中,與AtAGO1親緣關(guān)系最近的AtAGO10突變后表現(xiàn)為莖尖分生組織發(fā)育異常,AtAGO1和AtAGO10競爭結(jié)合miR165/miR166,調(diào)節(jié)HD-ZIP Ⅲ 的表達,進而調(diào)節(jié)SAM發(fā)育和保持[18]。擬南芥中的AtAGO5僅在生殖組織中表達[19],與水稻中的OsMEL1表達相似[15]。AGO7在反式作用的短干擾RNA(trans-acting short interfering RNAs,tasiRNA)的形成及其功能途徑中起重要作用[12]。AtAGO2與AtAGO3結(jié)構(gòu)高度相似且功能冗余,AGO2在植物逆境環(huán)境下高效表達[15],暗示在抗逆過程中起重要作用。AGO4蛋白主要是圍繞RNA介導(dǎo)的DNA甲基化(RdDM)過程中的作用機制展開,在整個發(fā)育過程中均有較高水平表達[15]。AGO6、AGO4在DNA甲基化上存在部分功能冗余,最近的研究證實AtAGO6在擬南芥莖和根的分生組織中存在RNA介導(dǎo)轉(zhuǎn)錄水平基因沉默的功能[20]。AtAGO8、AtAGO9序列相似度很高,其中,AtAGO8在擬南芥所有組織中表達量均較低,被認為是一個假基因[21]。最近的報道發(fā)現(xiàn)擬南芥中的 AtAGO9 在胚珠和花藥中的表達量非常高[22]。而與AtAGO9高度同源的玉米AGO104基因,控制玉米的無融合生殖,在性母細胞旁的體細胞大量富集[23]。截至目前,植物不同根系中AGO基因家族的表達模式還未見報道。
玉米(Zea mays L.)是當(dāng)今世界最重要的糧、飼、能源、工業(yè)原料兼用的高產(chǎn)作物。根系是玉米重要的組織器官,在保持植株形態(tài)、水分和營養(yǎng)吸收與運輸、響應(yīng)植物對環(huán)境脅迫等方面起著重要的作用。本研究以玉米測序自交系B73為材料,選取玉米幼苗不同根系組織包括初生胚根、冠根、次生胚根和側(cè)根對17個AGO基因進行表達分析,為探索AGO基因在根系形態(tài)建成方面的調(diào)控機制奠定基礎(chǔ),與此同時,利用RACE技術(shù)對玉米17個AGO基因的全長cDNA進行克隆測序分析,以完善玉米AGO基因的序列信息,為全面解析玉米的AGO基因提供基礎(chǔ)。
1 材料與方法
1.1 供試材料
本試驗選用的材料玉米自交系B73,為美國優(yōu)良自交系,配合力好,具有參考基因組序列。
選取大小均勻、籽粒飽滿的玉米B73種子用15%的H2O2浸泡30 min進行表面消毒處理后,滅菌蒸餾水沖洗3次,播種于沙缽中(沙子高壓滅菌),室內(nèi)培養(yǎng)。當(dāng)初生胚根和次生胚根長出時,分別取樣,最后取側(cè)根、冠根,每種根系取樣不少于3株,液氮速凍,-80 ℃冰箱保存。
1.2 方法
1.2.1 全長cDNA克隆 使用FirstChoice RLM-RACE(Ambion公司)試劑盒(貨號:AM1700)對玉米中鑒定到的ZmAGO基因進行5′末端和3′ 末端的擴增,試驗步驟嚴格按照說明書執(zhí)行,5′-RACE和3′-RACE所用的巢式引物見Zhai等發(fā)表的文章[16],最后一步擴增得到的PCR產(chǎn)物進行瓊脂糖凝膠電泳,將目的條帶切膠回收,連接至pGEM-T Easy載體(Promega公司),4 ℃連接過夜后進行轉(zhuǎn)化,篩選約10個陽性克隆送至Invitrogen公司進行菌液測序。
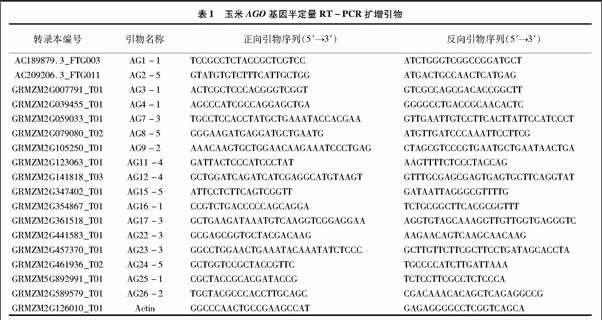
1.2.2 半定量RT-PCR 以Zhai等報道的17個玉米AGO基因家族[16]作為研究對象,利用NCBI網(wǎng)站上在線工具 Primer-Blast 進行基因特異引物設(shè)計(http://www.ncbi.nlm.nih.gov),擴增產(chǎn)物進行測序以確保擴增片段的特異性,所使用的引物信息見表1,以Actin(NM_001155179)作為內(nèi)參基因,進行玉米AGO基因家族成員的半定量RT-PCR。首先用內(nèi)參引物對4個組織的cDNA進行不同循環(huán)數(shù)目的PCR擴增,確定處于指數(shù)擴增期的循環(huán)數(shù)并調(diào)整模板加入體積使其在相同的循環(huán)數(shù)下亮度一致,然后利用內(nèi)參調(diào)好的模板體積進行基因擴增,此時同樣要進行指數(shù)擴增期循環(huán)數(shù)的確定,最終得出不同基因在不同組織中的相對表達水平。
2 結(jié)果與分析
2.1 AGO家族基因的全長cDNA克隆及分析
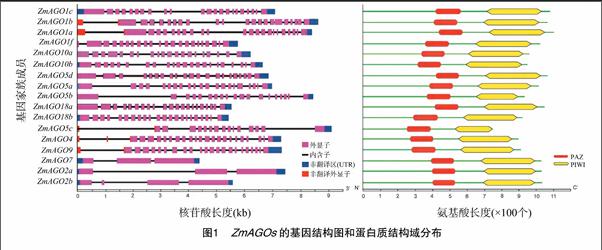
基于所預(yù)測的基因序列設(shè)計基因特異性引物,使用RACE技術(shù)擴增所有17個基因的全長cDNA,我們共得到了11個ZmAGOs的5′末端和17個ZmAGOs的3′末端。大多數(shù)基因的轉(zhuǎn)錄本與B73 RefGen v2所預(yù)測的相似,但ZmAGO1b與B73 RefGen v2 所預(yù)測的基因結(jié)構(gòu)存在較大差異,實際擴增所得到的5′-UTR第1個184 bp長度的非編碼外顯子(untranslated exon)位于預(yù)測基因的第1內(nèi)含子區(qū)域,起始密碼子后移15 bp,說明該基因可能存在多個選擇性剪切轉(zhuǎn)錄本。通過序列分析發(fā)現(xiàn),ZmAGO1a/b/f、ZmAGO5c、ZmAGO4、ZmAGO9存在5′非編碼外顯子,有可能這6個ZmAGO基因受該機制調(diào)控。
2.2 AGO家族基因在不同類型根組織中的表達分析
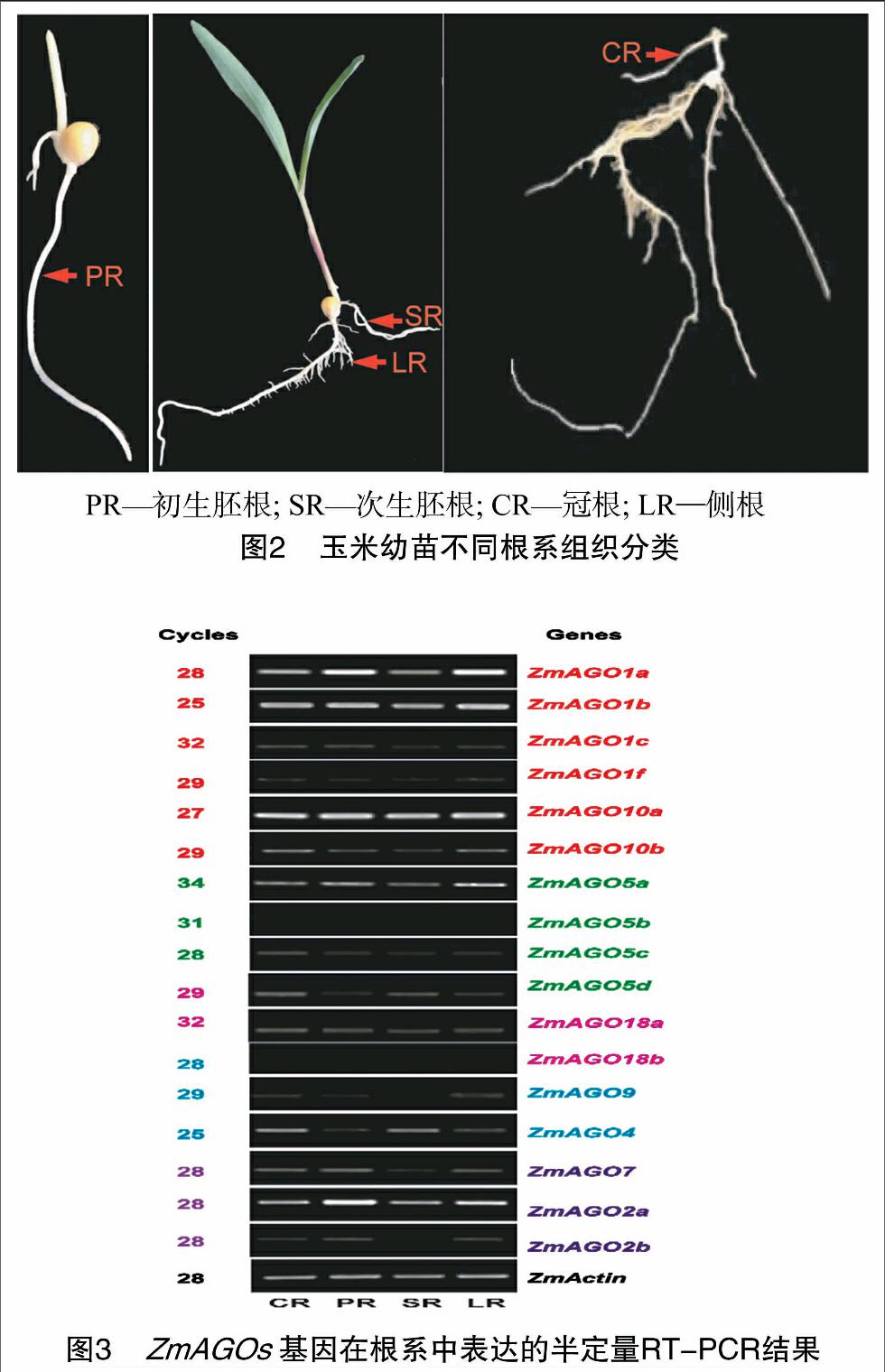
為詳細鑒定ZmAGOs基因在各類根系組織中的表達,將各類根組織細分為:冠根、初生胚根、次生胚根、側(cè)根并分別取樣(圖2)。圖3的RT-PCR結(jié)果表明:ZmAGO5b和 ZmAGO18b 在被測的玉米根系組織中未檢測到表達,15個ZmAGOs在玉米根系組織中表達,其中ZmAGO1a、ZmAGO1b、ZmAGO2a、ZmAGO10在各類根系都高水平表達,暗示這些基因在玉米根系發(fā)育中的重要作用;其他11個ZmAGOs基因的表達水平則相對較低。另外,有些ZmAGOs基因也顯示出其在不同類型根組織中表達的特異性,如ZmAGO2b、ZmAGO9在冠根、初生胚根和側(cè)根中表達,但在次生胚根中未檢測到其表達;ZmAGO5d、ZmAGO4則在冠根、次生胚根和側(cè)根中表達,但在初生胚根中未檢測到其表達。不同類型的根組織中大多數(shù)ZmAGOs基因具有相似的表達模式,說明這些ZmAGOs基因是各種根系組織生長發(fā)育共同需要的,以保持根系的基本組織特性;而不同類型的根組織表達不同的ZmAGOs基因,說明選擇性地表達不同的ZmAGOs基因可能是不同類型的根系分化及其功能的精細調(diào)控所必需的。
2.3 ZmAGOs與OsAGOs的微共線性分析
通過微共線性分析發(fā)現(xiàn)(圖4),玉米第10染色體的ZmAGO1c、ZmAGO2b,第2染色體的ZmAGO2a和ZmAGO1b與水稻第4染色體的OsAGO1b、OsAGO2的片段高度同源;玉米第9染色體的ZmAGO10a,第6染色體的ZmAGO10b與水稻第6染色體的OsPNH1高度同源;玉米第2染色體的ZmAGO18a,第1染色體的ZmAGO18b與水稻第7染色體的OsAGO18高度同源。由此推測玉米和水稻分化后,可能玉米的部分基因組序列發(fā)生了重復(fù)或加倍。
3 討論
小RNA介導(dǎo)的基因沉默在植物的生長發(fā)育和抗逆脅迫響應(yīng)等方面均發(fā)揮重要作用,RISC作為小RNA 行使功能的主要組分,AGO蛋白是核心元件,甚至有學(xué)者認為研究AGO蛋白所結(jié)合的小RNA的表達量比整體研究小RNA的表達量更能說明某種小RNA的功能[24]。近年來,在植物中開展關(guān)于AGO蛋白功能及其結(jié)合的小RNA類型的研究越來越多,使得AGO蛋白的研究成為小RNA調(diào)控途徑的熱點。目前,AGO基因的功能在模式植物擬南芥中的研究最為全面和透徹,而在玉米中的報道較少。Qian等利用B73 RefGen v1的基因組序列對玉米全基因組的AGO蛋白進行了預(yù)測和表達分析,結(jié)果顯示,玉米基因組存在18個AGO基因,并以玉米幼苗為材料對AGO基因家族在干旱和鹽脅迫下的表達模式進行了分析[25]。許鑫等以玉米自交系昌7-2為材料,研究了6個AGO基因在玉米幼苗第1葉、第2葉、第3葉、第4葉、總根、莖尖和胚芽鞘中的表達情況[26]。Zhai等利用B73 RefGen v2基因組序列發(fā)現(xiàn)了17個編碼AGO蛋白的基因,并選取了8個包含營養(yǎng)組織和生殖組織的材料進行了表達分析,結(jié)果顯示,所有AGO家族基因在生殖組織的表達遠高于營養(yǎng)組織[16],這與水稻中OsAGOs的表達模式相似[15],預(yù)示著小RNA在生殖生長階段發(fā)揮重要的調(diào)控作用。
根系是玉米重要的組織器官,在保持植株形態(tài)、水分和營養(yǎng)吸收與運輸、響應(yīng)植物對環(huán)境脅迫等方面起著重要的作用。本研究以Zhai等報道的17個ZmAGO基因為研究對象,以玉米自交系B73為材料,對該基因家族成員的基因結(jié)構(gòu)進行了解析,并將玉米幼苗的4種根系分別取材進行表達分析,結(jié)果發(fā)現(xiàn),ZmAGOs有6個成員存在5′非翻譯外顯子,可能AGO基因家族受到此機制的調(diào)控[16];對ZmAGOs在各類根系中的表
達分析表明,有些ZmAGOs基因顯示出其在不同類型根組織中表達的特異性,如ZmAGO2b、ZmAGO9在冠根、初生胚根和側(cè)根中表達,但在次生胚根中未檢測到其表達,ZmAGO5d、ZmAGO4則冠根、次生胚根和側(cè)根中表達,但在初生胚根中未檢測到其表達,說明選擇性地表達不同的ZmAGOs基因可能是不同類型的根系分化及其功能的精細調(diào)控所必需的。
參考文獻:
[1]Voinnet O. Origin,biogenesis,and activity of plant microRNAs[J]. Cell,2009,136(4):669-687.
[2]Bohmert K,Camus I,Bellini C,et al. AGO1 defines a novel locus of Arabidopsis controlling leaf development[J]. The EMBO Journal,1998,17(1):170-180.
[3]Tolia N H,Joshua-Tor L. Slicer and the argonautes[J]. Nature Chemical Biology,2007,3(1):36-43.
[4]Hutvagner G,Simard M J. Argonaute proteins:key players in RNA silencing[J]. Nature Reviews Molecular Cell Biology,2008,9(1):22-32.
[5]Song J J,Smith S K,Hannon G J,et al. Crystal structure of argonaute and its implications for RISC slicer activity[J]. Science,2004,305(5689):1434-1437.
[6]Liu J,Carmell M A,Rivas F V,et al. Argonaute2 is the catalytic engine of mammalian RNAi[J]. Science,2004,305(5689):1437-1441.
[7]Rivas F V,Tolia N H,Song J J,et al. Purified argonaute2 and an siRNA form recombinant human RISC[J]. Nature Structural & Molecular Biology,2005,12(4):340-349.
[8]Vaucheret H. Plant argonautes[J]. Trends in Plant Science,2008,13(7):350-358.
[9]Qi Y,Denli A M,Hannon G J. Biochemical specialization within Arabidopsis RNA silencing pathways[J]. Molecular Cell,2005,19(3):421-428.
[10]Qi Y,He X,Wang X J,et al. Distinct catalytic and non-catalytic roles of argonaute4 in RNA-directed DNA methylation[J]. Nature,2006,443(7114):1008-1012.
[11]Baumberger N,Baulcombe D C. Arabidopsis argonaute1 is an RNA Slicer that selectively recruits microRNAs and short interfering RNAs[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(33):11928-11933.
[12]Montgomery T A,Howell M D,Cuperus J T,et al. Specificity of argonaute7-miR390 interaction and dual functionality in TAS3 trans-acting siRNA formation[J]. Cell,2008,133(1):128-141.
[13]Ji L J,Liu X G,Yan J,et al. Argonaute10 and argonaute1 regulate the termination of floral stem cells through two microRNAs in Arabidopsis[J]. PLoS Genetics,2011,7(3):e1001358.
[14]Morel J B,Godon C,Mourrain P,et al. Fertile hypomorphic argonaute(ago1) mutants impaired in post-transcriptional gene silencing and virus resistance[J]. The Plant Cell,2002,14(3):629-639.
[15]Kapoor M,Arora R,Lama T,et al. Genome-wide identification,organization and phylogenetic analysis of Dicer-like,argonaute and RNA-dependent RNA polymerase gene families and their expression analysis during reproductive development and stress in rice[J]. BMC Genomics,2008,9(1):451.
[16]Zhai L,Sun W,Zhang K,et al. Identification and characterization of argonaute gene family and meiosis-enriched argonaute during sporogenesis in maize[J]. Journal of Integrative Plant Biology,2014,56(11):1042-1052.
[17]Wu L,Zhang Q,Zhou H,et al. Rice MicroRNA effector complexes and targets[J]. The Plant Cell,2009,21(11):3421-3435.
[18]Zhu H,Hu F,Wang R,et al. Arabidopsis argonaute10 specifically sequesters miR166/165 to regulate shoot apical meristem development[J]. Cell,2011,145(2):242-256.
[19]Schmid M,Davison T S,Henz S R,et al. A gene expression map of Arabidopsis thaliana development[J]. Nature Genetics,2005,37(5):501-506.
[20]Changho E,Lorkovic Z J,Ulf N,et al. AGO6 functions in RNA-mediated transcriptional gene silencing in shoot and root meristems in Arabidopsis thaliana[J]. PLoS One,2011,6(10):e25730.
[21]Takeda A,Iwasaki S,Watanabe T,et al. The mechanism selecting the guide strand from small RNA duplexes is different among argonaute proteins[J]. Plant & Cell Physiology,2008,49(4):493-500.
[22]Durán-Figueroa N,Vielle-Calzada J P. Argonaute9-dependent silencing of transposable elements in pericentromeric regions of Arabidopsis[J]. Plant Signaling & Behavior,2010,5(11):1476-1479.
[23]Singh M,Goel S,Meeley R B,et al. Production of viable gametes without meiosis in maize deficient for an argonaute protein[J]. The Plant Cell,2011,23(2):443-458.
[24]Thomson D W,Pillman K A,Anderson M L,et al. Assessing the gene regulatory properties of Argonaute-bound small RNAs of diverse genomic origin[J]. Nucleic Acids Research,2015,43(1):470-481.
[25]Qian Y,Cheng Y,Cheng X,et al. Identification and characterization of Dicer-like,argonaute and RNA-dependent RNA polymerase gene families in maize[J]. Plant Cell Reports,2011,30(7):1347-1363.
[26]許 鑫,李丹丹,李雙江,等. 玉米AGO基因的克隆與表達分析[J]. 西北植物學(xué)報,2014,34(3):449-453.肖 松,周棱波,張國兵,等. 醬香型白酒用糯高粱種質(zhì)遺傳多樣性分析[J]. 江蘇農(nóng)業(yè)科學(xué),2016,44(4):45-49.

