siRNA沉默EGLN1基因對低氧下大鼠肺動脈平滑肌細胞生長的影響*
孫 莉, 嘎 琴, 楊全余, 靳國恩
(青海大學高原醫學研究中心,青海 西寧 810001)
?
siRNA沉默EGLN1基因對低氧下大鼠肺動脈平滑肌細胞生長的影響*
孫莉,嘎琴,楊全余,靳國恩△
(青海大學高原醫學研究中心,青海 西寧 810001)
[摘要]目的: 體外培養大鼠肺動脈平滑肌細胞(PASMCs),利用小干擾RNA技術轉染PASMCs干擾EGLN1基因表達,檢測細胞活力變化,從而驗證EGLN1在PASMCs活力變化中的作用。方法: 采用原代培養PASMCs,構建出特異的EGLN1 siRNA脂質體并轉染到PASMCs;分別在常氧和低氧下進行細胞培養,采用Western blot 檢測PASMCs 的EGLN1蛋白、VEGF蛋白表達水平;用CCK-8法檢測細胞活力,探討低氧條件下沉默EGLN1基因表達后對PASMCs活力的影響。結果: 低氧下PASMCs活力變化和VEGF的蛋白水平表達較常氧下增加并呈時間依賴性;EGLN1沉默后,無論低氧和常氧下,PASMCs活力變化和VEGF的蛋白水平表達均受到抑制。結論: EGLN1基因參與調控低氧下大鼠PASMCs的生長,其調節可能是通過VEGF的介導而完成的。
[關鍵詞]低氧; EGLN1基因; 大鼠肺動脈平滑肌細胞; 細胞活力
低氧性肺動脈高壓(hypoxic pulmonary hypertension,HPH)是高原地區常見病、不同年齡段均可發病,其主要病理特征為肺動脈壓的持續增高和肺動脈壁的增厚及血管肌性化,嚴重時可誘發右心結構和功能改變,甚至出現心力衰竭而危及生命。其中低氧是該病發生的最主要因素。肺動脈血管收縮性增加、肺血管重構及微血管損傷是HPH的主要病理機制[1],前者主要發生在低氧早期,具有可逆性,后者出現在低氧后期,其可逆性差。其中肺血管重塑主要表現為肺動脈平滑肌細胞(pulmonary artery smooth muscle cells,PASMCs)肥大、增生和細胞外基質合成增多導致肺小動脈管壁變厚,內徑變窄,肌型血管中膜肥厚,非肌型血管出現平滑肌樣細胞等。因此,低氧性肺血管重構是慢性低氧性肺動脈高壓的基礎,低氧性肺血管重構的防治研究日益受到人們的重視。
EGLN1基因編碼的脯氨酸羥化酶2(proline hydroxylase 2,PHD2)是重要的低氧反應元件和高海拔低氧環境功能適應的主要氧感受器。其作為低氧誘導因子(hypoxia inducible factor,HIF)信號通路中的重要調節因子,低氧下PHD2羥基化HIF-1α受阻,蛋白質的降解中斷,HIF-1α亞基大量累積,啟動多種低氧反應基因的轉錄從而誘導靶基因表達,形成低氧反應調節通路,參與調節高海拔低氧適應過程。當前研究發現,與缺氧有關的2 個基因EPAS1(HIF-2α)和EGLN1在西藏夏爾巴人中強表達,這2個基因與非藏族的低海拔地區(漢族與日本人)明顯不同[2-4]。雖然國內外在研究HIF-1α對PASMCs的影響方面的報道很多,但有關EGLN1是否也參與了低氧下對肺動脈平滑肌細胞活力的調控尚未見報道。
由于,EGLN1對于PASMCs生長與肺血管重建的作用并不明確, 本研究主要研究干擾EGLN1 基因的表達, 是否影響其下游低氧應答反應的激活, 最終調節一系列如血管內皮生長因子(vascular endothelial growth factor,VEGF)等下游低氧應答基因的表達,使得機體適應高海拔低氧環境。因此,本實驗利用siRNA技術,體外轉染PASMCs并干擾EGLN1的表達,檢測細胞活力變化,探討EGLN1在PASMCs生長中的作用。
材料和方法
1主要試劑
胎牛血清和OPTI-MEM購于Gibco;DMEM/F12購于HyClone;0.25%胰蛋白酶-EDTA消化液和青、鏈霉素混合液(100×)購于Solarbio;Lipo2000購于Invitrogen;DAPI和FITC標記山羊抗兔IgG(H+L)購于碧云天生物技術公司;蛋白預染Marker購于Fermentas;BCA蛋白定量試劑盒購于Thermo;吐溫-20(Tween-20)購于Amresco;NC膜購于Millipore;EGLN1、VEGF和α-平滑肌肌動蛋白(alpha smooth muscle actin,α-SMA)抗體購于Abcam;GAPDH抗體購于CST;CCK-8購于七海生物。
2方法
2.1大鼠PASMCs的分離、培養及鑒定取SD大鼠超凈臺內處死,取肺組織,分離肺內動脈血管于PBS中。分離出血管中膜,輕刮內膜面3~5次,PBS漂洗1次,置于含20%胎牛血清和1%雙抗的D/F12培養液中。用眼科剪將血管中膜剪碎(1 mm2左右),將碎片移到培養瓶底均勻排布,加入足量的DMEM/F12,倒置培養箱中孵育4~6 h后,另一側翻轉培養瓶使培養液沒過組織塊。在培養箱中孵育3~7 d后進行觀察和換液,鏡下觀察細胞已融合生長即可傳代培養。傳代培養時,吸去培養液和漂浮的組織塊,用PBS漂洗培養瓶2~3次,胰蛋白酶(0.25%)消化3 min,使細胞脫落后離心。取細胞懸液,置于培養皿中繼續培養,培養箱中孵育。傳代時,將細胞懸液靜置,使部分細胞(成纖維細胞和內皮細胞)貼壁,然后將未貼壁的細胞轉移至另一培養皿中,再次靜置、貼壁,重復2次即可得到較純的平滑肌細胞。
將細胞培養液洗去,細胞爬片用0.02 mol/L PBS洗滌3次,用4 %甲醛固定30 min,0.02 mol/L PBS洗5 min 3次。滴加合適比例稀釋的I抗,4 ℃下孵育過夜。PBS漂洗5 min 3次,不時振蕩洗去多余游離抗體。滴加合適比例稀釋的熒光II抗,4 ℃下孵育1 h。防淬滅封片劑封片,熒光顯微鏡下拍片。
2.2siRNA細胞轉染及靶點篩選轉染對照組:250 μL Opti-mem無血清培養基;陰性對照(negative control,NC)組:將5 μL NCsiRNA(約100 pmol)溶于245 μL Opti-mem無血清培養基中;陽性對照(postive control,PC)組:將5 μL PCsiRNA溶于245 μL Opti-mem無血清培養基中;干擾組:將5 μL siRNA溶于245 μL Opti-mem無血清培養基中;每組加入5 μL的lipo2000及245 μL Opti-mem無血清培養基混合溶液,室溫靜置20 min。轉染時棄去原培養基,用無菌PBS漂洗 1 次,再加入1 mL不含血清培養液。把各管復合物緩緩加入相應的培養液中,搖勻,37 ℃培養箱中放置6 h,吸除無血清轉染液,換入完全培養液繼續培養。轉染后用Western blot檢測siEGLN1的3個靶點的表達。EGLN1基因3個siRNA oligo序列如下:靶點1為5’-AUGGAGACGGAAGAUGUGUUU-3’(348~370);靶點2為5’-GACGGAAGAUGUGUGACAUUU-3’(353~375);靶點3為5’-GCGGAGGUAUUCUUCGAAUUU-3’(411~433)。
2.3低氧條件下培養PASMCs并檢測干擾效果空白組只有培養基無PASMCs;陰性對照組(非干擾組)即在培養基中加入PASMCs;干擾組為siRNA干擾EGLN1后的PASMCs加入培養基中。采用含10%胎牛血清和1%青鏈霉素混合液 的DMEM/F12培養液,常氧培養置于37 ℃、5% CO2、20% O2的培養箱(Thermo Forma 3111)中進行培養,低氧培養置于37 ℃、5% CO2、2% O2的培養箱(Thermo Forma 3131)中培養。臺盼藍染色活細胞率達95%以上。在常氧和低氧條件下分別培養0 h、24 h、48 h、72 h。72 h后用Western blot法檢測siRNA的干擾效果。
2.4Western blot法檢測VEGF蛋白的表達水平Western blot法檢測VEGF蛋白表達,提取細胞總蛋白,取20 μg蛋白樣品于10% SDS-PAGE分離并轉膜。膜在室溫下封閉1 h,分別加入I 抗(EGLN1為1∶1 000、GAPDH為1∶1 000)及HRP標記的 II 抗孵育。ECL化學發光顯影,以目的蛋白與 GAPDH灰度比為表達值,取 3次結果的平均值作為相對密度值。
2.5CCK-8法檢測EGLN1對低氧條件下PASMCs細胞活力的影響將轉染48 h的細胞胰蛋白酶消化,稀釋細胞使其濃度為3×107/L培養液。分別取100 μL至96孔培養板,每種細胞每塊板接種3個同樣的孔作為復孔,每孔3×103個細胞,常氧培養過夜貼壁。在常氧和低氧條件下分別培養0 h、24 h、48 h、72 h后,按1∶10 體積比混合CCK-8和無血清基本培養基DMEM/F12,每孔100 μL加入待測孔中,37 ℃、5% CO2孵育1 h;用微板分光光度計測定450 nm波長下的吸光度(A)值,記錄每塊板的數值。
3統計學處理
采用 SPSS 16.0統計軟件,數據以均數±標準差(mean±SD)表示,采用單因素方差分析進行組間差異比較,兩兩比較分別采用SNK-q法、Tamhane’s T2法,以P<0.05為差異有統計學意義。
結果
1PASMCs細胞形態學鑒定
原代培養3 d,可見PASMCs貼壁伸展,形態各樣,大小不一,三角形、梭形、帶狀或不規則型的都有,胞漿豐富。部分區域多層重疊生長,高低起伏,細胞多的地方疊在一起,形成一個山峰,細胞少的地方一個都沒有,呈現“峰-谷”狀,是PASMCs的典型生長特點。應用免疫熒光的方法對PASMCs進行鑒定,熒光顯微鏡下可見,綠色熒光標記的α-SMA,見圖1。
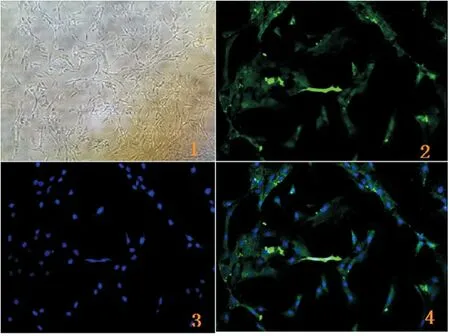
Figure 1.The immunofluorescence staining of α-SMA in primary cultured rat PASMCs. 1: primary cell culture (×100); 2: α-SMA (×200); 3: DAPI (×200); 4: merge (×200).
圖1大鼠PASMCs原代培養及其免疫熒光鑒定結果
2EGLN1 siRNA靶點篩選
Western blot檢測結果顯示,EGLN1的3個靶點經干擾沉默后, 靶點2、3干擾沉默后EGLN1蛋白表達均明顯受到抑制(P<0.05),其中干擾靶點3的效果最好,見圖2。
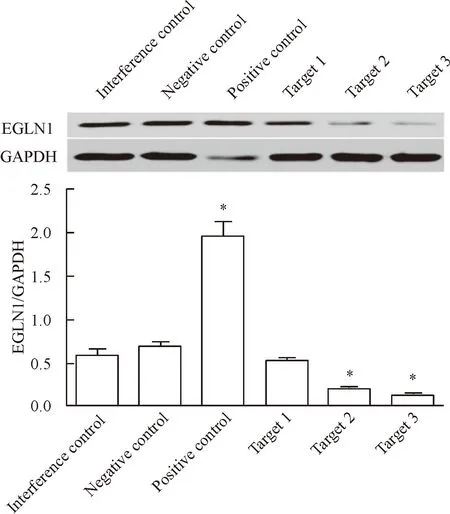
Figure 2.The expression of EGLN1 was interfered by the various interference targets determined by Western blot. Mean±SD. n=3.*P<0.05 vs interference control.
圖2Western blot檢測各干擾靶點EGLN1的表達量
3低氧后檢測干擾效果
低氧分組培養72 h后,常氧下和低氧下的siEGLN1組都有較好的干擾效果(P<0.05)。常氧下陰性對照組EGLN1的表達較與低氧下陰性對照組低(P<0.05),見圖3。
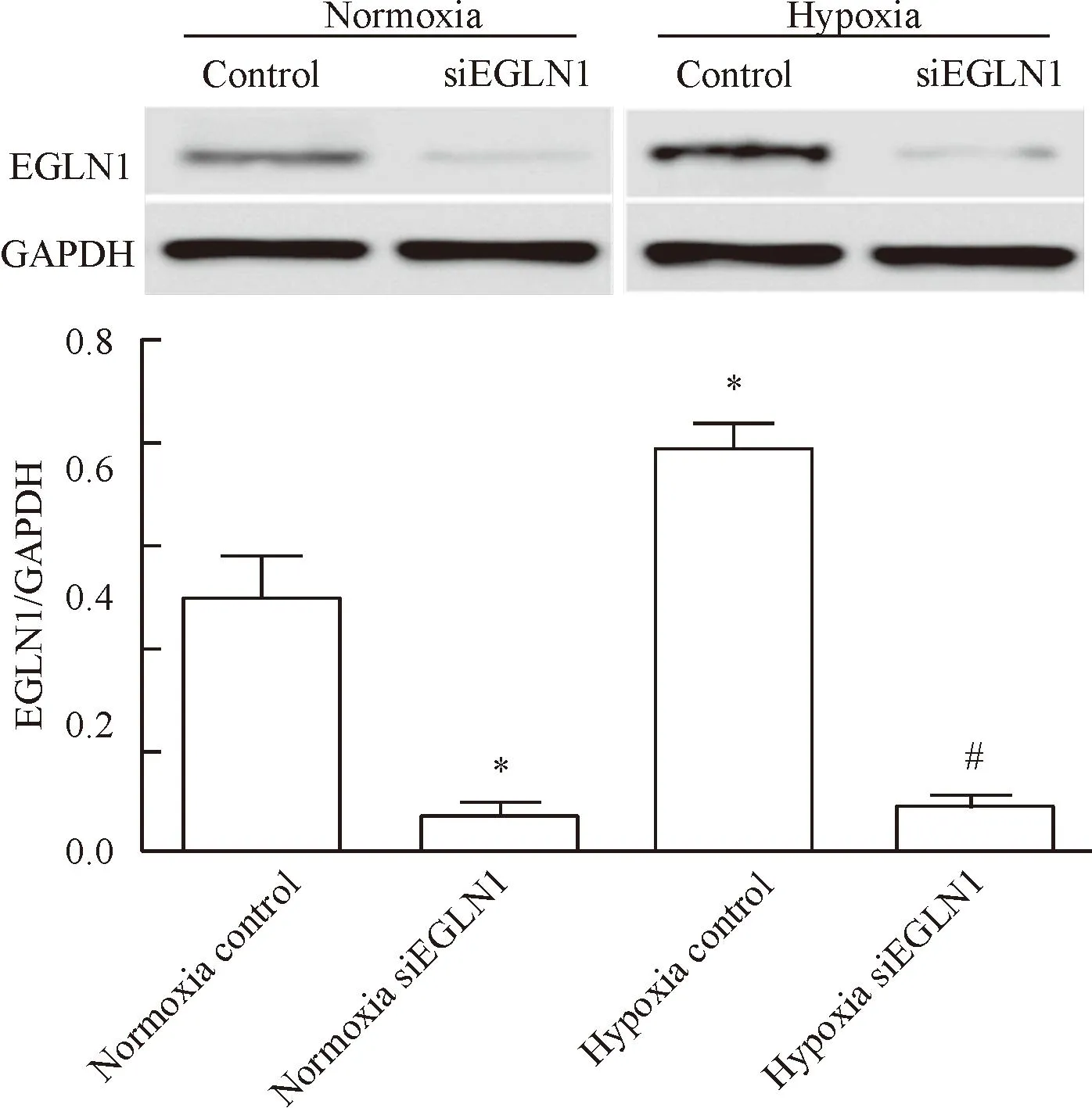
Figure 3.The protein expression of EGLN1 under the condition of normoxia or hypoxia for 72 h determined by Western blot. Mean±SD. n=3.*P<0.05 vs normoxia control;*P<0.05 vs hypoxia control.
圖3Western blot檢測分組培養72 h后的EGLN1干擾效果
4Western blot法檢測VEGF蛋白的表達水平
當低氧培養48 h和72 h時,無論對照組還是干擾組與常氧下相比,VEGF的表達均有所升高。常氧干擾組和低氧干擾組VEGF的表達與相應的對照組均有所減少。各組的VEGF表達均隨培養時間有所增加,但常氧組增加并不明顯,僅少數組有統計學差異,而低氧組VEGF增加更明顯,見圖4、表1。
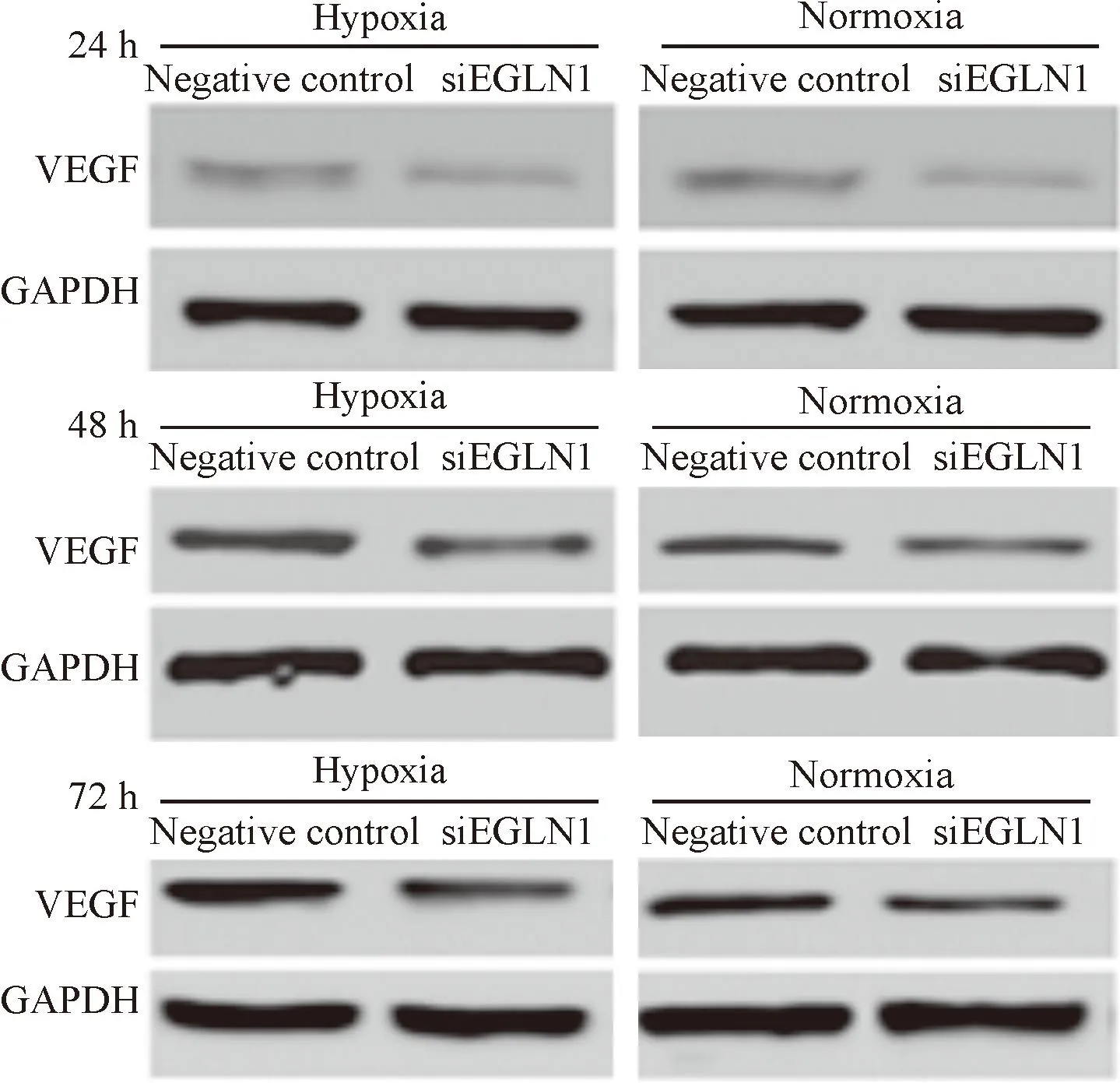
Figure 4.Western blot determined the protein expression of VEGF.
圖4Western blot法檢測VEGF蛋白的表達水平
其中,我們在分別培養72 h后檢測各組EGLN1和VEGF的蛋白表達, 由圖5可見,低氧下各組EGLN1與VEGF的表達較常氧下表達均有所增加,2個干擾組的EGLN1受到抑制時,各干擾組相對其對照組的VEGF表達均降低。
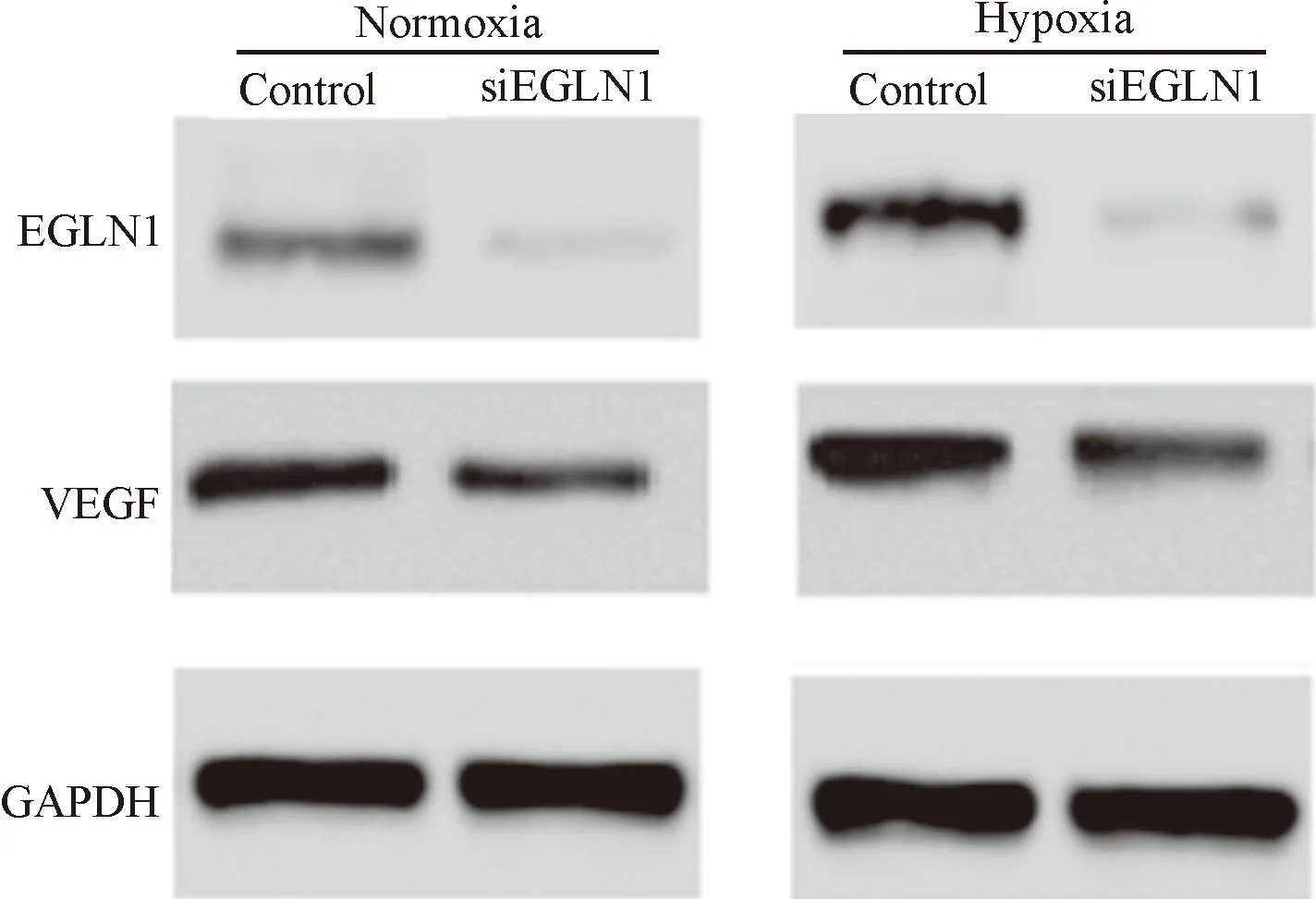
Figure 5.Western blot determined the protein expression of EGLN1 and VEGF.
圖5Western blot檢測培養72 h后各組EGLN1和VEGF的蛋白表達

表1 各組VEGF/GAPDH相對表達量的比較
*P<0.05 vs negative control;#P<0.05 vs normoxia group;△P<0.05 vs 24 h group;◆P<0.05 vs 48 h group.
5CCK-8法檢測EGLN1對低氧下PASMCs細胞活力的影響
CCK-8法檢測細胞活力情況,結果顯示出各組的吸光度值均隨時間增強,其中低氧對照組增強最明顯,低氧干擾組和常氧對照組次之,常氧干擾組最弱。由表2可知,因為空白組除培養基外并無肺動脈平滑肌細胞,空白組在低氧與常氧下無差異。各組在0 h時吸光度無差異。無論在常氧或低氧情況下,對照組和空白組與干擾組相比差異均有統計學顯著性(P<0.05)。在常氧和低氧情況下,干擾組的細胞活力與對照組相比均減弱(P<0.05)。對照組和干擾組在低氧培養下細胞活力與常氧組比均有所增強(P<0.05)。
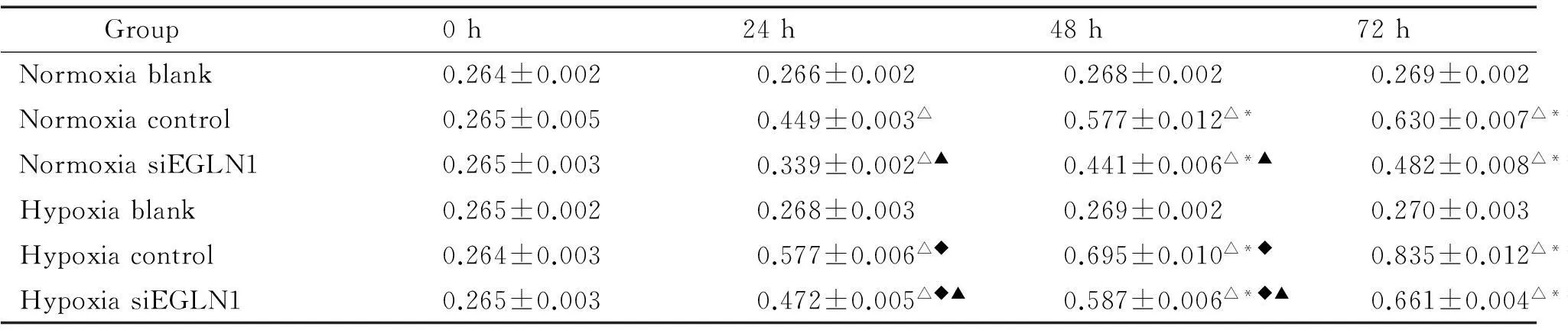
表2 CCK-8法測量不同分組下PASMCs細胞活力情況
△P<0.05 vs 0 h group;*P<0.05 vs 24 h group;#P<0.05 vs 48 h group;◆P<0.05 vs normoxia group;▲P<0.05 vs control group.
討論
低氧性肺血管重建是HPH的主要病理變化,包括肌型動脈中膜平滑肌增殖肥大、非肌型動脈肌化內膜增厚以及外膜成纖維細胞增殖,其中位于血管壁中膜的PASMCs在增殖中起主要作用,是導致HPH的重要環節,而細胞活力的變化能從側面說明細胞增殖情況。對于低氧性HPH研究顯示,低氧促進了PASMCs的異常增殖,PASMCs低氧性增殖在肺血管重建中起重要作用[5],這與本研究的研究結果相符。EGLN1(PHD2)是在人體內普遍存在的Fe2+和2-同戊二酸依賴的加氧酶超家族成員, 對HIF-1α的調節起關鍵作用, 是HIF-1α降解反應的限速酶[6-8]。近年來的研究表明,發現EGLN1與藏族的高原適應性有關。其中,EGLN1 基因在高海拔低氧環境適應的人群中存在很強的正選擇, 它是歐亞(包括藏族)和安第斯人群共同的與高海拔低氧環境適應相關的基因[9-11]。VEGF是HIF-1α介導的下游轉錄基因,而VEGF與肺血管通透性、血管生成以及血管結構重構密切相關。因此,本研究用轉染法將外源siRNA摻入到肺平滑肌細胞而獲得新的遺傳標志的過程來構建EGLN1干擾模型。在經過體外轉染PASMCs并做篩選后,選定轉染效率最好的靶點3,采用Western blot實驗來檢查轉染結果,結果顯示干擾后的EGLN1表達顯著降低,說明轉染模型構建成功。低氧下,EGLN1的表達量增加,VEGF表達增高,PASMCs活力較常氧下有明顯增高,并具有時間依賴性,這與羅穎等[12]的研究結果一致。而EGLN1siRNA作用后,EGLN1的表達受到抑制的同時,VEGF的表達相比未干擾組有所下降,這與Fisher等[13]的研究結果一致。此外,研究結果也顯示EGLN1對PASMCs活力可能具有一定的增強作用,低氧下PASMCs細胞活力較常氧下增加。當EGLN1受到抑制時,VEGF的表達和細胞活力變化均受抑制。EGLN1能夠促進對機體PASMCs活力增強及肺血管重建,但該基因的過度表達對非低氧適應性動物并不起保護作用。而也有研究顯示PHD-2敲除后增加細胞HIF-1α水平和導致增加VEGF等下游血管生成因子的轉錄[14]。因此,低氧下,EGLN1是如何調控VEGF的表達來影響肺平滑肌細胞生長的尚需要進一步證明。
[參考文獻]
[1]Tuder RM, Archer SL, Dorfmüller P, et al. Relevant issues in the pathology and pathobiology of pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62(25): D4-D12.
[2]Simonson TS, Yang YZ, Ge RL, et al. Genetic evidence for high-altitude adaptation in Tibet[J]. Science, 2010, 329(5987):72-75.
[3]Yi X, Liang Y, Huerta-Sanchez E, et al. Sequencing of 50 human exomes reveals adaptation to high altitude[J]. Science, 2010, 329(5987):75-78.
[4]Peng Y, Yang Z, Zhang H, et al. Genetic variations in Tibet an populations and high-altitude adaptation at the Himalayas[J]. Mol Biol Evol, 2011, 28(2): 1075-1081.
[5]Archer S, Ryan J, Kim G, et al. Epigenetic mechanisms of pulmonary hypertension[J]. Pulm Circ, 2011, 1(3):347-356.
[6]Bruick RK, Mcknight SL. A conserved family of prolyl-4-hydroxylases that modify HIF[J]. Science, 2001, 294(5545):1337-1340.
[7]van Patot MCT, Gassmann M. Hypoxia: adapting to high altitude by mutating EPAS-1, the gene encoding HIF-2α[J]. High Alt Med Biol, 2011, 12(12): 157-167.
[8]Tian YM, Mole DR, Ratcliffe PJ, et al. Characterization of different isoforms of the HIF prolyl hydroxylase PHD1 generated by alternative initiation[J]. Biochem J, 2006, 397(1):179-186.
[9]Ji LD, Qiu YQ, Xu J, et al. Genetic adaptation of the hypoxia inducible factor pathway to oxygen pressure among eurasian human populations[J]. Mol Biol Evo, 2012, 29(11):3359-3370.
[10]Pagani L, Ayub Q, Macarthur DG, et al. High altitude adaptation in Daghestani populations from the Caucasus[J]. Hum Gene, 2012, 131(3):423-433.
[11]Aggarwal S, Negi S, Jha P, et al. EGLN1 involvement in high-altitude adaptation revealed through genetic analysis of extreme constitution types defined in Ayurveda[J]. Proc Natl Acad Sci U S A, 2010, 107(44):18961-18966.
[12]羅穎,李志超,張齊,等. VEGF和PCNA在慢性低氧性肺動脈高壓大鼠主動脈、肺動脈平滑肌細胞中表達[J]. 細胞與分子免疫學雜志, 2006,22(1):103-105.
[13]Fisher TS,PD,Lira PD,Stock JL,et al. Analysis of the role of the HIF hydroxylase family member in erythopoiesis[J]. Biochem Biophys Res Commun, 2009, 338(4):683-688.
[14]Zimmermann AS, Morrison SD, Hu MS, et al. Epidermal or dermal specific knockout of PHD-2 enhances wound healing and minimizes ischemic injury[J]. PLoS One, 2014, 9(4):e93373.
(責任編輯: 陳妙玲, 余小慧)
Effects of EGLN1 siRNA on growth of rat pulmonary artery smooth muscle cells under hypoxic condition
SUN Li, GA Qin, YANG Quan-yu, JIN Guo-en
(ResearchCenterofHigh-AltitudeMedicine,QinghaiUniversity,Xining810001,China.E-mail:jmcy2005_teacher@aliyun.com)
[ABSTRACT]AIM: To observe whether EGLN1 gene is involved in the growth of pulmonary arterial smooth muscle cells (PASMCs) during hypoxia when EGLN1 gene expression was interference by siRNA. METHODS: The rat primary pulmonary arterial smooth muscle cells were cultured, and the specific lipidosome of EGLN1 siRNA was constructed and transfected into the PASMCs. The transfected PASMCs were cultured under hypoxia or normoxia conditions, respectively. The viability of the PASMCs was detected by CCK-8 assay. The protein expression of EGLN1 and vascular endothelial growth factor (VEGF) was determined by Western blot. RESULTS: The viability of the PASMCs was increased and the protein expression of VEGF was up-regulated in the PASMCs under hypoxic condition in a time-dependent manner. In hypoxia or normoxia condition, the viability and VEGF protein expression of the PASMCs were suppressed by EGLN1 siRNA. CONCLUSION: EGLN1 gene may involve in the growth of rat PASMCs by regulating VEGF protein level under hypoxic condition.
[KEY WORDS]Hypoxia; EGLN1 gene; Rat pulmonary arterial smooth muscle cells; Cell viability
[文章編號]1000- 4718(2016)05- 0787- 05
[收稿日期]2015- 07- 27[修回日期] 2016- 03- 11
*[基金項目]國家自然科學基金資助項目(No. 81160243); 人社部留學人員科技活動項目([2011]518號); 青海省重點實驗室發展專項(No. 2014-Z-Y-30)
通訊作者△Tel: 0971-8172252; E-mail: jmcy2005_teacher@aliyun.com
[中圖分類號]R332; R363.2
[文獻標志碼]A
doi:10.3969/j.issn.1000- 4718.2016.05.003
雜志網址: http://www.cjpp.net

