劍麻不定芽玻璃化過程中的細胞學和生理變化研究
張燕梅 李俊峰 陸軍迎 鹿志偉 周文釗

摘 要 玻璃化問題是植物組織培養過程中的普遍現象,已成為植物組織快速繁殖的瓶頸。本研究以H.11648為材料,分析H.11648不定芽玻璃化過程中氣孔形態、DNA含量、葉片含水量、可溶性蛋白含量、丙二醛(MDA)含量以及過氧化氫酶(CAT)、過氧化物酶(POD)、抗壞血酸過氧化物酶(APX)和超氧化物歧化酶(SOD)等防御酶活性變化情況,結果表明:玻璃化后的不定芽葉片保衛細胞膨大,氣孔變大。體細胞DNA含量沒有變化,但細胞數減少。隨著玻璃化程度的增加,葉片含水量顯著增加,可溶性蛋白和丙二醛含量明顯降低,POD活性顯著上升,SOD活性先上升后又略有下降,但均顯著高于正常水平,APX活性先明顯上升后又恢復到正常水平,CAT活性略有下降但不顯著。本研究為揭示劍麻不定芽玻璃化的生理機制提供參考。
關鍵詞 劍麻;不定芽;玻璃化
中圖分類號 S563.8 文獻標識碼 A
Abstract Hyperhydricity is a serious problem during in vitro culture of plant, and it is considered as a bottleneck to micropropagation of plants. Stomata form and DNA content, water content, concentrations of soluble protein and malonyldialdehyde, the activities of antioxidative enzymes, e.g. peroxidase(POD), catalase(CAT), ascorbate peroxidase(APX)and superoxide dismutase(SOD), were examined in adventitious shoots of H.11648. The results showed that guard cell expanded and the pore surrounded by the guard cues in hyperhydric leaves were more rounded in contrast to the elliptical pore in normal leaves. The DNA content was not changed while cell number decreased after hyperhydriciting. Hyperhydric shoots had higher water content,lower soluble protein and MDA concentration than normal shoots. The activities of antioxidant enzymes, such as POD and SOD significantly increased in hyperhydric shoots than in healthy shoots. CAT showed a slight decrease in activity in the hyperhydric leaves than in healthy leaves, APX activity significantly increased at H1 stage and then recovered normal levels at H2 stage. The results would provide a reference for revealing the physiological mechnism of hyperhydricity of adventitious shoots of H.11648.
Key words H.11648; Adventitious shoots; Hyperhydricity
doi 10.3969/j.issn.1000-2561.2016.10.010
劍麻是一種極具特色的熱帶纖維作物,它不僅是主要的熱帶纖維原料[1],同時劍麻莖心也是釀造龍舌蘭酒的主要原料[2]。此外,劍麻汁液含有較高皂素,可用來制藥[3],同時劍麻也可視為是一種重要的生物質能源作物[4-5],經濟價值高。劍麻是營養體繁殖為主的植物,組培快繁是其重要的繁殖手段之一,然而,在劍麻植株再生過程中發現,不定芽玻璃化比較嚴重,玻璃化的植株常呈透明或半透明水漬狀,葉片卷曲、膨大變厚且易碎,最終因無法正常生長而死亡[6-7](圖1-c)。張燕梅等[8]曾通過改良培養基來克服劍麻再生植株玻璃化問題,但對于引起玻璃化的原因及機制還不是十分清楚。針對上述現象,本研究從生理和細胞學水平對玻璃化的劍麻進行了研究,旨在為探討劍麻玻璃化的發生機理和控制玻璃化的發生提供參考。
1 材料與方法
1.1 材料
以主栽品種H.11648為試材,將其愈傷組織接種于不定芽誘導培養基上,不定芽誘導培養基參照張燕梅等[9]的方法。待不定芽長至2~3 cm時,采取葉片并按照玻璃化程度進行分級,其中0級為正常不定芽(H0),Ⅰ級為葉片玻璃化面積占總面積的1/2及以下(H1),Ⅱ級為葉片玻璃化面積占總面積的1/2以上(H2)(圖1)。
1.2 方法
1.2.1 含水量測定 分別取0級、Ⅰ級和Ⅱ級的葉片1 g(G0),裝入牛皮紙袋中,于80 ℃烘箱中烘干至恒重(G1),按下式計算葉片含水量:
葉片含水量/(g/g FW)=[(G0-G1)/G0]×100%
1.2.2 可溶性蛋白含量(μg/g)測定 分別取0級、Ⅰ級和Ⅱ級劍麻葉片0.5 g,采用考馬斯亮藍G-250染色法進行測定,具體參照高俊鳳[10]的方法。
1.2.3 葉片下表皮氣孔特征觀察 取0級、Ⅰ級和Ⅱ級劍麻葉片,在顯微鏡(Nikon ECLIPSE 80i)下觀察葉片下表皮氣孔特征。具體參照張燕梅等[11]的方法。
1.2.4 流式細胞儀檢測 取0級、Ⅰ級和Ⅱ級劍麻不定芽,采用流式細胞儀(Beckman)測定正常不定芽與玻璃化不定芽體細胞DNA的相對含量。具體參照Palomino等[12]方法進行。DNA含量由中國熱帶農業科學院熱帶作物品種資源研究所檢測。
1.2.5 防御酶活性測定 分別取0級、Ⅰ級和Ⅱ級的劍麻不定芽0.5 g,加入2 mL提前預冷的酶液提取液后于冰浴下研磨成漿,再加提取液沖洗2~3次(總體積為5 mL),轉入離心管中,于4 ℃ 10 000 r/min下離心15 min,取上清液分裝后于4 ℃保存備用。
抗壞血酸過氧化物酶(APX)活性測定參考孫云等[13]的方法,以每分鐘氧化1 μmol抗壞血酸(AsA)的酶量為一個酶活單位(U)。超氧化物歧化酶(SOD)活性測定參照南京建成公司的SOD試劑盒說明書進行,以每克鮮樣中SOD抑制率達50%時所對應的SOD量為一個酶活單位(U)。過氧化氫酶(CAT)活性測定采用比色法,具體參照劉琳等[14]的方法,以每分鐘內A240變化0.01為1個酶活性單位(U)。過氧化物酶(POD)活性測定采用愈創木酚法,具體參照鄒琦[15]的方法進行,以每分鐘內A470變化0.01為1個酶活性單位(U)。丙二醛(MDA)的含量測定參照Wang等[16]的方法進行。
1.3 數據處理
上述所有數據均采用SAS分析軟件統計并進行差異顯著性分析(p≤0.05)。
2 結果與分析
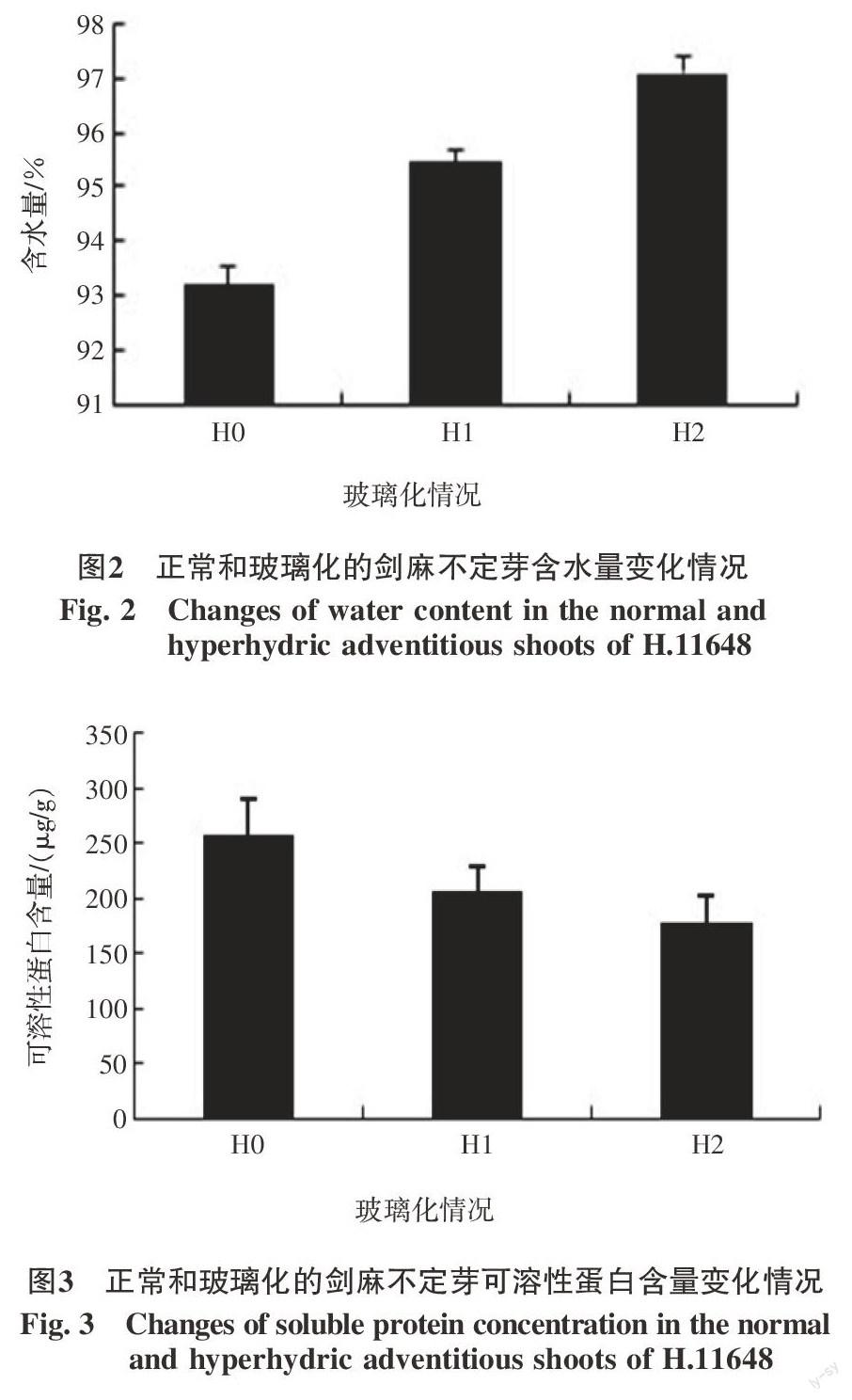
2.1 玻璃化過程中含水量變化情況
正常不定芽(H0)含水量為93.215%,部分玻璃化后的不定芽(H1)含水量為95.457%,玻璃化后的不定芽(H2)含水量為97.09%,玻璃化后的不定芽含水量顯著高于正常不定芽含水量。在整個玻璃化過程中,不定芽含水量呈現明顯遞增趨勢(圖2)。
2.2 玻璃化過程中可溶性蛋白變化情況
正常不定芽(H0)可溶性蛋白含量為258.007 μg/g,部分玻璃化的不定芽(H1)可溶性蛋白含量為205.773 μg/g,玻璃化后的不定芽(H2)可溶性蛋白含量為178.282 μg/g,玻璃化后的不定芽可溶性蛋白顯著低于正常不定芽可溶性蛋白。在整個玻璃化過程中,不定芽可溶性蛋白呈現明顯遞減趨勢(圖3)。說明在玻璃化過程中,蛋白質合成減少,分解速率增加。
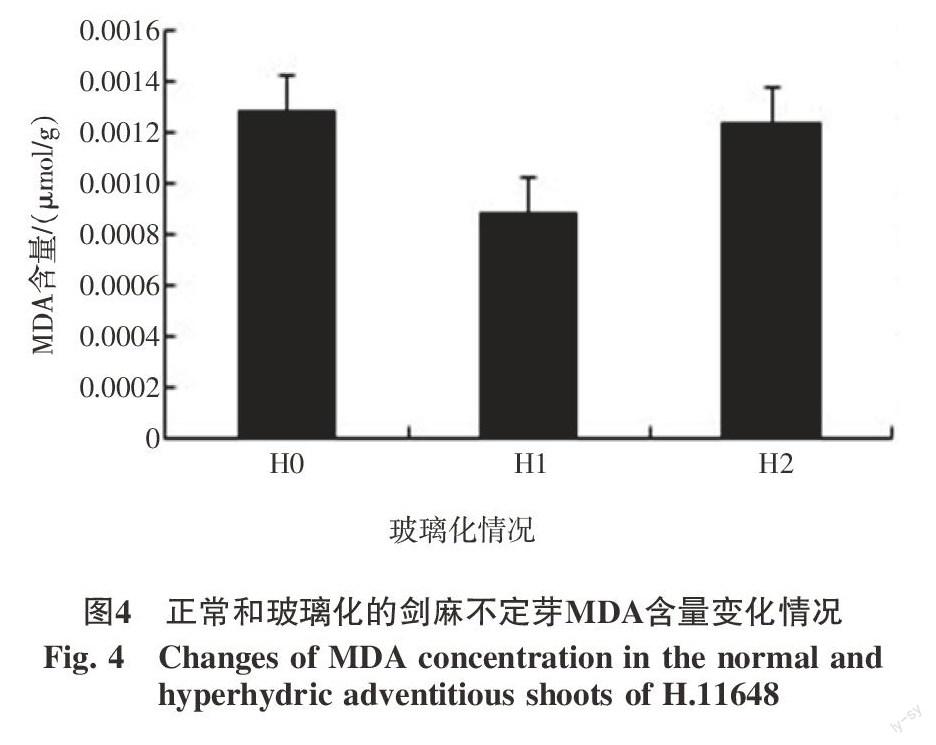
2.3 玻璃化過程中MDA含量變化情況
正常不定芽(H0)MDA含量為0.001 3 μmol/g,部分玻璃化(H1)時MDA含量明顯下降,為0.000 9 μmol/g,但不定芽完全玻璃化(H2)時,MDA又略有上升,為0.001 2 μmol/g,在整個玻璃化過程中表現為先下降然后又恢復到正常水平(圖4)。
2.4 葉片下表皮氣孔特征觀察
顯微鏡觀察顯示:正常葉片下表皮細胞呈長條形,排列整齊致密,2個腎形保衛細胞位于2個表皮細胞的交聯處,氣孔長條形,氣孔和2個保衛細胞組成一個紡錘體形,放大后可看到大量的葉綠體整齊地排列在保衛細胞內(圖5-a,5-d)。完全玻璃化(H2)后的葉片下表皮細胞明顯比正常葉片下表皮細胞短、粗,保衛細胞膨脹并向內彎曲,氣孔變大,氣孔和2個保衛細胞組成一個球形。保衛細胞內的葉綠體數也明顯減少(圖5-c,5-f)。部分玻璃化的葉片下表皮細胞則處于兩者之間,細胞有長條形,也有粗壯形,葉綠體減少不明顯(圖5-b,5-e)。另外,在單個視野內,氣孔密度H0>H1>H2(圖5-a,5-b,5-c)。
2.5 體細胞DNA相對含量測定
如圖6所示:正常不定芽(H0)在熒光強度為55處出現了一個單峰(圖6-a),玻璃化的不定芽(H2)在55處出現了一個單峰(圖6-b),即在不定芽玻璃化過程中,體細胞DNA相對含量沒有發生變化。在相同條件下,正常不定芽細胞數約500,玻璃化后的不定芽細胞數為280,即玻璃化后的細胞數目減少,細胞分裂減慢。
2.6 玻璃化過程中抗氧化酶APX、POD、CAT和SOD變化情況
劍麻不定芽玻璃化過程中4種抗氧化酶APX、POD、CAT和SOD變化情況如表1所示。正常不定芽APX活性為4 944.762 μmol/(g·min),在H1時顯著上升,達到最高值6 665.357 μmol/(g·min),在H2時又略有下降,為4 420.952 μmol/(g·min),但與H0相比,降低不顯著,在整個玻璃化過程中,APX活性呈現先上升后下降。CAT活性在整個玻璃化過程中呈現逐漸下降趨勢,正常不定芽CAT活性為3 322.000 U/(g·min),H1時為2 837.778 U/(g·min),H2時為2 712.444 U/(g·min),隨著玻璃化程度的增加,其活性下降但不顯著。POD酶活性在玻璃化過程中呈遞增趨勢,在H0時為904.271 U/(g·min),H1時為1 340.486 U/(g·min),H2時最高,為2 102.343 U/(g·min),完全玻璃化后的不定芽POD顯著高于正常不定芽。SOD酶活性在玻璃化過程中則先升高后下降,H0時為17.577 U/g,H1時最高,為29.713 U/g,H2又略有減低,為24.613 U/g,玻璃化后的不定芽(H1和H2)SOD酶活性均顯著高于正常不定芽。
3 討論與結論
玻璃化是植物組織培養過程中的普遍現象,在瑪珈[16]、甜櫻桃[17]、康乃馨[18]、擬南芥[19]、蘋果[20]、大蒜[21]等植物中均有報道。本研究發現H.11648不定芽玻璃化過程中含水量增加,氣孔變大且無法正常關閉。關于含水量與玻璃化的關系較為復雜,van den Dries等[19]認為玻璃化的葉片質外體腔中的水積累過多,氣體體積嚴重變小,氣體交換速率減慢,這樣反過來會使質外體中乙烯,茉莉酸甲酯等濃度升高,從而導致植物玻璃化。氣孔的大小和關閉是由保衛細胞細胞壁調控,玻璃化后的葉片保衛細胞木質素、纖維素等含量降低[22],次生壁和細胞板形成受阻,細胞無法正常分裂,細胞壁也隨之受損,因此無法正確調控氣孔的關閉[23],這與蘋果[24]、康乃馨[25]、香草[26]等研究結果一致。
流式檢測表明,在劍麻玻璃化過程中,體細胞數目減少,DNA相對含量不變。這與Franck等[17]的研究結果一致。Franck等[17]認為細胞數目減少是由于玻璃化過程中細胞分裂頻率降低了,這樣可以防止活性氧引起的子細胞DNA的損傷。Ochatt等[27]則認為,玻璃化能引起DNA含量的改變,但兩者之間的因果關系仍需進一步的實驗驗證。此外,也有學者認為玻璃化不僅能引起DNA含量變化,還可引起染色體斷裂、重排以及DNA甲基化等[28-30]。
本研究中的劍麻不定芽玻璃化過程中MDA含量下降,POD、SOD、APX和CAT抗氧化酶活性發生明顯改變。SOD、CAT、 POD 和APX是4 個重要抗氧化酶,其中 SOD 能催化體內的歧化反應,使超氧陰離子自由基(O2·- )轉化為 H2O2和O2,其在玻璃化過程中活性的顯著升高可以減少劍麻不定芽玻璃化過程中由于活性氧爆發產生的超氧陰離子自由基對細胞膜的損害,這與Franck等[17]和Chakrabarty等[20]的研究結果一致。而POD、APX和CAT的高活性,則可進一步將H2O2分解成沒有毒害的H2O和O2,維持H2O2的動態平衡,抑制MDA 的積累,從而降低膜脂過氧化程度,減緩玻璃化的發生[19]。
玻璃化是一個非常復雜的生理生化過程,本研究僅對劍麻不定芽玻璃化進行了初步的探討,有關不定芽玻璃化過程中是否存在活性氧的爆發、活性氧與玻璃化的關系以及引起劍麻不定芽玻璃化的生理機制則需更深入的研究。
參考文獻
[1] Iniguez-Covarrubias G, Diaz-Teres R, Sanjuan-Duenas R, et al. Utilization of by-products from the tequila industry. Part 2: potential value of Agave tequilana Weber azul leaves[J]. Bioresource Technology, 2001, 77(2): 101-108.
[2] Martinez-Aguilar J F, Pena-Alvarez A. Charactirization of five typical agave plants used to produce mescal through their simple lipid composition analysis by gas chromatography[J]. J Agric Food Chem, 2009, 57: 1 933-1 939.
[3] Mancilla-Margalli N A, Lopez M G. Generation of Maillard compounds from inulin during the thermal processing of Agave tequilana Weber Var. azul[J]. J Agric Food Chem, 2002, 50(4): 806-812.
[4] Chambers D, Holtum J A M. Feasibility of Agave as a feedstock for biofuel production in Australia[J]. GCB Bioenergy, 2011, 3(10): 58-67.
[5] Borland A M, Griffiths H, Hartwell J, et al. Exploiting the potential of plants with crassulacean acid metabolism for bioenergy production on marginal lands[J]. Journal of Experimental Botany, 2009, 60(10): 2 879-2 896.
[6] Zhang Y M, Xin L, Zhi C, et al. Shoot organogenesis and plant regeneration in Agave hybrid No.11648[J]. Scientia horticulturae, 2013, 161: 30-34.
[7] Kevers C, Franck T, Strasser R J, et al. Hyperhydricity of micropropagated shoots: a typically stress-induced change of physiological state[J]. Plant Cell Tiss Org, 2004, 77(2): 181-191.
[8] 張燕梅, 周文釗, 李俊峰, 等. 一種克服劍麻不定芽玻璃化的方法: 中國, ZL201210293863.3[P]. 2012-08-17.
[9] 張燕梅, 陳 志, 李俊峰, 等. 劍麻愈傷組織的誘導和再生體系的建立[J]. 熱帶作物學報, 2013, 34(1): 61-66.
[10] 高俊鳳. 植物生理學實驗指導[M].北京:高等教育出版社, 2006:142-143.
[11] 張燕梅, 李俊峰, 陸軍迎, 等. 劍麻四倍體誘導與倍性鑒定[J]. 熱帶作物學報, 2013, 34(8): 1 409-1 415.
[12] Palomino G, Dolezel J, Méndez I, et al. Nuclear genome size analysis of Agave tequilana Weber[J]. Caryologia, 2003, 56(1): 37-46.
[13] 孫 云, 江春柳, 賴鐘雄, 等. 茶樹鮮葉抗壞血酸過氧化物酶活性的變化規律及測定方法[J]. 熱帶作物學報, 2009, 29(5):562-566.
[14] 劉 琳, 侯喜林, 王麗英, 等. 不結球白菜感染蕪箐花葉病毒后4種防御酶活性變化及其抗病相關性[J]. 南京林業大學學報, 2009, 32(3): 14-18.
[15] 鄒 琦. 植物生理學實驗指導[M]. 北京:中國農業出版社, 2000.
[16] Wang Y L, Wang X D, Zhao B, et al. Reduction of hyperhydricity in the culture of Lepidium meyenii shoots by the addition of rare earth elements[J]. Plant Growth Regulation, 2007, 52(2):151-159.
[17] Franck T, Kevers C, Gaspar T, et al. Hyperhydricity of Prunus avium shoots cultured on gelrite: a controlled stress response[J]. Plant Physiology and Biochemistry, 2004, 42: 519-527.
[18] Saher S, Piqueras A, Hellin E, et al. Hyperhydricity in micropropagated carnation shoots: the role of oxidative stress[J]. Physiologia plantarum, 2004, 120: 152-161.
[19] van den Dries N, Giannì S, Czerednik A, et al. Flooding of the apoplast is a key factor in the development of hyperhydricity[J]. J Exp Bot, 2013, 64(16): 5 221-5 230.
[20] Chakrabarty D, Park S Y, Ali M B, et al. Hyperhydricity in apple: Ultrastuctural and physiological aspects[J]. Tree physiology, 2005, 26(3): 377-388.
[21] Wu Z, Chen L J, Long Y J. Analysis of ultrastructure and reactive oxygen species of hyperhydric garlic(Allium sativum L.)shoots[J]. In Vitro Cellular and Developmental Biology Plant, 2009, 45(4): 483-490.
[22] Zil M, Ariel T. The relationship between cell wall deformity and stomatal malfunction in the leaves of carnation in vitro[C]. Proceedings of the International Society Congress on Plant Molecular Biology, Jerusalem: Israel, 1988: 425.
[23] Laloi C, Apel K, Danon A. Reactive oxygen signalling: the latest news[J]. Curr Opin Plant Biol, 2004, 7(3): 323-328.
[24] Blanke M M, Belcher A. Stomata of apple leaves cultured in vitro[J]. Plant Cell Tissue Organ Cult, 1989, 19: 85-89.
[25] Meira Z I V. Quality of micropropagated plants-vitrification[J]. In Vitro Cell Dev Biol, 1991, 27: 64-69.
[26] Sreedhar RV, Venkatachalam L, Neelwarne B. Hyperhydricity-related morphologic and biochemical changes in Vanilla(Vanilla planifolia)[J]. J Plant Growth Regul, 2009, 28(1): 46-57.
[27] Ochatt S J, Muneaux E, Machado C, et al. The hyperhydricity of in vitro regenerants of grass pea(Lathyrus sativus L.)is linked with an abnormal DNA content[J]. J Plant Physiol, 2002, 159(9): 1 021-1 028.
[28] Bohr V A, Dianov G L. Oxidative DNA damage processing in nuclear and organellar DNA[J]. Biochimie, 1999, 81: 155-160.
[29] Cerda S, Weitzman S A. Influence of oxygen radical injury on DNA methylation[J]. Mutation Res, 1997, 386: 141-152.
[30] Kaeppler S M, Phillips R L. DNA methylation and tissue culture induced variation in plants[J]. In Vitro Cell Dev Biol, 1993, 29: 125-130.

