基于CGE技術的甘蔗SSR—PCR反應體系優化
桂意云 陳忠良 秦翠鮮 汪淼 劉麗敏 李楊瑞 黃東亮

摘要:【目的】優化基于毛細管凝膠電泳(CGE)技術的甘蔗SSR-PCR反應體系,為甘蔗遺傳多樣性和親緣關系研究、分子輔助育種及遺傳圖譜構建提供技術支持。【方法】基于CGE技術,采用正交試驗設計,選擇dNTPs濃度、DNA聚合酶量、引物濃度和DNA模板量為考察因素進行優化,確定最佳SSR-PCR反應體系,并用于8個甘蔗種質資源材料的遺傳多樣性分析。【結果】最佳SSR-PCR反應體系(20 μL):dNTPs濃度0.15 mmol/L,DNA聚合酶1.5 U,引物濃度0.50 μmol/L,DNA模板量25 ng。利用該體系對8份來自不同國家地域的甘蔗種質材料進行遺傳多樣性分析,發現8對SSR引物共擴增出101個片段,其中多態性片段為93個,多態性比率為92.1%。聚類分析結果表明,參試材料間的遺傳相似性系數為0.521~0.871,在相似性系數為0.614處,所有參試材料可分為兩大類,3份國外種質材料PINDAR、CP72-1210、CP84-1198與ROC20、GT69-156聚為一類;而ROC26、GT02-237和GT97-69聚為另一類。【結論】基于CGE技術的SSR-PCR反應體系檢測結果穩定,重復性好,適用于甘蔗的遺傳分析及遺傳作圖。
關鍵詞: 甘蔗;SSR分子標記;毛細管凝膠電泳(CGE);反應體系;遺傳分析
中圖分類號: S566.1 文獻標志碼:A 文章編號:2095-1191(2016)09-1463-07
Abstract:【Objective】SSR-PCR reaction system of sugarcane based on capillary gel electrophoresis(CGE) technology was optimized to provide technical support for research on genetic diversity and genetic relationship, molecular-assisted breeding and genetic map construction of sugarcane. 【Method】Four factors affecting SSR-PCR were optimized by orthogonal exprement based on CGE technology, including dNTPs concentration, primer concentration, Taq DNA polymerase amount and DNA template amount. Then the optimal SSR-PCR reaction system was confirmed and applied to genetic analysis of 8 sugarcane germplasm resources. 【Result】The results showed that, the optimal reaction system(20 μL) was composed of 0.15 mmol/L dNTPs, 1.5 U Taq DNA polymerase, 0.50 μmol/L primers and 25 ng DNA templates. Using optimal reaction system and 8 pairs of SSR primers, a total of 101 fragments were amplified from 8 sugarcane germplasms of several countries, 93 of which was polymorphic, with a polymorphism rate of 92.1%. The cluster analysis showed that, coefficient of genetic similarity among 8 germplasms ranged from 0.521 to 0.871. All tested materials could be clustered into two groups at similarity coefficient of 0.614, three foreign germplasms viz., PINDAR, CP72-1210, CP84-1198 and ROC20, GT69-156 were clustered into the same group, but ROC26, GT02-237 and GT97-69 were clustered into another group. 【Conclusion】The established SSR-CGE system is suitable for genetic diversity analysis and genetic mapping of sugarcane due to its stable detection result and good reproducibility.
Key words: sugarcane; SSR molecular marker; capillary gel electrophoresis(CGE); reaction system; genetic analysis
0 引言
【研究意義】甘蔗是世界上重要的糖料和能源作物,我國甘蔗糖產量占全國食糖總產量的90%以上(李楊瑞和楊麗濤,2009)。甘蔗常規育種工作量大、育種周期長、效率低,是當前甘蔗育種面臨的共性問題。由于SSR分子標記具有數量多、多態性高、重復性好、遺傳上呈共顯性等優點,已被廣泛應用于作物輔助育種、生物遺傳學研究。對SSR分子標記進行檢測時,與常規凝膠電泳檢測方法相比,毛細管凝膠電泳(Capillary gel electrophoresis,CGE)具有高靈敏度、高效率、高準確性等優點(Bor et al.,2003;郝晨陽等,2005),可用于蛋白質、核酸等分子化合物的分離。因此,建立基于CGE技術的甘蔗SSR-PCR反應體系可快速準確鑒別甘蔗雜交后代,掌握甘蔗品種(系)間的遺傳多樣性與遺傳關系,對于加快甘蔗育種進程具有重要意義。【前人研究進展】目前,已有大量關于SSR熒光標記CGE檢測技術的研究報道。Huang等(2002)利用24對SSR熒光引物檢測了來自五大洲共68個國家的998份六倍體面包小麥,共檢測到470個等位基因,結果表明利用SSR熒光標記可快速獲得用于種質登記的高通量指紋數據及評估物種遺傳多樣性。張鳳娟(2004)利用SSR熒光標記CGE技術對雜交水稻岡優527進行真實性檢測和純度鑒定。易紅梅等(2006)利用7對SSR熒光引物對192份玉米材料進行擴增,結果表明,CGE熒光檢測比常規變性PAGE銀染檢測更適用于高通量材料的檢測分析。梁俊等(2010)利用SSR熒光標記CGE技術對甘蔗屬3個不同種的12個材料進行遺傳多樣性及遺傳關系分析。程本義等(2011)以16個雜交水稻不育系、恢復系及組合為材料,建立了SSR熒光標記CGE檢測方法,可準確讀出目標DNA片段的大小,且檢測數據精確,與常規凝膠電泳檢測方法相比,其檢測效率更高。鄒麗梅等(2011)通過建立適用于玉米特定分離群體的高通量SSR檢測技術,對180份玉米DH系材料進行擴增及電泳分析,結果發現該技術提高了玉米分子育種效率。【本研究切入點】雖然SSR熒光標記CGE技術已成功應用于水稻、小麥、玉米、甘蔗等作物遺傳分析研究,但不同物種使用不同的PCR反應體系。PCR反應體系的建立是一個關鍵環節,反應體系中的多個因子均會直接影響PCR擴增效果及后續產物檢測準確性,尤其甘蔗是異源多倍體植物,其基因組DNA較復雜,但目前鮮見基于CGE技術的甘蔗SSR-PCR反應體系優化的研究報道。【擬解決的關鍵問題】建立基于CGE技術的甘蔗SSR-PCR反應體系,并用于甘蔗種質資源遺傳分析,為甘蔗遺傳多樣性和親緣關系研究、分子輔助育種及遺傳圖譜構建等提供可靠、有效的技術支持。
1 材料與方法
1. 1 試驗材料
供試甘蔗種質材料為PINDAR、ROC26、ROC20、CP72-1210、CP84-1198、GT02-237、GT97-69和GT69-
156,均采集自廣西農業科學院甘蔗研究所甘蔗資源圃;DNA聚合酶、dNTPs、SLS(上樣緩沖液,甲酰胺)、Genescan-500分子量內標和PAGE膠柱等購自生工生物工程(上海)股份有限公司;SSR引物由生工生物工程(上海)股份有限公司合成。
1. 2 總DNA提取
采用SDS法提取甘蔗總DNA(陳忠良等,2010;黃東亮等,2010):①取100 mg甘蔗嫩葉加入液氮于研缽中快速研磨成粉末,轉入2.0 mL離心管,加入800 μL DNA抽提緩沖液,搖勻,65 ℃水浴40 min。②加入200 μL 5 mol/L KAc(pH 5.2)充分混勻,冰浴12 min,4 ℃下10000 r/min離心15 min,取上清液加入等體積酚/氯仿、氯仿各抽提1次,12000 r/min離心10 min。③上清液加入1/10體積3 mol/L NaAc(pH 4.8)和2倍體積無水乙醇,-20 ℃靜置30 min沉淀DNA,再于4 ℃下10000 r/min離心10 min,棄上清液,用72%乙醇漂洗3次,晾干后加入100 μL TE溶解。④加入RNaseA至終濃度50 μg/mL,37 ℃水浴30 min。最后取2 μL總DNA液于0.8%瓊脂糖凝膠電泳檢測,-20 ℃保存備用。
1. 3 SSR引物篩選及合成
通過常規PAGE技術篩選出擴增條帶清晰、多態性高、重復性好的SSR引物,然后合成熒光引物(正向引物序列5′端加入CY5熒光分子信標,反向引物為常規合成),再進行SSR熒光引物篩選(Cordeiro et al.,2001;Pan et al.,2007)。
1. 4 SSR-PCR反應體系的建立
以甘蔗ROC26的總DNA為模板,SMC336BS為引物,反應體系20 μL,每處理重復2次。采用正交試驗設計L16(45),選擇dNTPs(含Mg2+)濃度、DNA聚合酶量、引物濃度和DNA模板量為考察因素,每個因素設計4個水平(表1)。PCR擴增程序:94 ℃預變性5 min;94 ℃ 45 s,退火1 min(退火溫度采用梯度PCR進行篩選),72 ℃ 50 s,進行30個循環;72 ℃終延伸2 min(陳忠良等,2010)。最后對PCR擴增結果依次打分(韓國輝等,2011)。
1. 5 PCR產物的CGE檢測
利用BECKMAN COULTER CEQ 8000系統遺傳分析儀對熒光SSR引物擴增的PCR產物進行CGE檢測。每個上樣孔的上樣體系:20.0 μL SLS,0.1 μL Genescan-500分子量內標,1.0 μL稀釋200倍的PCR產物。電泳分離程序:90 ℃變性2 min;進樣電壓2.0 kV,時間30 s;分離電壓7.5 kV,時間40 min,保存樣本信息。
1. 6 數據處理分析
利用GeneMapper-v3.0對遺傳分析系統儀收集的數據進行分析(Levinson and Gutman,1987;Clark,1988;Schlotterer and Tautz,1992)。將SSR標記片段與Genescan-500分子量標準品比較,得到SSR標記片段長度。對信號穩定且易于判讀的峰高采用“0-1”系統記錄其位置,在相同的片段大小位置有峰高記為“1”,無峰高則記為“0”,建立甘蔗SSR標記的0、1數據矩陣。最后利用NTSYS-pc 2.1,結合UPGMA進行聚類分析。
2 結果與分析
2. 1 甘蔗總DNA提取結果
0.8%瓊脂糖凝膠電泳檢測結果如圖1所示,提取的DNA樣品條帶明亮、清晰、完整,無拖尾現象,無明顯RNA帶,且點樣孔下端干凈不發亮,表明DNA未降解,純度較高,蛋白質和RNA等雜質去除較徹底。經測定,OD260/OD280為1.76~1.87,OD260/OD230為1.89~2.07,表明提取的甘蔗總DNA質量較好,可用于SSR分子標記分析。
2. 2 PCR反應體系的正交試驗結果
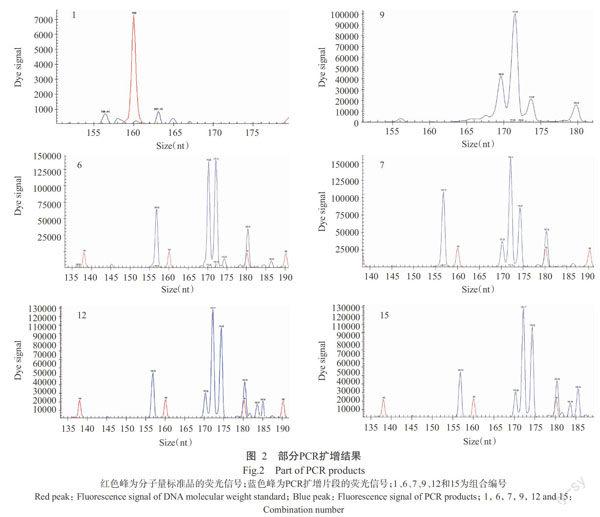
正交試驗L16(45)結果如圖2所示,16個組合的PCR產物均能檢測到目標峰高信號,組合15的峰高最多、信號強且穩定;dNTPs濃度和DNA聚合酶量過低均會影響PCR產物生成,導致檢測信號弱、峰高數少(擴增片段少);DNA聚合酶量和引物濃度過高會造成非特異性片段生成,檢測到雜峰,影響目標峰高的判讀。
PCR擴增結果得分如表2所示,目標峰高信號強、峰高數量多、穩定且易讀取的最佳產物記16分,最差的記1分。對其進行直觀分析,由于極差(R)大小能反映各因素對PCR反應體系的影響程度,正交設計的4個因素對SSR-PCR反應體系的影響排序依次為dNTPs濃度>DNA聚合酶>DNA模板量>引物濃度。根據各因素水平下的得分平均值(K)可初步確定最佳反應體系(20 μL):dNTPs 0.15 mmol/L,DNA聚合酶1.5 U,引物濃度0.50 μmol/L,DNA模板25 ng。這個體系與組合12(評分15分)最接近,僅DNA聚合酶用量有所不同。
2. 3 基于CGE技術的甘蔗SSR-PCR反應體系建立
根據正交試驗優化結果,采用最佳SSR-PCR反應體系(20 μL):dNTPs濃度0.15 mmol/L,DNA聚合酶1.5 U,引物濃度0.50 μmol/L,DNA模板量25 ng,用2對SSR熒光引物(SMC336BS和mSSCIR43)分別對2份甘蔗總DNA進行PCR擴增。擴增結果如圖3所示,所選用引物對的PCR產物檢測圖譜出峰有序、信號強、條帶峰單一、雜峰較少、重復性好,表明建立的基于CGE技術SSR-PCR反應體系穩定可靠。
2. 4 甘蔗種質資源遺傳分析結果
利用基于CGE技術的SSR-PCR反應體系對8份甘蔗種質材料進行遺傳多樣性分析,結果表明,8對引物共擴增出101個片段(表3),擴增片段在90~255 bp,平均每對引物擴增出12.6個片段,其中多態性片段93個,多態性比率為92.1%。引物SMC16SA擴增的片段最多,為16個;引物SMC336BS擴增片段最少,為10個,但其在ROC20和ROC26各擴增出1個能區別于其他甘蔗品種的特異片段,大小分別為169(圖4-c)和184 bp(圖4-b);引物mSSCIR43則從ROC20、ROC26和CP84-1198各擴增出1個能區別于其他甘蔗種質材料的特異片段,大小分別為232、234和247 bp。其中,SMC336BS和mSSCIR43的擴增產物檢測信號強、穩定、峰高單一、雜峰較少、區分度高,可將8份甘蔗種質材料有效區分,故用雙引物組合產生的分子數據可用于DNA指紋身份證構建(圖5)。
聚類分析結果如圖6所示,8份甘蔗種質材料間的相似性系數平均值為0.657,CP84-1198和GT69-156的相似性系數最大,為0.871;PINDAR和ROC26的相似性系數最小,為0.521。在相似性系數0.614處,所有參試材料可分為兩大類,3份國外種質材料PINDAR、CP72-1210、CP84-1198與ROC20、GT69-156聚為一類;而ROC26、GT02-237和GT97-69聚為另一類。3份桂糖種質材料(GT02-237、GT97-69和GT69-156)未聚在同一類,可能與其父母本親緣關系有關。這說明8份甘蔗種質材料有豐富的遺傳多樣性,且建立的SSR- CGE技術體系檢測結果穩定,重復性好,適用于甘蔗的遺傳分析及遺傳作圖。
3 討論
基于CGE熒光檢測系統建立的DNA自動分析技術,灌膠、上樣、片段分離和數據收集均自動完成,電泳檢測時各樣品中均加入分子量內標,可直接精確獲得各泳道DNA片段的大小,區分度達1 bp,該技術具有高通量、高效率、高精確性等優點,特別適用于大規模材料的分析研究。Bor等(2003)僅用50 h就完成了198份樣品約1000個位點的CGE熒光檢測分析。郝晨陽等(2005)對5000份北方冬小麥樣品進行檢測,除去儀器損耗成本,多重PCR-SSR熒光標記分析技術和常規的變性PAGE銀染技術的使用經費基本持平,但前者的效率顯著高于后者。本研究中SSR熒光引物合成的成本約800元1對引物(2OD),保存年限為2年,其成本遠高于普通引物的合成。常規的變性PAGE銀染技術所需成本較低,一般的實驗室就能完成,在分析較少的材料和位點時,是一套經濟有效的檢測技術,但人工讀取膠板工作繁瑣,且存在一定的人為誤差。因此,建議先運用常規的變性PAGE銀染檢測法對SSR引物進行篩選,再對篩選出的引物進行熒光標記,并進行多重PCR擴增分析;將變性PAGE銀染檢測法與CGE熒光檢測法有效結合起來完成試驗材料的檢測分析,可節省費用,同時提高工作效率。因此,SSR熒光標記CGE技術的不斷完善和發展,為作物的分子輔助育種研究提供了有力的技術支持。
通過SSR熒光標記與CGE檢測技術相結合,可實現SSR分子標記的自動化分析,而確立SSR-PCR反應最佳體系是實現自動化分析的前提。反應體系中各組分的含量均可能會影響PCR擴增的特異性、敏感性及產物的產量等。因此,本研究采用具有均衡分散性和整齊可比性的正交試驗設計,實行多因素聯合優化方法對甘蔗SSR-PCR反應體系的dNTPs濃度、DNA聚合酶量、引物濃度和DNA模板量進行優化,篩選各因素的最佳水平,獲得最優水平組合,最終確立最佳PCR反應體系,并通過重復試驗和8對SSR引物對其進行檢驗,結果表明所建立的SSR-PCR反應體系穩定可靠。利用該SSR-PCR反應體系和8對SSR引物對8份來自不同國家地區的甘蔗種質材料進行遺傳多樣性分析,并選用2對引物聯合進行指紋圖譜構建,結果表明SSR位點數量多、多態性高,且穩定性強、重復性好,為甘蔗種質資源遺傳分析和遺傳作圖構建等提供了有效的技術支持。
4 結論
通過正交試驗設計優化,建立了基于CGE技術的甘蔗SSR-PCR反應體系(20 μL):dNTPs濃度0.15 mmol/L,DNA聚合酶1.5 U,引物濃度0.50 μmol/L,DNA模板量25 ng。利用該體系對甘蔗種質材料進行檢測分析,其結果穩定、重復性好,適合甘蔗的遺傳分析及遺傳作圖。
參考文獻:
陳忠良,秦翠鮮,郭元元,楊翠芳,羅海斌,何海波. 2010. 一種適用于甘蔗SSR-PCR的DNA快速提取方法[J]. 廣西農業科學,41(11):1155-1157.
Chen Z L,Qin C X,Guo Y Y,Yang C F,Luo H B,He H B.2010. A rapid DNA extraction method from sugarcane leaves for SSR-PCR[J]. Guangxi Agricultural Sciences,41(11):1155-1157.
程本義,夏俊輝,龔俊義,楊仕華. 2011. SSR熒光標記毛細管電泳檢測法在水稻DNA指紋鑒定中的應用[J]. 中國水稻科學,25(6):672-676.
Cheng B Y,Xia J H,Gong J Y,Yang S H. 2011. Application of capillary electrophoresis detection with fluorescent SSR marker in rice DNA fingerprint identification[J]. Chinese Journal of Rice Science,25(6):672-676.
韓國輝,向素瓊,汪衛星,賈志剛,洪棋斌,梁國魯. 2011. 柑橘SCoT分子標記技術體系的建立及其在遺傳分析中的應用[J]. 園藝學報,38(1):1243-1250.
Han G H,Xiang S Q,Wang W X,Jia Z G,Hong Q B,Liang G L. 2011. Establishment and application of SCoT molecular marker system for citrus[J]. Acta Horticulturae Sinica,38(1):1243-1250.
郝晨陽,王蘭芬,賈繼增,董玉琛,張學勇. 2005. SSR熒光標記和銀染技術的比較分析[J]. 作物學報,31(2):144-149.
Hao C Y,Wang L F,Jia J Z,Dong Y C,Zhang X Y. 2005. Comparison of fluorescence and silver-staining detection systems of microsatellite markers[J]. Acta Agronomica Sinica,31(2):144-149.
黃東亮,覃肖良,廖青,高軼靜,方鋒學. 2010. 高質量甘蔗基因組DNA的簡便快速提取方法研究[J]. 生物技術通報,(5):101-106.
Huang D L,Qin X L,Liao Q,Gao Y J,Fang F X. 2010. Simple and rapid procedure for isolation of high quality genomic DNA from sugarcane[J]. Biotechnology Bulletin,(5):101-106.
李楊瑞,楊麗濤. 2009. 20世紀90年代以來我國甘蔗產業和科技的新發展[J]. 西南農業學報,22(5):1469-1475.
Li Y R,Yang L T. 2009. New developments in sugarcane industry and technologies in China since 1990[J]. Southwest China Journal of Agricultural Sciences,22(5):1469-1475.
梁俊,PAN Yong-bao,李楊瑞,方鋒學. 2010. 利用SSR標記與毛細管電泳技術對甘蔗屬進行的遺傳分析[J]. 廣西植物,30(1):106-111.
Liang J,Pan Y B,Li Y R,Fang F X. 2010. Assessment of genetic diversity in Saccharum using SSR markers and capillary electrophoresis[J]. Guihaia,30(1):106-111.
易紅梅,王鳳格,趙久然,王璐,郭景倫,原亞萍. 2006. 玉米品種SSR標記毛細管電泳熒光檢測法與變性銀染檢測法的比較研究[J]. 華北農業學報,21(5):64-67.
Yi H M,Wang F G,Zhao J R,Wang L,Guo J L,Yuan Y P.2006. Comparison of two maize SSR detection methods:capillary electrophoresis with fluorescence detection method and denaturing PAGE silver_staining detection method[J].Acta Agricuiture Boreali-Sinica,21(5):64-67.
張鳳娟. 2004. 雜交水稻岡優527品種真實性和純度的SSR檢測方法[D]. 楊凌:西北農林科技大學.
Zhang F G. 2004. The variety identification and purity detection of the hybrid rice GANG-YOU 527 using SSR marker[D].Yangling:Northwest Sci-Tech University of Agriculture and Forestry.
鄒麗梅,王鳳格,趙久然,許理文,易紅梅,宋偉. 2011. 適用于玉米特定分離群體的高通量SSR檢測技術研究[J]. 玉米科學,19(2):26-28,33.
Zou L M,Wang F G,Zhao J R,Xu L W,Yi H M,Song W. 2011.Mapping population of maize by high throughput measurement ssr electrophoresis technique[J]. Journal of Maize Sciences,19(2):26-28,33.
Bor P,Hindkjaer J,Kolvraa S,Ingerslev H J. 2003. A new approach for screening for Y microdeletions:capillary electrophoresis combined with fluorescent multiplex PCR[J]. Journal of Assisted Reproduction and Genetics,20(1):46-51.
Clark J M. 1988. Novel non-templated nucleotide addition reactions catalyzed by prokaryotic and eukaryotic DNA polymerases[J]. Nucleic Acids Research,16(20):9677-9686.
Cordeiro G M,Casu R,McIntyre C L,Manners J M,Henry R J.2001. Microsatellite markers from sugarcane(Saccharum spp.) ESTs cross transferable to erianthus and sorghum[J]. Plant Science,160(6):1115-1123.
Huang X,Borner A,Boder M,Ganal M. 2002. Assessing genetic diversity of wheat(Triticum aestivum L.) germplasm using microsatellite markers[J]. Theoretical and Applied Genetics,105(5):699-707.
Levinson G,Gutman G A. 1987. Slipped-strand mispairing:a major mechanism for DNA sequence evolution[J]. Molecular Biology & Evolution,4 (3):203-221.
Pan Y B,Scheffler B,Richard E P. 2007. High throughput genotyping of commercial sugarcane clones with microsatellite (SSR) DNA markers[J]. Sugar Tech,9:176-181.
Schlotterer C,Tautz D. 1992. Slippage synthesis of simple sequence DNA[J]. Nucleic Acids Research,20(2):211-215.
(責任編輯 陳 燕)

