花期低溫對晚稻干物質積累及分配的影響*
白光志,劉壽東,余焰文,楊再強**,殷建敏(. 南京信息工程大學氣象災害預報預警與評估協同創新中心,南京 0044;. 江西氣候中心,南昌330000)
?
花期低溫對晚稻干物質積累及分配的影響*
白光志1,劉壽東1,余焰文1,楊再強1**,殷建敏2
(1. 南京信息工程大學氣象災害預報預警與評估協同創新中心,南京 210044;2. 江西氣候中心,南昌330000)
摘要:以“廣兩優香66”為試材, 于2014年8-10月在南京信息工程大學農業氣象站進行人工控制實驗, 研究花期低溫對晚稻光合作用和后期灌漿過程的影響, 并分析低溫脅迫下晚稻后期干物質積累和分配的變化。低溫脅迫溫度設定為22℃ /17℃(晝/夜), 處理時間分別為2、4、6和8d, 分別依次記為T2d、T4d、T6d和T8d, 以外界環境條件32℃ /25℃ (晝/夜)為對照(CK)。結果表明:(1)低溫處理后, T2d處理最大光合速率(Pmax)變化較小, T4d和T6d分別比CK下降11.66%和21.47%, T8d的Pmax僅為17.25μmol·m?2·s?1, 比CK減少28.54%。低溫處理后葉片光飽和點(LSP)降低, 而光補償點(LCP)明顯升高, 與CK相比, T2d、T4d、T6d、T8d的LSP分別降低6.68%、8.08%、8.63%、10.87%, LCP升高2、3、4、6倍。說明低溫處理降低晚稻葉片的光合能力;(2)對不同處理的灌漿過程的擬合表明, 低溫處理時間越長, 達到最大灌漿速率所需時間(T-GRmax)越長, 晚稻最大千粒重(A)越小, 灌漿活躍期的時間(T90)也越短, 導致整體平均灌漿速率(GR)呈不同程度下降, 說明低溫會減緩晚稻的灌漿過程;(3)低溫處理時間越長, 晚稻結實率越低, 不超過2d低溫對結實率無顯著影響, 但4d及以上低溫處理能顯著降低晚稻結實率, T8d處理的結實率比CK降低34.39%;(4)晚稻總干物質與花期低溫處理時間呈負相關, 且低溫處理6d后總干物質顯著減少, T8d處理總干物質比CK減少28.05%, 其中葉片和穗部減少較明顯, 低溫處理4d后兩者干物質均明顯下降, 處理8d后比CK分別減少42.57%和38.70%。研究表明花期低溫處理抑制晚稻光合作用, 4d及以上低溫處理顯著降低結實率, 減緩籽粒灌漿過程, 對產量形成不利。
關鍵詞:花期低溫;晚稻;光合作用;灌漿;干物質
白光志,劉壽東,余焰文,等.花期低溫對晚稻干物質積累及分配的影響[J].中國農業氣象,2016,37(2):206-212
水稻的低溫冷害在許多國家均有發生,是全球性自然災害。全球有1500萬hm2以上的稻作面積受到低溫威脅,尤以日本、朝鮮和中國為甚[1]。據Deng 等[2]研究報道,全球每年因低溫傷害造成的農、林業損失高達數千億,Bertrand等[3]指出隨著全球氣候變暖,極端氣候尤其是低溫將更頻發,這一損失甚至還有可能增加。
Lyons[4]研究表明,水稻在溫度低于10~12℃時即表現出冷害癥狀。關于冷害對植物造成危害的原因,目前較普遍接受的觀點是0℃以上低溫引起了生物膜系統的損害[5],自由基產生和清除機制失衡[6-8],葉綠體超微結構破壞[9-10],葉綠素合成受抑制,導致光合能力下降[11]。低溫不僅降低在葉綠體基質中進行的光合作用暗反應活性[8],也引起類囊體膜介導的光反應活性降低[12],使類囊體膜上的PSⅡ的光能傳遞效率和光能轉換效率降低[13],從而導致CO2同化能力降低。據Kaniuga等[14]報道,低溫使葉綠體的希爾反應活性降低,使類囊體膜中PSⅡ的電子傳遞活性受抑,也會降低植物的光合能力。
穎花分化期低溫不僅顯著降低早稻葉片氣體交換能力,明顯降低穗粒數、結實率、千粒重和最終產量[15]。抽穗開花期遭遇低溫后,花粉育性受到影響,子房延長受到阻礙,空粒顯著增加[16],可導致結實率降低10%~20%,嚴重時可導致晚稻大幅減產[17]。邱上深[18]通過實驗證明,水稻花期和灌漿期的冷害機制主要是因低溫影響同化物的形成和運輸,進而影響劣勢位粒胚乳的分化和灌漿,致使部分子粒停止灌漿變為秕谷。低溫下,作物的多種生理活動均會有不同程度的下降,在宏觀上表現為延緩生長發育,進而導致生育期延長,此外還表現為作物生長量降低,干物質積累減少,群體生產力下降。夜間不同時段低溫處理明顯降低作物植株地上部分干物質積累總量,并導致葉片中糖和淀粉的積累,夜低溫處理使根中的干物質分配比率前期減少而后期增加,葉、莖的干物質分配比率增加,果實的干物質分配比率降低[19-20]。水稻產量形成的過程實質上是干物質積累與分配的過程,但關于晚稻干物質積累和分配對花期低溫的響應研究報道并不多見,本文通過研究花期不同低溫處理晚稻后期干物質積累和分配的特征,以期為晚稻后期低溫災害研究和指標制定提供一定科學依據。
1 材料與方法
1.1試驗設計
試驗在南京信息工程大學農業試驗站進行,以南京晚稻品種“廣兩優香66”為試材,2014年4月30日播種,5月30日將秧苗(五葉)分別移栽至30個塑料盆中,盆上口為邊長35cm 的正方形,盆底為邊長30cm 的正方形,盆深40cm。每個處理6盆,3盆用于測定灌漿速率,3盆用于測定成熟期干物質分配情況。每盆栽3株秧苗,置于田間保持良好生長,待水稻開始進入抽穗揚花期(8月27日)掛標識牌定穗,并取其中的24盆置于人工氣候箱(TPG-1260, Australian)中進行低溫處理,參照氣象行業標準《寒露風等級》[21]氣候箱設定白天(6:00-18:00 )和夜間(18:00-6:00)溫度分別為22℃和17℃,為避免臨界時間對試驗的影響,低溫處理時間設定為2、4、6和8d(分別記為T2d、T4d、T6d和T8d),處理結束后即取出置于室外。剩余6盆一直置于室外自然環境中,作為對照(CK)處理,處理期間晝/夜平均溫度為32℃/25℃。期間需關注室外溫度情況,若溫度低于處理溫度則需將室外水稻移至室內,避免自然低溫對試驗結果的影響,并記錄試驗期間各處理晚稻從灌漿至成熟所經歷的時間天數。
1.2測定項目
1.2.1光響應曲線測定
每個處理結束后的第一天9:00-11:00 測定水稻葉片光合速率,選取上3葉(劍葉、倒1葉和倒2葉)進行測定,采用便攜式光合作用測定系統(Li-6400,USA)測定水稻葉片凈光合速率(Pn)。設定參比室CO2濃度為400μL·L?1,葉室溫度為25℃,按照由強到弱的順序手動設定光輻射強度(PAR)分別為2000、1800、1600、1400、1200、1000、800、600、400、200、150、100、50、0μmol·m?2·s?1。每葉1次,共3次,即為3次重復。
1.2.2灌漿速率測定
每5d取一次掛標識牌定穗的稻穗,每次3穗,取下籽粒后,數其總粒數后放入鋁盒,在恒溫干燥箱中,60~80℃烘烤24h以上(幼小籽粒烘烤溫度宜低),使用精度為0.001g電子天平稱取籽粒干重,直至兩次重量相差不超過0.01g,再轉換成千粒重。
1.2.3干物質分配
將不同處理組的水稻按成熟先后依次收獲并分解為根、莖、葉和穗洗凈,分別在烘箱中烘干至恒重(前后兩次相差不超過0.01g)后測定干物質量,然后計算植株各器官干物質分配比例,并統計各處理組的結實率。
1.3統計分析
試驗數據運用DPS、SPSS進行相關統計分析,Excel作圖,使用Photosynthesis Work Bench程序進行光響應曲線擬合,使用Matlab對晚稻灌漿速率進行擬合,擬合方程為Richard模型,其表達式為

式中,t為晚稻開花后天數(d),y為對應時間t的晚稻千粒重,B為初值參數,K為生長速率參數,A為生長終止時的最大千粒重(g),N為環境充分系數,決定曲線形狀[22]。通過式(1)對t求導得到灌漿速率GR的表達式為

當t=0時,可求出初始灌漿速率GR0和初始相對灌漿速率即起始勢RGR0= GR0/y0,式(2)再對t求導,可得到灌漿速率的變化率GR′,由此可再求出灌漿持續天數T90、平均灌漿速率GR等,詳細參數說明及來源參考文獻[23-24]。
2 結果與分析
2.1花期低溫對晚稻葉片光響應曲線的影響
由圖1可見,與CK相比,低溫處理后晚稻葉片對光能的利用有不同程度的下降,相同光照強度下,隨著低溫處理時間的延長,晚稻葉片的凈光合速率下降,且下降幅度與低溫脅迫時間呈正相關。對各處理光響應曲線擬合后的特征值進行對比可見,CK的最大凈光合速率Pmax相對最高,為24.15μmol·m?2·s?1,隨著低溫處理時間的增加,Pmax持續減小,T2d相對CK變化較小,T4d和T6d分別比CK下降11.66%和21.47%,T8d的Pmax僅為17.25μmol·m?2·s?1,比CK減少了28.54%。不同處理下晚稻葉片光飽和點LSP的變化與Pmax的變化趨勢類似,低溫處理8d的LSP最低,僅1280μmol·m?2·s?1,比CK的1436μmol·m?2·s?1下降了約10%。不同處理下晚稻光補償點LCP的變化趨勢則與LSP相反,以CK為最低,僅4μmol·m?2·s?1,低溫處理后LCP有明顯升高,T2d、T4d、T6d、T8d 的LSP分別較CK升高2、3、4、6倍。

圖1 各處理葉片光響應曲線Fig. 1 Light response curves of rice leave under different treatments
2.2花期低溫對晚稻灌漿速率的影響
對不同處理晚稻灌漿速率進行方程擬合,結果見表1。由表可見,各處理方程的決定系數均超過0.98,說明擬合結果較可靠。最大千粒重A隨花期低溫處理時間的增加呈不同程度下降,且低溫處理時間越長下降幅度越大,CK的A值最大,為29.311g,低溫處理2d后減小了16.89%。低溫處理4d后A值為22.022g,低溫處理6d和8d的A值有明顯下降,分別僅為CK的64.59%和53.88%。
在確定方程參數基礎上進一步確定灌漿過程的相關特征參數,結果見表2。由表可見,初始灌漿速率GR0隨著低溫處理時間的增加呈持續下降趨勢,T2d、T4d、T6d和T8d各處理GR0相對CK分別減小了19.26%、47.31%、59.87%和69.01%,說明花期低溫處理對晚稻初始灌漿速率有一定的抑制作用,且低溫處理時間越長,抑制作用越明顯。不同處理下晚稻的初始相對灌漿速率RGR0和最大灌漿速率GRmax則均呈先增加后減小的趨勢,低溫處理2d,兩者相對CK均有一定上升,隨著低溫時間的增加,則又開始有不同程度的下降,其中GRmax的變化幅度相對較小,RGR0下降則更明顯,T8d處理下RGR0比CK減少了近50%。最大灌漿速率對應的花后天數T-GRmax和此時的千粒重y-GRmax兩者對花期低溫響應的整體趨勢大致相似,短期(2d)低溫處理,兩者有不同程度減小,低溫處理時間超過2d,則均隨低溫處理時間增加而增加,且T-GRmax對低溫的響應更明顯,長時間花期低溫處理后晚稻灌漿速率最大時的時間明顯推遲,T8d處理相對CK更是晚了近12d,但此時千粒重減少卻不多。此外,花期低溫也會明顯縮短晚稻的灌漿活躍期T90,各低溫處理組灌漿活躍期相對CK縮短5~12d,且低溫處理時間和T90的下降幅度呈正相關。

表1 不同處理下Richard方程的參數結果Table 1 The simulated results of Richard equation parameters for rice grouting process under different treatments
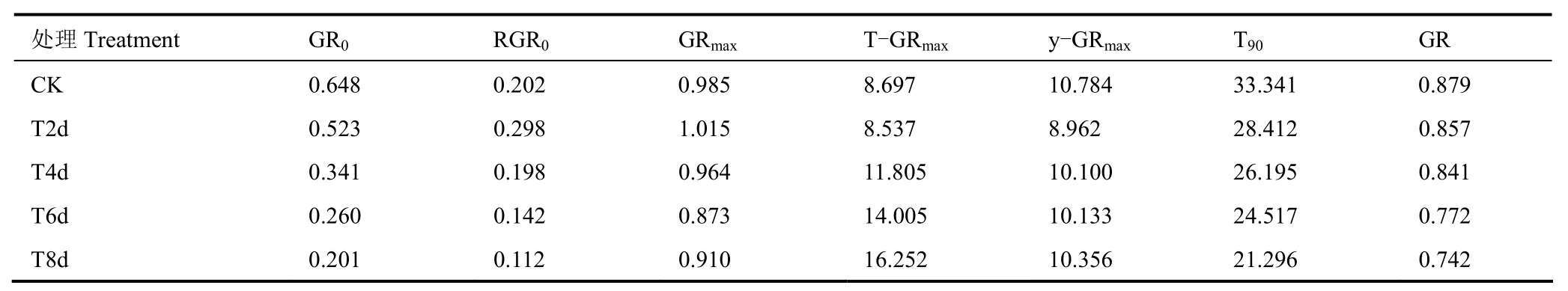
表2 不同處理晚稻灌漿速率的特征參數Table 2 Characteristic parameters of rice filling rate under different treatments
2.3花期低溫對晚稻結實率和干物質分配的影響

表3 不同處理下晚稻的結實率(%)Table 3 Seed setting of rice under different treatments(%)
不同低溫處理下晚稻的結實率見表3,由表可見,隨著低溫處理時間的延長,晚稻結實率有不同程度的降低,低溫處理時間越長,結實率越低,CK結實率最高,為86.02%,低溫處理8d后結實率最低,僅56.44%,相對CK減少了34.39%。各低溫處理組間結實率均差異顯著,但T2d和CK差異不顯著。
由圖2a可見,短期(不超過4d)低溫處理晚稻干物質有不同幅度下降,但與CK相比并不顯著,而低溫脅迫時間超過(含)6d后則總干物質明顯減少,T6d和T8d總干物質分別為170.43和147.13g/株,比CK分別減少16.65%和28.05%,說明較長時間的低溫脅迫處理對晚稻干物質積累的影響顯著。不同低溫處理時間下晚稻成熟后根系的干重有所增加,但是各處理間差異均不顯著,低溫脅迫時間不超過8d處理下晚稻莖稈干重減少不明顯,低溫脅迫8d后則會顯著減少。晚稻葉片和穗的干重對花期低溫的響應相似,低溫脅迫4d后葉和穗的干重顯著降低,低溫脅迫8d處理葉和穗的干重最小,分別僅為21.06 和54.96g,比CK分別減少42.57%和38.70%。
晚稻各器官干物質所占比例的變化見圖2b,由圖可見,各處理組間莖稈所占的比例無顯著變化,花期低溫脅迫不超過6d,晚稻葉片干物質占總干物質的比例無明顯變化,而低溫脅迫8d后葉片占干物質的比例明顯減少,穗占干物質比例在各器官中最高,其變化規律與葉片基本一致。各處理間根系的干物質變化雖然不顯著,但其所占總干物質的比例卻有較明顯的差異。隨著低溫脅迫時間的增加,根系干物質所占比例也增加,脅迫時間超過2d后與CK相比增加顯著。

圖3 不同處理晚稻成熟時單株各器官干物質重量(a)及其比例(b)Fig. 3 Organs dry weight(a) and its percentage(b) at rice maturity stage under different treatments

3 結論與討論
光合作用是作物最重要的生理過程之一,是植物生長發育的基礎,是植物合成有機物質和獲得能量的根本來源,它可以反映植株生長勢和抗性強弱[25],同時其受低溫的影響也最明顯。低溫對作物光合作用的影響幾乎貫穿整個光合過程的各個環節,包括光電子的吸收和轉運、氣體交換、碳同化過程等。楊猛等[26]以玉米為實驗材料發現隨著低溫脅迫處理時間的延長和程度的加強,光合速率(Pn)、氣孔導度(Gs)、蒸騰速率(Tr)、PSⅡ最大光能轉換效率(Fv/Fm)和光系統PSⅡ的潛在活性(Fv/Fo)呈下降趨勢,說明低溫脅迫使葉片光系統PSⅡ活性中心受損,光合作用效率也因此降低,從而表現出光合速率下降趨勢。本實驗也得出類似結論,隨著低溫脅迫時間的增加,水稻葉片最大光合速率和光飽和點下降,光補償點和暗呼吸速率升高,說明低溫對光合作用的抑制作用明顯。李平等[27]研究發現,水稻后期受低溫影響后表觀量子效率和最大光合速率均降低,而FBPase活性也在低溫影響下有一定的降低。FBPase對光合作用的運轉和光合產物轉化以及運輸有非常重要的作用,低溫作用下水稻光合效率和FBPase活性均下降,光合產物運輸受阻,導致源庫失衡,這可能是導致水稻減產的主要原因之一。雖然低溫處理時間的不同導致各處理間測定葉片的葉齡不完全一致,但測定時仍處于晚稻抽穗揚花期,葉齡差異相對低溫對光合作用的影響相對較小。結實率是水稻產量重要的要素之一,許多研究對后期低溫處理后水稻結實率降低已形成共識[28-29],主要原因是低溫使花粉發育延遲,花藥開裂不暢,花粉萌發率下降,影響水稻受精結實[16,30],這也是低溫降低水稻產量的重要原因之一。
灌漿過程是光合產物向籽粒運輸和積累的過程,水稻籽粒灌漿狀況最終決定了籽粒的產量和稻米的質量。本文通過Richard方程對水稻的灌漿過程進行擬合,決定系數均超過0.98,說明擬合的結果可信度較高,再通過擬合方程的參數,根據灌漿過程的生物學意義得出灌漿過程的相關參數,結果表明,低溫作用下晚稻的初始灌漿速率和灌漿活躍期均隨著低溫脅迫時間增加有明顯下降,平均灌漿速率也呈現相同規律,而灌漿速率最大時對應的花后天數對低溫脅迫時間的響應則表現為增加的趨勢。初始相對灌漿速率對低溫脅迫時間的響應則表現出先增大后減小的趨勢,這可能是晚稻對低溫逆境適應性的一種表現。說明低溫脅迫影響下,晚稻整體的灌漿速率和灌漿時間均有所縮小,最終導致千粒重下降,產量降低。徐田軍等[31]的研究也得出類似結論。
光合產物向各個器官的運輸與分配直接關系到植物體的生長和產量的形成,分析晚稻后期的干物質分配特點可以更好地研究光合產物運輸過程的源庫平衡關系。試驗發現,晚稻的總干重隨著低溫脅迫時間的增加呈不同程度的減小,且低溫脅迫6d后減小顯著,莖、葉和穗對低溫的響應也表現出類似規律,葉和穗的干重在低溫脅迫4d后明顯下降,而莖稈的干重則在低溫脅迫8d后顯著減少,根系的干重隨著低溫脅迫時間的增加有所增加,但是并不顯著。綜合分析,本研究認為,短期低溫處理下(不超過2d),低溫主要影響水稻光合作用,但是恢復正常溫度后光合作用能達到正常水平,這是T2d與CK相比,最終各器官干物質無顯著差異的原因。低溫處理超過4d則會減緩花粉發育,使花藥不能正常開裂,影響水稻受精,導致結實率降低,此外還會引起庫源失衡,籽粒飽滿程度降低,最大千粒重減小,灌漿活躍期縮短,減緩籽粒的灌漿過程,這可能是花期低溫導致水稻產量降低的主要原因。
本研究旨在分析花期低溫對晚稻干物質積累和分配的影響,為晚稻的低溫災害研究提供一定理論依據,也可為水稻的低溫防御提供理論支撐,但供試品種僅選用一個,其結果對其它水稻品種是否試用有待更多的試驗考究。
參考文獻References
[1]鐘克友,唐湘如,胡飛,等.水稻劍葉氣孔性狀與孕穗期耐冷性的關系研究[J].西北植物學報,2010, 30(1):98-103.
Zhong K Y,Tang X R,Hu F,et al.Correlations between the cold tolerance during the booting stage and the stomatal traits of flag leaf surface in rice[J].Acta Bot.Boreal.-Occident.Sin, 2010,30(1):98-103.(in Chinese)
[2]Deng J.Advances of studies on plant freezing tolerance mechanism:freezing tolerance gene expression and its function[J].Chinese Bulletin of Botany,2001,18(5):521-530.
[3]Bertrand A,Castonguay Y.Plant adaptations to overwintering stresses and implications of climate change[J].Canadian Journal of Botanical,2003,81:1145-1152.
[4]Lyons J M.Chilling injury in plants[J].Ann Rev Plant Physiol,1973,24(6):445- 451.
[5]Levitt J.Responses of plants to environmental stresses[S].New York:Academic Press,1980: 23-64.
[6]曾乃燕,何軍賢,趙文,等.低溫脅迫期間水稻光合膜色素與蛋白水平的變化[J].西北植物學報,2000,20(1): 8-14.
Zeng N Y, He J X, Zhao W, et al.Changes in components of pigments and proteins in rice photosynthetic membrane during chilling stress[J].Acta Bot.Boreal.-Occident. Sin,2000, 20(1):8-14.(in Chinese)
[7]陳善娜,鄒曉菊,梁斌.水稻不同抗冷品種幼苗葉細胞膜系統的電鏡觀察(簡報)[J].植物生理學通訊,1997,33(3):191-194.
Chen S N,Zou X J,Liang B.Electronmicroscope observation on membrane system of leave cells of some varieties of rice seedlings with different cold-resistance[J].Plant Physiology Communications,1997,33(3):191-194.(in Chinese)
[8]Weeden N F,Buchanan B B.Leaf cytosolic fructose-1, 6-biphosphatase-A potential targets in low temperature stress[J].Plant Physiol,1983,2(1):259-261.
[9]王靜,張成軍,陳國祥,等.低溫對灌漿期水稻劍葉光合色素和類囊體膜脂肪酸的影響[J].中國水稻科學,2006,20(2):177-182.
Wang J,Zhang C J,Chen G X,et al.Effect of low temperature on photosynthetic pigments and thylakoid membrane fatty acid in flag leaves of rice at the milky stage[J].Chinese J Rice Sci,2006,20(2):177-182.(in Chinese)
[10]Kratsch H A,Wise R R.The ultrastructure of chilling stress[J].Plant Cell and Environment,2000,23(4): 337-350.
[11]王國莉,郭振飛.低溫對水稻不同耐性品種幼苗光和速率和葉綠素熒光參數的影響[J].中國水稻科學,2005,19(4):381-383.
Wang G L,Guo Z F.Effects of chilling stress on photosynthetic rate and the parameters of chlorophyll fluorescence in two rice varieties differing in sensitivity[J]. Chinese J Rice Sci,2005,19(4):381-383.(in Chinese)
[12]李平,劉鴻先,王以柔,等.低溫對雜交水稻及其親本三系始穗期旗葉光合作用的影響[J].植物學報,1990,32(6):456-464.
Li P,Liu H X,Wang Y R,et al.Effect of chilling on photosynthesis in flag leaves at primary heading stage of F1 hybrid rice cultivars and their parental lines(Three lines)[J]. Acta Botanica Sinica,1990,32(6):456-464.(in Chinese)
[13]李平,陳貽竹,李曉萍,等.秈稻的耐冷性與親本的關系[J].植物學報,1994,37(7):544-551.
Li P,Chen Y Z,Li X P,et al.The cold tolerance of INDICA type rice in relation to its parents[J].Acta Botanica Sinica,1994,37(7):544-551.(in Chinese)
[14]Kaniuga Z,Zabek J,Sochanoeicz B.Photosynthetic apparatus in chilling-sensitive plants Ⅲ:contribution of loosely bound manganese to the mechanism of reversible in activation of Hill reaction activity following cold and dark storage and illumination of leaves[J].Planta,1979,144:490-502.
[15]張金恩,聶秋生,李迎春,等.穎花分化期低溫處理對早稻葉片光合能力和產量的影響[J].中國農業氣象,2014,35(4): 410-416.
Zhang J E,Nie Q S,Li Y C,et al.Effects of low temperature stress on the photosynthetic capacity and yield components of early rice at the spikelet differentiation stage[J].Chinese Journal of Agrometeorology,2014,35(4):410-416.(in Chinese)
[16]鄧化冰,車芳璐,肖應輝,等.開花期低溫脅迫對水稻花粉性狀及劍葉理化特性的影響[J].應用生態學報,2011,22 (1):66-72.
Deng H B,Che F L,Xiao Y H,et al.Effects of low temperature stress during flowering period on pollen characters and flag leaf physiological and biochemical characteristics of rice[J].Chinese Journal of Applied Ecology,2011,22(1):66-72. (in Chinese)
[17]黃宇,王華.寒露風對水稻生產的影響[J].湖南農業,2008, (9):12.
Huang Y,Wang H.Effect of autumn low temperature on rice production[J].Hunan Agricuture,2008,(9):12.(in Chinese)
[18]邱上深.水稻冷害機制探討[J].中國農業氣象,1994,15(5): 41-45.
Qiu S S.Investigation of the mechanism of rice cold damage[J].Chinese Journal of Agrometeorology,1994,15(5): 41-45.(in Chinese)
[19]王麗娟,李天來,崔娜.夜間不同時段低溫對番茄光合產物積累與分配的影響[J].沈陽農業大學學報,2006,37(6): 811-815.
Wang L J,Li T L,Cui N.Effects of different Time Lowtemperature at night on dry matter accumulation and distribution in tomato[J].Journal of Shenyang Agricultural University,2006,37(6):811-815.(in Chinese)
[20]王麗娟,李天來,齊紅巖,等.長期夜間亞低溫對番茄生長發育及光合產物分配的影響[J].沈陽農業大學學報,2006, 37(3):300-303.
Wang L J,Li T L,Qi H Y,et al.Effects of Long-term Sub-low Temperature on growth and development and dry matter distribution in Tomato[J].Journal of Shenyang Agricultural University,2006,37(3):300-303.(in Chinese)
[21]王保生,杜筱玲,劉文英,等.QX/T94-2008寒露風等級[S].北京:氣象出版社, 2008.
Wang B S,Du X L,Liu W Y,et al.QX/T94-2008 grade of autumn low temperature[S].Beijing:China Meteorological Press,2008.(in Chinese)
[22]薛香,吳玉娥,陳榮江,等.小麥籽粒灌漿過程的不同數學模型模擬比較[J].麥類作物學報,2006,26(6):169-171.
Xue X,Wu Y E,Chen R J,et al.Comparison of different mathematical equations for simulating the grain filling process of wheat[J].Journal of Triticeae Crops,2006,26(6): 169-171.(in Chinese)
[23]朱慶森,曹顯祖,駱亦其.水稻籽粒灌漿的生長分析[J].作物學報,1988,14(3):182-192.
Zhu Q S,Cao X Z,Luo Y Q.Growth analysis on the process of grain filling in rice[J].Acta Agronomica Sinica,1988, 14(3):182-192.(in Chinese)
[24]顧世梁,朱慶森,楊建昌,等.不同水稻材料籽粒灌漿特性的分析[J].作物學報,2001,27(1):7-14.
Gu S L,Zhu Q S,Yang J C,et al.Analysis on grain fil1ing characteristics for different rice types[J].Acta Agronomica Sinica,2001,27(1):7-14.(in Chinese)
[25]Sharp R E,Poroyko V,Hejlek L G.Root growth maintenance during water deficits:physiology to functional genomies[J].J Exp Bot,2004,55:2343-2351.
[26]楊猛,魏玲,胡萌,等.低溫脅迫對玉米幼苗光合特性的影響[J].東北農業大學學報,2012,43(1):66-70.
Yang M,Wei L,Hu M,et al.Effect of low temperature stress on photosynthetic characteristics of maize seedling[J]. Journal of Northeast Agricultural University,2012,43(1): 66-70.(in Chinese)
[27]李平,王以柔,陳貽竹,等.低溫對雜交水稻乳熟期劍葉光合作用和光合產物運輸的影響[J].植物學報,1994,36(1): 45-52.
Li P,Wang Y R,Chen Y Z.Effects of chilling temperature on photosynthesis and photosynthate transport in flag leaves of hybrid rice at milky stage[J].Acta Bot anica Sinica,1994, 36(1):45-52.(in Chinese)
[28]王連敏,王立志,張國民.寒地水稻耐冷基礎的研究Ⅲ:花期低溫對水稻結實的影響[J].中國農業氣象,1997,18(5):9-11.
Wang L M,Wang L Z,Zhang G M.Effect of cooling temperature at flowering stage on spikelet fertility of rice plant[J].Chinese Journal of Agrometeorology,1997,18(5): 9-11.(in Chinese)
[29]朱海霞,王秋京,閆平,等.孕穗抽穗期低溫處理對黑龍江省主栽水稻品種結實率的影響[J].中國農業氣象,2012,33(2): 304-309.
Zhu H X,Wang Q J,Yan P,et al.Effect of low temperature at heading stage on seed setting rate of major rice varieties in Heilongjiang province[J].Chinese Journal of Agrometeorology, 2012, 33(2):304-309.(in Chinese)
[30]Satake T,Shibata M.Male sterility caused by cooling treatment at the young micro spore stage in rice plants X X XI:four components participating in fertilization[J].Japanese Journal of Crop Science,1992,61:454-462.
[31]徐田軍,王榮煥,趙久然,等.不同播期條件下‘京單68’和‘鄭單958’的籽粒灌漿特性研究[J].農學學報,2013,3(10): 1-5.
Xu T J,Wang R H,Zhao J R,et al.The study on the grain filling characteristics of ‘Jingdan68’ and ‘Zhengdan958’under different sowing dates[J].Journal of Agriculture,2013, 3(10):1-5.(in Chinese)
Effect of Low Temperature at Flowering Stage on Late Rice Dry Matter Accumulation and Distribution
BAI Guang-zhi1, LIU Shou-dong1, YU Yan-wen1, YANG Zai-qiang1, YIN Jian-min2
(1.Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044,China; 2.Jiangxi Province Climate Center, Nanchang 330000)
Abstract:To study the impact of low temperature during flowering stage to photosynthesis, grain filling process, and dry matter accumulation and distribution, we took Guangliangyouxiang 66as a material in artificial control test in Nanjing University of Information Science & Technology from August to October in 2014. The low stress temperature was set as 22℃/17℃(day/night), and processing time was 2d, 4d, 6d and 8d (denoted as T2d, T4d, T6d and T8d), and 32℃/25℃ (day/night) as the control (CK). The results showed that: (1)after low temperature treatment, maximum photosynthetic rate (Pmax) of T2d changed smaller, and that of T4d and T6d were respectively 11.66% and 11.66% lower than CK. Pmaxof T8d was only 17.25μmol·m?2·s?1, which decreased by 28.54% than CK. In addition, the light saturation point (LSP) reduced after low temperature treatment, and the light compensation point (LCP) increased significantly. Compared with CK, T2d, T4d, T6d, T8d LSP was reduced by 6.68%, 8.08%, 8.63%, 10.87%, but LCP increased 2, 3, 4, 6 times. This means low temperature treatment can reduce thephotosynthetic capacity of late rice leaf. (2)When modeling grain fitting process of different treatments, we found that with more treatment time, the time required to reach the maximum filling rate(T-GRmax) was more, the largest grain weight(A) and time of the active period (T90) were less, which resulting a decline of average filling rate (GR). And this indicated that the low temperature will slow the process of rice grain filling. (3)The longer processing time, the lower the seed setting of rate rice. Treatment no more than 2d, the seed setting would not change significantly, but treatment more than 4d would result seed setting significant decline. Compared to CK, seed setting of T8d reduced by 34.39%. (4)The total dry matter was negatively correlated with low temperature treatment time, and the total dry matter would significant reduced if low temperature treatment after 6d. That of T8d showed a 28.05% decline compared to CK, which leaf and spike contributed obviously. And after 4d treatment, dry matter of leaf and spike would significant decline. Compared to CK, dry matter of leaf and spike of T8d were reduced by 42.57% and 38.07%. Result showed that low temperature at flowering stage could inhibit late rice photosynthesis. More than 4d treatment could significantly reduce the seed setting, slow down the process of grain filling, and those were adverse to the yield formation.
Key words:Low temperature at flowering stage; Late rice; Photosynthesis; Grain filling; Dry matter
doi:10.3969/j.issn.1000-6362.2016.02.0103
* 收稿日期:2015-07-21**通訊作者。E-mail:yzq@nuist.edu.cn
基金項目:國家科技部農業科技成果轉化資金項目(2012GB24160606)
作者簡介:白光志(1971-),碩士生, 主要從事農業氣象災害研究。E-mail: 00687@nuist.edu.cn

