大穗材料高麥1號/ 密小穗F2群體穗長性狀的QTL初步定位
劉書含,侯立江,華冠勛,宋瑜龍,牛 娜,馬守才,宋亞珍,王軍衛,張改生
(西北農林科技大學農學院/國家楊凌農業生物技術育種中心/國家小麥改良中心楊凌分中心/小麥育種教育部工程研究中心/陜西省作物雜種優勢研究與利用重點實驗室,陜西楊凌 712100)
?
大穗材料高麥1號/ 密小穗F2群體穗長性狀的QTL初步定位
劉書含,侯立江,華冠勛,宋瑜龍,牛 娜,馬守才,宋亞珍,王軍衛,張改生
(西北農林科技大學農學院/國家楊凌農業生物技術育種中心/國家小麥改良中心楊凌分中心/小麥育種教育部工程研究中心/陜西省作物雜種優勢研究與利用重點實驗室,陜西楊凌 712100)
摘要:為了解小麥穗長性狀的遺傳特性,并將其應用于分子標記輔助育種,以大穗材料高麥1號/密小穗的292個植株的F2群體為材料,利用SSR標記對穗長進行了QTL定位分析。結果表明,選用500對SSR引物對高麥1號和密小穗兩個親本進行多態性檢測,共獲得180對在雙親間有多態性的引物,多態性引物檢出率為36.0%。利用這180對引物進一步進行F2群體篩選,有96對引物在群體中表現出多態性,占多態性標記的53.3%。利用QTL_IciMapping軟件構建出小麥染色體組的8個連鎖群圖譜,并將96對SSR引物定位到遺傳連鎖圖譜上。圖譜全長1 383.29 cM,標記間的平均遺傳距離15.37 cM。平均每個連鎖群有11.25個標記,含有標記最多的是4A和6B染色體,各有17個標記,其次是3A和7B染色體,含有9~14個標記,1B和5D染色體含有的標記最少,只有5~7個。共檢測出7個與穗長相關的QTL位點,包括6個加性QTL和1個加性+顯性QTL。7個QTL的加性效應值均為正值,單個QTL的貢獻率為2.04%~15.26%。其中3A染色體上的QTL位點距離其最近標記只有0.58 cM,為連鎖最緊密的一個位點,并且其加性效應值最大,可解釋表型變異的15.26%。因此,3A染色體上存在控制穗長的主效基因。
關鍵詞:小麥;F2群體;穗長;QTL;連鎖圖譜
穗長是小麥的一個重要農藝性狀,與小麥的三個產量構成因素密切相關,許多育種家將穗長性狀作為育種和考種環節中的一個重要指標。已有的研究發現,小麥穗長的遺傳力和雜種優勢均較高。目前,國內外研究者利用不同群體進行小麥穗部相關性狀的QTL定位已有諸多報道。Li等[1]以Opata85和W-7984雜交構建的重組自交系群體(RILs)為研究對象,檢測到7個與穗長相關的QTL,分別位于1A、4A、7A和7B四條染色體的長臂上以及1B染色體的短臂上,基因作用方式為顯性效應,親本Opata85的穗長等位基因具有增加穗長的效應。Sourdille等[2]選用DH群體為研究對象,共定位了5個與穗長相關的QTL位點,分別位于1AL、2BS、2DS、4AS和5AS染色體上,單個QTL可解釋6.9%~11.6%的穗長變異。Kumar等[3]以WL711×PH132構建的100份RILs進行小麥穗長QTL定位時,共檢測到8個QTL,分別位于2BL和2DL兩條染色體上,單個QTL的貢獻率為9.86%~18.10%。Manickavelu等[4]以中國春×KT19-1構建的F8代RILs群體為材料,檢測到4個控制穗長的QTL,分別位于2A和5AL上,對表型變異的貢獻率為7.7%~49.4%。Patil等[5]利用PDW233×Bhalegaon 4獲得的RILs群體共檢測到5個控制穗長的QTL,它們與環境效應緊密相關,分別位于3B、4B和7A上,貢獻率為7.08%~16.35%。但這眾多研究結果卻存在差異,導致這一結果的原因可能是試驗材料和群體類型不一樣,此外,環境因素也會對試驗數據調查的準確性造成影響。
楊在君和彭麗娟[6]認為穗長是一個具有高遺傳力的數量性狀。盧 翔等[7]認為穗長性狀是由多基因控制的,但不存在主基因,這與畢曉靜等[8]的研究結果相一致。杜希朋等[9]也認為穗長受微效多基因控制,無主基因。而海 燕等[10]研究認為控制穗長的基因對數較少,主效基因作用明顯。不同的研究結果表明,穗長性狀遺傳具有復雜性。目前,有關穗長基因的克隆還未見報道,因此,對穗長進行QTL研究顯得尤為重要。
高麥1號和密小穗,在籽粒形態及大小、株高、穗長、穗粒數及穗粒重等性狀上差異顯著,且后代遺傳變異豐富,是研究小麥農藝性狀重要基因/QTL比較理想的材料。所以,本研究以高麥1號和密小穗雜交構建的含292個植株的F2群體為試驗材料,利用微衛星(Simple sequence repeat,SSR)標記對穗長進行數量性狀基因座(Quantitative trait locus,QTL)定位分析,以期對小麥穗長性狀QTL進行初步定位,為下一步的精細定位和分子標記輔助育種奠定基礎,同時為研究小麥穗長遺傳提供參考。
1材料與方法
1.1試驗材料及其田間種植
供試材料為高麥1號、密小穗及其二者雜交所獲得的292個F2代材料,均由本實驗室提供。2013年10月上旬將所有材料播種于西北農林科技大學試驗農場,2行區,行長l m,行距25 cm,株距6 cm,田間管理同大田生產,生長期間沒有發生倒伏和其他病害。成熟后,統計穗長數值。
1.2引 物
本研究所用SSR引物信息均可從 http://wheat.pw.usda.gov網站上搜索得到,大部分引物由Invitrongen公司合成,部分引物由西北農林科技大學農學院韓德俊實驗室提供。
1.3DNA的提取及PCR擴增
DNA提取采用常規CTAB法。PCR反應體系(20 μL):模板DNA(50 ng·μL-1)1.5 μL ,2×TaqMaster Mix(Vazyme Biotech公司)10 μL,上下游引物(10 mmol·L-1)各1 μL,ddH2O補足至20 μL。PCR反應程序:95 ℃預變性3 min;94 ℃變性30 s,55~60 ℃退火30 s(各引物具體退火溫度參考http: //wheat.pw.usda.gov網站),72 ℃延伸1 min,30個循環;72 ℃延伸7 min,4 ℃保存。
1.4連鎖圖譜的構建和QTL定位
根據SSR擴增結果,將與高麥1號相同的帶型記為2,與密小穗相同的帶型記為0,雜合、缺失或者模糊的帶型記為1;穗長表型值記錄方式與帶型統計相同。利用QTL_IciMapping作圖軟件構建連鎖圖譜。利用SPSS軟件對小麥穗長的表型數據進行統計分析。用QTL_IciMapping軟件(http://www.isbreeding.net)中ICIM-ADD方法以及復合區間作圖法進行QTL分析。檢測過程中,以LOD=2.5為統計檢測閾值[13],step值為1 cM,若LOD≥2.5,則認為該區間LOD值最高處所對應的位點即為該性狀的1個QTL,并計算每個QTL的貢獻率和加性效應值。QTL的命名方式:Q+性狀名稱縮寫+染色體編號+編號。
2結果與分析
2.1親本及其F2群體的穗長分析
由圖1、表1可知,2個親本穗部性狀差異較大,其中,高麥1號在穗長上為高值親本,平均穗長14 cm;密小穗為低值親本,平均穗長4.1 cm。F2群體中,穗長最大值為20.0 cm,最小值為3.0 cm,平均10.5 cm (表1)。F2群體穗長偏斜度值(0.585)和峰度值(-0.522)的絕對值都小于1,符合正態分布(圖2)。

圖1 親本表型

性狀Trait親本 Parent高麥1號Gaomai1密小穗Mixiaosui親本間差值DifferencebetweenparentsF2群體 F2population平均值Mean變化范圍Range標準差Standarddeviation變異系數Coefficientofvariation/%穗長 Spikelength/cm144.19.9**10.5**3.0~20.04.1439.4
** 表示差異達極顯著水平
** indicated the level of highly significant difference
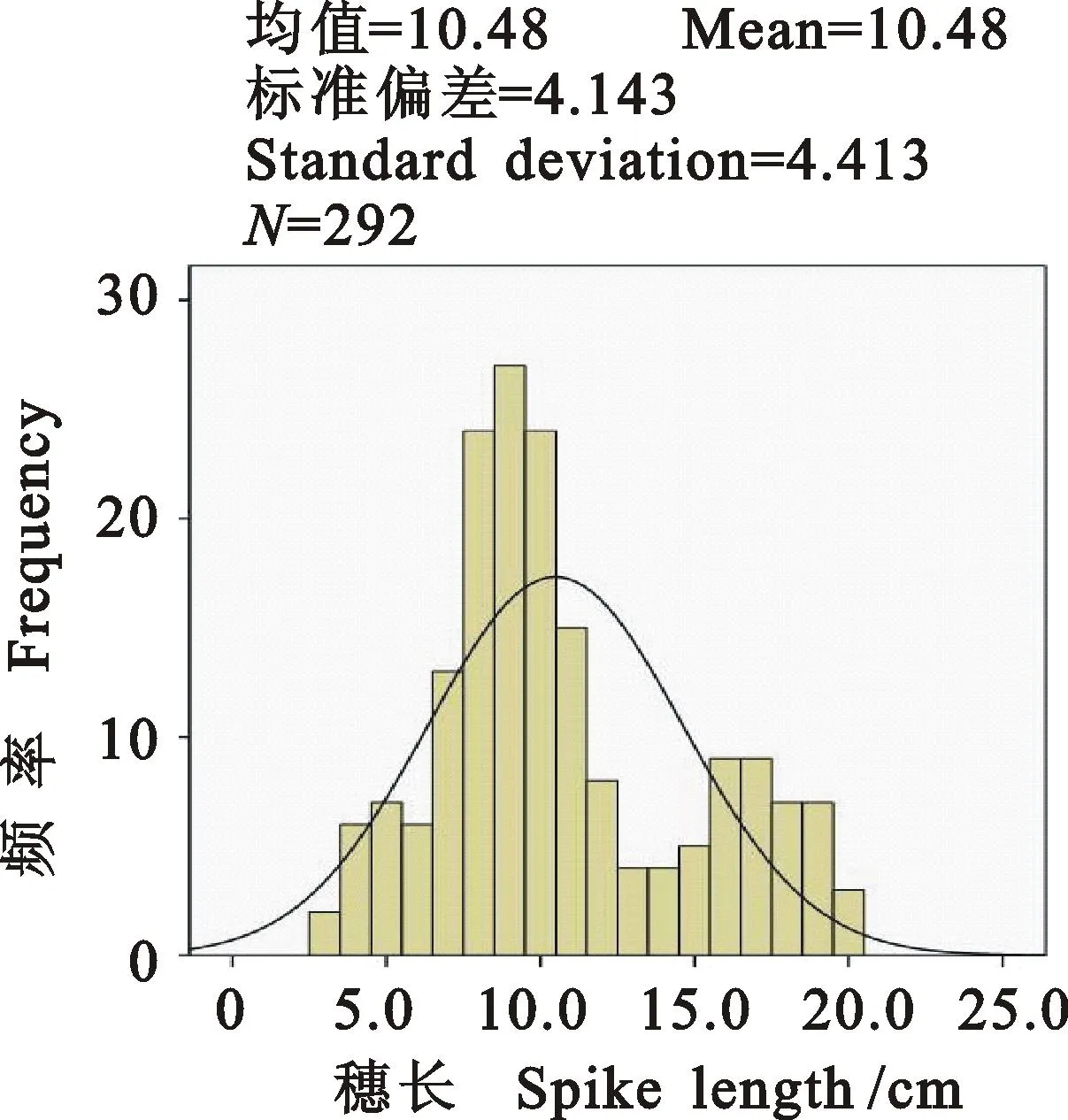
圖2 F2 群體的穗長表型分布
2.2遺傳圖譜的構建
利用所選500對SSR引物對高麥1號和密小穗兩個親本進行多態性檢測,共獲得180對多態性引物,多態性引物檢出率為36.0%。然后利用這180對引物進一步進行F2群體基因型分析,有96對引物在群體中表現多態性,占多態性標記的53.3%,其中部分多態性引物在群體中存在模糊帶型,多態性不可靠。未免造成多態性遺漏,本研究將不可靠的多態性結果保留,后續研究會進一步證實這些多態性的可靠性。利用QTL_IciMapping軟件構建出小麥染色體組的8個連鎖圖譜,并將96對SSR引物定位到遺傳連鎖圖譜上。圖譜全長為1 383.29 cM,標記間的平均遺傳距離為15.37 cM。平均每個連鎖群有11.25個標記,含有標記最多的是4A和6B染色體,各有17個標記,其次是3A和7B染色體,含有9~14個標記,1B和5D染色體含有的標記最少,都只有5~7個(圖3)。
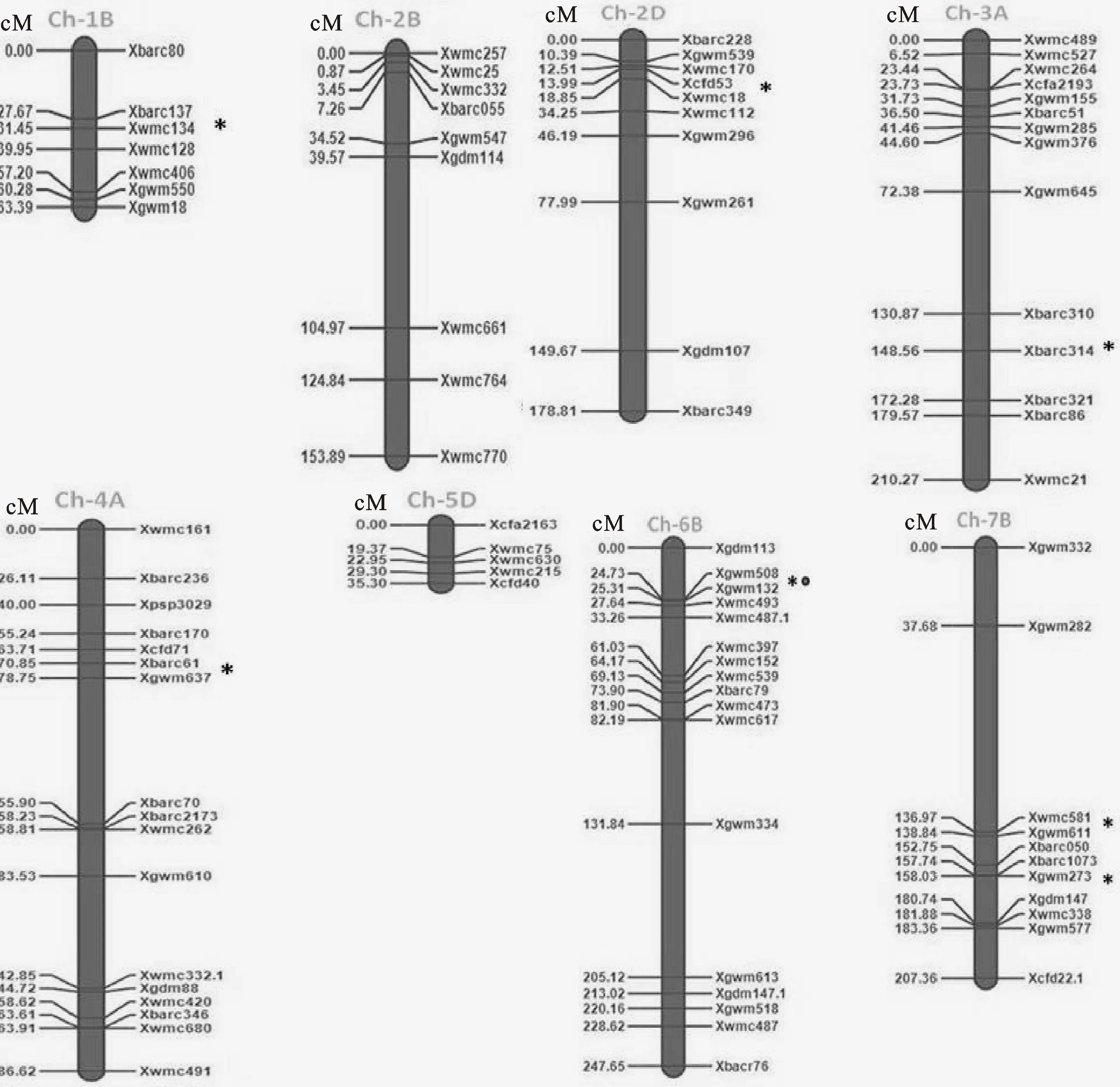
“*”代表該位置存在1個加性QTL;“*。”代表該位置為在1個加性+顯性QTL
“*” indicated there was one additive QTL at this locus;“*。” indicated there was one additive+dominant QTL
圖3小麥穗長QTL在染色體上的位置
Fig.3Positions of QTLs for spike length
2.3穗長QTL分析
采用QTL_IciMapping軟件中ICIM-ADD方法以及復合區間作圖法進行QTL分析,結果共檢測到7個與穗長相關的QTL,包括6個加性QTL和1個加性+顯性QTL,并沒有檢測到上位性QTL(圖3、表2)。1B、2D、3A、4A和6B染色體上各檢測到1個QTL位點,其中,1B染色體上的QTL位于Xbarc137~Xwmc134之間,距離Xwmc134標記3.05 cM,該位點為加性QTL,對應的效應值是0.45,可解釋為5.26%的穗長變異,暫命名為 Qsl1B;2D染色體上的QTL位于Xcfd53~Xwmc18之間,與標記Xwmc18相距1.89 cM,該位點為加性QTL,對應的效應值是0.48,可解釋10.09%的穗長變異,暫命名為 Qsl2D;染色體3A上的QTL位于barc310~Xbarc314之間,距離Xbarc314標記0.58 cM,該位點為加性QTL,對應的效應值是0.53,可解釋15.26%的穗長變異,暫命名為 Qsl3A;4A染色體上的QTL位于Xbarc61~Xgwm637之間,與標記Xgwm637相距4.02 cM,該位點為加性QTL,對應的效應值是0.29,可解釋3.09%的穗長變異,暫命名為 Qsl4A;6B染色體上的QTL位于Xgwm508~Xgwm132之間,與標記Xgwm132相距3.72 cM,該位點基因作用方式為加性+顯性,對應的效應值是0.34,可解釋2.04%的穗長變異,暫命名為 Qsl6B。7B染色體上檢測到2個QTL位點,其中,1個位于Xgwm611~Xwmc581之間,與標記Xwmc581相距2.85 cM,該位點為加性QTL,對應的效應值是0.31,可解釋7.34%的穗長變異,暫命名為 Qsl7B-1;另1個位于Xgwm273~Xgdm147之間,與標記Xgwm273相距3.69 cM,該位點也為加性QTL,對應的效應值是0.26,可解釋6.58%的穗長變異,暫命名為 Qsl7B-2。
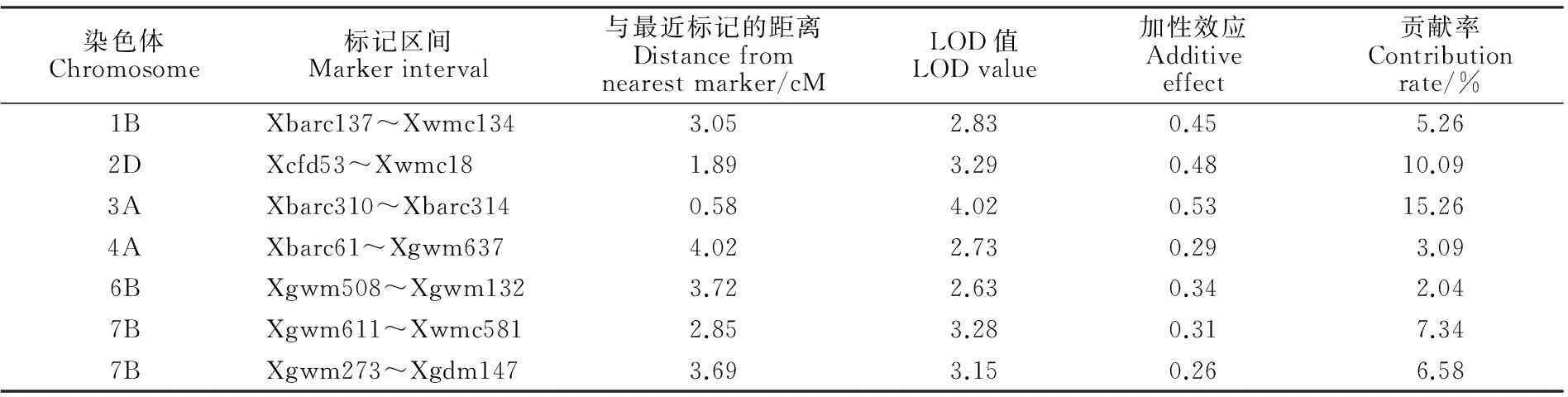
表2 復合區間作圖法檢測到的穗長QTL
3討 論
本研究利用高麥1號和密小穗兩個穗長差異明顯的小麥品種進行雜交,以其F2群體作為研究對象,構建遺傳連鎖圖譜,用復合區間作圖法共檢測出6個與穗長相關的加性QTL位點和1個與穗長相關的加性+顯性QTL位點。7個QTL的加性效應值均為正值,貢獻率為2.04%~15.26%。其中,3A染色體上的QTL位點距離其最近標記只有0.58 cM,為連鎖最緊密的一個位點,并且其加性效應值最大,可解釋表型變異的15.26%。因此,3A染色體上很可能含有與穗長相關的基因,后續實驗應該重點研究3A染色體。
在小麥穗長QTL研究中,利用不同的作圖群體檢測出的QTL位置并不完全相同,這些差異反應了QTL遺傳和表達的復雜性,與遺傳背景關系密切。Li等[1]在1B染色體的短臂和7B染色體的長臂上檢測到與穗長相關的QTL均為顯性,而本研究在1B及7B染色體上檢測到的QTL均為加性,顯性QTL位于6B染色體上。Kumar等[3]在其所選的群體1中,共檢測到8個QTL,其中2BL上的7個QTL位于Xwmc272~Xwmc474區間,加性效應值均為負值,單個QTL的貢獻率為9.86%~18.10%;2DL染色體上檢測到1個QTL位于區間Xgwm349~Xgwm382區間,加性效應值為-0.33,可解釋11.36%的表型變異。王 瑾等[11]選用通過人工來合成的大穗型小麥進行QTL定位研究時,將 2個與穗長相關的QTL分別定位于4A和2D上,單個QTL可解釋l%~22%的表型變異。張坤普等[12]以豫麥57(父本)和花培3號(母本)培育的168個DH群體作為研究對象,結果檢測到5個與穗長相關的QTL,基因作用方式均為加性,它們分別位于2B、2D、4D、5D以及6B染色體上,可解釋穗長性狀37.46%的表型變異。本研究在2D和4A染色體上也檢測到與穗長相關的2個QTL,但所對應的標記區間不同,應為不同的QTL。楊 睿等[13]在3A染色體的Xbarc356~Xbarc51區間檢測到1個控制穗長的主效QTL,加性效應為0.82,貢獻率為13.93%。本研究在3A染色體上檢測到的QTL位于Xbarc310~Xbarc314區間,二者所屬區間相同,可能為同一位點。另外,崔 勇等[14]利用親本豫麥57(父本)和花培3號(母本)培育的168個DH群體研究不同施氮期對小麥主要農藝性狀QTL的影響,在不施氮(T0)水平下,檢測到5個穗長QTL,分別位于2A、2D、5D、6B和7B染色體上。其中,7B染色體上的QTL位點所屬標記區間與本研究一致,很可能為同一位點。這些相同區間的QTL若能進一步被證實,將對克隆穗長基因以及開發穗長相關的標記提供依據。
本研究中所選的親本為高麥1號和密小穗,兩個親本的穗長差異明顯,且親緣關系較遠。在292個F2分離群體中,穗長分離明顯,且有明顯的兩極超親現象。與同類研究穗長性狀的材料相比,具有更大的優勢。
在提高小麥產量研究中,育種和考種是其重要的環節,在這兩大環節中,育種家都會注重小麥的一些農藝性狀測量,穗長就是其中的一個重要指標。小麥許多產量性狀屬于數量性狀,由微效多基因控制。相關研究證實穗長性狀的遺傳力相當高。研究小麥穗長的遺傳規律以及不同穗長組合的雜種優勢差異是小麥穗長性狀研究的兩個重要方面,只有了解和掌握了小麥穗長的遺傳規律,才能更好的將其應用于育種中。本研究定位了7個與穗長相關的QTL位點,這些定位的QTL若能進一步被確認,則將為分子標記輔助育種奠定一定的基礎。
參考文獻:
[1]Li W L,Nelson J C,Chu C Y.Chromosomal locations and genetic relationships of tiller and spike characters in wheat [J].Euphytica,2002,125:357-366.
[2]Sourdille P,Cadalen T,Guyomarch H,etal.An update of the Courtot × Chinese Spring intervarietal molecular marker linkage map for the QTL detection of agronomic traits in wheat [J].TheoreticalandAppliedGenetics,2003,106(3):530-538.
[3]Kumar N,Kulwal P L,Balyan H S.QTL mapping for yield and yield contributing traits in two mapping populations of bread wheat [J].MolecularBreeding,2007,19:163-177.
[4]Manickavelu A,Kawaura K,Imamura H.Construction of SSR linkage map and QTL mapping for spike characters in common wheat RIL population [J].JapaneseJournalofGenetics,2008,3:1-3.
[5]Patil R M,Tamhankar S A,Oak M D.Mapping of QTL for agronomic traits and kernel characters in durum wheat (TriticumdurumDesf.) [J].Euphytica,2013,190(1):117-129.
[6]楊在君,彭麗娟.小麥三雌蕊突變體主要農藝性狀的遺傳力分析 [J].西華師范大學學報,2013,34(1):2-4.
Yang Z J,Peng L J.Analysis of genetic abilities of major characters of wheat tri-pistil mutant [J].JournalofChinaWestNormalUniversity,2013,34(1):2-4.
[7]盧 翔,張錦鵬,王化俊,等.小麥-冰草衍生后代3558-2穗部相關性狀的遺傳分析和QTL定位[J].植物遺傳資源學報,2011,12(1):86-91.
Lu X,Zhang J P,Wang H J,etal.Genetic analysis and QTL mapping of wheat spike traits in a derivative line 3558-2 from wheat×Agropyroncristatumoffspring [J].JournalofPlantGeneticResources,2011,12(1):86-91.
[8]畢曉靜,史秀秀,馬守才,等.小麥農藝性狀的主基因+多基因遺傳分析 [J].麥類作物學報,2013,33(4):630-634.
Bi X J,Shi X X,Ma S C,etal.Genetic analysis of agronomic traits related to yield based on major gene plus polygene model in wheat [J].JournalofTriticeaeCrops,2013,33(4):630-634.
[9]杜希朋,閆媛媛,劉偉華,等.螞蚱麥×碧玉麥雜交F2代部分重要農藝性狀的遺傳分析 [J].麥類作物學報,2011,31(4):624-629.
Du X P,Yan Y Y,Liu W H,etal.Genetic analysis on several important agronomic traits in F2generation of Mazhamai×Quality [J].JournalofTriticeaeCrops,2011,31(4):624-629.
[10]海 燕,何 寧,康明輝,等.小麥主要農藝性狀的遺傳分析 [J].中國農學通報,2008,24(6):168-171.
Hai Y,He N,Kang M H,etal.Genetic analysis of agronomic traits in wheat [J].ChineseAgriculturalScienceBulletin,2008,24(6):168-171.
[11]王 瑾,廖祥政,楊學舉,等.人工合成小麥Am3大穗多粒QTL的發掘與利用 [J].植物遺傳資源學報,2008,9(3):277-282.
Wang J,Liao X Z,Yang X J,etal.Mapping of large-spike and much-kernel QTL by using a synthetic wheat Am3 as donor [J].JournalofPlantGeneticResources,2008,9(3):277-282.
[12]張坤普,徐憲斌,田紀春.小麥籽粒產量及穗部相關性狀的QTL定位 [J].作物學報,2009,35(2):270-278.
Zhang K P,Xu X B,Tian J C.QTL mapping for grain yield and spike related traits in common wheat [J].ActaAgronomicaSinica,2009,35(2):270-278.
[13]楊 睿,劉聯正,李 華,等.波蘭小麥×普通小麥品系中13重組自交系(RIL)群體穗部性狀的QTL分析 [J].農業生物技術學報,2012,20(5):506-513.
Yang R,Liu L Z,Li H,etal.QTL analysis of spike traits in an recombinant inbred lines (RILs) population derived from the cross ofTriticumpolonicum×T.aestivumline Zhong 13 [J].JournalofAgriculturalBiotechnology,2012,20(5):506-513.
[14]崔 勇.不同施氮期對小麥主要農藝性狀影響的QTL分析 [D].泰安:山東農業大學,2013.
Cui Y.QTL mapping for main agronomic traits in wheat under various nitrogen supplying dates [D].Tai’an:Shandong Agricultural University,2013.
Quantitative Trait Loci Mapping of Spike Length Using F2Population of Gaomai 1/Mixiaosui in Wheat(TriticumaestivumL.)
LIU Shuhan,HOU Lijiang,HUA Guanxun,SONG Yulong,NIU Na,MA Shoucai,SONG Yazhen,WANG Junwei,ZHANG Gaisheng
(College of Agronomy,Northwest A&F University/National Yangling Agricultural Biotechnology & Breeding Center/Yangling Branch of State Wheat Improvement Center/Wheat Breeding Engineering Research Center,Ministry of Education/Key Laboratory of Crop Heterosis of Shaanxi Province,Yangling,Shaanxi 712100,China)
Abstract:Spike length is one of the important factors determining wheat yield. To understand the genetic characteristics of spike length characters in wheat,and to apply it in molecular marker assisted breeding,the trait of spike length was selected as the research object. At present,domestic and foreign researchers have used different groups to anchor the QTL location of spike related traits in wheat,but there are many differences in the results. In this study,the QTLs of spike length were analyzed using simple sequence repeat (SSR) markers with a population consisting of 292 F2 lines derived from the cross between Gaomai 1 and Mixiaosui. Using DNA markers and QTL mapping,the QTLs of spike length were determined. Eight linkage groups were constructed by QTL-IciMapping software,and 96 pairs of SSR primers were located on the genetic linkage map. The full length of the map is 1383.29 cM,and the average genetic distance between the markers is 15.37 cM. On average,there are 11.25 markers in each linkage group.Seven QTL loci associated with spike length were detected,including six additive QTLs and one additive+dominant QTL. Seven QTL additive effect value were positive,with the contribution rate of 2.04% to 15.26%. The distance between the QTL locus on chromosome 3A and the nearest marker is only 0.58 cM,and the additive effect value of the QTL locus on chromosome 3A is the largest,which can explain 15.26% of the phenotypic variation. Therefore,chromosome 3A is likely to contain the main effect genes associated with spike length,and the follow-up study should focus on chromosome 3A.
Key words:Triticum aestivum L.; F2 population; Spike length; QTL; Linkage map
中圖分類號:S512.1;S330
文獻標識碼:A
文章編號:1009-1041(2016)04-0409-06
通訊作者:王軍衛(E-mail: wjw@nwsuaf.edu.cn); 張改生(E-mail: zhanggaisheng18@sohu.com)
基金項目:國家高技術研究發展計劃(863計劃)重大專項(2011AA10A106); 陜西省科技統籌創新工程計劃課題(2014KTZB02-01-02); 西北農林科技大學唐仲英育種基金項目
收稿日期:2015-12-09修回日期:2016-01-23
網絡出版時間:2016-04-01
網絡出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160401.1529.006.html
第一作者E-mail:435238851@qq.com(劉書含);E-mail:hlj2013@nwsuaf.edu.cn(侯立江,與第一作者同等貢獻)

