線蟲蛔甙(Ascarosides)信息素研究進展
魏亞楠, 黨政武, 陳 立, 方宇凌, 孔祥波, 胡春祥, 趙莉藺
1 東北林業大學林學院,哈爾濱 150040 2 中國科學院動物研究所農業蟲害鼠害綜合治理研究國家重點實驗室,北京 100101 3 商洛市林木病蟲防治檢疫站,商洛 726000 4 中國林業科學研究院森林生態環境與環保研究所國家林業局森林保護重點實驗室,北京 100091
?
線蟲蛔甙(Ascarosides)信息素研究進展
魏亞楠1,2, 黨政武3, 陳立2, 方宇凌2, 孔祥波4, 胡春祥1,*, 趙莉藺2
1 東北林業大學林學院,哈爾濱1500402 中國科學院動物研究所農業蟲害鼠害綜合治理研究國家重點實驗室,北京1001013 商洛市林木病蟲防治檢疫站,商洛7260004 中國林業科學研究院森林生態環境與環保研究所國家林業局森林保護重點實驗室,北京100091
摘要:大多數生物通過信息素系統來對環境進行感應和個體間交流,并指導其行為、發育和生理代謝。線蟲是在地球上生存策略最多樣的動物之一,但其信息素系統卻鮮為人知。近年來發現一組稱為蛔甙(ascarosides)的線蟲種內化學信號物質,在秀麗隱桿線蟲(Caenorhabditis elegans)的交配、聚集和滯育等行為及發育調控方面起著至關重要的作用。隨后發現蛔甙在線蟲界廣泛存在。對蛔甙進行深入全面的了解有利于促進線蟲化學生態學學科發展,并填補傳統化學生態學中關于化學信息對生物發育調控的知識。因此,對近年來蛔甙的最新研究進展進行了系統總結,包括蛔甙結構與鑒定、組成和功能、生物合成與代謝調控、化學感受信號途徑及信息調節模式,從而更好地理解化感信號對線蟲乃至高等生物的行為、發育、新陳代謝及衰老的調控機制,為研究生命科學中信息素調控理論提供新的參考。
關鍵詞:蛔甙;秀麗隱桿線蟲;寄生線蟲;信息素
線蟲是一類低等無脊椎動物,在自然界分布很廣[1]。一部分線蟲可以獨立生存,稱為自由生活線蟲;另一部分采用寄生策略,大部分以植物和動物為寄主,對特殊食物、傳播媒介和資源加以利用。因為這些線蟲通常生活在土壤或寄生物中,沒有適宜的視覺或聽覺系統,接收環境信號的重要途徑就是精細的化學感受系統[2- 5]。通過進化,化學感受系統越來越精細,不僅能引起線蟲行為的改變,還能調控線蟲的發育途徑。在不良環境中,線蟲進入擴散周期,形成滯育蟲態,從而進一步擴散傳播到新的適宜環境[2, 4- 5]。
秀麗隱桿線蟲Caenorhabditiselegans一直是線蟲化感研究最主要的模式生物,但主要集中在基因調控水平[2- 5],信息素鑒定和結構研究進展緩慢。直到2005年,Jeong等[6]在秀麗隱桿線蟲中提取并鑒定出一類誘導滯育蟲態形成的新型化合物——蛔甙(ascarosides)。從此,蛔甙的相關研究取得了一系列突破性進展。人們定義蛔甙為線蟲的特定信號分子,由脂肪酸等側鏈鏈接到雙脫氧蛔糖基(dideoxysugar ascarolyse)上組成。通過側鏈長度的改變以及衍生物的差異生成結構多樣的蛔甙[7],用以調節線蟲的聚集、交配、多爾(dauer)形成等行為。
最近發現,各種寄生線蟲中普遍存在蛔甙成分。眾所周知,各類寄生線蟲危害可造成重大農業經濟損失及全球性人類疾病。如果不同線蟲種類對不同蛔甙能夠特異性識別,那么蛔甙有望發展成為新型藥物特異干擾線蟲的繁殖和生存。深入研究蛔甙對線蟲行為和發育的調節,對于控制重大農業經濟損失及人類疾病具有舉足輕重的意義。因此,本文對近年來線蟲蛔甙信息素研究的突破性進展進行了總結。
1秀麗隱桿線蟲蛔甙結構鑒定與功能

圖1 蛔甙結構示意圖Fig.1 Overall structure of ascarosides蛔糖(ascarylose sugar)編號的位置顯示已知的修飾官能團
線蟲對蛔甙這種小分子信號的利用,讓人聯想到細菌群體感應系統通過檢測復雜的環境條件來調節自身的行為和發展。蛔甙信息素主結構均由蛔糖基連接一個脂肪酸側鏈形成,因側鏈的長度和衍生物的不同而形成結構和功能的多樣性。蛔甙的總體結構見圖1。根據發現的先后順序,依次命名為ascr#1, 2, 3,…,n。不同的蛔甙或蛔甙組合調節不同的表型特征,在化學結構上即使很小的差異都可能極大地改變線蟲的生理活動[8]。蛔甙的活性和特異性依賴于化學結構和濃度。因此蛔甙信號特異性可以通過定性、定量來表達。
Choe[9]總結秀麗隱桿線蟲包含三類蛔甙結構:一種是結構簡單的蛔甙,簡寫為ascr,一種是吲哚蛔甙(indole ascarosides),簡寫為icas,另外一種是ω-1氧化ascr常伴隨的ω氧化異構體,簡寫為oscr(化學結構見表4)。
1.1誘導秀麗隱桿線蟲多爾幼蟲形成的信息素結構及其鑒定
線蟲信息素蛔甙是在多爾幼蟲形成研究中被發現的。多爾是秀麗隱桿線蟲幼蟲在生長發育過程中出現的滯育蟲態,此蟲態的形成與多爾信息素誘導密切相關。
不論自然界中的環境好壞,秀麗隱桿線蟲都能適應并生存。在環境適宜的條件下,秀麗隱桿線蟲僅需3—5 d就能由受精卵經過L1—L4四齡幼蟲階段發育為成蟲,并產生約300個后代。在L1或L2初期,當遇到食物缺乏、種群密度增加、溫度升高等惡劣環境時,秀麗隱桿線蟲將進入滯育,形成持久型L3幼蟲,稱為多爾幼蟲[10]。線蟲進入滯育階段會停止取食和發育[11]。滯育階段能維持數月,當環境適宜時(如食物充足、低濃度信息素),線蟲恢復發育,蛻皮成繁殖型L4幼蟲,進入繁殖周期[11- 12]。
早在20世紀80年代,科學家們就發現秀麗隱桿線蟲的多爾形成是受化學信息素調控的,認為此類信息素是親水性的雙脫氧蛔糖基衍生物,但一直難以明確其結構組成[13- 14]。直到2005年,Jeong等突破了提取和鑒定方法,在300 L大型發酵罐中進行了秀麗隱桿線蟲的大規模液體培養,并用乙酸乙酯提取液體培養液進行多爾信息素的活性物質分離純化。然后進行色譜分離,結合生物活性測試獲得具有顯著誘導效果餾分后,用標準核磁共振NMR(nuclear magnetic resonance)和質譜技術鑒定出一類新型物質——ascr#1(即daumone)[6]。Butcher等[15]用類似的方法通過多爾恢復試驗純化鑒定了ascr#2,并用核磁共振譜分析找到另一個蛔甙,即ascr#3。Ascr#1及ascr#3的熒光探針顯示,在多爾形成過程中集中在咽(pharynx)表皮,ascr#3探針甚至能移動到化感器神經元(amphid neurons)[16]。
隨后,Gallo和Riddle[17]比較了ascr#1合成物[6]和秀麗隱桿線蟲提取物[18]的生理特性,發現ascr#1并不是形成多爾信息素的主要成分,而且Jeong已報道的濃度[6]對秀麗隱桿線蟲有毒,接觸后會降低其壽命[17]。
雖然業界對Jeong的研究有所質疑,但它依然為蛔甙的后續研究開辟了一個新的天然產物研究方向,大規模的蛔甙分離鑒定工作展開,甚至發現了蛔甙衍生物,如icas#9[19]。這些蛔甙在不同的發展階段產生,并在各種惡劣條件誘導下增加[20]。多個蛔甙(ascr#1-3,5,8,icas#9)(表1)協同作用形成一個誘導型的混合物。其中,一種側鏈為3-羥丙酸(3-hydroxypropionatea)的蛔甙是多爾信息素中一個非常重要的成分[21],ascr#2和ascr#3比最初確定的ascr#1功能更強[15, 20- 21]。誘導多爾幼蟲形成的蛔甙結構見表1。
1.2秀麗隱桿線蟲性信息素的結構與鑒定
最近的研究發現,低濃度蛔甙能夠誘導秀麗隱桿線蟲的交配行為。科學家們通過多種手段,如核磁共振光譜分析(NMR spectroscopic analyses)方法及二維核磁共振光譜DANS(differential analysis of 2D NMR spectra)鑒定方法得到能夠誘導交配活性的蛔甙結構,包括ascr#4[22], ascr#6.1, 6.2, 8[23]。

表1 誘導多爾幼蟲形成的蛔甙結構
當Jeong等人都使用標準液體細菌和線蟲的混合培養液作為原材料時,Srinivasan等則將特定發育階段的線蟲轉移到水中來專門收集線蟲的化合物,以防止細菌污染[22]。這種策略可達到3個重要優勢目標:首先,它大大簡化了雄蟲的趨化生物測定,因為線蟲也會被很多細菌小分子所吸引而增加生測難度;其次,它簡化了原材料的化學成分鑒定;最后,明確了蟲態特異性。因為雄蟲活動只出現在L4齡幼蟲、年輕成蟲以及成蟲3個階段[22],因此蟲態特異性對性信息素的鑒定尤為重要,這種策略集合了每個發育階段所產生的特定物質組成,而不是同步培養時隨著時間推移從而積累所有的化合物。
吸引雄性的信息素是由一個以上的化合物組成的,單個的色譜成分不能充分引起特異雄性的反應,但重組成分卻能使其恢復活力[22]。其中一個主要成分是被葡萄糖修飾的ascr#2衍生物,這個化合物稱作ascr#4。Ascr#2、ascr#3和ascr#4表現為協同作用,在pmol/L濃度下活性強,特別吸引雄性。
從此,鑒定蛔甙的手段越來越先進,以Paul W. Sternberg[23]為首的實驗室采用二維核磁共振光譜DANS鑒定方法得到另一些蛔甙結構,包括能夠誘導交配活性的ascr#6.1、ascr#6.2,以及功能未知的ascr#7(結構見表4)。他們通過這種方法實現了蛔甙的核磁共振痕量檢測,并且通過DANS差異分析,簡化了連接的小分子代謝物鑒定和它們的生物學功能研究[23]。
秀麗隱桿線蟲雄蟲也會產生蛔甙,以飽和ascr#10為主,而雌雄同體線蟲產生的蛔甙為α, β-不飽和蛔糖苷,ascr#3。雖然兩者的化學結構只有微小差別,但生理活性有很大不同:雌雄同體線蟲產生的ascr#3能夠排斥其他雌雄同體個體、吸引雄蟲,而雄蟲產生的ascr#10能夠強烈吸引雌雄同體線蟲[25]。同時,Srinvisan等[22]的研究表明,很多蛔甙的混合物,特別是ascr#3和ascr#8,能夠在超低濃度下吸引強壯的雄性個體。在較高濃度下,相同的混合物對雄性喪失吸引力,取而代之的是對雌雄同體的排斥。蛔甙性信息素的結構見表2。

表2 蛔甙性信息素結構
1.3秀麗隱桿線蟲聚集信息素的結構與鑒定
蛔甙還能夠誘導秀麗隱桿線蟲的聚集行為。這類蛔甙含有色氨酸吲哚衍生物(tryptophan-derived indolemoeities-indole ascarosides),其中一個命名為indolecarboxyl-ascaroside C5,即icas#9[19]。秀麗隱桿線蟲的雌雄同體能夠被濃度為fmol/L到pmol/L的icas#3(表3)和icas#9強烈吸引,造成聚集現象[26]。
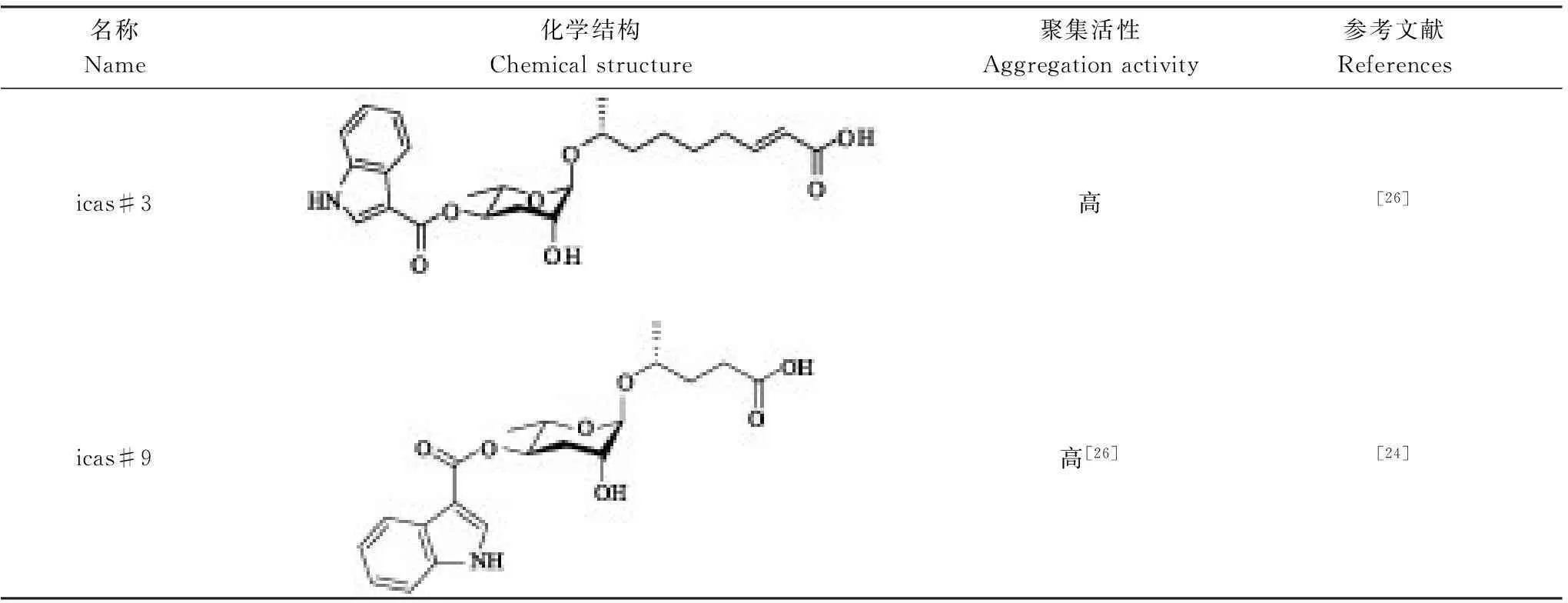
表3 蛔甙聚集信息素結構
1.4蛔甙其他信息素的結構與鑒定
蛔甙還能調節其它行為和趨化反應。如最近的幾項研究[22, 26- 28]都提到了調控不同行為的蛔甙信號,包括特異性別吸引、排斥、聚合以及嗅覺可塑性。蛔甙除了直接影響線蟲的行為之外,還能引起對其他異嗅物質的趨化反應,如野生型線蟲對苯甲醛氣味的反應依賴于種群密度[27]。值得注意的是,誘導這種行為產生的部分蛔甙與調節多爾形成的蛔甙是相同的,誘導多爾形成需要的濃度為nmol/L—μmol/L級別,而行為反應的濃度可能只需要fmol/L—pmol/L。目前,除了上述一些短鏈蛔甙功能被明確,表4列出的長鏈蛔甙功能還未知,尚有很大的研究潛力和空間。
總之,線蟲蛔甙方面的最新發現,為研究信息素交流及其演變提供了前所未有的實驗依據。在功能上,蛔甙信息素主要分為多爾幼蟲信息素、性信息素、聚集信息素等三類。蛔甙根據結構的不同功能也有所不同。結構相同的信息素在功能上又有重疊,例如ascr#1, #2, #3, #5, #8既是多爾誘導信息素也是雄性誘導信息素,而icas#9既是多爾誘導信息素又是聚集信息素。秀麗隱桿線蟲的其他一些蛔甙信息素(見本文1.4)功能還有待進一步深入探索。
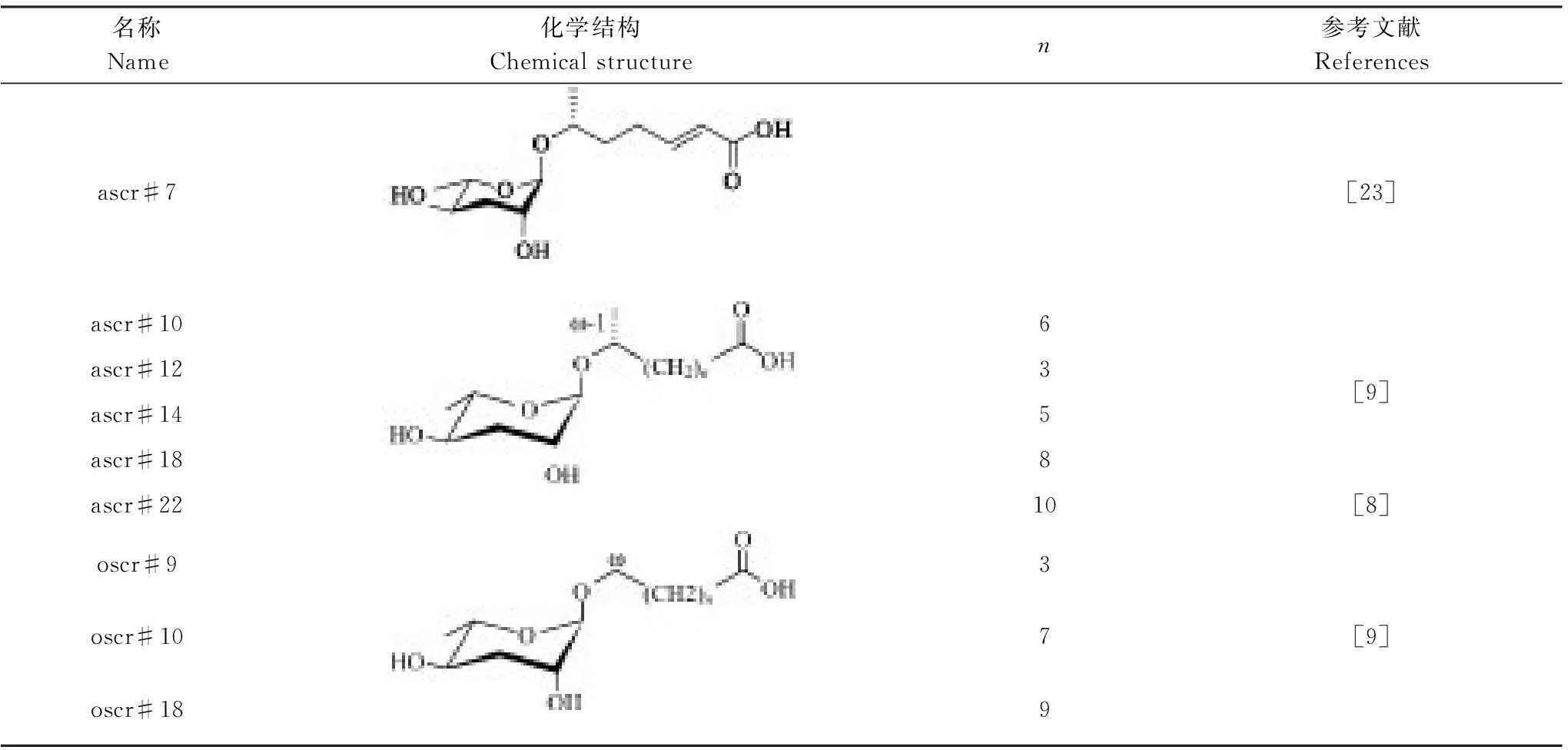
表4 蛔甙其他信息素結構
2寄生線蟲蛔甙結構鑒定與功能
屬于線蟲門的蛔蟲屬(Ascaris)也存在蛔甙,包括馬蛔蟲Parascarisequorum[29]、人體蛔蟲Ascarislumbricoides、豬蛔蟲Ascarissuum[30- 32]。主要存在于蛔蟲屬卵中,抵抗由質變而導致的生理退化,使蛔蟲卵在潮濕的土壤中存活數年[33]。蛔蟲卵具有3層結構,外層是蛋白質、中間是甲殼素,蛔甙包被在內部。存在于最內層的是蛔甙長鏈混和物,具有非滲透性(結構見圖2)[34]。
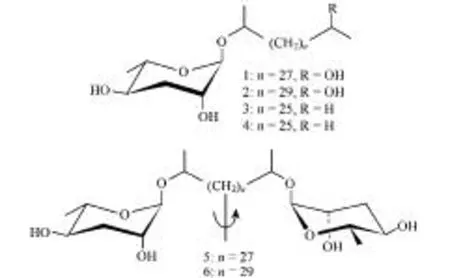
圖2 豬蛔蟲Ascaris suum卵中的6種長鏈蛔甙的結構[32]Fig.2 Ascaroside structures. Six long-chain ascarosides from the eggs of the parasitic nematode Ascaris suum[32]箭頭和直線表示5和6為對稱結構,均含有兩個蛔糖[32]
蛔甙既存在于蛔蟲屬,也存在于秀麗隱桿線蟲,二者雖然都屬于線蟲門,但蛔蟲目Ascaridida和小桿目Rhabditida在形態學、生理學特征上有顯著區別[32],導致多數人認為寄生線蟲的長鏈蛔甙與秀麗隱桿線蟲的蛔甙信息素組成是不同的。直到2009年才研究發現兩者是非常相似的[8- 9],其功能上也承擔了信息傳遞、幼蟲滯育的功能。
蛔甙結構決定其在蛔蟲屬卵發育的特定功能。圖2為豬蛔蟲Ascarissuum卵中的6種長鏈蛔甙結構,類似的長鏈結構在秀麗隱桿線蟲N2(野生型)和daf-22中有報道[23]。蛔蟲和秀麗隱桿線蟲的蛔甙在功能上有異同之處:秀麗隱桿線蟲從卵中孵化的階段作為L1幼蟲,而豬蛔蟲在卵中要經歷兩次蛻皮。當蛔蟲的卵被攜帶進入新的寄主時,孵化得到L3齡幼蟲,類似于秀麗隱桿線蟲的多爾幼蟲階段[35]。卵中的蛔甙與幼蟲有直接關系,與秀麗隱桿線蟲的蛔甙在多爾形成(或至少在多爾維持)上扮演著相同角色[36]。因此,調查研究動物寄生線蟲的蛔甙功能將為控制線蟲的侵染提供新見解。
蛔甙結構特征在不同線蟲種類進化中出現差異。Choe等[9]通過對比自由生活線蟲、動物、昆蟲和植物寄生性線蟲等在進化關系上較遠的19種線蟲的蛔甙結構特征[37](表5),發現不同線蟲種類演變為占據不同生態位的種群,盡管都顯示出利用蛔甙作為信號分子的保守性,但在蛔甙種類和組成上有很大差異。甚至4種因自然隔離而導致基因差異的秀麗隱桿線蟲產生的蛔甙也是不同的。當然,這些種內差異與種間差異相比是非常小的。

表5 不同種線蟲產生的蛔甙
A: 成蟲,IJ: 感染性幼蟲,D: 多爾幼蟲,♂: 雄蟲,♀: 雌蟲,0: 雌雄同體;部分種對應中文種名未知
19種線蟲樣本中都含有蛔甙,且由兩個或兩個以上化合物組成[9]。除了小桿科Rhabditidae的幾個未知種:Caenorhabditissp.7和Rhabditissp.(突變種)產生的蛔甙在碳末端上連接著蛔糖(即“ω”位置,如oscr#9和oscr#10)[7],大多數線蟲產生的蛔甙都在倒數第2個碳上連接著蛔糖(即“ω-1”位置)。同樣地,作為秀麗隱桿線蟲聚集信號的吲哚蛔甙——icas#9[26],也只在小桿科的幾個種:Caenorhabditisspp.(多個未知種)和Oscheiuscarolinensis中出現。這些發現表示,在碳末端上連接蛔糖的蛔甙或是蛔甙的吲哚羰基衍生物可能代表著第9分支(其中包括小桿科家族的成員)衍生的一個新的里程碑[37]。他們還發現第9分支的線蟲(木耳線蟲屬未知種Peloderasp.,小桿線蟲屬未知種Oscheius.sp和異小桿線蟲屬未知種Heterorhabditisp.)能大量產生含有12—15個碳原子的長鏈蛔甙,而第10分支的線蟲(昆蟲病原斯氏線蟲屬未知種Steinernemaspp.和Panagrellussp.)不產生這些蛔甙。值得注意的是,小桿線蟲屬Oscheius和斯式線蟲科(Steinernematidae)、異小桿線蟲科(Heterorhabditidae)的成員包含了所有已知的昆蟲寄生線蟲[38],它們進化為不同分支是由蛔甙的側鏈長度決定的,而不是生活方式。具有蛔甙相同結構特征的種有著相似的生態位[9]。因此推斷,蛔甙生物合成的模式似乎與親緣關系以及生活方式或生態位在某種程度上是相關的。
綜上所述,通過蛔甙在蛔蟲屬等寄生性線蟲中的不同結構研究,發現不同物種通過特異蛔甙信號進行識別,進而干擾蛔蟲屬、寄生性線蟲的繁殖和生存,但是目前對于不同寄生線蟲種類的滯育誘導信息素、性信息素、聚集信息素功能的特異性蛔甙組分尚待進行深入研究。
3蛔甙生物合成與代謝調控
從結構研究表明蛔甙信息素組分不同,但功能相似。蛔甙在生物合成和代謝通路中所處的位點、生理生化功能不同。蛔甙生物合成及代謝包括對糖類和脂肪酸兩方面的調控。在生物合成方面已明確了在脂肪鏈合成過程中的兩個蛋白參與其代謝過程,其他方面的功能有待進一步研究確定。
3.1蛔甙生物合成
蛔甙的合成主要是通過編碼蛋白的兩種基因daf-22(thiolase)和dhs-28(dehydrogenase)發現的。Daf-22編碼一種人體固醇載體蛋白(human sterol carrier protein)的同系物SCPx(sterol carrier protein X)[15]。這種酶能催化過氧化物酶反應中脂肪酸β-氧化(β-oxidation)反應的最后一步[19]。Dhs-28基因編碼人類雙功能蛋白(human D-bifunctional protein)的一個同族蛋白質,這種蛋白質只能合成SCPx的上游部分。該蛋白在腸道中表達,而腸道是秀麗隱桿線蟲中蛔甙的合成位點[19]。這個途徑使得短鏈、中鏈、長鏈的脂肪酸降解為乙酰輔酶A(acetyl-CoA)和膽汁酸中間體(bile acid intermediates)。將daf-22和dhs-28線蟲在液體培養基下培養10d、20d,發現培養了10d的兩種突變體多爾形成都不活躍,而培養20d的突變體在多爾形成中十分活躍[15]。培養20d的dhs-28線蟲中發現了一些長鏈蛔甙,其中最長的含有15個碳,表明這些蛔甙就是信息素生物合成的中間體。蛔甙生物合成的許多步驟仍有待闡明,包括長鏈蛔甙的初始形成階段以及特定官能團如ascr # 8中的芳酰胺(aromatic a-mide)[23]以及ascr # 9中的吲哚(indole)官能團[24]的細節性描述。蛔甙生化合成通路如何使其生物學功能得以實現也有待進一步研究。
3.2蛔甙代謝調控
通過生化代謝過程,形成蛔甙的前體分子,為蛔甙的生物合成提供原料。秀麗隱桿線蟲繁殖周期線蟲靠取食細菌來攝取能量和生物合成的前體分子[39]。糖類和一些核酸、氨基酸首先通過糖酵解途徑代謝產生乙酰輔酶A;而脂類物質則通過β-氧化代謝產生乙酰輔酶A。乙酰輔酶A再通過三羧酸循環TCA(tricarboxylic acid)和氧化磷酸化(oxidative phosphorylation)產生ATP(adenosine triphosphate)[39- 40]。在秀麗隱桿線蟲繁殖型線蟲中,糖酵解、β-氧化、三羧酸循環和氧化磷酸化這四種代謝途徑都處于活躍狀態。而在多爾幼蟲階段,由于線蟲不再進食,必須依靠身體內部儲存的物質為機體提供能量和生物合成前體。在多爾形成過程中,最主要的能量物質是那些在皮下和腸道部位積累的脂肪。這些脂肪主要以三酰甘油(triacylglycerides)的形式存在,由3個長鏈脂肪酸分子以酰基的方式連接到甘油的三個羥基上。不同于繁殖型線蟲,多爾必須依靠脂肪來提供能量和生物合成前體,這就需要脂肪酸通過β-氧化產生乙酰輔酶A進入后續TCA循環和氧化磷酸化產生ATP;同時通過β-氧化、乙醛酸循環(glyoxylate cycle)和糖異生(gluconeogenesis)途徑來產生供蛔甙生物合成用的前體分子[39- 40](圖3)。
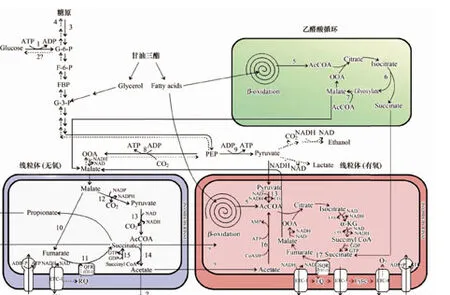
圖3 C. elegans 多爾主要代謝途徑[41]Fig.3 Main metabolic pathways in C. elegans[41]
4蛔甙化學感受信號途徑
蛔甙信號傳導途徑解釋了其信息素功能的實現方式。線蟲通過對外界化學信號的接收、傳遞,進而改變自身的行為和發育,并且通常利用化學感受和溫度感受來控制擴散周期的形成。目前最重要的任務就是闡明線蟲的感覺系統是如何感知并集成復雜的蛔甙的組合,進而引起特定發育和行為變化的。
性信息及聚集信息行為的實現是通過神經傳遞通路實現的。秀麗隱桿線蟲神經系統能夠傳導及感應蛔甙信息素來指導其交配和聚集行為[22, 26- 28]。其中,化學感受神經元用來識別種內信息物質。翅狀神經元ADF(actin depolymerizing factor)和ASI(acid-sensing ion)控制線蟲侵染蟲態形成并進入擴散周期。成對的感覺神經元控制從擴散周期恢復發育狀態,轉入繁殖周期[42]。這些神經元主要存在于頭感器、尾感器以及內/外唇和中食道球與后食道球之間[43]。這些神經元都有樹突狀結構,一直延伸到頭部開口處。
多爾滯育現象也是通過神經傳遞系統信號傳遞實現的。De Bono等[44]發現了npr-1(neuropeptide receptor)的無效突變(null mutation)在蛔甙化感中的功能。Npr-1基因作用的初始位點是RMG(relative maturity group)中間神經元(interneuron)[28]。RMG形成的缺口處連接著負責ascr#3特異性雄性吸引的ASK(amphid single-ciliated sensory neuron type K)感覺神經元[22]。ASK神經元中鈣含量減少,而后形成ascr#2, ascr#3和ascr#5三者的混合物,同時ASK產生蛔甙的信號能夠傳遞到其他細胞[28]。RMG的高活性能促進群體聚集行為,還能增強ASK對蛔甙的反應,而NPR-1的高活性能降低這種反應[28]。因此在特化蟲株中,蛔甙通過調控聚集行為來增強之前建立的多爾滯育和交配功能[36]。
蛔甙的化學感受生理生化過程包括以下兩個步驟[42]:①化學信號分子與化感器分泌蛋白相接觸并結合[3],這些分泌蛋白的特殊性質能夠增強線蟲嗅覺感受效果;②通過特殊轉換途徑,外界化學分子信息轉換為神經信號,被線蟲化感器神經元識別:神經元和化學信息分子之間相互作用,刺激GTP(guanosine triphosphate)聯接的蛋白(G蛋白)活性,通過G蛋白信號途徑轉換為神經信號[4, 45- 46]。G蛋白偶聯受體家族中一些特異化感受體基因用來響應蛔甙[47- 48]。Zwaal等明確了兩個G蛋白的α亞基,GPA-2和GPA-3參與信號轉導[49]。McGrath等[48]分析并演示了在多爾形成過程中,G蛋白偶聯化感受體作為蛔甙受體被基因srg(serpentinereceptorclassg)編碼,而且在實驗室有利條件下終止多爾形成。
蛔甙在信號傳遞過程中受相關基因的調控,當線蟲遇到化學信號刺激時,G蛋白偶聯化感受體與配體化學分子結合,啟動鳥苷酸環化酶途徑,導致神經元細胞內cGMP(cyclic guanosine monophosphate)濃度升高,激活cGMP-門控離子通道(cGMP-gated ion channel),進而使細胞去極化產生鈉離子和鈣離子內流。經過一系列細胞核轉錄事件,產生Insulin-like和TGF-β(transforming growth factor-beta)通路的信號分子。這些信號分子在內分泌細胞表面與各自受體結合,分別啟動相應通路信號轉導。最終兩條信號通路共同調控一種細胞色素P450(cytochrome P450)基因daf-9的表達;此基因負責核受體DAF-12(the nuclear hormone receptor)的配體DA(dafachronic acid)生物合成的最后一步。DA與靶組織DAF-12結合后,促進繁殖發育,抑制dauer形成;相反,當DA含量下降時,空載核受體DAF-12則促進多爾形成,抑制繁殖發育[50]。Insulin/IGF-1(insulin-like growth factor I)和TGF-β信號通路在動物寄生性線蟲中有少量研究,結果表明,Insulin信號通路在寄生性線蟲中作用是保守的,而TGF-β信號通路可能起不同于秀麗隱桿線蟲的作用[51]。
可形成蛔甙受體的輔基庫有待深入研究。可與蛔甙匹配的受體庫應考慮到單個神經元表達多種化學感受器,從線蟲的化學感受基因種類、功能等方面進行挖掘[52]。
5蛔甙信息調節模式
蛔甙的信號傳導原理有了一定的研究,但信息調節過程除了內部基因、生理調控、生化代謝等影響,也受環境因子的限制。環境對秀麗隱桿線蟲的蛔甙的表達、蛔甙釋放機制(例如組成型分泌、調節分泌、排便、以及其他可能的機制)、蛔甙家族信號分子的協同機制并未獲知。研究僅發現協同作用的10個或更多蛔甙分泌自幾個少數的細胞,當達到一定濃度才能實現調節,對于揭密蛔甙的上述多重影響任重道遠,明確蛔甙信息調節仍要深入研究。
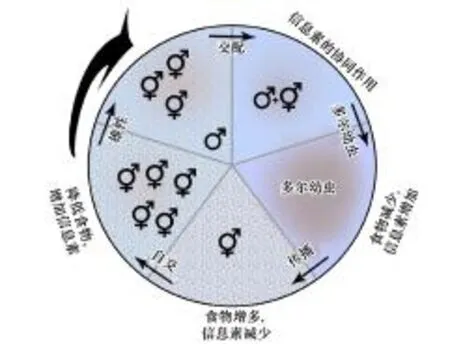
圖4 C.elegans 蛔甙信息素運行的一般模式Fig.4 General model for C. elegans ascaroside pheromone function
現研究發現雌、雄蟲蛔甙信息素水平有差異。Edison[36]認為蛔甙信息素能夠增加雄蟲出現的頻率,而且效果會隨著本地整體信息素水平的升高而升高。圖4闡明了秀麗隱桿線蟲生態循環中雌雄蟲受蛔甙影響的幾個關鍵點。雌雄同體發展到即將交配階段時會釋放少量不同的蛔甙,在相對統一的多爾信息素水平下,為雄蟲尋找多產的雌雄同體提供了方向性[36]。同時,蛔甙通過組成型表達來監測種群密度,也能根據環境或發育因素進行調節。這為環境條件惡化時秀麗隱桿線蟲的雌雄同體與雄性的異型雜交提供了一種機制。當信息素增加,食物減少時,產生的異型雜交后代將成為多爾幼蟲。該多爾狀態會導致雄蟲的增加[53],且允許這些后代存活數月,并傳播到一個食物充足的新微環境中,從而完成循環。圖4說明雌雄同體個體最初傳播到新的食物環境時,與雄性的異交顯著[53]。這使后代的數量可以從300增加到1000,大大增加了秀麗隱桿線蟲存活機率。
從圓圈底部楔形開始,代表高食物含量和低量信息素的微環境,沿順時針方向表示食物水平依次降低,信息素水平依次增加。圓形表面的圖案表示食物,顏色深淺表示信息素[36]
6線蟲蛔甙對其他物種行為的影響
寄生線蟲真菌中有一種稱為捕食線蟲真菌(nematode-trapping fungi),是一種生活在土壤中的線蟲專性寄生天敵[54]。捕食線蟲真菌在進化中形成了專用于寄生的捕食器。2012年發現,線蟲分泌在土壤中的蛔甙誘導捕食真菌產生捕食器[55]。此現象是以微生物天敵基于線蟲信息傳遞信號使寄生與被寄生產生協同進化的一個例證,證明了三營養級水平的信息物質也參與進化進程。
7討論
近年來蛔甙的結構與鑒定、組成和功能、生物合成與代謝調控、化學感受信號途徑以及信息調節模式都有了深入快速的研究,為線蟲化學生態學的學科發展提供了借鑒。今后需要繼續鑒定和深入研究蛔甙對寄生線蟲的滯育發育誘導機制。同時,在分子生物學方面,可以繼續深入完善蛔甙的化感通路,包括新的化感受體、化感器、神經元及其功能等。而蛔甙在線蟲及其與捕食真菌協同進化中的作用更顯示出蛔甙在多物種互作和進化方面研究的巨大潛力。
在應用方面,蛔甙是寄生線蟲種群發展的重要調節器,了解寄生線蟲的化學信號能夠幫助人們挖掘控制這些物種的工具。識別蛔甙的物種特異性可能使該信息素能夠干擾并控制寄生線蟲的繁殖和生存,對于研發控制動植物寄生線蟲危害和傳播新型藥劑提供了新思路。有研究表明,昆蟲寄生線蟲嗜菌異小桿線蟲利用小分子信息素來控制感染勢態的發展。該信息素與秀麗隱桿線蟲的多爾幼蟲信息素蛔甙在結構上類似,但存在種間高度特異性[56]。蛔甙對昆蟲寄生線蟲滯育態的維持功能有利于提高昆蟲寄生線蟲在農業害蟲防控中的應用,即解決昆蟲寄生線蟲的長途運輸和季節性進入繁殖周期的問題。例如將蛔甙維持昆蟲寄生線蟲的多爾狀態進行長途運輸和長期保存,在需要發揮作用的時候進行釋放,并使其進入繁殖周期。而植物寄生線蟲多爾形成和雌雄交配行為對于它們的種群密度和擴散傳播等危害程度影響也很大[55],急需綠色、安全的信息素防控技術,對蛔甙在其中起的關鍵調控作用進行研究將給予新型技術研發的希望。因此,圍繞蛔甙進行寄生線蟲種群調控的意義很大。
參考文獻(References):
[1]Poinar G O Jr. The natural History of Nematodes. Englewood Cliffs: Prentice-Hall, 1983.
[2]Huettel R N. Chemical communicators in nematodes. Journal of Nematology, 1986, 18: 3- 8.
[3]Perry R N. Chemoreception in plant parasitic nematodes. Annual Review of Phytopathology, 1996, 34(1): 181- 199.
[4]O′halloran D M, Burnell A M. An investigation of chemotaxis in the insect parasitic nematode Heterorhabditis bacteriophora. Parasitology, 2003, 127(4): 375- 385.
[5]Bargmann C I. Chemosensation inC.elegans// TheC.elegansResearch Community. WormBook, 2006: 1- 29.
[6]Jeong P Y, Jung M, Yim Y H, Kim H, Park M, Hong E, Lee W, Kim Y H, Kim K, Paik Y K. Chemical structure and biological activity of theCaenorhabditiselegansdauer-inducing pheromone. Nature, 2005, 433(7025): 541- 545.
[7]von Reuss S H, Bose N, Srinivasan J, Yim J J, Judkins J C, Sternberg P W, Schroeder F C. Comparative Metabolomics Reveals Biogenesis of Ascarosides, a Modular Library of Small-Molecule Signals inC.elegans. Journal of the American Chemical Society, 2012, 134(3): 1817- 1824.
[8]Ludewig A H, Schroeder F C. Ascaroside signaling inC.elegans. WormBook: the online review ofC.elegansbiology, 2013: 1.
[9]Choe A, von Reuss S H, Kogan D, Gasser R B, Platzer E G, Schroeder F C, Sternberg P W. Ascaroside signaling is widely conserved among nematodes. Current Biology, 2012, 22(9): 772- 780.
[10]Hu P J. Dauer. WormBook, 2007: 1- 19. http://www.wormbook.org/chapters/www_dauer/dauer.html.
[11]Cassada R C, Russell R L. The dauerlarva, a post-embryonic developmental variant of the nematodeCaenorhabditiselegans. Developmental Biology, 1975, 46(2): 326- 342.
[12]Klass M, Hirsh D. Non-ageing developmental variant ofCaenorhabditiselegans. Nature, 1976, 260(5551): 523- 525.
[13]Golden J W, Riddle D L. A pheromone influences larval development in the nematodeCaenorhabditiselegans. Science, 1982, 218(4572): 578- 580.
[14]Golden J W, Riddle D L. ACaenorhabditiselegansdauer-inducing pheromone and an antagonistic component of the food supply. Journal of Chemical Ecology, 1984, 10(8): 1265- 1280.
[15]Butcher R A, Fujita M, Schroeder F C, Clardy J. Small-molecule pheromones that control dauer development inCaenorhabditiselegans. Nature Chemical Biology, 2007, 3(7): 420- 422.
[16]Baiga T J, Guo H B, Xing Y L, O′Doherty G A, Dillin A, Austin M B, Noel J P, La Clair J J. Metabolite induction ofCaenorhabditiselegansdauer larvae arises via transport in the pharynx. ACS Chemical Biology, 2008, 3(5): 294- 304.
[17]Gallo M, Riddle D L. Effects of aCaenorhabditiselegansdauer pheromone ascaroside on physiology and signal transduction pathways. Journal of Chemical Ecology, 2009, 35(2): 272- 279.
[18]Golden J W, Riddle D L. TheCaenorhabditiselegansdauer larva: Developmental effects of pheromone, food, and temperature. Developmental Biology, 1984, 102(2): 368- 378.
[19]Butcher R A, Ragains J R, Li W, Ruvkun G, Clardy J, Mak H Y. Biosynthesis of theCaenorhabditiselegansdauer pheromone. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(6): 1875- 1879.
[20]Kaplan F, Srinivasan J, Mahanti P, Ajredini R, Durak O, Nimalendran R, Sternberg P W, Teal P E A, Schroeder F C, Edison A S, Alborn H T. Ascaroside expression inCaenorhabditiselegansis strongly dependent on diet and developmental stage. PLoS ONE, 2011, 6(3): e17804.
[21]Butcher R A, Ragains J R, Kim E, Clardy J. A potent dauer pheromone component inCaenorhabditiselegansthat acts synergistically with other components. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(38): 14288- 14292.
[22]Srinivasan J, Kaplan F, Ajredini R, Zachariah C, Alborn HT, Teal P E, Malik R U, Edison A S, Sternberg P W, Schroeder F C. A blend of small molecules regulates both mating and development inCaenorhabditiselegans. Nature, 2008, 454(7208): 1115- 1118.
[23]Pungaliya C, Srinivasan J, Fox B W, Malik R U, Ludewig A H, Sternberg P W, Schroeder F C. A shortcut to identifying small molecule signals that regulate behavior and development inCaenorhabditiselegans. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(19): 7708- 7713.
[24]Butcher R A, Ragains J R, Clardy J. An indole- containing dauer pheromone component with unusual dauer inhibitory activity at higher concentrations. Organic Letters, 2009, 11(14): 3100- 3103.
[25]Izrayelit Y, Srinivasan J, Campbell S L, Jo Y, von Reuss S H, Genoff M C, Sternberg P W, Schroeder F C. Targeted metabolomics reveals a male pheromone and sex- specific ascaroside biosynthesis inCaenorhabditiselegans. ACS Chemical Biology, 2012, 7(8): 1321- 1325.
[26]Srinivasan J, von Reuss S H, Bose N, Zaslaver A, Mahanti P, Ho M C, O′Doherty O G, Edison A S, Sternberg P W, Schroeder F C. A modular library of small molecule signals regulates social behaviors inCaenorhabditiselegans. PLoS Biology, 2012, 10(1): e1001237.
[27]Yamada K, Hirotsu T, Matsuki M, Butcher R A, Tomioka M, Ishihara T, Clardy J, Kunitomo H, Iino Y. Olfactory plasticity is regulated by pheromonal signaling inCaenorhabditiselegans. Science, 2010, 329(5999): 1647- 1650.
[28]Macosko E Z, Pokala N, Feinberg E H, Chalasani S H, Butcher R A, Clardy J, Bargmann C I. A hub-and-spoke circuit drives pheromone attraction and social behaviour inC.elegans. Nature, 2009, 458(7242): 1171- 1175.
[29]Fouquey C, Polonsky J, Lederer E. Chemical structure of ascarylic alcohol isolated fromParascarisequorum. Bulletin De La Société De Chimie Biologique, 1957, 39(1): 101- 132.
[30]Jezyk P F, Fairbairn D. Ascarosides and ascaroside esters inAscarislumbricoides(Nematoda). Comparative Biochemistry and Physiology, 1967, 23(3): 691- 705.
[31]Tarr G E, Fairbairn D. Conversion of ascaroside esters to free ascarosides in fertilized eggs ofAscarissuum(Nematoda). The Journal of Parasitology, 1973, 59(3): 428- 433.
[32]Bartley J P, Bennett E A, Darben P A. Structure of the ascarosides fromAscarissuum. Journal of Natural Products, 1996, 59(10): 921- 926.
[33]Lapage G. Veterinary Parasitology. Edinburgh: Oliver and Boyd, 1956.
[34]Barrett J. Studies on the induction of permeability inAscarislumbricoideseggs. Parasitology, 1976, 73(1): 109- 121.
[35]Fagerholm H P, Nansen P, Roepstorff A, Frandsen F, Eriksen L. Differentiation of cuticular structures during the growth of the third-stage larva ofAscarissuum(Nematoda, Ascaridoidea) after emerging from the egg. Journal of Parasitology, 2000, 86(3): 421- 427.
[36]Edison A S.CaenorhabditiselegansPheromones Regulate Multiple Complex Behaviors. Current Opinion in Neurobiology, 2009, 19(4): 378- 388.
[37]Holterman M, van der Wurff A, van den Elsen S, van Megen H, Bongers T, Holovachov O, Bakker J, Helder J. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among nematodes and accelerated evolution toward crown clades. Molecular Biology and Evolution, 2006, 23(9): 1792- 1800.
[38]Ye W M, Torres-Barragan A, Cardoza Y J.Oscheiuscarolinensisn. sp. (Nematoda: Rhabditidae), a potential entomopathogenic nematode from vermicompost. Nematology, 2010, 12(1): 121- 135.
[39]Wang J, Kim S K. Global analysis of dauer gene expression inCaenorhabditiselegans. Development, 2003, 130(8): 1621- 1634.
[40]Berg J M, Tymoczko J L, Stryer L. Biochemistry. 5th ed. New York: WH Freeman and Co., 2002.
[41]Burnell A M, Houthoofd K, O′Hanlon K, Vanfleteren J R. Alternate metabolism during the dauer stage of the nematodeCaenorhabditiselegans. Experimental Gerontology, 2005, 40(11): 850- 856.
[42]Troemel E R. Chemosensory signaling inC.elegans. Bioessays, 1999, 21(12): 1011- 1020.
[43]Inglis P N, Ou G S, Leroux M R, Scholey J M. The sensory cilia ofCaenorhabditiselegans. WormBook, 2007, 1- 22.
[44]de Bono M, Bargmann C I. Natural variation in a neuropeptide Y receptor homolog modifies social behavior and food response inC.elegans. Cell, 1998, 94(5): 679- 689.
[45]Ebrahimi F A W, Chess A. Olfactory G proteins: simple and complex signal transduction. Current Biology, 1998, 8(12): R431- R433.
[46]O′Halloran D M, Fitzpatrick D A, Burnell A M. The chemosensory system ofCaenorhabditiselegansand other nematodes // Schoonhoven L M, Van Loon J J A, Dicke M. Chemical Ecology: From Gene to Ecosystem. New York: Springer Press, 2006, 71- 88.
[47]Kim K, Sato K, Shibuya M, Zeiger D M, Butcher R A, Ragains J R, Clardy J, Touhara K, Sengupta P. Two chemoreceptors mediate developmental effects of dauer pheromone inC.elegans. Science, 2009, 326(5955): 994- 998.
[48]McGrath P T, Xu Y F, Ailion M, Garrison J L, Butcher R A, Bargmann C I. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature, 2011, 477(7364): 321- 325.
[49]Zwaal R R, Mendel J E, Sternberg P W, Plasterk R H A. Two neuronal G proteins are involved in chemosensation of theCaenorhabditiselegansdauer- inducing pheromone. Genetics, 1997, 145(3): 715- 727.
[50]Fielenbach N, Antebi A.C.elegansdauer formation and the molecular basis of plasticity. Genes & Development, 2008, 22(16): 2149- 2165.
[51]Beall M J, Pearce E J. Transforming growth factor-beta and insulin-like signalling pathways in parasitic helminths. International Journal for Parasitology, 2002, 32(4): 399- 404.
[52]Thomas J H, Robertson H M. The Caenorhabditis chemoreceptor gene families. BMC Biology, 2008, 6(1): 42.
[53]Morran L T, Cappy B J, Anderson J L, Phillips P C. Sexual partners for the stressed: facultative outcrossing in the self-fertilizing nematodeCaenorhabditiselegans. Evolution, 2009, 63(6): 1473- 1482.
[54]Barron G L. The nematode-destroying fungi. Guelph, Canada: Canadian Biological Publications Ltd., 1977.
[55]Hsueh Y P, Mahanti P, Schroeder F C, Sternberg P W. Nematode-trapping fungi eavesdrop on nematode pheromones. Current Biology, 2013, 23(1): 83- 86.
[56]Noguez J H, Conner E S, Zhou Y, Ciche T A, Ragains J R, Butcher R A. A novel ascaroside controls the parasitic life cycle of the entomopathogenic nematodeHeterorhabditisbacteriophora. ACS Chemical Biology, 2012, 7(6): 961- 966.
Research progress on pheromone ascarosides in nematodes
WEI Yanan1,2, DANG Zhengwu3, CHEN Li2, FANG Yuling2, KONG Xiangbo4, HU Chunxiang1,*, ZHAO Lilin2
1CollegeofForestry,NortheastForestryUniversity,Harbin150040,China2StateKeyLaboratoryofIntegratedManagementofPestInsectsandRodents,InstituteofZoology,ChineseAcademyofSciences,Beijing100101,China3ShangluoForestPestsControlandQuarantineStation,Shangluo726000,China4KeyLaboratoryofForestProtectionofStateForestryAdministration,ResearchInstituteofForestEcology,EnvironmentandProtection,ChineseAcademyofForestry,Beijing100091,China
Abstract:Most organisms can secrete pheromones to mediate their behavior, development, and physiological metabolism. However, prior to the discovery of a group of intra-specific chemical signal substrates called ascarosides the pheromones of nematodes had not yet been described. The main chemical structures of ascarosides are made up of the sugar ascarylose, which is linked to fatty acid-like side chains of varying lengths. Ascarosides were originally isolated from the parasitic nematodeAscaris, the animal after which the group of compounds was named. Ascarosides play important roles in mediating different behaviors and development, such as mate finding, aggregation, and diapause in the free-living species Caenorhabditis elegans. Ascarosides also mediate distinct nematode behaviors, such as retention, avoidance, and long-range attraction. Likewise, a growing body of literature reports the identification of ascarosides in a wide range of other nematodes. The different nematode species respond to distinct, but overlapping, sets of ascarosides.
A wide range of biological functions is facilitated by a great diversity of ascarosides with varying chemical structures. Different ascarosides or combinations of ascarosides mediate the production of different phenotypes, and even small differences in chemical structures are often associated with strongly altered activity profiles. Additional complexity arises from concentration-dependent effects, and synergism between different ascarosides. At picomolar concentrations, a synergistic mixture of at least three ascarosides produced by hermaphrodites triggers male-specific attraction inC.elegans. At higher concentrations, the same ascarosides, perhaps in a different mixture, induce the developmentally arrested stage known as dauer.
Ascaroside signaling communicates detailed information about the life history and metabolic state of a nematode individual. The production of ascarosides is strongly dependent on environmental conditions, with the expression and concentrations of different ascarosides being sensitive to life stage, sex, food availability, and other environmental factors, suggesting that ascarosides regulate the overall life cycle ofC.elegans. At the same, in some studies investigating the ascarosides of parasitic nematodes, most of the species produce species-specific ascaroside mixtures, e.g., ascaroside biosynthesis patterns appear to be correlated with phylogeny.
The ascarosides are sensed by several types of chemosensory head neurons, including the ASK, ASI, and ADL neurons, as well as the male-specific CEM neurons. Ascaroside perception is mediated by diverse families of G-protein coupled membrane receptors that act upstream of conserved signal transduction pathways, including insulin/IGF-1 signaling and transforming growth factor beta (TGF-β) signaling. The biosynthesis of ascarosides appears to integrate input from several primary metabolic pathways, including peroxisomal β-oxidation of long-chain fatty acids and amino acid catabolism.
In this paper, we reviewed recent discoveries in this field, including reports of the structures and identification, components and functions, biosynthesis and metabolic regulation, allelopathic signaling pathways, and signal regulate mode of ascarosides, not only in nematodes, but also in other organisms. The aim is to provide an updated and comprehensive synthesis of the ascaroside literature. This will benefit future research on the chemical ecology of nematodes, and be of great value to the field of neurobiology.
Key Words:ascarosides; Caenorhabditis elegans; parasitic nematodes; pheromone
DOI:10.5846/stxb201409011734
*通訊作者
Corresponding author.E-mail: hcx386@163.com
收稿日期:2014- 09- 01; 網絡出版日期:2015- 07- 29
基金項目:林業公益性行業科研專項(201204501); 國家高技術研究發展計劃(863計劃:2014AA020529); 國家自然科學基金(31221091, 31272323, 31370650); 中國科學院創新工程項目(KSCX2-EW-J-2); 中國科學院戰略先導專項(XDB11050100)
魏亞楠, 黨政武, 陳立, 方宇凌, 孔祥波, 胡春祥, 趙莉藺.線蟲蛔甙(Ascarosides)信息素研究進展.生態學報,2016,36(6):1501- 1514.
Wei Y N, Dang Z W, Chen L, Fang Y L, Kong X B, Hu C X, Zhao L L.Research progress on pheromone ascarosides in nematodes.Acta Ecologica Sinica,2016,36(6):1501- 1514.

