一種準確測定熱軋鋼板酸洗模擬液中鹽酸濃度的方法
羅 坤,沈少波,毛尚偉
(1.北京科技大學冶金與生態工程學院,北京100083; 2.重慶賽迪冶煉裝備系統集成工程技術研究中心有限公司,重慶401122)
?
一種準確測定熱軋鋼板酸洗模擬液中鹽酸濃度的方法
羅 坤1,沈少波1,毛尚偉2
(1.北京科技大學冶金與生態工程學院,北京100083; 2.重慶賽迪冶煉裝備系統集成工程技術研究中心有限公司,重慶401122)
摘 要:用EDTA-Ca、KSCN以及NH4SCN作為有Fe(2+)存在的熱軋鋼板酸洗模擬溶液中Fe(2+)掩蔽劑,用NaOH滴定法測定溶液中鹽酸的濃度,并記錄溶液p H值隨NaOH溶液消耗的體積變化,選擇相應的曲線段的數學拐點作為滴定終點。結果發現這些掩蔽劑的加入都可使測定誤差降低,測量誤差從18.75%(沒有掩蔽劑)分別降低為-7.9%,3.1%和0.2%,很顯然,NH4SCN掩蔽效果很好。NH4SCN作為亞鐵離子掩蔽劑,用在Fe(2+)存在的酸性溶液中鹽酸濃度測定,這之前未見報導。該方法具有操作簡單、準確的特點。
關鍵詞:鹽酸濃度測定;熱軋鋼板酸洗液;亞鐵離子掩蔽劑;硫氰酸銨
1 引言
鋼廠通常采用鹽酸酸洗去除熱軋鋼板表面的氧化鐵皮[1],酸液濃度對酸洗效果起著至關重要的影響。目前,鋼廠普遍采用在線測量的方法檢測酸液濃度,該方法根據實驗測定酸液密度、電導率和溫度三者與實際鹽酸濃度建立關系,從而得出酸液濃度的計算經驗公式[2]。由于經驗公式只能在實驗室或鋼鐵廠通過實驗獲得,而準確測定酸洗液中鹽酸濃度對建立經驗公式十分重要[2,3,4],因此必須找到合適的方法準確測定室溫下酸洗液中HCl濃度[4]。雖然已經有一些測定鍋爐酸洗過程等相關酸濃度的方法[3,5-13],但文獻中鮮有提出準確測定熱軋帶鋼酸洗溶液中HCl濃度的記錄。因此,下面提出一種準確測定熱軋鋼板酸洗模擬液中鹽酸濃度的方法。
酸洗時,酸液中HCl濃度隨著酸洗進行不斷下降,而Fe2+和Fe3+濃度不斷升高,隨著溫度的升高Fe2+也會被氧化成Fe3+[3],但檢測發現酸洗槽中主要還是Fe2+,因此用HCl+ FeCl2溶液來模擬實際酸洗液。實驗室一般采用NaOH滴定法來測定鹽酸濃度,然而鹽酸酸洗時鹽酸與氧化鐵皮反應生成的Fe2+和Fe3+會與NaOH形成沉淀,消耗額外的OH-,從而導致滴定結果偏高[3,4,6,7]。因此在酸洗液的鹽酸濃度測定時,需要使用掩蔽劑來掩蔽Fe2+和Fe3+[6,7]。前人研究結果表明,采用檸檬酸銨和氟化鉀作掩蔽劑[6,7]時,雖然能掩蔽Fe2+和Fe3+,但是檸檬酸銨和氟化鉀溶解時會因水解而顯堿性,從而導致滴定終點結果比實際偏低;用碳酸鈉、硫代硫酸鈉作為掩蔽劑[3,4],會使滴定終點結果偏大;在搪瓷酸液洗鹽酸濃度測定時,EDTACa是一個很好的鐵離子掩蔽劑[3]。然而,在熱軋帶鋼酸洗液測定中并沒有用EDTA-Ca用作鐵離子的掩蔽劑。同時我們發現在測定熱軋帶鋼酸洗液中鹽酸濃度時,硫氰酸鹽是一個更好的鐵離子掩蔽劑,然而這項研究從來沒有報道過。因此,在本文中,研究EDTA-Ca、KSCN和NH4SCN幾種比較新穎的熱軋帶鋼酸洗溶液中亞鐵離子掩蔽劑對鐵離子的掩蔽效果。當用NaOH滴定鹽酸,通常用酚酞作終點滴定指示劑。在滴定終點p H值為8.3左右時,酚酞的顏色會由無色變為紅色。由于鐵離子與硫氰酸根離子的絡合物也是紅色,會干擾酚酞滴定終點顏色變化。因此實驗中不能用酚酞作為指示劑,可通過p H值計測定酸洗溶液隨NaOH滴定體積變化的p H值,然后繪制p H隨NaOH滴定體積變化的曲線,選擇相應的曲線段的數學拐點作為滴定終點。
2 儀器與試劑
PHS-CW數顯臺式酸度計;
NaOH標準溶液(CNaOH=1.01mol/L) 1。準確稱量4.055 6g NaOH于50m L燒杯中以適量的蒸餾水溶解,轉移至100ml容量瓶,定容。然后用基準鄰苯二甲酸氫鉀標定(CC8H5O4K=0.20mol/L)。
NaOH標準溶液(CNaOH=2.52mol/L) 2。準確稱量10.083 6g NaOH于50m L燒杯中以適量的蒸餾水溶解,轉移至100ml容量瓶,定容。然后用基準鄰苯二甲酸氫鉀標定(CC8H5O4K=0.20mol/L)。
NaOH標準溶液(CNaOH=0.98mol/L) 3。準確稱量20.004 5g NaOH于50m L燒杯中以適量的蒸餾水溶解,轉移至500ml容量瓶,定容,然后用基準鄰苯二甲酸氫鉀標定(CC8H5O4K=0.20mol/L)。
HCl(CHCl=1.07mol/L)溶液A。用移液槍準確量取10ml濃鹽酸(AR)于50m L燒杯中以適量蒸餾水稀釋,轉移燒杯中溶液至100ml容量瓶,定容,用標準NaOH溶液1標定。
HCl(CHCl = 1.07mol/L)+ FeCl2(CFeCl2=0.56mol/L)溶液B。用移液槍準確量取10ml濃鹽酸(AR)于50m L燒杯中以適量蒸餾水稀釋;準確稱量11.102 1g FeCl2·4H2O,然后加入燒杯,溶解,轉移燒杯中溶液至100ml容量瓶中,定容。
HCl(CHCl=3.16mol/L)溶液C。用移液槍準確量取27.1ml濃鹽酸(AR)于50m L燒杯中以適量蒸餾水稀釋,轉移燒杯中溶液至100ml容量瓶中,定容,用標準NaOH溶液1標定。
HCl(CHCl= 3.16mol/L)+ FeCl2(CFeCl2=0.56mol/L)溶液D。用移液槍準確量取27.1ml濃鹽酸(AR)于50m L燒杯中以適量蒸餾水稀釋;準確稱量11.103 2g FeCl2·4H2O,然后加入燒杯,溶解,轉移燒杯中溶液至100ml容量瓶中,定容。
EDTA-Ca(CEDTA-Ca=0.1mol/L)溶液E。將50m L的0.2 mol/L CaCO3(用HCl溶解)溶液與50m L的0.2mol/L EDTA標準溶液混勻,然后加入甲基橙指示劑,用10%NaOH溶液中和至橙黃色為止。
3mol/L KSCN溶液F。準確稱量72.750 2g KSCN于燒杯中以適量的蒸餾水溶解,轉移至250ml容量瓶,定容。
3mol/L NH4SCN溶液G。準確稱量57.324 2g NH4SCN于燒杯中以適量的蒸餾水溶解,轉移至250ml容量瓶,定容。
3 實驗方法
3.1 實驗1(無掩蔽劑時鋼板酸洗液中鹽酸濃度測定)
取8ml A容量瓶(CHCl=1.07mol/L)中酸液于250ml錐形瓶1中,加水稀釋至100ml;取8mlB容量瓶(CHCl=1.07mol/L; CFeCl2=0.56mol/L)中酸液于250ml錐形瓶2中,加水稀釋至100ml;然后用堿式滴定管中標準NaOH溶液1(CNaOH=1.01mol/L)分別滴定錐形瓶1和2溶液,記錄溶液p H值隨NaOH標準溶液1消耗量的變化。
3.2 實驗2(掩蔽劑EDTA-Ca存在時鋼板酸洗液中鹽酸濃度測定)
分別取8ml C容量瓶(CHCl=3.16mol/ L)中酸液于250ml錐形瓶3、4中,分別加水稀釋至100ml;取8ml D容量瓶中(CHCl= 3.16mol/L;CFeCl2=0.56mol/L)酸液于250ml錐形瓶杯5中,加水稀釋至100ml。往錐形瓶3中加入50ml蒸餾水,往燒杯4和5中分別加入50ml 0.1mol/L EDTA-Ca溶液。然后用堿式滴定管中標準NaOH溶液2 (CNaOH=2.52mol/L)分別滴定錐形瓶3、4 和5溶液,分別記錄溶液p H隨NaOH標準溶液2消耗量的變化。
3.3 實驗3(掩蔽劑KSCN存在時鋼板酸洗液中鹽酸濃度測定)
分別取8ml C容量瓶(CHCl=3.16mol/ L)中酸液于250ml錐形瓶6和7中,分別加水稀釋至100ml;取8mlD容量瓶(CHCl= 3.16mol/L;CFeCl2=0.56mol/L)中酸液于250ml錐形瓶8中,加水稀釋至100ml。往燒杯6中加20ml蒸餾水,往燒杯7和8中加入20ml 3mol/L KSCN溶液。然后用堿式滴定管中標準NaOH溶液3(CNaOH=0.98mol/ L)分別滴定錐形瓶6、7、8中溶液,記錄溶液p H隨NaOH標準溶液3消耗量的變化。
3.4 實驗4(掩蔽劑NH4SCN存在時鋼板酸洗液中鹽酸濃度測定)
取8ml C容量瓶(CHCl=3.16mol/L)中酸液于250ml錐形瓶9中,加水稀釋至100ml;取8mlD容量瓶(CHCl=3.16mol/L; CFeCl2=0.56mol/L)中酸液于250ml錐形瓶10中,加水稀釋至100ml。往燒杯9和10中分別加入20ml 3mol/L NH4SCN。然后用堿式滴定管中標準NaOH溶液3(CNaOH= 0.98mol/L)分別滴定錐形瓶9和10溶液,記錄溶液p H隨NaOH標準溶液3消耗量的變化。
然后利用公式1,計算實驗1至實驗4酸洗液中鹽酸濃度:

式中:CHCl—酸洗液中鹽酸的濃度, mol/L;VNaOH—滴定消耗的Na OH標準溶液體積,m L;CNaOH—Na OH標準溶液濃度, mol/L;V酸—酸洗液體積,m L。
4 結果與討論
4.1 無掩蔽劑時鋼板酸洗液中鹽酸濃測度定實驗1的結果見圖1。當沒有屏蔽劑時,用NaOH標準溶液1(CNaOH=1.01mol/L)分別滴定溶液A(CHCl=1.07mol/L)和溶液B(CHCl=1.07mol/L;CFeCl2=0.56mol/ L),滴定終點的p H值分別為3.34和9.97,此時分別消耗8.48 m L和10.07m LNaOH標準溶液1。當存在氯化亞鐵時,鹽酸濃度的測定結果偏大,相對誤差高達18.75%(見表1)。
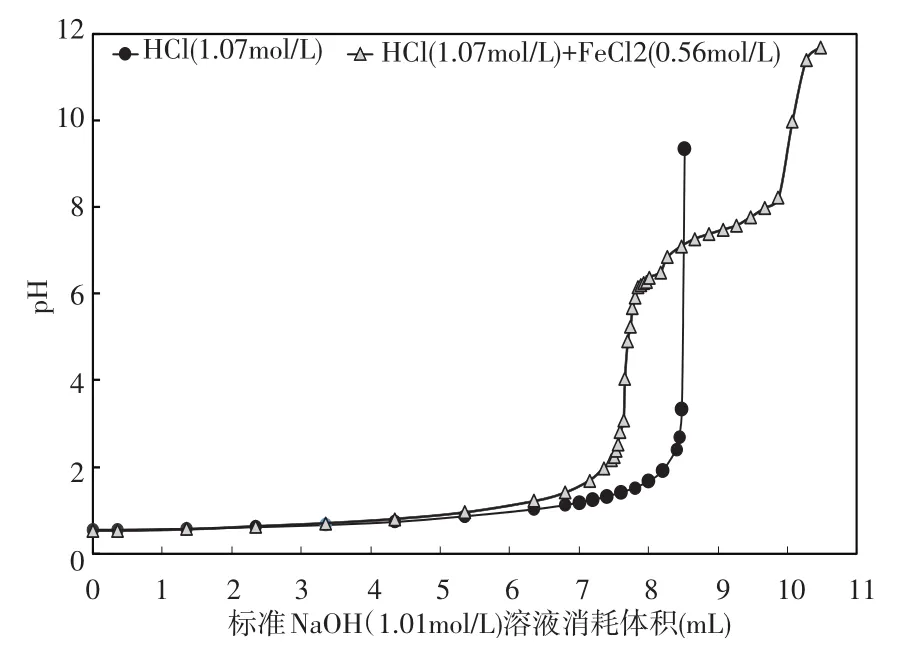
圖1 實驗1中溶液p H值與消耗的NaOH(1.01mol/L)的體積變化圖
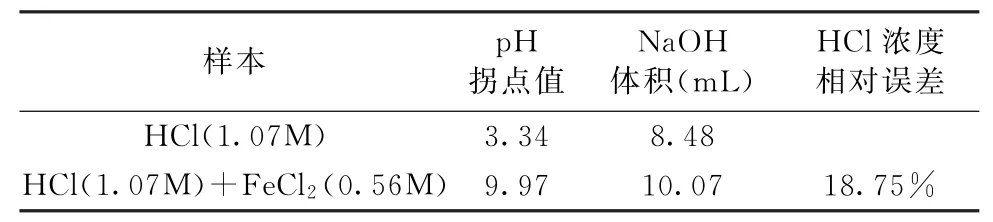
表1 實驗1的結果
4.2 掩蔽劑EDTA-Ca存在時鋼板酸洗液中鹽酸濃度測定
實驗2的結果見圖2。當無掩蔽劑時,用NaOH標準溶液2(CNaOH=2.52mol/L)滴定溶液C(CHCl=3.16 mol/L),消耗NaOH標準溶液2的體積為10.04 m L(見表2)。當使用掩蔽劑EDTA-Ca時,用NaOH標準溶液2(CNaOH=2.52 mol/L)分別滴定溶液C (CHCl=3.16 mol/L)和溶液D(CHCl=3.16 mol/L;CFeCl2=0.56mol/L),滴定終點的p H值分別是6.34和3.62(見表2),消耗NaOH標準溶液2的體積分別為10.20m L 和9.30 m L,HCl濃度測定的相對誤差分別為1.0%和-7.9%,(見表2)。實驗結果可以看出,當存在EDTA-Ca時,含有FeCl2的酸液HCl濃度測定值低于實際值;同時,EDTA-Ca的加入雖然降低了鹽酸濃度測定的相對誤差(從18.75%到-7.9%),但EDTACa不能有效地掩蔽FeCl2的干擾。
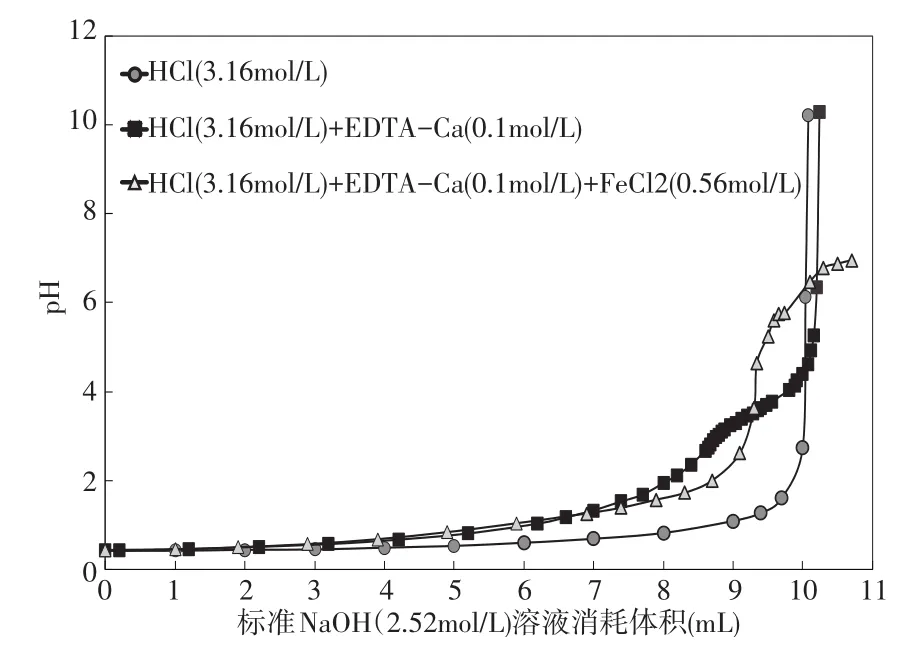
表2 實驗2中溶液p H值與消耗的NaOH(2.52mol/L)的體積變化圖
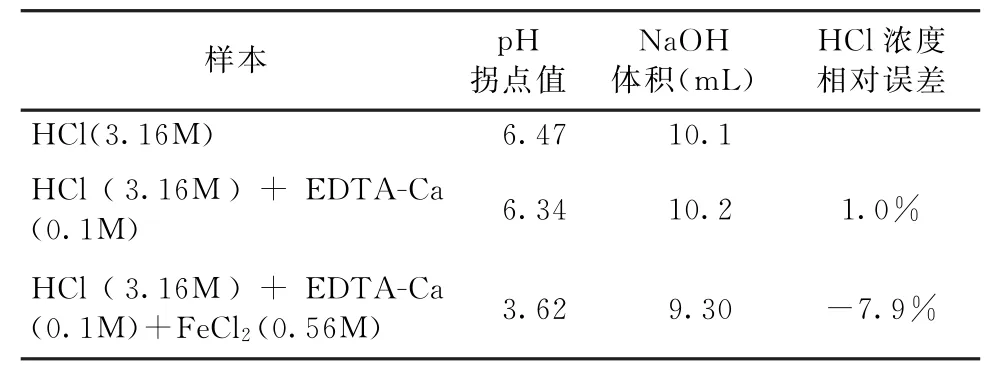
表2 實驗2的結果
4.3 掩蔽劑KSCN存在時鋼板酸洗液中鹽酸濃度測定
實驗3的結果見圖3。在沒有掩蔽劑時, 用NaOH標準溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16 mol/L),滴定終點的p H值為6.64,溶液3消耗的體積為25.7m L(見表3)。當存在掩蔽劑KSCN時, 用NaOH標準溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16mol/L)和溶液D (CHCl=3.16mol/L;CFeCl2=0.56mol/L),滴定終點的p H值分別為6.34和4.58,溶液3的消耗量分別為25.70m L和26.50m L,此時HCl濃度測定的相對誤差分別為0和3.1%(見表3)。實驗結果可以看出,當鹽酸溶液中加入KSCN后,此時HCl濃度測定的相對誤差為0,說明KSCN的加入不會對鹽酸溶液的測定產生影響;當含有FeCl2的酸洗溶液中加入KSCN時,HCl濃度測定值與實際值誤差減小(從18.75%到3.1%),說明KSCN溶液能有效地掩蔽FeCl2的干擾。
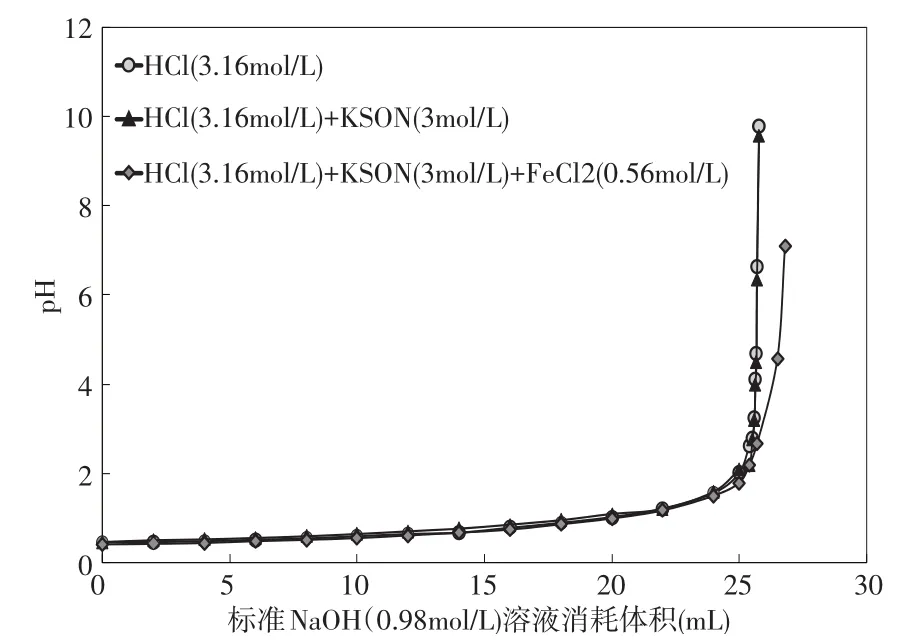
圖3 實驗3中溶液p H值與消耗的NaOH(0.98mol/L)的體積變化圖
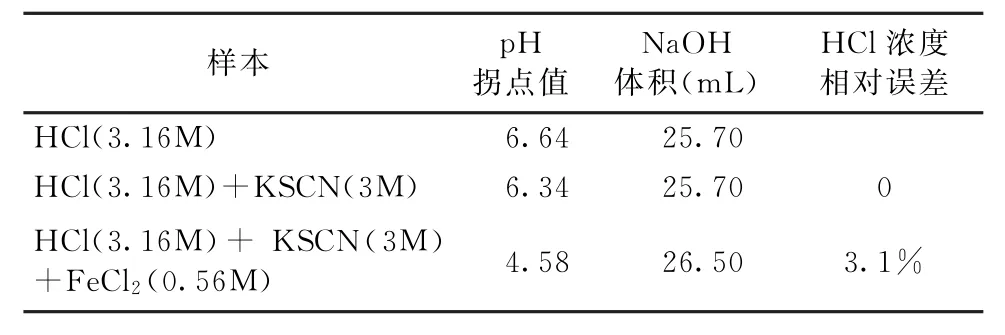
表3 實驗3的結果
4.4 掩蔽劑NH4SCN存在時鋼板酸洗液中鹽酸濃度測定
實驗4的結果見圖4。當無掩蔽劑,用NaOH標準溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16 mol/L),滴定終點的p H值為6.64,消耗溶液3的體積為25.7m L(見表4)。當使用NH4SCN作為掩蔽劑時, 用NaOH標準溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16 mol/L)和溶液D (CHCl=3.16mol/L;CFeCl2=0.56mol/L),滴定終點的p H值分別為6.44和4.49(見表4),溶液3的消耗體積分別為25.76m L和25.76m L,HCl濃度測定的相對誤差分別為0.2%和0.2%(見表4)。實驗結果可以看出,當NH4SCN加入到鹽酸溶液中時,HCl濃度測定的相對誤差為0.2%,說明NH4SCN不會對HCl濃度測定產生影響;當含有FeCl2的酸洗溶液采用NH4SCN作為掩蔽劑時,HCl濃度測定值最接近實際值,說明NH4SCN對FeCl2的掩蔽效果最佳。
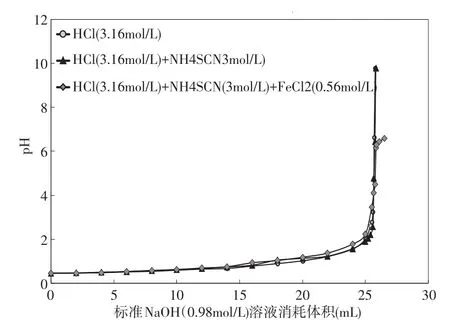
圖4 實驗4中溶液p H值與消耗的NaOH(0.98mol/L)的體積變化圖

表4 實驗4的結果
以上實驗可以看出,在測量模擬含有Fe2+的酸洗溶液鹽酸濃度中,NH4SCN是最好的掩蔽劑。同時,在國內某鋼廠酸洗線的現場測試表明,用NH4SCN作掩蔽劑測定的HCl濃度和現場在線檢測計算HCl濃度平均相對誤差<1%。
4.5 NH4SCN滴定酸洗液鹽酸濃度的方法原理
用標準NaOH溶液滴定含有亞鐵離子的酸洗液中的鹽酸時,溶液的p H值不斷升高,一部分亞鐵離子可能會被氧化成三價鐵離子,形成氫氧化物沉淀,使得測得的鹽酸濃度高于實際值。當NH4SCN作Fe2+和Fe3+的掩蔽劑時,由于SCN與Fe2+和Fe3+形成復雜穩定絡合物,避免了三價鐵沉淀的形成, Fe2+和Fe3+與SCN-形成絡合物的主要反應式:
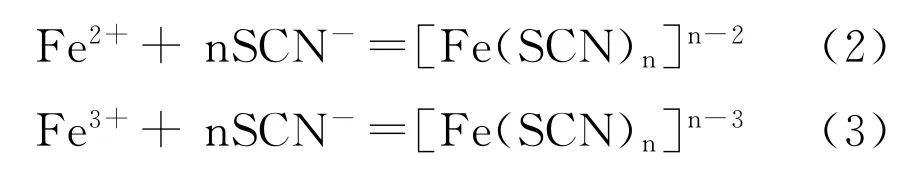
βn(2)、βn(3)為累積穩定常數,表達式分別如下:
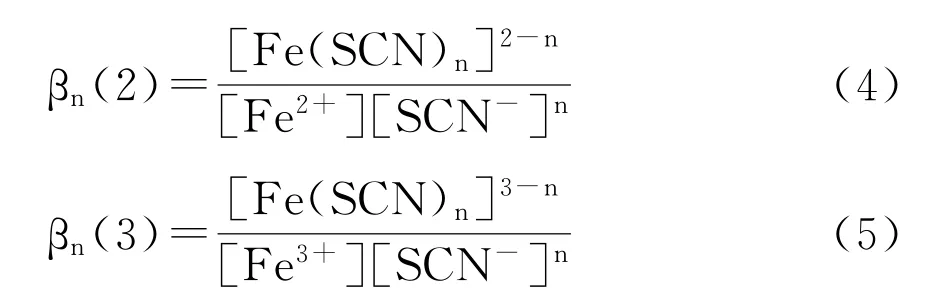
其中 lgβ(n=2,5)分別為5.6和6.4, lgβ(n=3,6)分別為6.3和6.1[14,15]。β是累積穩定常數,例如對Fe2+,β
這表明SCN-能同時和熱軋鋼板酸洗液中Fe2+和Fe3+絡合,形成穩定的水溶性絡合物,從而阻礙Fe2+和Fe3+在滴定過程中形成氫氧化物沉淀,對Fe2+和Fe3+起到掩蔽作用。
5 結論
用EDTA-Ca、KSCN及NH4SCN作掩蔽劑時,用酸堿中和滴定法測定含有亞鐵離子的熱軋板酸洗模擬液中的鹽酸濃度。研究結果如下。
(1)Fe2+存在會使酸洗液中的鹽酸濃度測定結果嚴重偏高,相對誤差可達18.75%。
(2)采用EDTA-Ca、KSCN及NH4SCN作為Fe2+掩蔽劑時,都可降低HCl濃度的測定誤差,并分別降低到-7.9%,3.1% 和0.2%。
(3)采用NH4SCN作為掩蔽劑時,HCl濃度測定值最接近實際值,說明NH4SCN對FeCl2的掩蔽效果最佳。
參考文獻:
[1] M.Tourabi,K.Nohair and M.Traisnel.Electrochemical and XPS studies of the corrosion inhibition of carbon steel in hydrochloric acid pickling solutions by 3,5-bis(2-thienylmethyl)-4-amino-1,2,4-triazole[J].Corro.Sci. 2013,(75):123-133.
[2] 王元槐.基于電導率和比重的酸濃度控制[J].酒鋼科技專刊,2011,(1):82-85.
[3] 彭大龍.酸洗溶液中酸度的準確測定[J].中國搪瓷,1994,15(6):16-17.
[4] 王獻科,李玉萍.鋼材酸洗液中酸、亞鐵的簡易測定法[J].化學清洗,1993,9(03):24-27.
[5] H.du.Plessis and J.F.van Staden.Determination of sulphuric acid in process effluent streams using sequential injection titration [J].Talanta,2002,(52):83-90.
[6] 齊賢成.鍋爐酸洗過程中總酸度的測定[J].化肥工業,2006,33(6):47.
[7] 余鴻恩.鹽酸冼爐時酸液濃度的測定法[J].電力技術,1980,(12):85.
[8] A.R.T?rresa et al.A digital image-based method for determining of total acidity in red wines using acid-base titration without indicator[J].Talanta,2011,(84):601-606.
[9] J.F.van Staden,M G Mashamba and R I Stefan.Determination of the total acidity in soft drinks using potentiometric sequential injection titration[J].Talanta,2002,(58): 1109-1114.
[10]M.Weiss,M Manneberg,J FJuranville,H W Lahm and M Fountoulakis.Effect of the hydrolysis method on the determination of the amino acid composition of proteins[J].J. Chromatogr.A,1998,(795):263 275.
[11]D.M.Albin,J E Wubben and V MGabert. The influence of hydrochloric acid concentration and measurement method on the determination of amino acid levels in soya bean products[J].Anim.Feed Sci.Tech,2000, (87):173-186.
[12]D.L.Jones,A G Owen and J F Farrar. Simple method to enable the high resolution determination of total free amino acids in soil solutions and soil extracts[J].Soil Biol.Biochem,2002,(34):1893-1902.
[13]J.Kozak,M Wójtowicz and P Ko'scielniak. An automatic system for acidity determination based on sequential injection titration and the monosegmented flow approach[J].Talanta,2011,(84):1379-1383.
[14]陳永雷,陳興國,何疆,陳宏麗.分析化學[M].北京:高等教育出版社,2012:446.
[15]溫金蓮,郭興杰.分析化學[M].北京:中國醫藥科技出版社,2012:457.
A Method for Accurate Determination of the Concentration of Hydrochloric Acid from Simulated Picking Solutions of Hot Rolled Steel Strip
LUO Kun1,SHEN Shao-bo1,MAO Shang-wei2
(1.School of Metallurgical and Ecological Engineering,University of Science and Technology Beijing,Beijing 100083,China; 2.CISDI Engineering Co.LTD,Chongqing 401122,China)
Abstract:EDTA-Ca,KSCN and NH4SCN were tested as the masking agents of the Fe(2+)of the simulated pickling solutions in the presence of Fe(2+),A volumetric method using NaOH as titration agent was studied for the determination of HCl concentration from the pickling solutions in this work.The variation of solution p H with the volume of NaOH solution consumed was recorded.The mathematical inflection point of the curve section corresponding to a p H jump was selected as the endpoint of titration.It was found that the relative measurement errors were reduced from 18.75%(No masking agent)to-7.9 %,3.1 % and 0.2 %for EDTA-Ca,KSCN and NH4SCN,respectively.Thus NH4SCN was the best masking agent of the ferrous ions.It hasbook=70,ebook=74never reported before that NH4SCN is used as a masking agent of ferrous ions for determination of concentration of hydrochloric acid from acidic solutions in the presence of Fe(2+).This method is simple and accurate.
Key words:determination of hydrochloric acid;pickling solution of hot rolled steel strip;masking agents of ferrous ions;ammonium thiocyanate
作者簡介:羅 坤,碩士生,主要從事濕法冶金和冶金物理化學研究。
文章編號:1001-5108(2016)01-0069-07
中圖分類號:O655.22
文獻標識碼:A

