158株耐多藥結核分枝桿菌對利奈唑胺耐藥及相關基因突變情況研究
王前 宋媛媛 王玉峰 逄宇 趙雁林
?
158株耐多藥結核分枝桿菌對利奈唑胺耐藥及相關基因突變情況研究
王前 宋媛媛 王玉峰 逄宇 趙雁林
目的 分析我國耐多藥結核分枝桿菌菌株對利奈唑胺的耐藥率,探究結核分枝桿菌對利奈唑胺耐藥相關基因的突變特征。 方法 作者于2013年10月采用直接抽選法,從401株來自于2007年全國結核病耐藥性基線調查的耐多藥結核分枝桿菌菌株中隨機抽取158株,分為耐多藥組(107/158,67.7%)、前廣泛耐藥組(41/158,26.0%)和廣泛耐藥組(10/158,6.3%);采用微孔板稀釋法檢測其對利奈唑胺的最低抑菌濃度(minimal inhibitory concentrataion,MIC),以結核分枝桿菌標準株H37Rv (ATCC 27249)作為對照,當MIC高于臨界濃度時,判定為結核分枝桿菌對利奈唑胺耐藥。同時對利奈唑胺耐藥的結核分枝桿菌相關基因23SrRNA、rplC和rplD進行測序,分析其突變特征;采用Fisher確切概率法及卡方檢驗統計不同組別間利奈唑胺耐藥率的差別,以P<0.05為差異有統計學意義。結果 158株耐多藥菌株對利奈唑胺的總耐藥率為10.8%(17/158)。其中10株廣泛耐藥菌株中有6株對利奈唑胺耐藥(6/10),明顯高于耐多藥組(5.6%,6/107)和前廣泛耐藥組(12.2%,5/41),經Fisher確切概率法檢驗差異均有統計學意義(P<0.001;P=0.004)。在17株利奈唑胺耐藥菌株中,共發現5株(29.4%)在23SrRNA或(和)rplC基因發生突變,同時首次鑒定到rplC基因His155Asp突變可能與低水平利奈唑胺耐藥(MIC=2 μg/ml)相關。結論 廣泛耐多藥結核分枝桿菌對利奈唑胺的耐藥率明顯高于耐多藥和前廣泛耐藥結核分枝桿菌;23SrRNA和rplC基因突變可能與利奈唑胺耐藥性相關。
分枝桿菌,結核; 惡唑烷酮類; 利奈唑胺; 結核, 抗多種藥物性; 基因, 細菌; 突變; 因果律
結核病是全世界面臨的公共衛生問題[1]。雖然得益于抗結核藥物的問世,全世界結核病發病率呈逐年下降趨勢,耐多藥(multi-drug resistance,MDR)、特別是廣泛耐藥結核病(extensively drug-resistant tuberculosis,XDR-TB)已成為結核病防控工作面臨的新挑戰[2]。我國是全球耐藥結核病高負擔國家之一,特別是MDR和XDR的發病率居高不下[3]。據全國結核病耐藥基線調查結果顯示,我國每年約發生110 000例MDR及8200例XDR患者,已成為我國臨床及公共衛生領域面臨的巨大威脅[2]。MDR患者治療通常需要二線抗結核藥物,但在完成全部療程后其治愈率僅為50%,因此迫切需要新的抗結核藥物補充現有治療方案[4]。利奈唑胺是惡唑烷酮類抗生素,體外試驗及動物實驗表明,利奈唑胺對MDR和XDR表現出良好的抑菌活性[5]。雖然利奈唑胺價格較高且存在不良反應,但多項病例報道和臨床回顧性研究表明,利奈唑胺能夠明顯提高MDR和XDR患者的治愈率[6-7]。因此,有必要在MDR患者中開展關于利奈唑胺耐藥率的流行病學研究;然而,目前對利奈唑胺耐藥率和耐藥機制等方面的研究甚少。本研究采用簡單隨機抽樣法中的直接抽選法抽取來自于全國耐藥基線調查的耐多藥結核分枝桿菌菌株,采用微孔板稀釋法檢測菌株對利奈唑胺的耐藥情況,同時,對利奈唑胺耐藥相關基因進行測序分析。
材料和方法
一、菌株來源
于2013年10月采用簡單隨機抽樣法中的直接抽選法從401株來自于2007年全國結核病耐藥性基線調查的耐多藥結核分枝桿菌菌株中抽取158株,菌株由中國疾病預防控制中心國家結核病參比實驗室提供[2],其各省來源如表1所示。上述菌株經過傳統比例法[2]藥物敏感性試驗(簡稱“藥敏試驗”)鑒定對利福平和異煙肼兩種藥物同時耐藥;同時采用對硝苯甲酸(PNB)和噻吩二羧酸肼(TCH)菌種鑒定試驗[2]證實是結核分枝桿菌復合群(Mycobacteriumtuberculosiscomplex,MTBC)。標準菌株H37Rv為國家結核病參比實驗室保藏菌株。
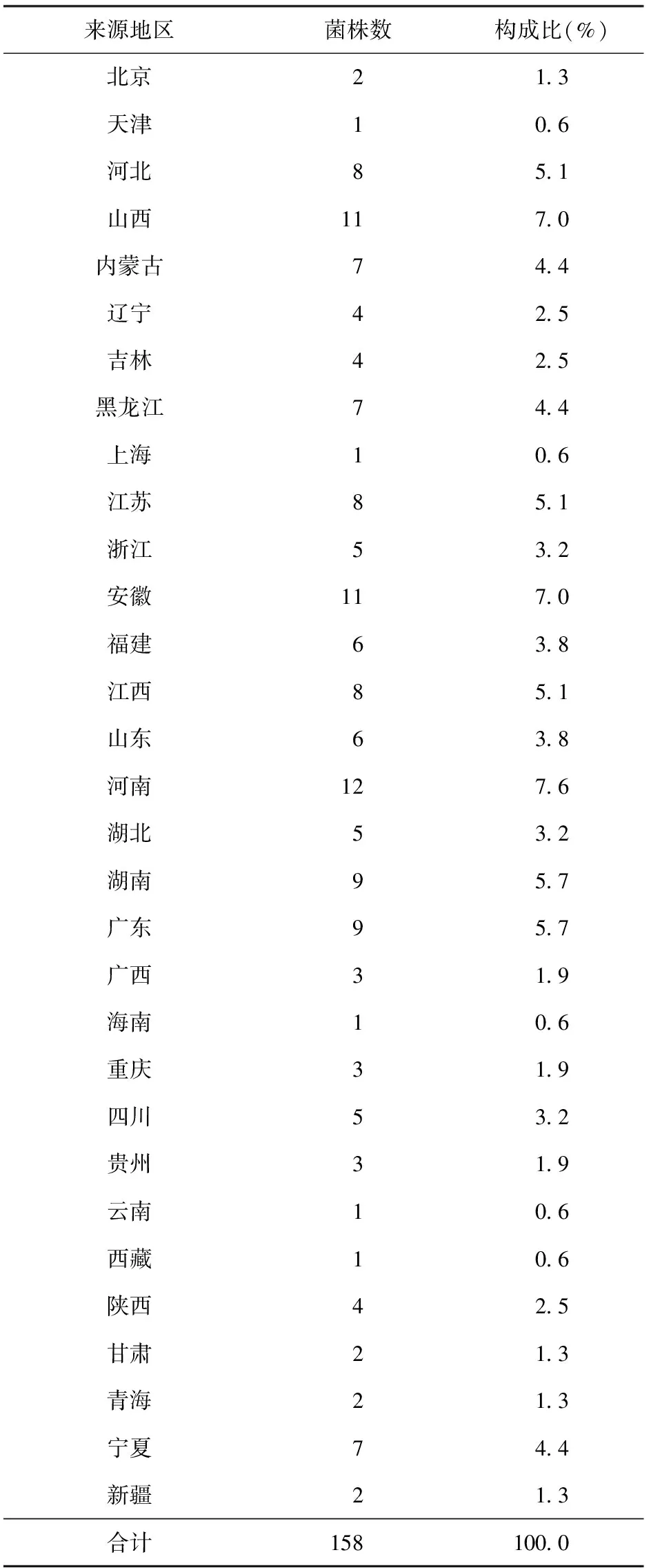
表1 菌株來源表
二、菌株分組
158株耐多藥結核分枝桿菌傳統藥敏試驗鑒定分為3組,分別為耐多藥組(107/158,67.7%)、廣泛耐藥組(41/158,26.0%)和前廣泛耐藥組(10/158,6.3%)。
三、相關定義
1.耐多藥結核分枝桿菌:至少同時對異煙肼和利福平耐藥的結核分枝桿菌菌株。
2.前廣泛耐藥(pre-XDR):對任何氟喹諾酮類藥物或者3種二線注射藥物(卷曲霉素、卡那霉素和阿米卡星)中的至少1種耐藥,但不同時對氟喹諾酮和任一二線注射類藥物耐藥的耐多藥結核分枝桿菌。
3.廣泛耐藥(XDR):對任何氟喹諾酮類藥物及3種二線注射藥物(卷曲霉素、卡那霉素和阿米卡星)中的至少1種耐藥的耐多藥結核分枝桿菌[8]。
4.全敏感菌株:對所有被檢測抗結核藥物均表現為敏感的結核分枝桿菌。
5.最低抑菌濃度(MIC):能抑制結核分枝桿菌生長的最低藥物濃度。MIC50是指在一批實驗中能抑制50%受試菌所需的最低抑菌濃度;MIC90是指是指在一批實驗中能抑制90%受試菌所需的最低抑菌濃度[9]。
6.工作濃度:用于檢測結核分枝桿菌體外藥敏試驗時培養基中藥物濃度。
7.靶標基因:結核分枝桿菌細胞內被藥物作用的蛋白質稱為靶標,編碼靶標蛋白的基因被稱為靶標基因。
8.天然耐藥機制:由于不同的細菌細胞結構與化學組成等不同,使其本身對某些抗生素天然不敏感的機制。
四、試劑來源
本試驗所用改良羅氏培養基購自珠海貝索生物有限公司;7H9培養基和OADC添加劑購自于美國碧迪生物公司;Alamar blue購自于美國伯樂生物公司;2×Taq預混液購自于北京康為世紀生物科技有限公司;所有引物均由北京擎科生物技術有限公司合成。
五、MIC測定及判定標準
選用微孔板Alamar藍(Alamar blue)顯色法進行檢測[10]。刮取改良中性羅氏培養基上生長4周的新鮮菌落,使用磨菌瓶磨菌,使用比濁儀將菌液稀釋到1個麥氏濃度,再以1∶20稀釋后向96孔微孔板加入100 μl 菌液。微孔板靜置于37 ℃培養箱中孵育7 d,向實驗微孔中加入70 μl 預混的顯色液(含20 μl Alamar blue和50 μl 5.0% Tween-80),37 ℃孵育24 h 后觀察各孔顏色,藍色孔為無結核分枝桿菌生長,紅色孔為有生長。從藍色孔結果可以得出能抑制結核分枝桿菌生長的MIC。利奈唑胺在微孔板中設置的工作濃度分別為0.0625、0.125、0.25、0.5、1、2、4、8、16、32和64 μg/ml。根據文獻[11],確定利奈唑胺的耐藥臨界濃度為1.0 μg/ml,當測試結核分枝桿菌MIC高于臨界濃度時,判定結核分枝桿菌對利奈唑胺耐藥。采用結核分枝桿菌標準株H37Rv (ATCC 27249)作為對照。
六、基因組DNA提取
采用水煮法提取結核分枝桿菌基因組DNA[8], 采用無菌生理鹽水清洗改良中性羅氏培養基斜面生長的菌落,吸取菌懸液1 ml于無菌離心管中,85 ℃ 30 min滅活,12 000×g離心5 min,棄上清。菌體用500 μl TE(Tris-EDTA)緩沖液(pH 8.0)充分懸浮,95 ℃金屬浴30 min,12 000×g離心5 min,將上清轉移至無菌離心管中,凍存于-20 ℃冰箱中備用。
七、基因擴增及測序
提取結核分枝桿菌基因組DNA后,為了分析對利奈唑胺耐藥的相關基因突變情況,選用特異性引物,分別擴增了所有利奈唑胺耐藥相關基因23SrRNA(23S 核糖體RNA),rplC(核糖體蛋白 L3)和rplD(核糖體蛋白 L4) 3個基因的序列(表2)。擴增體系:2×Taq預混液25 μl,兩條引物各0.2 μmol、3 μl 基因組DNA。反應條件:預變性94 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min, 72 ℃ 1 min,總計35個循環;72 ℃ 延伸 5 min。PCR產物送北京擎科生物技術有限公司測序。測序結果采用BioEdit軟件與標準菌株H37Rv基因序列進行比對。
八、統計學分析
采用SPSS 14.0 軟件進行不同組別利奈唑胺耐藥率的卡方檢驗或Fisher確切概率法檢驗,以P<0.05為差異有統計學意義。
結 果
一、MDR結核分枝桿菌的耐藥譜
在158株耐多藥結核分枝桿菌菌株中,對一線抗結核藥物鏈霉素和乙胺丁醇耐藥的菌株數分別為115株 (72.7%)和86株(54.4%);對二線抗結核藥物氧氟沙星和卡那霉素耐藥的菌株數分別為45株(28.5%)和8株(10.1%)。此外,傳統藥敏試驗鑒定獲得41株(25.9%)前廣泛耐藥菌株和10株(6.3%)廣泛耐藥菌株。

表2 本研究所用引物序列基因名稱
注 F:上游引物; R:下游引物;S、C、D分別為基因名稱自帶的字母
二、不同組別結核分枝桿菌對利奈唑胺的耐藥率比較
耐多藥組、前廣泛耐藥組、廣泛耐藥組的MIC50和MIC90分別為(0.25 μg/ml 和1 μg/ml)、(0.25 μg/ml 和2 μg/ml)、(2 μg/ml 和32 μg/ml)。158株耐多藥結核分枝桿菌中發現17株(10.8%)對利奈唑胺耐藥。其中10株廣泛耐藥組中有6株對利奈唑胺耐藥 (6/10),明顯高于耐多藥組的5.6%(6/107)及前廣泛耐藥組的12.2%(5/41),經Fisher確切概率法檢驗,差異均有統計學意義(P<0.001;P=0.004);而耐多藥組和前廣泛耐藥組對利奈唑胺耐藥率經卡方檢驗,差異無統計學意義(χ2=1.87,P=0.307)。同時,3株菌株均來自于耐藥水平最高(MIC=32 μg/ml)的廣泛耐藥組(表3)。
三、結核分枝桿菌對利奈唑胺耐藥的相關基因突變情況
本研究檢測了158株耐多藥菌株中的23SrRNA,rplC和rplD3個基因的序列(表4)。在17株利奈唑胺耐藥菌株中,共發現5株(29.4%)在23SrRNA或(和)rplC基因發生突變,有4株(23.5%)rplC基因發生基因突變,包括2種不同的氨基酸置換:Cys154Arg(TGC460CGC)和His155Asp(CAC463GAC)。其中有3株(17.6%)耐藥菌株帶有第154位氨基酸突變,攜帶第155位氨基酸突變的結核分枝桿菌菌株的MIC為2 μg/ml;此外,有2株(11.6%)耐藥菌株在23SrRNA基因的第2061位核苷酸發生突變,帶有該突變類型的菌株的MIC均為32 μg/ml。未發現對利奈唑胺耐藥菌株中有rplD突變;在對利奈唑胺敏感的菌株中,鑒定出2種非同義單核苷酸多態性(single nucleotide polymorphism,SNP),包括5株帶有Arg79His(CGT→CAT)及6株帶有Ser104Cys(AGC→TGC)。
討 論
本研究首次對耐多藥結核分枝桿菌對利奈唑胺耐藥情況進行了系統研究,并且分析了耐藥基因的突變情況,獲得了一定的參考數據。
一、廣泛耐藥結核分枝桿菌對利奈唑胺耐藥的相關機制
除了經典的耐藥相關基因突變機制外,藥物外排泵在結核病耐藥機制中發揮著重要功能[12]。有研究表明耐藥菌株中藥物外排泵基因表達水平通常比敏感菌株更高[13];此外,當聯合藥物外排泵抑制劑與抗結核藥物治療廣泛耐藥肺結核患者時,其治療效果往往比單獨使用抗結核藥物更好[14]。上述結果提示,藥物外排泵機制可能在廣泛耐藥菌株中發揮更重要的作用。因此,筆者推測,廣泛耐藥菌株具有的藥物外排泵機制導致了其對利奈唑胺的耐藥率明顯高于耐多藥菌株和前廣泛耐藥菌株。

表3 耐多藥、前廣泛耐藥和廣泛耐藥菌株中利奈唑胺MIC分布特征
注 MIC50是指是指在一批實驗中能抑制50%受試菌所需的最低抑菌濃度;MIC90是指是指在一批實驗中能抑制90%受試菌所需的最低抑菌濃度。其中耐多藥組,前廣泛耐多藥組和廣泛耐多藥組的MIC50分別為0.25 μg/ml,0.25 μg/ml和2 μg/ml;MIC90分別為1 μg/ml,2 μg/ml和32 μg/ml;表中括號外數值為菌株數,括號內數值為構成比
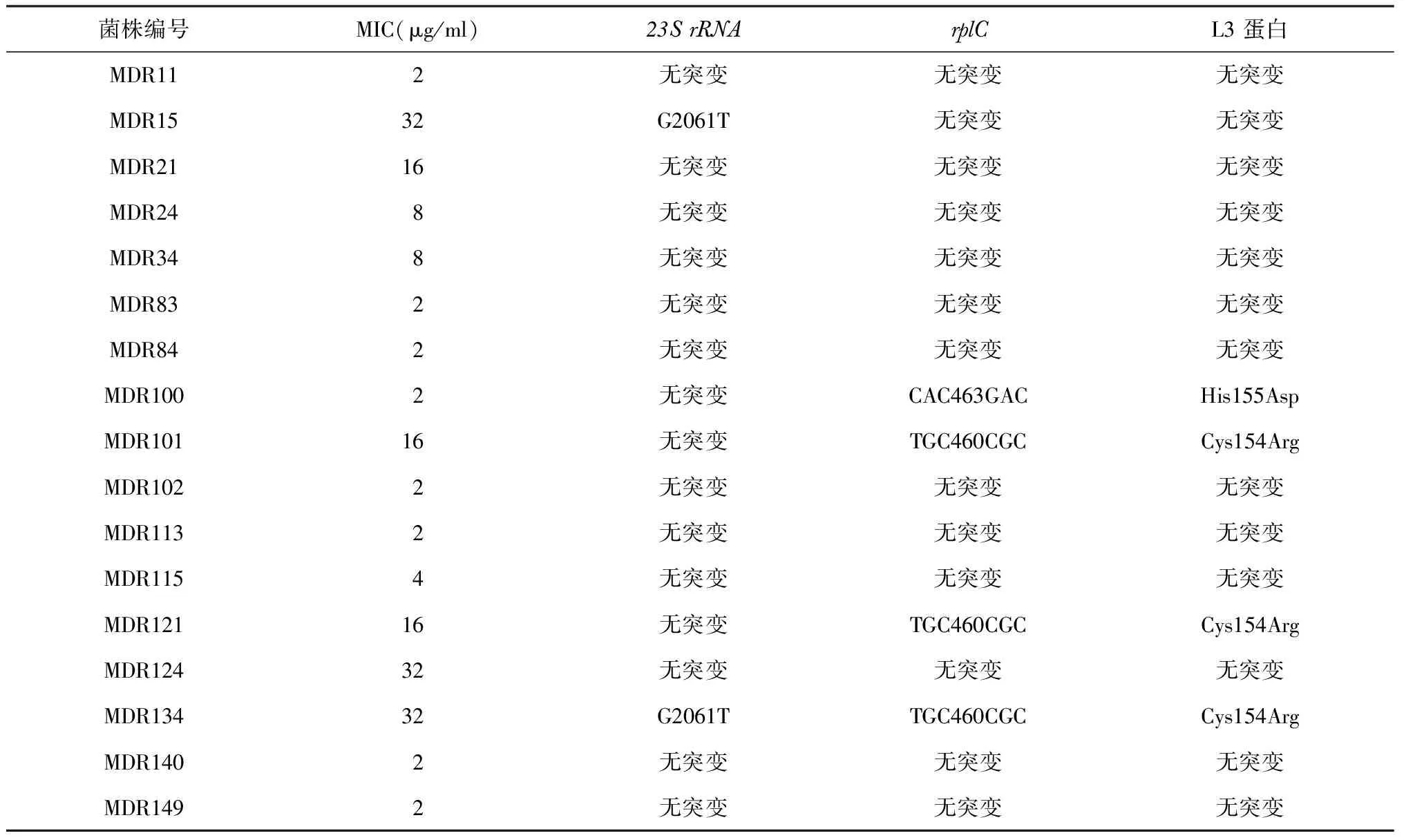
表4 17株對利奈唑胺耐藥菌株在23S rRNA和rplC中的突變情況
注 L3蛋白為rplC編碼蛋白
除了藥物外排泵,微生物細胞壁通透性也是一個耐藥的重要機制。細胞壁的厚度通常認為是細胞壁通透性的重要指標[15]。近期的一項研究通過觀察全敏感、耐多藥、廣泛耐藥結核分枝桿菌細胞壁的超微結構,發現廣泛耐藥結核分枝桿菌的細胞壁厚度明顯高于耐多藥和全敏感菌株[16]。因此,廣泛耐藥菌株增厚的細胞壁可能導致其細胞通透性降低,進而提高其對包括利奈唑胺在內的多種抗結核藥物的耐藥性。
二、23SrRNA和rplC基因突變與結核分枝桿菌對利奈唑胺耐藥相關
23SrRNA編碼23S核糖體RNA,其第2061位點突變在金黃色葡萄球菌、恥垢分枝桿菌等中均有報道與對利奈唑胺耐藥相關[17],本研究鑒定結核分枝桿菌2061位點突變導致對利奈唑胺高水平耐藥,與前述報道一致。rplC基因編碼核糖體蛋白 L3,該蛋白大部分位于核糖體 50S 亞基的表面,有一個環狀的尾部延伸至肽基轉運中心(peptidyl transferase center,PTC),利奈唑胺通過結合到 PTC 重疊區發揮抑菌作用[17]。雖然本研究未在對利奈唑胺耐藥的菌株中發現rplD突變,但在對利奈唑胺敏感的菌株中,本研究鑒定出2種非同義單核苷酸多態性包括5株帶有Arg79His (CGT→CAT)以及6株帶有Ser104Cys (AGC→TGC)。鑒于這些SNP僅發生在對利奈唑胺敏感的菌株中,因此可考慮上述SNP可能與結核分枝桿菌對利奈唑胺耐藥無關。本研究首次鑒定到非同義突變His155Asp,攜帶該突變的結核分枝桿菌菌株的MIC為2 μg/ml,可能導致利奈唑胺低水平耐藥;4株(23.5%)rplC基因有3株(17.6%)耐藥菌株帶有第154位氨基酸突變,提示第154位氨基酸突變較常見。然而,仍然有超過70%(12/17)對利奈唑胺耐藥的菌株未能鑒定到在23SrRNA、rplC和rplD的基因突變。一方面,藥物外排泵或者其他天然耐藥機制通常導致低水平耐藥;而靶標基因突變通常產生高水平耐藥。因此,本研究中多株未發現基因突變的菌株可能有其他非核糖體突變機制參與到結核分枝桿菌對利奈唑胺耐藥之中。近期有研究表明,轉錄調控因子Rv0678基因突變導致的MmpL5外排泵上調表達可能是結核分枝桿菌對利奈唑胺耐藥的另一耐藥機制[19]。考慮到本研究主要圍繞利奈唑胺的耐藥靶標基因開展,因此未開展對Rv0678基因的檢測,后續研究將對未發現基因突變的菌株的Rv0678基因進行檢測,以明確其在結核分枝桿菌對利奈唑胺耐藥中的作用[19-20]。另一方面,結核分枝桿菌對利奈唑胺耐藥的基因型與耐藥表型的相關性較低(29.4%(5/17)),提示目前利奈唑胺尚不宜作為目標藥物用于開發分子生物學診斷技術來診斷結核分枝桿菌對利奈唑胺的耐藥性。
由于利奈唑胺主要應用于耐多藥及廣泛耐多藥菌株的治療,因此,本研究未增加對敏感菌株的檢測。
總之,本研究首次分析了我國耐多藥結核分枝桿菌對利奈唑胺的耐藥性,同時發現廣泛耐藥結核分枝桿菌對利奈唑胺的耐藥率明顯高于耐多藥菌株。同時23SrRNA和rplC基因突變與結核分枝桿菌對利奈唑胺耐藥有相關性,但相關性僅為29.4%(5/17),提示其他結核分枝桿菌對利奈唑胺的耐藥機制有待于進一步研究。但因樣本量較少,尤其是廣泛耐藥菌株僅10株,影響到數據的參考價值,希望今后擴大樣本量進行進一步研究。
[1] 王黎霞,姜世聞.我國結核病控制策略的發展與展望.中國防癆雜志,2014,36(8):630-633.
[2] Zhao Y,Xu S,Wang L,et al.National survey of drug-resistant tuberculosis in China.N Engl J Med,2012,366(23):2161-2170.
[3] World Health Organization.Global tuberculosis report 2015. Geneva: World Health Organization,2015.
[4] Orenstein EW,Basu S,Shah NS,et al.Treatment outcomes among patients with multidrug-resistant tuberculosis:systematic review and meta-analysis. Lancet Infect Dis,2009,9(3): 153-161.
[5] Cynamon MH,Klemens SP,Sharpe CA,et al.Activities of se-veral novel oxazolidinones againstMycobacteriumtuberculosisin a murine model. Antimicrob Agents Chemother,1999,43(5):1189-1191.
[6] Schecter GF,Scott C,True L,et al.Linezolid in the treatment of multidrug-resistant tuberculosis.Clin Infect Dis,2010,50(1):49-55.
[7] Lee M,Lee J,Carroll MW,et al.Linezolid for treatment of chronic extensively drug-resistant tuberculosis.N Engl J Med,2012,367(16):1508-1518.
[8] 孟慶琳,王玉峰,逄宇,等. 耐多藥結核分枝桿菌耐藥相關基因突變特征分析.中國防癆雜志,2016,38(2):116-121.
[9] Zhang Z,Pang Y,Wang Y,et al.Differences in risk factors and drug susceptibility betweenMycobacteriumaviumandMyco-bacteriumintracellularelung diseases in China.Int J Antimicrob Agents,2015,45(5):491-495.
[10] 王前,宋媛媛,逢宇.耐氧氟沙星結核分枝桿菌對五種氟喹諾酮類藥物交叉耐藥的研究.中國防癆雜志, 2014,36(6):453-457.
[11] Beckert P,Hillemann D,Kohl TA,et al.rplC T460C identified as a dominant mutation in linezolid-resistantMycobacteriumtuberculosisstrains. Antimicrob Agents Chemother,2012,56(5):2743-2745.
[12] Long KS,Vester B.Resistance to linezolid caused by modifications at its binding site on the ribosome.Antimicrob Agents chemother,2012, 56(2):603-612.
[13] Escribano I,Rodriguez JC,Llorca B,et al.Importance of the eff-lux pump systems in the resistance ofMycobacteriumtuberculosisto fluoroquinolones and linezolid.Chemotherapy,2007,53(6):397-401.
[14] Amaral L,Viveiros M.Why thioridazine in combination with antibiotics cures extensively drug-resistantMycobacteriumtuberculosisinfections.Int J Antimicrob Agents,2012,39(5):376-380.
[15] Jarlier V,Nikaido H.Mycobacterial cell wall: structure and role in natural resistance to antibiotics.FEMS Microbiol Lett,1994,123(1-2):11-18.
[16] Velayati AA,Farnia P,Ibrahim TA,et al.Differences in cell wall thickness between resistant and nonresistant strains ofMycobacteriumtuberculosis: using transmission electron microscopy. Chemotherapy,2009,55(5):303-307.
[17] 夏夢巖,張卓然.細菌對利奈唑胺的耐藥機制及檢測方法研究進展.微生物與感染,2009, 4(3):170-173.
[18] 王立朋,何云燕,嚴立,等.利奈唑胺耐藥腸球菌耐藥機制分析.臨床檢驗雜志,2013,31(8):625-628.
[19] Hartkoorn RC,Uplekar S,Cole ST.Cross-resistance between clofazimine and bedaquiline through upregulation of MmpL5 inMycobacteriumtuberculosis.Antimicrob Agents Chemother,2014,58(5):2979-2981.
[20] Andries K,Villellas C,Coeck N,et al.Acquired resistance ofMycobacteriumtuberculosisto bedaquiline.PLoS One,2014,9(7): e102135.
(本文編輯:孟莉 范永德)
Analysis of the prevalence of linezolid resistance and mutations conferring linezolid resistance in multidrug resistantMycobacteriumtuberculosisisolates from China
WANGQian,SONGYuan-yuan,WANGYu-feng,PANGYu,ZHAOYan-lin.
NationalTuberculosisReferenceLaboratory,NationalCenterforTuberculosisControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
s:ZHAOYan-lin,Email:zhaoyanlin@chinatb.org;PANGYu,Email:pangyu@chinatb.org
Objective To explore the prevalence of linezolid (Lzd) resistance among multidrug resistant (MDR)Mycobacteriumtuberculosisisolates from China, and to investigate the characteristics of mutations in genes conferring linezolid resistance. Methods A total of 158 MDR tuberculosis (TB) isolates, including 107 (67.7%) MDR-TB, 41 (26.0%) pre-extensively drug-resistant TB (pre-XDR), and 10 (6.3%) extensively drug-resistant TB isolates, were used in this study. The broth dilution method was used to determine minimal inhibitory concentrations (MIC) ofM.tuberculosisisolates against linezolid (Lzd). The reference isolate H37Rv (ATCC 27249) was used as a control. Lzd resistance was declared if the MIC value of theM.tuberculosisisolate was higher than the cut-off value of Lzd. In addition, the 23SrRNA,rplCandrplDgenes conferring Lzd resistance were sequenced in all isolates. Fisher’s exact test was performed to compare the proportions of Lzd resistance among different groups, and differences were considered significant whenP<0.05. Results 10.8% (17/158) of the 158 MDR tuberculosis isolates were Lzd-resistant. A higher frequency of Lzd-resistant isolates was identified among extensively drug resistant (XDR)M.tuberculosisisolates (6/10) than among MDR (5.6%, 6/107) and pre-XDR (12.2%, 5/41) isolates, and Fisher’s exact test revealed that the difference was significant (P<0.001 for MDR group;P=0.004 for pre-XDR group). In addition, only 5 (29.4%) of 17 Lzd-resistant isolates harbored mutations in 23SrRNAand/orrplC. A novel non-synonymous substitution His155Asp inrplCwas identified as a potential contributor to low-level Lzd-resistance (2 μg/ml) inM.tuberculosisfor the first time. Conclusion The prevalence of Lzd resis-tance among XDR isolates was significantly higher than that of MDR isolates. In addition, genetic mutations located in 23SrRNAandrplCwere associated with Lzd resistance inM.tuberculosis.
Mycobacterium,tuberculosis; Oxazolidinones; Linezolid; Tuberculosis, multidrug-resistant; Genes, bacteria; Mutation; Causality
10.3969/j.issn.1000-6621.2016.09.004
“十二五”國家科技重大專項(2013ZX0003-003)
102206 北京,中國疾病預防控制中心結核病預防控制中心辦公室 國家結核病參比實驗室
趙雁林,Email:zhaoyanlin@chinatb.org;逄宇,Email:pangyu@chinatb.org
2016-07-11)

