銨鹽溶液能溶解Mg(OH)2的主因探析
柴國英 吳文中
(1,2浙江省越州中學 浙江紹興 312075)
?
銨鹽溶液能溶解Mg(OH)2的主因探析
柴國英1吳文中2
(1,2浙江省越州中學浙江紹興312075)
摘要:氯化銨溶液能溶解Mg(OH)2,實為沉淀溶解平衡、氨水的電解質平衡以及水的電離平衡綜合作用的結果,其本質為離子反應,是NH4+還是H3O+首先作用于Mg(OH)2的沉淀溶解平衡,對此學術界無統一的觀點。復分解反應的活化能幾乎為0,但各種離子的擴散速率不盡相同,多種離子參加反應時,到底哪種離子首先碰撞先發生反應,實難判斷,事實上也不重要,但我們可以通過計算、實驗得出銨鹽溶解Mg(OH)2的“功勞”主要是NH4+,而不是H3O+,同時指出低濃度的銨鹽難以溶解氫氧化鎂的事實。
關鍵詞:銨鹽;氫氧化鎂;主反應;實驗
一、研究背景
NH4Cl溶液可以使Mg(OH)2懸濁液變澄清,其原因很多學者都有所研究。
李家郢[1]的研究認為NH4Cl溶液水解呈酸性,促進了Mg(OH)2(s)?Mg2+(aq)+OH-(aq)該沉淀溶解平衡往溶解方向移動,使得Mg(OH)2懸濁液變澄清,其本質等同于稀鹽酸溶解Mg(OH)2,而忽略了NH4+對上述沉淀平衡的影響,顯然不符合事實。學者戴亞等[2]在《氫氧化鎂為什么可溶于銨鹽中》一文中,通過計算NH4Cl與Mg(OH)2反應的平衡常數,回答了Mg(OH)2可溶于NH4Cl溶液中的熱力學原因,但并未闡述NH4Cl溶解Mg(OH)2動力學原因。
本文認為,復分解反應的活化能幾乎為0,但各種離子的擴散速率不盡相同,多種離子參加反應時,到底是NH4+還是H3O+首先碰撞Mg(OH)2的沉淀溶解平衡體系中的OH-,難以判斷,也不重要[3],但由于NH4Cl溶液中的c(NH4+)≥c(H3O+),我們可以認為c(NH4+)碰撞OH-的機會遠遠大于H3O+,從動力學范疇層面上,可以認為NH4+首先進攻OH-,是銨鹽溶解Mg(OH)2的主因,該結論與學者許洪福[4]一文中的觀點基本一致。
二、理論探討
1.NH4+和H3O+對溶解Mg(OH)2的影響力
往少量Mg(OH)2懸濁液中加入適量的飽和NH4Cl溶液,充分振蕩,Mg(OH)2懸濁液變澄清,Mg(OH)2懸濁液溶解在NH4Cl溶液中的原理是什么?常見觀點有兩種:
觀點一:NH4+的水解呈酸性,溶解了Mg(OH)2,從而促進了Mg(OH)2的沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)往溶解方向移動。
觀點二:NH4+直接結合了Mg(OH)2懸濁液中的OH-,從而使得以上沉淀溶解平衡往溶解方向移動。
經計算,0.1 mol·L-1的NH4Cl溶液中,c(NH4+)= 0.099992mol/L,c(H+)=7.54×10-6mol·L-1,c(NH3·H2O)= 7.53684×10-6mol·L-1,也就是說NH4+濃度是H+濃度的13262倍,同時我們也可以計算得到Mg(OH)2懸濁液中的
(注Ksp[Mg(OH)2]=5.6×10-12)
當上述兩種離子都遇到OH-時,將發生以下過程:
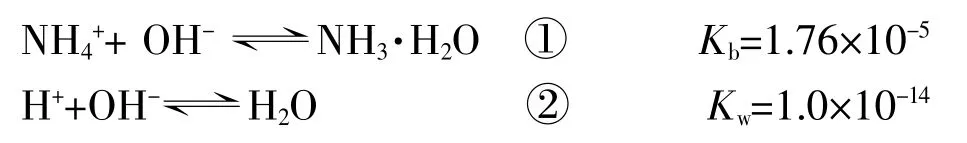
現在人為假定只有單一變量對Mg(OH)2的沉淀溶解平衡有影響,分別計算NH4+和H+發生上述離子反應時所消耗的OH-為多少,然后判斷上述兩種過程對Mg(OH)2的沉淀溶解平衡的影響力,演算如下(其中a、b分別為NH4+與H+消耗OH-的物質的量濃度):
NH4++ OH-?NH3·H2O
始態:0.099992 0.00018 7.53684×10-6
變化量:aaa
平衡態:0.099992- a 0.00018- a 7.53684×10-6+ a的電離平衡)解得:a=1.79967×10-4mol·L-1。
H++ OH-?H2O
始態:7.54×10-60.00018
變化量:bb
平衡態:7.54×10-6- b 0.00018- b
(7.54×10-6)×(0.00018-b)=1.0×10-14(水的電離平衡)
解得:b=7.53994×10-6mol·L-1。
以上計算表明,NH4+使得OH-的減少量遠遠大于H+使OH-的減少量,即促進Mg(OH)2溶解平衡往溶解方向移動的“功勞”主要不是H+,而是NH4+。
水解的本質,實際上是某些離子結合了水電離出來的H+或OH-,NH4Cl放入到Mg(OH)2(s)?Mg2++ 2OH-平衡體系中,NH4+實際上不但可以去結合水電離出來的OH-,也可以去結合Mg(OH)2溶解產生的OH-,由于Mg(OH)2溶解產生的c(OH-)=1.8×10-4mol·L-1,遠遠大于水電離得到的c(OH-)=1.0×10-7mol·L-1,因此NH4Cl在水溶液中只發生“水解”,而在Mg(OH)2懸濁液中,就主要發生“Mg(OH)2水解”了,計算結果也與此吻合,Mg(OH)2也可以溶解在幾乎為中性的CH3COONH4溶液中的事實,也印證上述觀點的正確。
2.NH4+溶解Mg(OH)2的熱力學分析
那么銨鹽溶解Mg(OH)2的程度如何?可通過研究下列過程的化學平衡常數得知:
Mg(OH)2+2NH4+?Mg2++2NH3·H2O
則K總= c(Mg2+)×c2(NH3·H2O)/c2(NH4+)=Ksp/Kb2=5.6×10-12/(1.77×10-5)2=1.8×10-2,
(已知:Ksp[Mg(OH)2]=5.6×10-12、Kb=1.77×10-5)
顯然,常數K=1.8×10-2,并不很小,上述過程可以發生,但反應程度并不大。
若0.058g Mg(OH)2完全被NH4Cl溶液溶解,需要10mL的NH4Cl溶液的濃度至少為x mol·L-1,則依據上述反應原理得:(注:若0.058g Mg(OH)2完全溶解在10mL溶液中后c(Mg2+)約為0.1 mol·L-1)
Mg(OH)2+2NH4+?Mg2++2NH3·H2O
始態:x 0 0
變化量:0.2 0.1 0.2
平衡態:x-0.2 0.1 0.2
則:0.22×0.1/(x-0.2)2=1.8×10-2解得:x= 0.67 mol·L-1
即在少量的Mg(OH)2懸濁液中加入較高濃度的NH4Cl溶液時,懸濁液才會變澄清得到0.1 mol·L-1的MgCl2溶液,經過同樣計算,得知低濃度的銨鹽是很難溶解少量的Mg(OH)2,或需要大量的銨鹽溶液才能溶解。
若采用1 mol·L-1的NH4Cl溶液去溶解Mg(OH)2,設得到的c(Mg2+)為x,則c(NH3·H2O)為2x,則依據題意得解得:x = 0.134mol·L-1。
即1L 1 mol·L-1的NH4Cl溶液可以溶解Mg(OH)2約為7.77g,溶解程度并不大,但比較Mg(OH)2在水中的溶解度提高了800多倍(注Mg(OH)2在18℃時的溶解度為0.0009g/100g水)。
三、實驗驗證
基于上述理論計算與碰撞理論視角的分析,進行了實驗驗證,并選擇不同銨鹽、不同濃度的銨鹽溶解等質量的Mg(OH)2的有關實驗(取0.05g Mg(OH)2)。
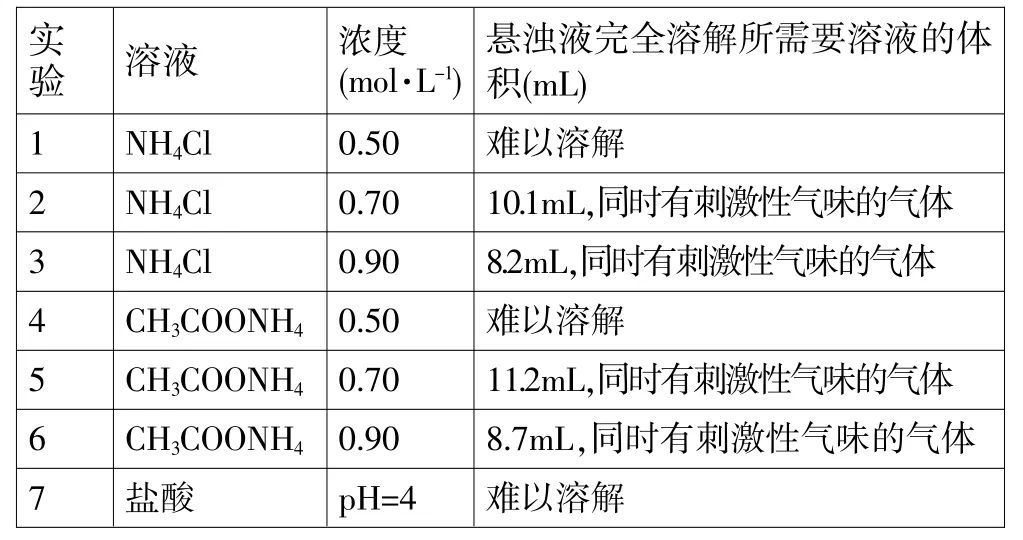
表1 常溫下不同濃度銨鹽溶液與Mg(OH)2沉淀反應的實驗數據
沉淀溶解平衡是一種動態平衡,NH4Cl溶液濃度越大,上述平衡越易向右進行,以上實驗表明,銨鹽的濃度越大,銨鹽溶解Mg(OH)2程度越大,銨鹽本身的酸性大小與銨鹽是否能溶解Mg(OH)2程度幾乎無關系,說明了Mg(OH)2被銨鹽溶解的本質特征是NH4+破壞了如下沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+ 2OH-(aq),或者說,在Mg(OH)2中加銨鹽,實為上述的沉淀溶解平衡與氨水的電離平衡共同作用,相互促進、相互抑制而共同達到平衡的結果,NH4+濃度小于0.5mol·L-1的銨鹽溶液難以溶解氫氧化鎂。
四、討論
銨鹽溶液能溶解Mg(OH)2,實為沉淀溶解平衡、氨水的電解質平衡以及水的電離平衡綜合作用的結果,其本質為離子反應,多種離子參加反應時,到底哪種離子首先碰撞先發生反應,實難判斷,也不重要,但可通過計算、實驗得出銨鹽溶解Mg(OH)2的“功勞”主要是NH4+,而不是H3O+。
參考文獻
[1]李家郢.為何在氯化鎂溶液中加氨水生成氫氧化鎂沉淀,而氫氧化鎂又可溶于氯化銨溶液[J].中學化學教學參考,1988,(3):26-27
[2]戴亞,李同善.氫氧化鎂為什么可溶于銨鹽中?[J].化學教學,1988,(1):26-27
[3]吳文中.如何判斷復雜復分解反應的產物[J].化學教與學,2015,(2):72-73
[4]許洪福.也談氫氧化鎂在氯化銨溶液中的溶解[J].中學化學教學參考,1989,(4):46
doi:10.3969/j.issn.1008-0546.2016.04.010
文章編號:1008-0546(2016)04-0027-02
中圖分類號:G632.41
文獻標識碼:B

