小立碗蘚CAD1基因敲除載體的構(gòu)建及酶切方法優(yōu)化
趙春燕+晏國洪+姜山


摘要: 苔蘚植物能否合成木質(zhì)素目前還存在一定的爭議。肉桂醇脫氫酶(CAD)催化木質(zhì)素單體合成的最后一步反應(yīng),Real-Time PCR表達分析表明,小立碗蘚CAD1基因在接種灰霉菌后的第2天表達量迅速上升。本試驗利用PCR技術(shù),以小立碗蘚基因組DNA為模板,使用Primer 5-Cracked設(shè)計的引物,擴增出小立碗蘚CAD1基因的上、下游同源臂基因片段。酶切CAD1上游同源臂和pTN182原始質(zhì)粒,經(jīng)連接酶連接、轉(zhuǎn)化至感受態(tài)大腸桿菌,篩選出陽性株。采用裂解液裂解、質(zhì)粒DNA提取、質(zhì)粒PCR以及酶切進行驗證,得到CAD11-pTN182。采用同樣的方法把下游片段轉(zhuǎn)入CAD11-pTN182,即得CAD11-pTN182-CAD12,最后進行測序分析。結(jié)果表明,已成功構(gòu)建CAD11-pTN182-CAD12敲除載體,并將該重組質(zhì)粒轉(zhuǎn)入目的菌株大腸桿菌中保存?zhèn)溆茫蔀楹罄m(xù)進行小立碗蘚CAD1基因敲除,驗證小立碗蘚CAD1基因功能,進一步了解模式植物小立碗蘚防衛(wèi)反應(yīng)機理研究奠定良好基礎(chǔ)。
關(guān)鍵詞: 小立碗蘚;CAD1基因;基因克隆;載體構(gòu)建;酶切
中圖分類號: Q782 文獻標志碼: A 文章編號:1002-1302(2016)03-0059-05
苔蘚植物是高等植物的低等類群,是陸生植物登陸早期的代表,含有一整套合成木質(zhì)素的基因[1],具備合成木質(zhì)素的生理基礎(chǔ),但是苔蘚植物能否合成木質(zhì)素目前還存在一定的爭議。小立碗蘚(Physcomitrella patens)隸屬葫蘆蘚目葫蘆蘚科(Funariaceae)小立碗蘚屬(Physcomitrium)。小立碗蘚生活史中單倍體的配子體時期占優(yōu)勢,其整個基因序列已知,核基因組易于與有同源片段的外源DNA發(fā)生高頻率的同源重組,這使得基因敲除成為可能,并且試驗過程中得到的突變體即為純合體,為基因功能的研究提供了良好的材料[2],已經(jīng)成為植物分子生物學(xué)研究的模式生物。
病原真菌和細菌感染維管束植物時,感染部位的細胞壁加厚并形成突起狀結(jié)構(gòu)——乳突。本試驗室前期工作中發(fā)現(xiàn)灰霉菌感染非維管束植物小立碗蘚后,小立碗蘚細胞壁加厚或形成乳突結(jié)構(gòu)。形成乳突是維管束植物常見的防衛(wèi)反應(yīng),是限制病原體入侵的一道物理障礙,其主要成分之一為木質(zhì)素,說明乳突是植物一個較為保守的抗病反應(yīng)機制。木質(zhì)素是一種復(fù)雜的酚類聚合物,廣泛存在于高等植物中的維管束植物中[3],苔蘚植物中是否合成木質(zhì)素目前還存在一定的爭議。相關(guān)文獻報道,苔蘚植物不合成木質(zhì)素,卻合成木酯素或類木質(zhì)素。用木質(zhì)素的特異性染料高錳酸鉀染色灰霉菌感染的小立碗蘚樣品并于電鏡下觀察發(fā)現(xiàn),細胞壁加厚或乳突部位出現(xiàn)明顯染色加深,說明小立碗蘚在灰霉菌脅迫下可能合成了類木質(zhì)素。木質(zhì)素的生物合成是以苯丙酸起始,在一系列酶催化下逐步轉(zhuǎn)化為木質(zhì)素單體,最終聚合成木質(zhì)素的過程,其中肉桂醇脫氫酶(CAD)是木質(zhì)素代謝途徑中第一個被研究的酶,其催化木質(zhì)素單體合成的最后一步反應(yīng),將3種肉桂醛還原生成相應(yīng)的3種肉桂醇[4]。本試驗室前期使用 Real-Time PCR表達分析表明,小立碗蘚CAD1基因在接種灰霉菌后的第2天表達量迅速上升,達到未接種對照組的17倍。綜上所述,小立碗蘚中可能合成了類木質(zhì)素。
本試驗構(gòu)建小立碗蘚CAD1基因的敲除載體,為后續(xù)敲除小立碗蘚CAD1基因,獲得CAD1基因敲除突變株,驗證小立碗蘚CAD1基因是否參與木質(zhì)素的合成奠定基礎(chǔ),對揭示模式植物小立碗蘚防衛(wèi)反應(yīng)機理有重要意義。
1 材料與方法
1.1 儀器、試劑與材料
1.1.1 儀器 電子天平,美國Denver Instrument MXX-612,TP-214;PCR儀,美國Bio-Rad Engine;電泳儀,美國Bio-Rad A101439;凝膠成像系統(tǒng),美國Bio-Rad Engine;微量冷凍離心機,日本3500;超凈工作臺,上海博迅VS-840-2;微電腦光照培養(yǎng)箱,上海博迅SPX-250B-G;101A-3型電熱鼓風干燥箱,上海市實驗儀器總廠;YXQ-LS-75 SⅡ型立式壓力蒸汽滅菌器,上海博訊實業(yè)有限公司;HHS型電熱恒溫水浴鍋,上海博訊實業(yè)有限公司;十萬分之一分析天平,梅特勒-托利多儀器有限公司;TGL-16G型離心機,上海安亭科學(xué)儀器廠;85-2A恒溫磁力攪拌器,金壇市科析儀器有限公司;精密酸度計,上海大普儀器有限公司。
1.1.2 試劑 引物,限制性核酸內(nèi)切酶(XhoⅠ、EcoRⅤ、XbaⅠ、BamHⅠ)、Premix TaqTM 、T4-DNA連接酶、DNA Marker DL15000,大連寶生物工程有限公司;Plasmid Mini KitⅠ試劑盒,OMEGAbiotek公司;Kanamycin;測序由上海生工完成;其他試劑均為國產(chǎn)分析純。
1.1.3 材料 小立碗蘚(提取其DNA,用于擴增CAD1基因上、下游同源臂)、質(zhì)粒pTN182(5 006 bp,用于構(gòu)建CAD11-NPTⅡ-CAD12敲除載體)由首都師范大學(xué)提供,E. coli DH5α(用于外源基因的轉(zhuǎn)化)由貴陽醫(yī)學(xué)院提供。pTN182質(zhì)粒模式見圖1,該質(zhì)粒含有NPTⅡ基因,在大腸桿菌中表現(xiàn)為抗卡那霉素,此外,該質(zhì)粒含有2個多酶切位點,可將小立碗蘚CAD1基因上、下游同源臂先后2次轉(zhuǎn)入該質(zhì)粒。
1.2 方法
1.2.1 引物設(shè)計 (1)在GenBank中搜索出藍桉樹CAD1基因的蛋白質(zhì)序列。(2)在blast中比對出相應(yīng)的mRNA序列。(3)在JGI Genome Portal(http://genome.jgi-psf.org/)通過mRNA序列比對出小立碗蘚CAD1基因的DNA序列(1 624 bp)。(4)將小立碗蘚CAD1基因的DNA序列均分為上、下游片段。(5)根據(jù)小立碗蘚CAD1上、下游片段的DNA序列使用引物設(shè)計軟Primer 5-Cracked分別設(shè)計CAD1基因上、下游片段的最佳引物與同源臂片段(上游同源臂CAD11-681 bp,下游同源臂CAD12- 650 bp)。(6)在DNAMAN軟件中根據(jù)比對的基因序列在引物前添加酶切位點。(7)根據(jù)GC%添加保護堿基。(8)大連寶生物工程有限公司合成引物[5]。所合成的引物序列見表1。
1.2.2 目的基因的獲取 以改良的CTAB法提取的小立碗蘚基因組DNA為模板[6-7],以CAD11-F、CAD11-R為引物進行PCR,擴增出CAD1上游同源臂CAD11;以CAD12-F、CAD12-R為引物進行PCR,擴增出CAD1下游同源臂CAD12,反應(yīng)體系見表2。PCR反應(yīng)條件:94 ℃預(yù)變性 5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min,35個循環(huán),72 ℃終延伸10 min,保存于4 ℃。擴增出目的基因片段采用乙酸鈉、乙醇洗脫法進行回收,溶于無菌去離子水中,置于 -20 ℃ 保存?zhèn)溆肹8-9]。
1.2.3 質(zhì)粒的提取 將含有pTN182質(zhì)粒的大腸桿菌置于LB固體培養(yǎng)基上37 ℃活化培養(yǎng)12~16 h,挑取單菌落接種于LB液體培養(yǎng)基中,37 ℃振蕩過夜培養(yǎng)。將該培養(yǎng)基轉(zhuǎn)移至5 mL EP管中,室溫離心(12 000 r/min,1 min),去上清。采用Plasmid Mini KitⅠ試劑盒(按試劑盒說明)抽提pTN182質(zhì)粒,將提取的質(zhì)粒溶于無菌去離子水中保存于4 ℃冰箱。
1.2.4 CAD1-pTN182克隆載體的構(gòu)建 使用XhoI、EcoRV 2種酶,分別使用同步雙酶切、分步酶切方法酶切CAD1上游目的基因和pTN182原始質(zhì)粒,經(jīng)乙醇洗脫后使用EcoRⅤ繼續(xù)酶切,酶切體系為2 μL酶、4 μL對應(yīng)buffer、12 μL目的基因,使用無菌去離子水補齊至40 μL,酶切反應(yīng)條件為37 ℃、3 h。取目的基因片段9 μL、質(zhì)粒3 μL、連接液 12 μL于EP管中混勻,封口膜密封EP管16 ℃過夜連接[10-15]。
1.2.5 克隆載體的轉(zhuǎn)化 采用CaCl2方法制作感受態(tài)大腸桿菌[16],保存于4 ℃冰箱。取1 μL過夜連接產(chǎn)物,加入到感受態(tài)大腸桿菌(感受態(tài)12~24 h轉(zhuǎn)化效率最高),輕旋,冰浴30 min,放入42 ℃水浴鍋熱激90 s,立即冰浴3 min,加入LB液體培養(yǎng)基1 mL,37 ℃振蕩培養(yǎng)1 h。取800 μL轉(zhuǎn)化液于含有卡那霉素(10 mg/mL)的LB固體平板培養(yǎng)基上,37 ℃放置20 min,待菌液完全被吸收后倒置過夜培養(yǎng)。
1.2.6 轉(zhuǎn)化菌株的鑒定 挑取長出的單菌落,轉(zhuǎn)移到新的含卡那霉素的LB固體平板培養(yǎng)基上并編號做進一步篩選。(1)挑取第2次在含卡那霉素的LB固體培養(yǎng)基上長出的單菌落將于裂解液中65 ℃裂解1.5 h,裂解產(chǎn)物用瓊脂糖凝膠電泳與pTN182原始質(zhì)粒對比驗證。(2)將篩選出的菌落用LB液體培養(yǎng)基37 ℃振蕩過夜培養(yǎng),使用質(zhì)粒DNA提取試劑盒提取質(zhì)粒,瓊脂糖凝膠電泳與pTN182原始質(zhì)粒對比驗證,篩選出比原始質(zhì)粒條帶略高的菌落。(3)以篩選出的質(zhì)粒為模板進行PCR驗證,瓊脂糖凝膠電泳驗證是否可以得到目的條帶。(4)用XhoⅠ、EcoRⅤ分步酶切驗證。以插入了上游片段的pTN182重組質(zhì)粒(CAD11-pTN182)為載體,采用插入上游臂方法構(gòu)建插入下游片段的重組質(zhì)粒(CAD11-pTN182-CAD12)。CAD1敲除載體構(gòu)建過程模式見圖1,以CAD11-pTN182-CAD12重組質(zhì)粒為模板,使用CAD11-F、CAD12-R為引物PCR出總目的基因條帶(CAD11-NPTⅡ-CAD12),送至上海生工測序。
2 結(jié)果與分析
2.1 提取出的小立碗蘚基因組DNA的檢測
采用改良的CTAB法提取小立碗蘚基因組DNA,最后用70%的乙醇洗脫,溶于蒸餾水中于-20 ℃?zhèn)溆谩-傊悄z電泳驗證提取出的DNA。從圖2可以看出,經(jīng)0.7%瓊脂糖凝膠電泳可看出預(yù)期的DNA條帶。
2.2 PCR擴增小立碗蘚CAD1基因上、下游目的基因
使用設(shè)計好的引物,以提取的小立碗蘚基因組DNA為模板,PCR擴增同源臂基因片段出現(xiàn)了模糊的彌散條帶(圖3),沒有出現(xiàn)目的基因條帶。將提取的小立碗蘚基因組DNA用高鹽TE溶液和無水乙醇沉淀,再用70%的乙醇洗脫3遍,以此DNA為模板進行PCR擴增,從圖4、圖5可以看出,PCR產(chǎn)物經(jīng)0.7%瓊脂糖凝膠電泳,可以獲得1條清晰明亮的特異性條帶,條帶大小與引物設(shè)計時設(shè)計的上、下游同源臂長度681、650 bp相符。
2.3 CAD1上游同源臂插入結(jié)果鑒定
采用裂解液裂解轉(zhuǎn)化的大腸桿菌進行驗證。利用裂解液裂解轉(zhuǎn)化后在含卡那霉素的LB固體平板培養(yǎng)基上生長的大腸桿菌,裂解產(chǎn)物經(jīng)0.7%瓊脂糖凝膠電泳,可以對比出比原始質(zhì)粒條帶高的為插入了上游片段的質(zhì)粒,進而可以篩選出對應(yīng)的插入了含上游同源臂質(zhì)粒的大腸桿菌。從圖6可以看出,第7道的質(zhì)粒比原始質(zhì)粒條帶略高,第7道的質(zhì)粒可能已經(jīng)插入了CAD1上游臂。
提取質(zhì)粒驗證。挑取上述第7道菌落于含卡那霉素的LB液體培養(yǎng)基37 ℃振蕩過夜培養(yǎng),用質(zhì)粒DNA提取試劑盒抽提,提取出的質(zhì)粒經(jīng)0.7%瓊脂糖凝膠電泳,與原始質(zhì)粒比對,可以比對出可能插入了目的片段的菌落。從圖7可以看出,第7道菌落提取出的質(zhì)粒條帶比原始質(zhì)粒條帶略高,表明第7道大腸桿菌中提取出的質(zhì)粒可能已插入了小立碗蘚CAD1上游臂基因。
質(zhì)粒PCR驗證。以上述7質(zhì)粒為模板,進行PCR擴增,PCR產(chǎn)物經(jīng)0.7%瓊脂糖凝膠電泳,獲得預(yù)期上游目的基因條帶則該質(zhì)粒可能已經(jīng)插入了CAD1上游臂。以圖6中第7道菌提取的質(zhì)粒為模板,以CAD11-F、CAD11-R作引物進行PCR驗證,PCR產(chǎn)物采用瓊脂糖凝膠電泳驗證,結(jié)果(圖8)表明,產(chǎn)生的1條特異性條帶與預(yù)期上游臂片段 681 bp 相符。可能成功構(gòu)建了CAD11-pTN182重組質(zhì)粒。
2.4 CAD1下游同源臂插入結(jié)果鑒定
CAD1下游同源臂插入CAD11-pTN182重組質(zhì)粒即得CAD11-pTN182-CAD12重組質(zhì)粒。驗證方法同上。
裂解法驗證。由圖9可知,第3、4、6、7、9道的質(zhì)粒比CAD11-pTN182重質(zhì)粒條帶略高,有可能第3、4、6、7、9道的質(zhì)粒已經(jīng)插入了CAD1下游同源臂。
提取質(zhì)粒驗證。挑取第3、4、6、7、9道的菌落于含卡那霉素的LB液體培養(yǎng)基37 ℃振蕩過夜培養(yǎng),進一步提取質(zhì)粒驗證。從圖10可以看出,第9道菌落提取出的質(zhì)粒條帶比CAD11-pTN182重組質(zhì)粒條帶略高,表明第9道大腸桿菌中提取出的質(zhì)粒可能已插入了小立碗蘚CAD1下游臂。
質(zhì)粒PCR驗證。以圖7中第9道菌提取的質(zhì)粒為模板見圖11,以CAD12-F、CAD12-R作引物進行PCR驗證,出來1條特異性條帶,與預(yù)期下游臂片段650 bp相符。可能成功構(gòu)建了CAD11-pTN182-CAD12重組質(zhì)粒。
2.5 CAD11-pTN182-CAD12重組質(zhì)粒鑒定
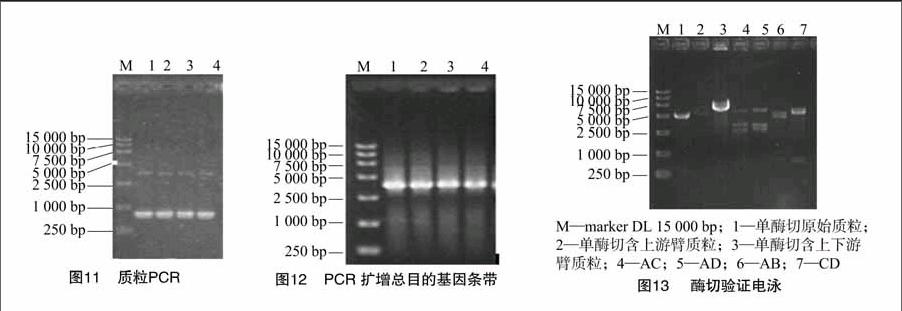
質(zhì)粒PCR驗證。以第9道菌提取出的質(zhì)粒為模板,CAD11-F、CAD12-R為引物,PCR出總目的基因條帶(上游臂681 bp,下游臂650 bp,NPTⅡ基因約2 000 bp,總目的基因條帶約3 300 bp)(圖12)。經(jīng)0.7%瓊脂糖凝膠電泳,可以看到3 300 bp左右的特異性條帶,與預(yù)期的3 300 bp條帶相符。
酶切驗證。 圖1中構(gòu)建好的CAD11-pTN182-CAD12重組質(zhì)粒,AB(681 bp)為插入的CAD1上游臂,CD(650 bp)為插入的CAD1下游臂,B′C′(2 114 bp)為選擇標記基因NPTⅡ基因,BB′、CC′為酶切位點與NPTⅡ基因連接片段。酶切驗證電泳見圖13,單酶切原始質(zhì)粒、CAD11-pTN182重組質(zhì)粒、CAD11-pTN182-CAD12重組質(zhì)粒(1、2、3),條帶依次略高。用XhoⅠ、XbaⅠ酶切可能含有上下游片段的質(zhì)粒(4),可得到2條約為2 700、3 700 bp的條帶。用XhoⅠ、BamHⅠ酶切可能含有上下游臂的質(zhì)粒(5)可得到2條約3 000、3 300 bp 的條帶。用XhoⅠ、EcoRⅤ酶切可能含有上游臂的質(zhì)粒(6)可能含有上下游臂的質(zhì)粒可得到2條約681、5 000 bp 的條帶。用XbaⅠ、BamHⅠ酶切可能含有上下游臂的質(zhì)粒(7)可得到2條約650、5 700 bp的條帶。從圖13可以看出,酶切得到的條帶與預(yù)期結(jié)果相符,說明原始質(zhì)粒中插入了CAD1上、下游同源臂。
測序驗證。取PCR出的總目的基因拿到大連寶生物工程有限公司進行測序,測序出來的結(jié)果用DNAMAN軟件與設(shè)計的目的片段比對,比對結(jié)果見圖14。比對結(jié)果顯示9905%互補配對,可能在BB′、CC′接口處會出現(xiàn)一些小的誤差,測序結(jié)果表明,插入了CAD1上下游同源臂,敲除載體構(gòu)建成功。
3 討論及結(jié)論
本試驗將CAD1基因的上、下游同源臂分別插入到含2個多酶切位點的pTN182質(zhì)粒。以改良的CTAB法提取的小立碗蘚基因組DNA為模板,使用引物設(shè)計軟件設(shè)計的小立碗蘚CAD1基因上、下游同源臂的引物,利用PCR技術(shù)擴增出小立碗蘚CAD1基因的上、下游同源臂。使用XhoⅠ、EcoRV 2種酶,酶切CAD1上游同源臂和pTN182原始質(zhì)粒,T4DNA連接酶過夜連接,連接產(chǎn)物轉(zhuǎn)化至感受態(tài)大腸桿菌,用含卡那霉素的LB固體平板培養(yǎng)基篩選陽性株,之后采用裂解液裂解、質(zhì)粒DNA提取、質(zhì)粒PCR以及酶切進行驗證。下游同源臂的構(gòu)建采用同樣的方法,最后進行測序分析。結(jié)果表明,已成功構(gòu)建了CAD1基因敲除載體。
本試驗過程當中,采用改良的CTAB方法提取小立碗蘚基因組DNA,用70%乙醇洗脫1遍。以此DNA為模板進行PCR擴增,PCR產(chǎn)物經(jīng)0.7%瓊脂糖凝膠電泳,沒有出現(xiàn)預(yù)期的681、650 bp目的基因條帶,而是在300 bp左右出現(xiàn)彌散帶[17]。改變DNA模板與引物的比例,仍出現(xiàn)同樣的彌散帶。在試驗過程中發(fā)現(xiàn)提取的DNA溶于水后,該溶液略微發(fā)黃并有黏稠感,分析可能是以下原因影響了后續(xù)PCR反應(yīng)[18]:(1)提取的DNA的純度不夠,其中可能含有蛋白質(zhì)、多糖和酚類等雜質(zhì)。(2)DNA在溶解前可能有乙醇殘留,乙醇抑制后續(xù)反應(yīng)。(3)提取的DNA中可能有殘留的金屬離子。為排除以上因素,將提取的小立碗蘚基因組DNA用高鹽TE溶液和無水乙醇沉淀,于-20 ℃沉淀1 h后離心,再用70%的乙醇洗脫3遍,從而去除混在DNA中的雜質(zhì),于超凈工作臺吹風晾干,讓乙醇充分揮發(fā)(不要過分干燥,以免DNA斷裂)后再加水溶解DNA。以此DNA為模板進行PCR擴增,可以得到目的基因。因此,在提取DNA時,應(yīng)將蛋白質(zhì)、多糖和酚類雜質(zhì)洗脫完全,以免影響后續(xù)反應(yīng)。試驗前期過程中采用同步雙酶切的方法酶切CAD1上游目的基因和pTN182原始質(zhì)粒,經(jīng)連接、轉(zhuǎn)化至大腸桿菌等過程,一直未篩選出插入上游目的片段的陽性株,后改用分步酶切的方法酶切,成功篩選出插入目的基因的陽性株。說明同步雙酶切沒有分步酶切效率高。可能是由于每一種酶都有隨酶提供的相應(yīng)的最佳buffer,以保證100%的酶活性。buffer的組成及內(nèi)切酶在不同緩沖液中的活性不同。在設(shè)計引物時,雖然選擇了能在最大程度上保證2種酶活性的緩沖液,但由于2種酶均在非最佳緩沖液條件下進行酶切,其效率會降低,從而影響后續(xù)的連接及轉(zhuǎn)化效率。因此,在同步雙酶切不成功時,可以考慮采用分步酶切的方法,提高酶切效率,為后續(xù)轉(zhuǎn)化、篩選等過程奠定良好的基礎(chǔ)。
參考文獻:
[1]Xu Z Y,Zhang D D,Hu J,et al. Comparative genome analysis of lignin biosynthesis gene families across the plant kingdom[J]. BMC Bioinformatics,2009,10(Suppl 11):S3.
[2]趙 奐,趙曉剛,何奕昆,等. 植物分子生物學(xué)研究極具前景的模式系統(tǒng)——小立碗蘚[J]. 植物學(xué)通報,2004,21(2):129-138.
[3]蔣挺大,木質(zhì)素[M]. 北京:化學(xué)工業(yè)出版社,2008:7-9,98.
[4]Mansell R L,Gross C G,Stockigt J,et a1.Purification and properties of cinnamyl alcohol dehydrogenase from higher plants involved in lignin biosynthesis[J]. Phytochemostry,1974,13:2427-2435.
[5]張新宇,高燕寧. PCR引物設(shè)計及軟件使用技巧[J]. 生物信息學(xué),2004,2(4):15-18,46.
[6]金東雁,黎孟楓,侯云德,等. 分子克隆實驗指導(dǎo)[M]. 2版.北京:科學(xué)出版社,1992.
[7]Sambrook J,Russell D W,. Molecular cloning:a laboratory manual[M]. New York:Cold Spring Harbour Laboratory Press,2002.
[8]林萬明. PCR技術(shù)操作與應(yīng)用指南[M]. 北京:人民軍醫(yī)出版社,1993.
[9]艾得希 H A. PCR技術(shù):DNA擴增的原理與應(yīng)用[M]. 田 丁,譯.北京:北京醫(yī)科大學(xué)中國協(xié)和醫(yī)科大學(xué)聯(lián)合出版社,1991.
[10]Gavit P,Better M. Production of antifungal recombinant peptides in Escherichia coli[J]. Journal of Biotechnology,2000,79(2):127-136.
[11]von Arnim A G,Deng X W,Stacey M G. Cloning vectors for the expression of green fluorescent protein fusion proteins in transgenic plants[J]. Gene,1998,221(1):35-43.
[12]李 晶,朱延明,李 杰. 轉(zhuǎn)錄因子DREB1A基因的克隆與植物表達載體的構(gòu)建[J]. 植物研究,2004,24(2):211-214.
[13]張 莉,蘇曼琳. 植物抗旱基因HDCS1的克隆和表達載體的構(gòu)建[J]. 中南林業(yè)科技大學(xué)學(xué)報,2012,32(6):115-117.
[14]Zhang Y,Wang X,Cheng C,et al. Molecular cloning and characterization of GhNPR1,a gene implicated in pathogen responses from cotton(Gossypium hirsutum L.)[J]. Bioscience Reports,2008,28(1):7-14.
[15]王 娟,韓科廳,戴思蘭. 玉米LC基因植物表達載體構(gòu)建及菊花轉(zhuǎn)化[J]. 基因組學(xué)與應(yīng)用生物學(xué),2009,28(2):229-236.
[16]羅 嬋,湯剛彬,謝體三,等. 感受態(tài)細胞制備與保存方法的比較研究[J]. 生物技術(shù),2005,15(1):52-54.
[17]張維銘. 現(xiàn)代分子生物學(xué)實驗手冊[M]. 2版.北京:科學(xué)出版社,2007:219-229.
[18]李榮華,夏巖石,劉順枝,等. 改進的CTAB提取植物DNA方法[J]. 實驗室研究與探索,2009,28(9):14-16.

