葡萄糖對水稻幼苗根系生長和生長素組織細胞分布的影響
陳豆豆++楊飛+++蔡鳳香+++鄭欣++張思韜+++趙鳳云

摘要:利用DR5-GUS轉基因水稻(Oryza sativa L.)中花 11 號為材料,分析了 0~5% 的葡萄糖和甘露醇處理 4~10 d 對水稻幼苗根系生長和生長素組織細胞分布的影響。結果表明,3%的葡萄糖有利于水稻根系生長,缺糖在幼苗生長后期顯著抑制了根系的生長,5%葡萄糖顯著延遲側根的形成和生長。通過根尖橫切片發現,生長素在組織細胞間的基本分布規律,即根冠和分生區細胞中生長素多且分布比較均勻,從伸長區到成熟區逐漸呈現梯度分布,成熟區中生長素主要分布在近表皮的皮層細胞和表皮細胞。不同濃度葡萄糖對生長素在根尖各區組織細胞間的梯度分布規律沒有明顯影響,但隨葡萄糖濃度升高根尖各區生長素含量逐漸升高。相同濃度條件下,甘露醇明顯抑制根系的生長并引起生長素的過量積累。試驗結果表明,葡萄糖對水稻根系生長的調節與其信號作用有關而非滲透作用引起的,且這種信號作用與其調節生長素的合成和分布有一定關系。
關鍵詞:葡萄糖;生長素分布;水稻根系
中圖分類號: S511.01文獻標志碼: A文章編號:1002-1302(2016)02-0101-04
收稿日期:2015-01-28
基金項目:山東省自然科學基金(編號:ZR2014DM010、ZR2015CL009);山東省淄博市科技發展計劃(編號:111089、113106)。
作者簡介:陳豆豆(1992—),男,湖南衡陽人,主要從事分子生物學研究。
通信作者:趙鳳云,博士,教授,主要從事分子生物學研究。E-mail:zfy1226@126.com。根系是作物吸收水分和營養物質的重要器官。水稻的根系屬于須根系,包括初生根 (種子根)、不定根及其側根。根系的生長發育狀況是由其內部遺傳因子和外界環境因子共同調控的[1]。土壤和植物本身的營養條件在植物根系的生長發育過程中具有決定性的作用。糖是植物體內重要的營養物質、能源物質和調節分子,在植物的生命活動過程中具有重要作用[2]。它參與植物營養器官和繁殖器官生長發育、代謝及脅迫應答等眾多過程的調節[3]。葡萄糖(glucose,G)是植物體內主要的糖源之一。近年來,就 G 在植物生長發育中的信號作用進行了研究,如不同濃度的 G 對根的形成和生長發育的調節存在差異,缺糖導致根系生長停滯、引起代謝和基因表達的變化,當 G 濃度高于5% 時則抑制根系的生長[4]。還有研究發現,高糖使葉片增大和增厚并且促進不定根的形成[5]。在水稻中發現一種短根突變體(srt5),該突變體在種子萌發期間根的伸長受到抑制,當添加外源 G 后能解除這種抑制作用,但用外源甘露醇處理則無作用,說明水稻根的生長與糖有關[6]。生長素是植物體內調控植物生長發育的關鍵激素之一,是調節不定根與側根形成和發育的重要信號分子。在植物生長發育過程中生長素的極性運輸和局部積累形成的時空梯度對器官的形成和生長至關重要[7]。研究表明,在植物根系生長發育過程中 G 和生長素信號存在交互作用[8],G 通過依賴于HXK1 代謝途徑與生長素相互作用調控植物的生長發育[3]。利用擬南芥研究發現 G 通過影響生長素合成、運輸及應答基因家族基因的表達與生長素信號發生相互作用,進而調節其根系的生長發育。G 濃度調節生長素極性運輸,缺糖使生長素極性運輸和積累減少,導致植物生長緩慢以致停滯[4]。G 調節生長素的合成與代謝,從而影響生長素的積累[9]。對玉米的研究也發現,G 調節其生長素合成基因ZmYUCCA的表達,說明 G 和生長素之間有密切關系[10]。筆者在前期報道了 G 在鋅誘導根系生長中的作用[11]。目前,關于 G 在水稻幼苗根系發育過程中作用研究較少。本試驗旨在通過分析 G 對水稻根系生長發育和生長素分布的影響,在生理水平上明確 G 與生長素信號在調節根系生長過程中的相互關系。1材料與方法
1.1材料與處理
以DR5-GUS 轉基因水稻(Oryza sativa L.)中花 11 號 為材料,挑選籽粒飽滿的種子去殼后消毒:75% 乙醇(30 s)、0.1% 氯化汞(15 min)、2% 次氯酸鈉(20 min),用無菌水洗凈。將種子分別植入含0、3%、5% 葡萄糖(glucose,G)和3%、5% 甘露醇 (mannitol,M)的MS 培養基上,置于培養箱內(光周期為14 h光照,光照強度為 200 μmol/(m2·s),溫度 26 ℃,夜間10 h,溫度 20 ℃;相對濕度為 50%~60%) 培養4~10 d后進行數據統計與分析。
G與生長素合成和運輸對初生根生長的影響:在含0、3%、5% G 的MS培養基上分別添加10-8 mol IBA、10-6 mol TIBA,在上述同樣條件下處理8 d。以上每種處理至少做3次重復,每次設置3個平行處理,每個重復用50株幼苗。
1.2根系生長統計
對根系生長的指標進行統計,包括初生根的長度及其側根的數量和長度;不定根的數量、長度及其側根的長度和數量。每個指標共統計60株(每個重復20株)。
1.3生長素時空分布的測定
通過GUS 活性測定對根系生長素的分布和積累進行分析,參照Petersson 等的方法[7]。根尖各區組織細胞生長素分布的測定,待GUS染色后取根尖連續切片,切片厚約 0.5 mm。
1. 4數據處理
用SPSS軟件對試驗數據進行處理,求出3次重復試驗的平均值和標準誤差。利用單因子方差分析不同處理之間的差異。
2結果與分析
2.1不同濃度葡萄糖對水稻根系生長的影響
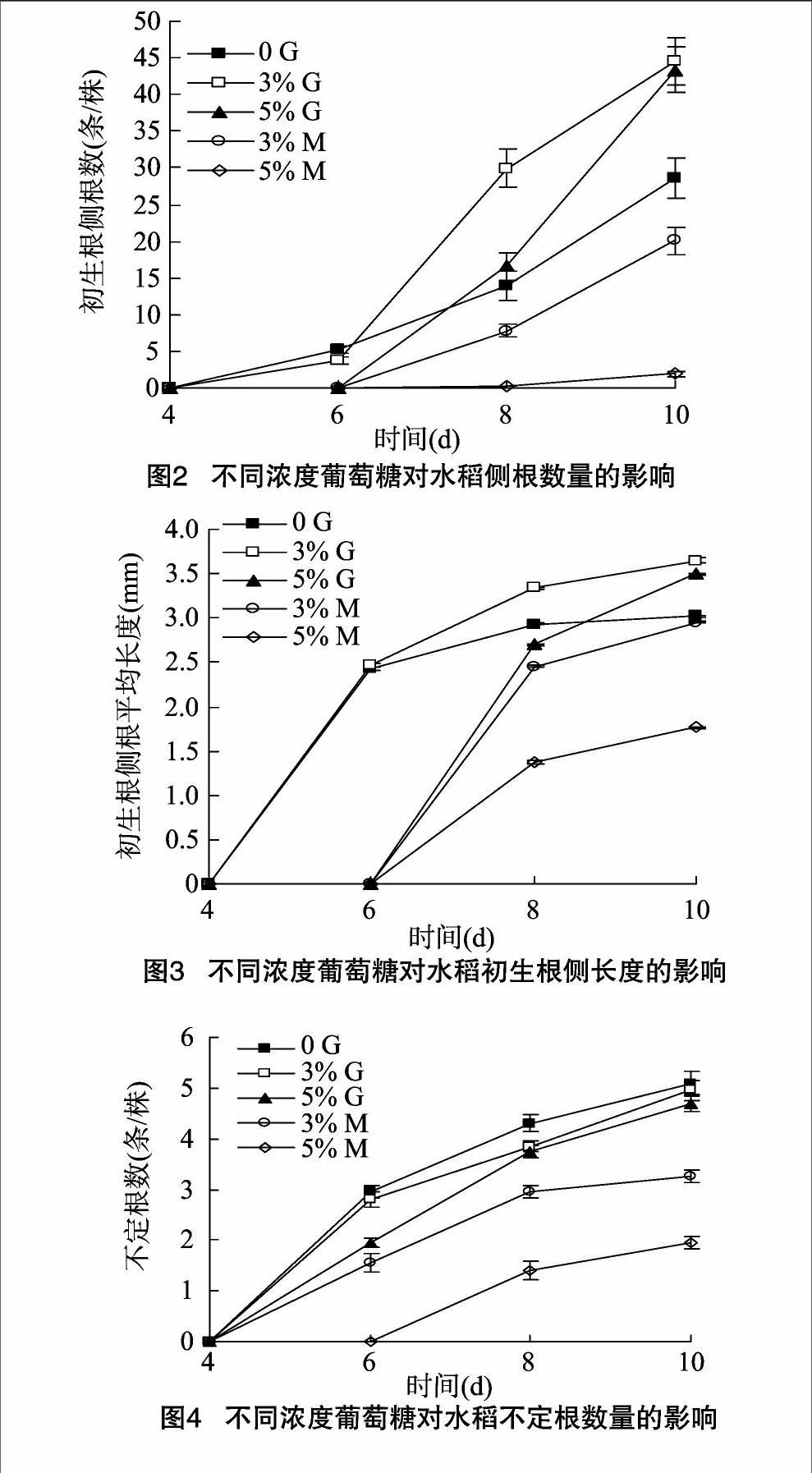
2.1.1不同濃度葡萄糖對水稻初生根長度的影響從圖1可以看出,3%葡萄糖處理8 d后的幼苗初生根長度極顯著大于0 G處理,但與5% 的G處理間差異不顯著。0 G處理8 d后初生根的伸長生長基本停止。相同濃度條件下甘露醇 (M)處理明顯抑制初生根的生長。
2.1.2不同濃度葡萄糖對水稻側根數量的影響3% G處理8 d后的初生根側根數目明顯比0 G處理的多,而與5% G處理的相比,則差異不顯著。相同濃度M處理的水稻的初生根側根數目顯著比G處理的少。M處理與5% G處理延遲初生根上側根的形成 (圖2)。
2.1.3不同濃度葡萄糖對水稻初生根側根長度的影響從圖3可以看出,0 G和 3% G處理的幼苗初生根上的側根在4 d后快速生長,但8 d后基本停止。其他處理的側根在6 d后快速生長,后期生長速度減緩。處理10 d時,3% G處理的幼苗初生根上的側根的長度比0 G處理的顯著增長。相同濃度處理下,M顯著抑制初生根上側根的生長。
2.1.4不同濃度葡萄糖對水稻不定根數量的影響不同濃度G處理條件下不定根的數目無顯著差異。與G處理相比,5% M處理極顯著減少了水稻不定根的數目(圖4)。
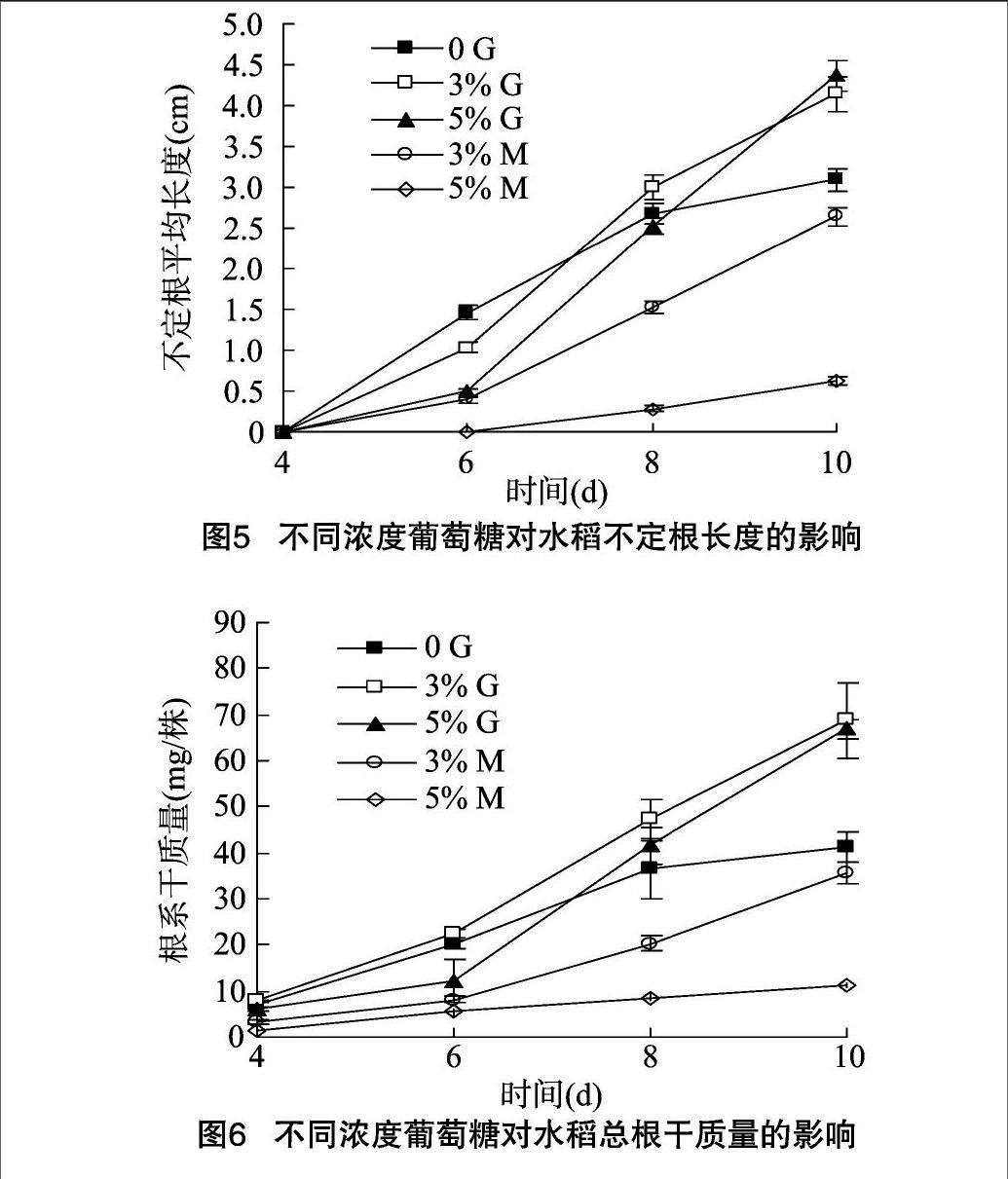
2.1.5不同濃度葡萄糖對水稻不定根長度的影響水稻幼苗用 3% G處理10 d后其不定根的長度顯著大于 0 G處理的(圖5),而與5% G處理的無顯著差異。與其他處理相比,5% M處理極顯著抑制了不定根的生長。
2.1.6不同濃度葡萄糖對水稻總根干質量的影響就根系總干質量而言,水稻幼苗處理10 d后,3% G和5% G處理的水稻根系干質量類似(圖6),這2種處理的根系干質量極顯著高于其他3種處理。
2.1.7不同濃度葡萄糖對水稻不定根上側根數量和長度的影響本試驗中只有 0 G和3% G在處理8~10 d時不定根
上有側根,與0 G相比,3% G顯著促進了水稻不定根側根數目的增多,但就側根長度來說二者之間差異不顯著。其他處理在試驗期間無可見側根。表明M和5% G抑制不定根上側根的生長和發育。
2.2葡萄糖對水稻根尖生長素積累和分布的影響
2.2.1不同處理時間對水稻初生根根尖生長素積累和分布的影響從圖7可以看出,處理 4 d 時整個根尖生長素含量比處理 6 d 的高,且二者之間生長素分布存在差異,處理4 d生長素集中在整個分生區和伸長區,處理6 d生長素主要集中在分生區和伸長區的后端。不同濃度 G 處理條件下生長素的分布方式類似,但生長素的含量隨糖濃度的升高而增加,缺糖導致伸長區和成熟區生長素減少。相同濃度條件下,M 處理的幼苗生長素顯著高于 G 處理,處理6 d 后分生區和伸長區的生長素逐漸減少,但是生長素的分布方式在不同處理間無明顯差異。相同處理條件下不定根中生長素的變化規律與初生根的類似,但是在變化時間上較初生根的晚。
2.2.2不同處理對水稻根尖各區生長素組織細胞分布規律的影響為進一步了解生長素在根尖各區組織細胞的分布特點,取初生根根尖連續切片觀察,以3% G處理4 d為例(圖8),根尖各區組織細胞間生長素分布的變化規律為根冠和分生區細胞中生長素的含量高且在各細胞間分布均勻。伸長區前端中柱部分生長素相對少,周緣(皮層)細胞生長素多。伸長區和成熟區皮層細胞內的生長素由前向后逐漸減少,呈現梯度分布。在成熟區中維管柱內的生長素從前往后含量也逐漸降低,生長素主要分布在近表皮的皮層細胞和表皮細胞中。生長素在根尖各區總體變化規律是從分生區到成熟區生長素含量由多變少,由均勻分布到梯度分布。在本試驗中不同處理條件下,生長素在各區的分布規律類似,但是在伸長區和成熟區生長素隨著糖濃度的升高而增加,M處理使生長素在相應部位顯著增加。
2.2.3IBA 和 TIBA 對不同濃度葡萄糖處理水稻幼苗初生根生長的影響從圖7、圖8可以看出,不同濃度 G 處理的幼苗生長素在根尖各區的分布方式類似,但是生長素積累量存在差異。結果表明,生長素的局部積累是其合成和運輸共同作用的結果。為進一步分析 G 對根系生長的調節是否與生長素合成和運輸有關,分析了在 G 處理的基礎上添加 IBA 和 TIBA 對初生根生長的影響,處理時間 8 d。結果表明,在缺糖(0 G)條件下添加 IBA 促進了初生根的生長;相反在高濃度糖(5% G)條件下添加 IBA 則抑制了初生根的生長,而 3% G+IBA 處理與3% G 處理的無明顯差異。在 0 G~5% G 處理條件下,添加生長素運輸抑制劑 TIBA 均抑制初生根的生長(圖9)。結果表明,G 對根生長的影響與其調節生長素的合成和運輸有一定關系。
3討論
G是調節根系生長的重要信號分子之一,不同濃度G處理后對根的形成和生長發育的調節存在差異[4-5]。本試驗中3% G 處理的幼苗根系生長最好,0 G 處理的幼苗根系在處理后6 d前其生長與 3% G 處理的沒有明顯差異,但是在 6 d后顯著抑制了根系的生長,而 5% G 處理延遲了幼苗側根的形成和生長,但是對初生根和不定根生長的影響較小。與相同濃度的G相比,M 處理顯著抑制了幼苗根系的生長。結果表明,G對根系生長的調節不是由滲透勢引起的而是糖信號本身的作用。在植物生長發育過程中由生長素的極性運輸和局部積累形成的時空梯度對器官的形成和生長至關重要[7]。生長素的局部積累是其極性運輸、合成、代謝共同作用的結果[12]。G濃度調節生長素極性運輸、合成與代謝,從而影響生長素的積累[9]。本試驗條件下,0 G 處理的幼苗根系組織細胞特別是伸長區細胞中的生長素明顯少于3% G 和5% G 處理,表明缺糖導致根系生長緩慢以致停滯,這與減少生長素的積累有關。進一步研究發現,在 0 G 處理的基礎上添加生長素 IBA 時根系的生長有所增強,但是生長素運輸抑制劑 TIBA 則顯著抑制了根系的生長。結果表明,G對生長素積累的調節可能與生長素合成和運輸有密切關系,相關分子機制有待于進一步研究。G是調節水稻幼苗根系生長發育的重要信號分子,這種信號作用與其調節生長素的積累和分布有關。
參考文獻:
[1]Malamy J E,Ryan K S. Environmental regulation of lateral root initiation in Arabidopsis[J]. Plant Physiology,2001,27:899-909.
[2]Bolouri-Moghaddam M R,Roy K L,Xiang L,et al. Sugar signalling and antioxidant network connections in plant cells[J]. FEBS Journal,2010,277:2022-2037.
[3]Rolland F B,Sheen J. Sugar sensing and signaling in plants:conserved and novel mechanisms[J]. Annual Review of Plant Biology,2006,57:675-709.
[4]Mishra B S,Singh M,Aggrawal P A. Glucose and auxin signaling interaction in controlling Arabidopsis thaliana seedlings root growth and development[J]. PLoS One,2009,4(2):0004502.
[5]Gibson S I. Control of plant development and gene expression by sugar signaling[J]. Current Opinion in Plant Biology,2005,8:93-102.
[6]Yao S G,Mushika J,Taketa S,et al. The short-root mutation srt5 defines a sugar-mediated root growth in rice(Oryza sativa L.)[J]. Plant Science,2004,167:49-54.
[7]Petersson S V,Johansson A I,Kowalczyk M,et al. An auxin gradient and maximum in the Arabidopsis root apex shown by high-resolution cell-specific analysis of IAA distribution and synthesis[J]. Plant Cell,2009,21(6):1659-1668.
[8]Eveland A L,Jackson D P. Sugars,signalling,and plant development[J]. Journal of Experimental Botany,2012,63(9):3367-3377.
[9]Sairanen I,Novák O,Pěncˇík A,et al. Soluble carbohydrates regulate auxin biosynthesis via PIF proteins in Arabidopsis[J]. Plant Cell,2012,24:4907-4916.
[10]Leclere S S E,Chourey P S. Sugar levels regulate tryptophan-dependent auxin biosynthesis in developing maize kernels[J]. Plant Physiology,2010,153:306-318.
[11]Chen Z H,Feng T T,Liu L Y,et al. Effect of glucose on zinc-induced growth of root system in rice[J]. Agricultural Science and Technology,2011,12(9):1334-1337.
[12]Tromas A,Perrot-Rechenmann C. Recent progress in auxin biology[J]. Comptes Rendus Biologies,2010,333(4):297-306.崔雪梅,郭海如,方嬙,等. 基于主成分分析的油菜鹽害生理反應規律[J]. 江蘇農業科學,2016,44(2):105-108.

