線粒體熒光探針最新研究進展
姜娜,樊江莉,楊洪寶,彭孝軍
(1大連理工大學精細化工國家重點實驗室,遼寧 大連 116024;2濟南大學化學化工學院,山東 濟南 250022)
?
線粒體熒光探針最新研究進展
姜娜1,2,樊江莉1,楊洪寶1,彭孝軍1
(1大連理工大學精細化工國家重點實驗室,遼寧 大連 116024;2濟南大學化學化工學院,山東 濟南 250022)
摘要:細胞器的研究一直是認識細胞結構和功能的重要手段。線粒體是細胞的能量工廠,參與眾多的新陳代謝過程,許多病理學過程均與它相關,是一種重要的細胞器,一直以來都是研究的熱點。定位于線粒體的熒光探針主要分為3大類,本文重點介紹并討論近10年基于帶有正電荷的熒光團或者在熒光團中引入三苯基膦等定位基團實現對線粒體染色熒光探針的研究進展。
關鍵詞:熒光;探針;線粒體;細胞生物學;生物技術;成像
2015-06-29收到初稿,2015-07-31收到修改稿。
聯系人:彭孝軍。第一作者:姜娜(1987—),女,博士研究生。
Received date: 2015-06-29.
引 言
線粒體是細胞的能量工廠,在細胞生命過程中起到至關重要的作用,其功能異常與許多疾病密切相關,因此開發線粒體相關的熒光探針具有重要的生物學和生理學意義。目前已報道的定位于線粒體的熒光探針主要分為3大類:一類是基于線粒體帶有-180 mV的膜電位,進而利用本身帶有正電荷的熒光團或者在熒光團中引入三苯基膦等正電荷基團來實現其對線粒體的染色;另一類是將探針與能夠標記線粒體的蛋白質或者短肽鏈連接(一般由20~40個氨基酸序列組成),進而達到線粒體特異性染色的目的。這類探針具有較好的生物相容性,但水溶性差、細胞通透性不好等限制其應用發展;第3類是利用膠束或者囊泡將藥物等不能夠滲透線粒體膜的物質包裹,進而選擇性堆積在線粒體。一般選用帶有正電荷的脂質體等作為囊泡的外表面,通過內吞作用,磷脂層與線粒體膜相融合后釋放內含物。該類探針能夠將帶負電的藥物或者大分子協同帶入線粒體內部,但是內含物的釋放率是值得關注的方面。本文將著重討論第一類熒光探針近10年的發展。
1 線粒體成像類熒光探針
線粒體是1894年德國科學家Altmann在動物細胞內首次發現的,它具有雙層膜結構,外膜是界膜,內膜向內折入形成嵴;內外膜不相通,形成約-180 mV的膜電位。目前大多數線粒體定位類熒光探針是基于線粒體負膜電位特性,利用本身帶有正電荷的熒光團或者在熒光團中引入帶有正電荷基團,實現對線粒體的染色,其中最為常用的是三苯基膦正電荷基團。線粒體不僅為人體生命活動提供能量,還積極參與多種生理過程,它的異常與癌癥、糖尿病、阿爾茨海默病等疾病相關,同時線粒體對各種外界損傷又極為敏感,通常其數量、大小和結構隨損傷均有改變。細胞受到損傷時,線粒體可由線狀變大或者變圓,損傷嚴重時可變成小空心泡狀結構。2013年,本課題組合成一例能夠長時間觀測線粒體形態變化的氟硼吡咯類(BODIPY類)熒光探針OBEP(1.1)(圖1)[1]。該探針具有良好的光學穩定性,小的細胞毒性,在生理pH范圍內對酸堿不敏感,可以通過激光共聚焦成像觀測到處于不同形態的線粒體。通過探究,作者認為探針(1.1)是基于吡啶N原子乙基季銨化后使得探針整體帶正電荷,易于與線粒體負的膜電位相結合進而特異性染色到線粒體。

圖1 探針1.1的分子結構及其對活細胞中不同損傷程度線粒體的熒光成像Fig.1 Structure of probe 1.1, and confocal fluorescence image for various damaged mitochondrial forms in living cells

圖2 探針1.2和1.3的分子結構及其對活細胞中線粒體的熒光成像Fig.2 Structures of probes 1.2 and 1.3, and fluorescent images of them for mitochondria in living cells
近紅外熒光探針可以有效地避開蛋白自發熒光,具有較深的組織穿透力,因此開發能夠定位于線粒體的近紅外熒光探針意義重大。2010年Shi課題組證實以吲哚季銨鹽為基礎的七甲川菁染料可以定位于線粒體[2]。由于探針IR-780(1.2)(圖2)具有較好的光學性質和生物相容性,優先聚集于腫瘤組織,因此作者希望可以利用該探針建立一個腫瘤診斷和治療的平臺。2013年Tung課題組報道一例基于七甲川菁染料的無細胞毒性探針AcQCy7 (1.3)(圖2)[3],該探針本身不發射熒光,當進入細胞后發生乙酰基水解作用生成化合物QCy7,同時伴隨紅色熒光發射。分子1.3可以很好地選擇性堆積在線粒體上,即使與細胞共孵育時間長達兩天,其染色位置不變,而且無任何細胞毒性表達,這為長時間觀測線粒體形態變化提供有利的研究工具。
2011年 Kawazoe課題組報道首例成像于線粒體膜的熒光探針[4],并且通過細胞磨碎技術、凝膠電泳、液質聯用技術等各種實驗證明該分子在膜上發生成環反應,由本身沒有熒光的分子1(1.4)在線粒體膜上反應生成發射綠色熒光的分子2(1.5)(結構如圖3),但是該分子定位于線粒體膜及其環化反應的機制尚不明確。

圖3 探針1.4和1.5的分子結構及其對活細胞中線粒體的熒光成像Fig.3 Structures of probes 1.4 and 1.5, and confocal images of HeLa cells
雙光子激光共聚焦成像由于具有高的空間分辨率、組織穿透性深、光損傷程度低和耐光性好等優點,目前受到廣泛關注。山東大學于曉強教授基于咔唑母體,設計合成兩例用于線粒體成像的雙光子熒光探針CAI(1.6)和CAEI(1.7)(圖4)[5]。這兩例探針之所以能夠定位于線粒體,很大部分是因為吡啶被碘代烷化合物取代后形成季銨鹽,使探針分子帶有正電荷。
目前已報道的能夠定位于線粒體的熒光探針大部分是基于三苯基膦基團或者探針本身帶有正電荷,而2013年Reddy及其合作者報道一例基于銪-β二酮絡合物用于線粒體定位的探針Eu(pfppd)3(tpy) (1.8)(圖5)[6],豐富了線粒體熒光探針的數據庫。
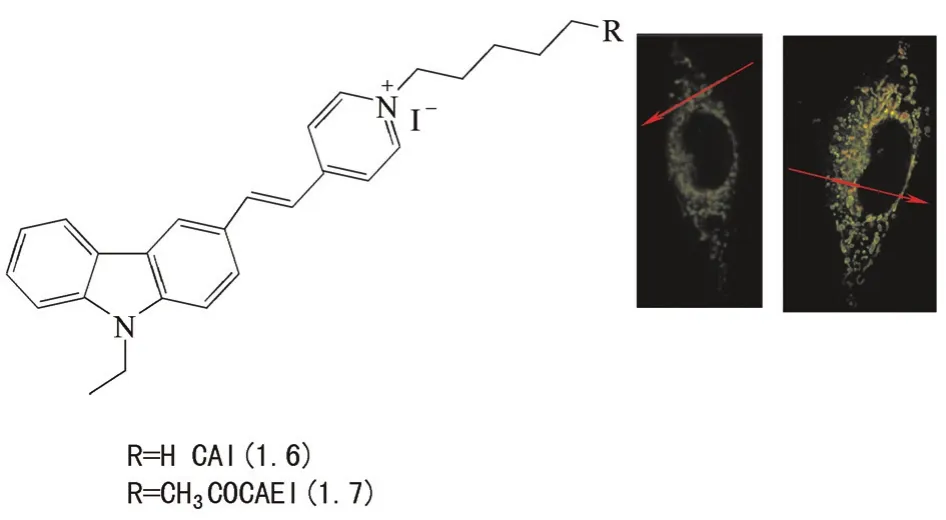
圖4 探針1.6和1.7的分子結構及其對活細胞中線粒體的熒光成像Fig.4 Structures of probes 1.6 and 1.7, and fluorescent images of them for mitochondria in living cells

圖5 探針1.8的分子結構及其與商品化線粒體染料在H9c2細胞中線粒體的熒光成像Fig.5 Structure of probe 1.8, and confocal images of H9c2 cells treated with Mitochondria tracker CellLight?Mitochondria-GFP BacMam 2.0 or molecule 1.8
2 線粒體內離子類熒光探針
鋅作為一種重要的過渡金屬元素,在人體中的含量僅次于鐵,Zn2+含量異常會影響相關蛋白以及DNA的轉化和功能,進一步影響正常生理過程,造成腦發育遲緩、癲癇等疾病。2003年Gee課題組報道一例基于羅丹明的探針RhodZin-3 AM(2.1)(圖6)[7],該探針與Zn2+結合后可實現75倍熒光增強,并且選擇性堆積于線粒體上,實現對線粒體中內源性自由Zn2+的檢測。2011年,韓國Cho課題組報道一例基于FRET機理檢測線粒體內Zn2+的紅色熒光探針5[8]。該探針斯托克斯位移大,可減少激發光的干擾,在生理范圍內不受pH干擾,實現了Zn2+的比率成像。緊接著,2012年,Cho和Kim合作,利用三苯基膦基團對線粒體的定位作用合成一例檢測Zn2+的雙光子熒光探針SZn2-Mito(2.2)(圖6)[9]。當與Zn2+結合后,探針536 nm處有70倍熒光增強,對鼠海馬組織深達100~200 μm處實現Zn2+雙光子激光共聚焦成像。

圖6 探針2.1和2.2的分子結構及其分別與相對應的線粒體商品化染料在活細胞中線粒體的共定位熒光成像Fig.6 Structures of probes 2.1 and 2.2, and co-localization of 2.1 and MitoTracker Green, and confocal images of HeLa cells treated 2.2 or Mitotracker Red FM
鐵是人體內含量最多的過渡金屬元素,具有重要的生理學意義,包括呼吸作用、電子轉移、遺傳信息轉錄等。尤其在線粒體內,鐵含量異常所引起的相關疾病正在增加,例如弗里德里奇共濟失調癥。這種疾病是由共濟蛋白的缺陷引起的,而三價鐵離子是這種蛋白合成的控制因素。大連理工大學寧桂玲教授帶領課題組設計合成一例基于羅丹明探針母體用于檢測細胞內三價鐵離子的探針RNP1(2.3)(圖7)[10],該探針基于萘酐與羅丹明之間發生FRET作用調節對Fe3+的絡合能力。值得注意的是,探針2.3定位于線粒體同樣是依賴于三苯基膦基團。Cabantchik課題組同樣通過修飾羅丹明母體來監測線粒體內Fe3+水平[11-14]RdITPA-TG(圖8)[15]。該系列探針在中性環境下選擇性與Cu+反應,使得母體螺環打開,發射542 nm的黃橙色熒光。當TG基團為三苯基膦基團時,探針2.4可很好地定位于線粒體上,達到對線粒體內。
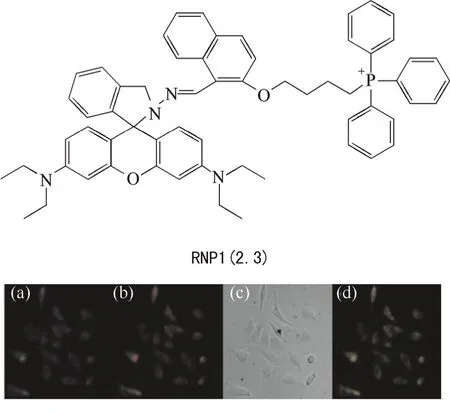
圖7 探針2.3的分子結構及與商品化線粒體綠色染料在HeLa細胞中共定位實驗Fig.7 Structure of 2.3, and localization of MitoTracker Green FM or 2.3 in HeLa cells

圖8 探針2.4的分子結構Fig.8 Structure of probe 2.4

圖9 分子2.5-a和2.5-b由零價鈀催化發生鈴木反應生成2.5的過程[16]Fig.9 Pd0-mediated Suzuki-Miyaura cross-coupling reaction for synthesis of anthofluorescein 2.5 from 2.5-a and 2.5-b[16]
銅同樣是線粒體內重要的基本金屬元素,參與線粒體細胞色素c氧化酶及超氧歧化酶的合成,而這兩種酶在能量產生和能量凋亡中起調配作用。Taki教授基于香豆素母體設計合成一系列探針Cu+檢測識別的目的。
鈀及其離子化合物在生物體內含量很低,大多數是通過呼吸作用吸入,進而滯留在肺部,其中一部分吸收的鈀化合物會快速轉運至肝、腎等器官。但是由于環境中鈀離子的濃度很低,又存在基體干擾,因此對它的檢測分析仍較為困難。Bradley及其合作者利用細胞內的耦合反應合成化合物5(2.5)(圖9)[16-17]。首先脂溶性不能夠發射熒光的探針母體2.5-a與帶有三苯基膦部分的2.5-b部分進入細胞后,在Pd0的催化作用下發生鈴木反應生成探針2.5,同時伴隨著綠色熒光的發射,而三苯基膦基團的引入,使得探針可以定位于線粒體。
氟離子是一種重要的陰離子,它廣泛地參與生物、醫藥和化學過程。當人體氟離子含量超標時,最常見的表現是氟斑牙、新陳代謝失調、骨質疏松癥和尿石癥等。研究表明,當線粒體暴露在高濃度的氟離子環境時,其呼吸作用效率下降,進而導致線粒體功能紊亂,誘發遲發性神經退行性類疾病。2014年,本課題組設計合成一例高選擇性和高靈敏性檢查F-的熒光探針FP(2.6)(圖10)[18-19]。分子2.6本身不發射熒光,當與F-發生水解作用后,將會在485 nm處發射強烈的綠色熒光,且對F-的檢測限達19×10-9mol·L-1。該探針雖不帶有正電荷(與F-作用后的產物YG也不帶正電荷),卻很好地選擇性定位于活細胞線粒體上。

圖10 探針2.6的分子結構及其對活細胞中線粒體的熒光成像Fig.10 Structure of probe 2.6, and its fluorescent images for mitochondria in living cells

圖11 探針3.1和3.2的分子結構以及探針3.2對HeLa細胞內線粒體選擇性染色Fig.11 Structures of probes 3.1 and 3.2, and localization of 3.2 in mitochondria in HeLa cells
3 線粒體內活性氧類熒光探針
氧氣是生物進行生命活動的必要因素。在生命活動中,機體通過呼吸作用產生一系列氧的衍生物,例如活性氧系列,通常包括超氧負離子(O-2·)、羥基自由基(HO·)、過氧自由基(ROO·)、過氧化氫(H2O2)和單線態氧(1O2)等。在正常的細胞環境內,活性氧的產生是必須的,但是當因外界刺激產生過量的活性氧時,可對機體造成損傷乃至損害[20]。早在2006年,Chang課題組合成一例基于FRET機理比率檢測過氧化氫的新型熒光探針RPF1(3.1)(圖11)[21]。未與H2O2反應前,只能觀察到香豆素的藍色熒光;與H2O2相互作用后,香豆素的藍色熒光逐漸減弱,而熒光素的綠色熒光恢復并且逐漸增強。探針RPF1(3.1)激發和發射波長均處于可見光區,不僅可減少對生物樣品的光損傷,還可以避開蛋白的自發熒光。值得注意的是,作者是將線粒體從細胞分離出后進行的檢測。緊接著,2007年Nagano課題組基于羅丹明母體帶有正電荷的性質,設計合成一例真正能夠檢測線粒體中活性氧的探針MitoAR(3.2)(圖11)[22],并實現在活細胞中對活性氧的熒光成像。
2010年,Shioji課題組將三苯基膦基團引入到四苯基芘熒光母體上,報道一例能夠檢測線粒體內過氧化合物的探針MitoDPPP(3.3)(圖12)[23]。通過觀察探針的染色情況,作者認為脂溶性的過氧化合物可有效地穿透線粒體膜。Robinson及其合作者同樣將三苯基膦基團引到乙啡啶母體上,合成能夠定位于線粒體的探針6(3.4)和7(3.5)(圖12)[24]。這兩例探針的熒光發射具有不同的形式。當細胞內僅發生自動氧化作用(無超氧化合物)時,探針510 nm激發時只產生乙啡啶部分的熒光;而當超氧化合物存在時,它將氧化探針生成2-羥基-乙啡啶的形式,并且在396 nm和510 nm處均可被激發,因此通過檢測396 nm和510 nm兩處的激發波長,可區分細胞一般氧化過程和超氧誘導過程。
2014年,新加坡國立大學的劉斌教授,通過三苯基膦基團的線粒體定位功能,很巧妙地利用癌細胞的線粒體膜電位比正常細胞更負,設計合成一例聚集態發光的探針AIE-mito-TPP(3.6)(圖13)[25]。該探針可以選擇性堆積在癌細胞中的線粒體上,并且通過探針的聚集達到熒光從無到有的過程。另外探針的進一步堆積可以誘導線粒體產生更多的活性氧,達到殺死癌細胞的目的。

圖12 探針3.3~3.5的分子結構Fig.12 Structures of probes 3.3—3.5
次氯酸和次氯酸根是常見的活性氧物種,在日常生活中,次氯酸一般被用于漂白織物。在生物體內,次氯酸一般存在于白細胞內,經過氧化氫和氯化物在過氧化物酶的催化作用下產生,次氯酸本身具有一定的防御功能,可以殺死多種病原體。當細胞內次氯酸含量異常時,動脈粥樣硬化、關節炎、風濕性關節炎和肺部炎癥等疾病都有可能產生。基于三苯基膦基團的線粒體定位功能,本課題組程光輝博士將其引入到BODIPY母體上,基于肟的還原反應合成一例對次氯酸根快速響應的熒光探針MitoClO(3.7)(圖14)[26]。測試體系中加入次氯酸根后,溶液由粉紅色變為黃色,肉眼可見,伴隨著綠色熒光的發射,并且探針3.7可對線粒體內次氯酸根進行共聚焦成像。
2014年,四川大學李坤副教授和余孝其教授合作,合成兩例基于羅丹明母體用于檢測細胞內源性次氯酸的熒光探針Rh-TPP(3.8)和Rh-Py(3.9)(圖15)[27]。其中探針3.8由于三苯基膦基團的引入,使得它能夠定位于活細胞中的線粒體,并且對線粒體中次氯酸的含量可通過共聚焦成像。
生物體內的過氧硝酸根一般認為是在酶的催化作用下由一氧化氮和超氧化物形成的。過氧硝酸根與蛋白質、磷脂、核酸等的合成密切相關。研究認為阿爾茨海默病、關節炎、癌癥、自身免疫缺陷病等均與過氧硝酸根含量的異常相關。2015年山西大學郭煒教授基于羅丹明母體合成探針1(3.10)(圖16)[28]。該探針可排除其他活性氧物種,只對過氧硝酸根響應,熒光由無到明亮綠色,并且響應快速(幾秒內即可完成響應)。該探針定位于線粒體是基于羅丹明母體帶有正電荷的性質。

圖13 探針3.6的分子結構及其對活細胞中線粒體的熒光成像[25]Fig.13 Structure of probe 3.6, and diagram of apoptosis was induced by 3.6[25]

圖14 探針3.7的分子結構及其與商品化線粒體深紅色染料在MCF-7細胞中共定位熒光成像Fig.14 Structure of probe 3.7, and confocal images of 3.7 or a mitochondria-specific probe MitoTracker Deep Red FM in MCF-7

圖15 探針3.8和3.9的分子結構及其對活細胞中線粒體的熒光成像Fig.15 Structures of probes 3.8 and 3.8, and fluorescent images of them for mitochondria in living cells
4 線粒體內有機小分子類熒光探針
硫化氫是一種有臭雞蛋味的無色氣體,是繼一氧化碳、一氧化氮后,人體內存在的第3種內源性氣體。在血管舒張、抗氧化作用、抗細胞凋亡和抗炎癥等生理過程中,硫化氫起著舉足輕重的作用,它含量異常與阿爾茨海默病、唐氏綜合征等息息相關。2013年,南京大學郭子建教授帶領團隊,將香豆素和半菁探針結合,設計合成一例超快速(30 s之內完成檢測)比率檢測線粒體內硫化氫的熒光探針CouMC(4.1)(圖17)[29-30]。由于探針本身帶有一個正電荷,因此無需額外引入其他線粒體定位基團便可很好地染色于線粒體上。探針4.1本身只在652 nm處發射強烈的紅色熒光,當與硫化氫作用后,652 nm處熒光強度不斷降低,510 nm處產生一個新的綠色熒光,隨著硫化氫濃度的增加該熒光強度不斷增強,實現對硫化氫的比率檢測。

圖16 探針3.10的分子結構及其與商品化紅光線粒體染料在BIU-87細胞中激光共聚焦成像Fig.16 Structure of probe 3.10, and fluorescence images of 3.10 and MitoTracker Red FM in BIU-87 cells
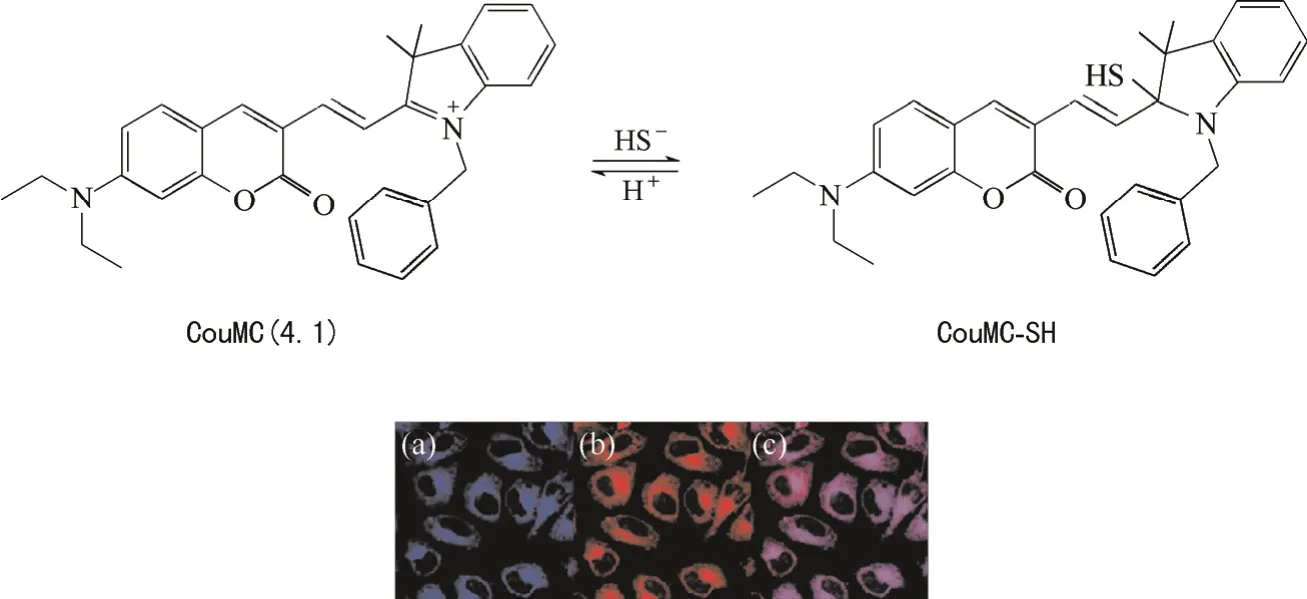
圖17 探針4.1的分子結構及其與商品化線粒體紅色熒光染料在MCF-7細胞中共定位成像Fig.17 Structure of probe 4.1, and confocal fluorescence images of MCF-7 cells costained by 4.1 and Mito tracker Deep Red
硫醇類化合物在細胞內氧化還原、細胞凋亡、DNA合成和血管形成等過程中起著重要的調控作用。谷胱甘肽和硫醇還蛋白是細胞內最重要的兩大類硫醇類化合物。硫醇還蛋白的功能主要體現在蛋白質二硫鍵的去除上,例如核苷酸還原酶、甲硫氨酸還原酶和過氧化還原酶等。然而,過量的硫醇還蛋白將會引起癌癥及心血管疾病。韓國Kim教授于2012年在J. Am. Chem. Soc. 雜志上發表一篇基于萘酰亞胺母體來檢測線粒體內硫醇還蛋白的熒光探針Mito-Naph(4.2)(圖18)[31]。作者的設計思想很明確,即一方面通過二硫鍵的去除來識別硫醇還蛋白,另一方面利用三苯基膦基團的正電荷特性來定位于線粒體。探針4.2本身不發射熒光,當與硫醇還蛋白類物質作用后,發射出強烈的綠色熒光(λem= 540 nm),檢測限可達50 nmol·L-1。基于該平臺,陸續又有該類探針被報道[32-34]。
盡管許多檢測線粒體硫醇化合物的探針是基于二硫鍵的去除或者邁克爾加成反應設計的,但是一例能夠用于單獨檢測線粒體內谷胱甘肽的近紅外熒光探針MitoGP(4.3)(圖19)[35]。菁探針本身帶有一個正電荷,因此該探針可以選擇性定位于線粒體;而七甲川菁探針中位氧-對氨基類化合物的取代,使得該探針對谷胱甘肽的選擇性大大高于半胱氨酸和高半胱氨酸,這正是該工作的亮點。
2011年,Miyata等報道首例能夠誘導線粒體產生一氧化氮的熒光探針RpNO(4.4)(圖)[36],該探針可用于研究生物體一氧化氮的生物學及生理學意義。探針4.4之所以能夠定位于線粒體也是基于羅丹明母體帶有正電荷的性質。緊接著該課題組又報道一例能夠光致釋放一氧化氮的熒光探針NBDNO(4.5)(圖20)[37]。不同的是,該探針是利用三苯基膦基團的正電荷性質定位到線粒體。

圖18 探針4.2的分子結構及其對活細胞中線粒體的熒光成像Fig.18 Structure of probe 4.2 and its fluorescent images for mitochondria in living cells
5 線粒體內酸堿環境熒光探針

圖19 探針4.3的分子結構及其對線粒體中谷胱甘肽響應Fig.19 Structure of probe 4.3, and glutathione detection in mitochondria
線粒體許多功能是依賴于其酸堿性來實現的,例如正常生理狀態下,基于呼吸作用將質子由線粒體內膜傳輸到線粒體外膜,因此線粒體基質會處于堿性環境(pH約為8)。當線粒體酸化時,將會發生自噬過程進而誘導一系列疾病的產生。2014年,Kim課題組設計合成一例用于實時檢測線粒體pH的探針1(5.1)(圖21)[38]。由于哌嗪基團上的N原子可對萘酰亞胺母體發生PET作用,因此探針本身無熒光;而當N原子與H+結合后,PET作用消失,探針發射出525 nm的綠色熒光。三苯基膦基大多數探針是不能夠將谷胱甘肽與半胱氨酸和高半胱氨酸進行區分的。2014年Kang課題組設計合成團的引入使得該探針可以很好地定位于線粒體上。通過細胞饑餓實驗,可以明顯地觀察到線粒體pH的變化與其酸化和融合等是相互依賴的。作者推論利用該探針檢測線粒體pH的異常將會對疾病的發現和診斷提供方便,但是該探針存在發射波長較短的不足。于是2014年山東師范大學唐波教授合成探針Spring Red(5.2)(圖21)[39]。探針5.2發射波長達到660 nm,屬于近紅外區,可有效地避開生物組織的本體熒光,利于實際應用。

圖20 探針4.4和4.5的分子結構及其對活細胞中線粒體的熒光成像Fig.20 Structures of probes 4.4 and 4.5, and fluorescent images of them for mitochondria in living cells

圖21 探針5.1和5.2的分子結構及5.2對HepG2細胞中線粒體不同酸堿環境的熒光成像Fig.21 Structures of probes 5.1 and 5.2, and fluorescent confocal microscopy images of 5.2 in HepG2 cells defined at pH 4.0—8.5
相比單一強度檢測的探針,比率熒光檢測具有兩個以上發射峰,相對來說每個發射峰不受探針濃度影響,熒光強度及比值能夠提供更多的信息,具有抗干擾能力強等優點。2015年李坤副教授和余孝其教授合作,合成一例基于香豆素母體通過比率方法檢測線粒體pH的熒光探針CP(5.3)(圖22)[40]。水溶性探針5.3對pH非常敏感,而對細胞內的陽離子、陰離子、反應類硫醇化合物和單線態氧等均無響應,可實時監測因細胞凋亡、藥物刺激等引起的線粒體酸化過程中線粒體pH的變化,這為定量線粒體pH提供有利的工具。
6 檢測線粒體內黏度的熒光探針
細胞內黏度在信號傳遞、核功能化、染色質定位、單線態氧的定位等生物過程中起著十分重要的作用[41-42]。細胞內黏度的突然變化會導致相關的功能化缺陷和疾病。線粒體是細胞的能量制造工廠,它對癌癥、阿爾茨海默病、帕金森綜合征等疾病都有著敏感的響應。線粒體膜黏度的降低,電子傳輸鏈活性的減弱,活性氧含量的增加,細胞色素c釋放量的增加等均可以引起線粒體功能損傷[43],因此檢測活細胞內線粒體內黏度具有重要的醫學和生物學意義。

圖23 探針6.1和6.2的分子結構及其與商品化線粒體染料的復染實驗Fig.23 Structures of probe 6.1 and 6.2, and fluorescent images of them for mitochondria in living cells
2013年,本課題組基于香豆素和BODIPY探針,合成一例自校準的黏度探針1(6.1)(圖23)[44],在設計階段作者將三苯基膦基團引入,使得探針可以選擇性定位于活細胞的線粒體上。該工作第一次估算出HeLa細胞內線粒體的黏度值在62 mPa·s,當細胞受到離子載體、莫能菌素、制霉菌素等刺激時,線粒體黏度可升高至110 mPa·s。同年,本課題組基于咔唑設計合成一例具有雙光子性能的黏度探針Caz-Cy2(6.2)(圖23)[45]。該探針可以比率檢測溶液黏度變化,不受極性或生物大分子的干擾,可以對線粒體內黏度進行成像。緊接著,設計合成雙模式監測線粒體黏度的熒光探針Mito-V(6.3)(圖24)[46]。探針6.3本身帶有一個正電荷,易于定位于線粒體上,可通過熒光比率成像和熒光壽命成像兩種方法來檢測活細胞中線粒體黏度的變化,并且作者觀察到線粒體黏度在細胞凋亡中增大的現象。

圖24 探針6.3分子結構及其與商品化深綠色熒光染料在HeLa細胞中共定位熒光成像Fig.24 Structures of probe 6.3, and confocal fluorescence images of HeLa cells stained with MitoTracker Green FM and 6.3
7 檢測線粒體內極性的熒光探針
在生物系統中,特別是在細胞水平上,極性的變化影響蛋白質、酶等的相互作用,并且在一定程度上反映出細胞膜的通透性。此外,它的異常變化與一些疾病密切相關,例如糖尿病、肝硬化等[47-49]。然而極性受許多復雜的因素影響,包括非共價相互作用、偶極和去偶極化作用、氫鍵相互作用等[50-51]。因此簡單地測試細胞內的極性是十分困難的,亟需發展一種新方法。另外,細胞內有多種細胞器,每種細胞器的極性也是不同的(其他參數,例如極性、單線態氧等也不同),所以更精確地檢測某一細胞器的極性具有更加明確的生物學意義[52-55]。
線粒體極性變化會強烈地影響蛋白質和生物大分子的運輸和交互作用。另一方面,線粒體極性還能夠在一定程度上反映該種亞細胞器的位置、形態和組件的變化等。而當線粒體功能異常時,其內部酶、蛋白質和生物大分子基質等將不能正常傳輸[56-57],例如線粒體蘋果酸脫氫酶的活性和穩定性會受到周圍環境極性的強烈影響[58],因此研究和開發出能夠用于檢測線粒體極性的熒光探針具有重要意義。2015年,本課題組設計合成一例以香豆素為基礎的半菁探針BOB(7.1)(圖25)[59]。該探針具有兩個吸收峰和兩個發射峰,隨著溶液極性增加,探針在短波長與長波長處熒光強度比例與溶液極性呈線性關系,可用作比率型極性熒光探針。BOB探針可對活細胞中的線粒體進行特異性染色,發現并驗證線粒體極性在細胞凋亡過程中降低,還發現線粒體極性在癌細胞中低于正常細胞,期望通過監測線粒體極性的異常來區分癌細胞和正常細胞。

圖25 探針7.1的分子結構及其與商品化深綠色熒光染料在MCF-7細胞中共定位熒光成像Fig.25 Structures of probe 7.1, and confocal fluorescence images of MCF-7 cells stained with Mito Tracker Green FM and 7.1
8 結論與展望

目前對于線粒體內黏度、極性等微環境參數檢測的熒光探針雖有報道,但是靈敏度不足限制了它的發展,成為生物醫學研究和診斷治療中的薄弱領域,所以提高探針檢測靈敏度將是研究的熱點之一。另一方面,把藥物通過二硫鍵等特殊基團連接到探針上,利用探針的線粒體定位功能將藥物攜入到線粒體內部,達到藥物定位釋放的目的,也將是線粒體相關類熒光探針的研究熱點。
References
[1] ZHANG S, WU T, FAN J L, et al. A BODIPY-based fluorescent probe for mitochondria in living cells, with low cytotoxicity and high photostability [J]. Organic & Biomolecular Chemistry, 2013, 11(4): 555-558.
[2] ZHANG C, LIU T, SU Y P, et al. A near-infrared fluorescent heptamethine indocyanine probe with preferential tumor accumulation for in vivo imaging [J]. Biomaterials, 2010, 31(25): 6612-6617.
[3] HAN J, HAN M S, TUNG C. A non-toxic fluorogenic probe for mitochondria labeling [J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2013, 1830(11): 5130-5135.
[4] KAWAZOE Y, SHIMOGAWA H, SATO A, et al. A mitochondrial surface-specific fluorescent probe activated by bioconversion [J]. Angewandte Chemie International Edition, 2011, 50(24): 5478-5481.
[5] MIAO F, ZHANG W J, SUN Y M, et al. Novel fluorescent probes for highly selective two-photon imaging of mitochondria in living cells [J]. Biosensors and Bioelectronics, 2014, 55: 423-429.
[6] DIVYA V, SANKAR V, RAGHU K G, et al. A mitochondriaspecific visible-light sensitized europium β-diketonate complex with red emission [J]. Dalton Transactions, 2013, 42(34): 12317-12323.
[7] SENSI S L, TON-THAT D, WEISS J H, et al. A new mitochondrial fluorescent zinc sensor [J]. Cell Calcium, 2003, 34(3): 281-284.
[8] SREENATH K, ALLEN J R, DAVIDSON M W, et al. A FRET-based indicator for imaging mitochondrial zinc ions [J]. Chemical Communications, 2011, 47: 11730-11732.
[9] YOUNGáBAEK N, HOáHEO C, SUáLIM C, et al. A highly sensitive two-photon fluorescent probe for mitochondrial zinc ions in living tissue [J]. Chemical Communications, 2012, 48(38): 4546-4548.
[10] CHEN W D, GONG W T, YE Z Q, et al. FRET-based ratiometric fluorescent probes for selective Fe3+sensing and their applications in mitochondria [J]. Dalton Transactions, 2013, 42(28): 10093-10096.
[11] SHVARTSMAN M, FIBACH E, CABANTCHIK Z. Transferrin-iron routing to the cytosol and mitochondria as studied by live and real-time fluorescence [J]. Biochem. J., 2010, 429: 185-193.
[12] SHVARTSMAN M, CABANTCHIK Z I. Intracellular iron trafficking: role of cytosolic ligands [J]. Biometals, 2012, 25(4): 711-723.
[13] MA Y M, ABBATE V, HIDER R C. Iron-sensitive fluorescent probes: monitoring intracellular iron pools [J]. Metallomics, 2015, 7(2): 212-222.
[14] CABANTCHIK Z I. Labile iron in cells and body fluids: physiology, pathology, and pharmacology [J]. Frontiers in Pharmacology, 2014, 5: 45. doi: 10.3389/fphar. 2014. 00045.
[15] TAKI M, AKAOKA K, MITSUI K, et al. A mitochondria-targeted turn-on fluorescent probe based on a rhodol platform for the detection of copper (Ⅰ) [J]. Organic & Biomolecular Chemistry, 2014, 12(27): 4999-5005.
[16] YUSOP R M, UNCITI-BROCETA A, JOHANSSON E M V, et al. Palladium-mediated intracellular chemistry [J]. Nature, 2011, 3(3): 239-243.
[17] LI H L, FAN J L, PENG X J. Colourimetric and fluorescent probes for the optical detection of palladium ions [J]. Chemical Society Reviews, 2013, 42(19): 7943-7962.
[18] ZHANG S L, FAN J L, ZHANG S Z, et al. Lighting up fluoride ions in cellular mitochondria using a highly selective and sensitive fluorescent probe [J]. Chemical Communications, 2014, 50(90): 14021-14024.
[19] ASHTON T D, JOLLIFFE K A, PFEFFER F M. Luminescent probes for the bioimaging of small anionic species in vitro and in vivo [J]. Chemical Society Reviews, 2015, 44: 4547-4595.
[20] CHEN X Q, TIAN X Z, SHIN I, et al. Fluorescent and luminescent probes for detection of reactive oxygen and nitrogen species [J]. Chemical Society Reviews, 2011, 40(9): 4783-4804.
[21] ALBERS A E, OKREGLAK V S, CHANG C J. A FRET-based approach to ratiometric fluorescence detection of hydrogen peroxide [J]. Journal of the American Chemical Society, 2006, 128(30): 9640-9641.
[22] KOIDE Y, URANO Y, KENMOKU S, et al. Design and synthesis of fluorescent probes for selective detection of highly reactive oxygen species in mitochondria of living cells [J]. Journal of the American Chemical Society, 2007, 129(34): 10324-10325.
[23] SHIOJI K, OYAMA Y, OKUMA K, et al. Synthesis and properties of fluorescence probe for detection of peroxides in mitochondria [J]. Bioorganic & Medicinal Chemistry Letters, 2010, 20(13): 3911-3915.
[24] ROBINSON K M, JANES M S, PEHAR M, et al. Selective fluorescent imaging of superoxide in vivo using ethidium-based probes [J]. Proceedings of the National Academy of Sciences, 2006, 103(41): 15038-15043.
[25] HU Q L, GAO M, FENG G X, et al. Mitochondria-targeted cancer therapy using a light-up probe with aggregation-induced-emission characteristics [J]. Angewandte Chemie International Edition, 2014, 53(51): 14225-14229.
[26] CHENG G H, FAN J L, SUN W, et al. A highly specific BODIPY-based probe localized in mitochondria for HClO imaging [J]. Analyst, 2013, 138(20): 6091-6096.
[27] HOU J T, WU M Y, LI K, et al. Mitochondria-targeted colorimetric and fluorescent probes for hypochlorite and their applications for in vivo imaging [J]. Chemical Communications, 2014, 50(63): 8640-8643.
[28] ZHANG H X, LIU J, SUN Y Q, et al. A mitochondria-targetable fluorescent probe for peroxynitrite: fast response and high selectivity[J]. Chemical Communications, 2015, 51(28): 2721-2724.
[29] CHEN Y C, ZHU C C, YANG Z H, et al. A ratiometric fluorescent probe for rapid detection of hydrogen sulfide in mitochondria [J]. Angewandte Chemie, 2013, 125(6): 1732-1735.
[30] GUO Z Q, PARK S, YOON J, et al. Recent progress in the development of near-infrared fluorescent probes for bioimaging applications [J]. Chemical Society Reviews, 2014, 43(1): 16-29.
[31] LEE M H, HAN J H, LEE J, et al. Mitochondrial thioredoxin-responding off-on fluorescent probe [J]. Journal of the American Chemical Society, 2012, 134(41): 17314-17319.
[32] LEE M H, JEON H M, HAN J H, et al. Toward a chemical marker for inflammatory disease: a fluorescent probe for membrane-localized thioredoxin [J]. Journal of the American Chemical Society, 2014, 136(23): 8430-8473.
[33] LEE M H, KIM J Y, HAN J H, et al. Direct fluorescence monitoring of the delivery and cellular uptake of a cancer-targeted RGD peptide-appended naphthalimide theragnostic prodrug [J]. Journal of the American Chemical Society, 2012, 134(30): 12668-12674.
[34] LEE M H, HAN J H, KWON P, et al. Hepatocyte-targeting single galactose-appended naphthalimide: a tool for intracellular thiol imaging in vivo [J]. Journal of the American Chemical Society, 2012, 134(2): 1316-1322.
[35] LIM S, HONG K, KIM D I, et al. Tunable heptamethine-azo probe conjugate as an NIR fluorescent probe for the selective detection of mitochondrial glutathione over cysteine and homocysteine [J]. Journal of the American Chemical Society, 2014, 136(19): 7018-7025.
[36] HORINOUCHI T, NAKAGAWA H, SUZUKI T, et al. Photoinduced nitric oxide release from a nitrobenzene derivative in mitochondria [J]. Chemistry-A European Journal, 2011, 17(17): 4809-4813.
[37] HORINOUCHI T, NAKAGAWA H, SUZUKI T, et al. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide [J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(7): 2000-2002.
[38] LEE M H, PARK N, YI C, et al. Mitochondria-immobilized pH-sensitive off-on fluorescent probe [J]. Journal of the American Chemical Society, 2014, 136(40): 14136-14142.
[39] LI P, XIAO H B, CHENG Y F, et al. A near-infrared-emitting fluorescent probe for monitoring mitochondrial pH [J]. Chem. Commun., 2014, 50(54): 7184-7187.
[40] WU M Y, LI K, LIU Y H, et al. Mitochondria-targeted ratiometric fluorescent probe for real time monitoring of pH in living cells [J]. Biomaterials, 2015, 53: 669-678.
[41] STUTTS M J, CANESSA C M, OLSEN J C, et al. CFTR as a cAMP-dependent regulator of sodium channels [J]. Science, 1995, 269(5225): 847-850.
[42] LUBY-PHELPS K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area [J]. International Review of Cytology, 1999, 192: 189-221.
[43] ALEARDI A M, BENARD G, AUGEREAU O, et al. Gradual alteration of mitochondrial structure and function by β-amyloids: importance of membrane viscosity changes, energy deprivation, reactive oxygen species production, and cytochrome c release [J]. Journal of Bioenergetics and Biomembranes, 2005, 37(4): 207-225.
[44] YANG Z Q, HE Y X, LEE J H, et al. A self-calibrating bipartite viscosity sensor for mitochondria [J]. Journal of the American Chemical Society, 2013, 135(24): 9181-9185.
[45] LIU F, WU T, CAO J F, et al. Ratiometric detection of viscosity using a two-photon fluorescent sensor [J]. Chemistry-A European Journal, 2013, 19(5): 1548-1553.
[46] JIANG N, FAN J L, ZHANG S, et al. Dual mode monitoring probe for mitochondrial viscosity in single cell [J]. Sensors and Actuators B: Chemical, 2014, 190: 685-693.
[47] ZHUANG Y D, CHIANG P Y, WANG C W, et al. Environmentsensitive fluorescent turn-on probes targeting hydrophobic ligandbinding domains for selective protein detection [J]. Angewandte Chemie International Edition, 2013, 52(31): 8124-8128.
[48] BERNS M W, KRASIEVA T, SUN C, et al. A polarity dependent fluorescence “switch” in live cells [J]. Journal of Photochemistry and Photobiology B: Biology, 2004, 75(1): 51-56.
[49] HUANG L, TAM-CHANG S. N-(2-(N′,N′-diethylamino) ethyl) perylene-3, 4-dicarboximide and its quaternized derivatives as fluorescence probes of acid, temperature, and solvent polarity [J]. Journal of Fluorescence, 2011, 21(1): 213-222.
[50] SZCZUPAK B, RYDER A G, TOGASHI D M, et al. Polarity assessment of thermoresponsive poly (NIPAM-co-NtBA) copolymer films using fluorescence methods [J]. Journal of Fluorescence, 2010, 20(3): 719-731.
[51] SUPPAN P. Solvent effects on the energy of electronic transitions: experimental observations and applications to structural problems of excited molecules [J]. Journal of the Chemical Society A: Inorganic, Physical, Theoretical, 1968: 3125-3133.
[52] WANG L, XIAO Y, TIAN W M, et al. Activatable rotor for quantifying lysosomal viscosity in living cells [J]. Journal of the American Chemical Society, 2013, 135(8): 2903-2906.
[53] KUIMOVA M K, BALAZ M, ANDERSON H L, et al. Intramolecular rotation in a porphyrin dimer controls singlet oxygen production [J]. Journal of the American Chemical Society, 2009, 131(23): 7948-7949.
[54] KOIDE Y, URANO Y, KENMOKU S, et al. Design and synthesis of fluorescent probes for selective detection of highly reactive oxygen species in mitochondria of living cells [J]. Journal of the American Chemical Society, 2007, 129(34): 10324-10325.
[55] CHALMERS S, CALDWELL S T, QUIN C, et al. Selective uncoupling of individual mitochondria within a cell using a mitochondria-targeted photoactivated protonophore [J]. Journal of the American Chemical Society, 2011, 134(2): 758-761.
[56] LANDES T, MARTINOU J. Mitochondrial outer membrane permeabilization during apoptosis: the role of mitochondrial fission [J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2011, 1813(4): 540-545.
[57] YOUSIF L F, STEWART K M, KELLEY S O. Targeting mitochondria with organelle-specific compounds: strategies and applications [J]. ChemBioChem, 2009, 10(12): 1939-1950.
[58] MUSRATI R A, KOLLAROVA M, MERNIK N, et al. Malate dehydrogenase: distribution, function and properties [J]. General Physiology and Biophysics, 1998, 17: 193-210.
[59] JIANG N, FAN J L, XU F, et al. Ratiometric fluorescence imaging of cellular polarity: decrease in mitochondrial polarity in cancer cells [J]. Angewandte Chemie International Edition, 2015, 54(8): 2510-2514.
Foundation item: supported by the National Natural Science Foundation of China (21136002, 21422601, 21421005), the National Basic Research Program of China (2013CB733702), Ministry of Education (NCET-12-0080) and the Natural Science Foundation of Liaoning Province (2013020115).
Progress in research of mitochondrial fluorescence probes
JIANG Na1, 2, FAN Jiangli1, YANG Hongbao1, PENG Xiaojun1
(1State Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian 116024, Liaoning, China;2School of Chemistry and Chemical Engineering, University of Jinan, Jinan 250022, China)
Abstract:The researches on organelles are important ways to study the structure and function of cells. Mitochondria, the principal energy-producing compartments in most cells, play roles in the numerous vital cellular processes. Thus, the organelles are crucially involved in various pathologies. As one of the most important cellular organelles, mitochondria are always the focus of researches. There are three kinds of mitochondrial fluorescence probes. This paper mainly introduces and discusses the progresses of mitochondrial staining kind of fluorescent probes in recent 10 years on the basis of the fluorophore with positive charge or the introduction of positioning groups such as triphenylphosphine.
Key words:fluorescence; probe; mitochondria; cell biology; biotechnology; imaging
Corresponding author:Prof. PENG Xiaojun, pengxj@dlut.edu.cn
基金項目:國家自然科學基金項目(21136002,21422601,21421005);國家重點基礎研究發展計劃項目(2013CB733702);教育部新世紀優秀人才支持計劃(NCET-12-0080);遼寧省自然科學基金項目(2013020115)。
中圖分類號:TQ 618.5
文獻標志碼:A
文章編號:0438—1157(2016)01—0176—15
DOI:10.11949/j.issn.0438-1157.20151007

