新疆薰衣草C-197優選優株快繁體系的建立及快繁
廖 晴 ,龔松旺 ,瑪爾哈巴·吾斯滿 ,沙 紅 ,高 燕
(1.新疆農業科學院園藝作物研究所,烏魯木齊 830091;2.新疆霍城縣農業技術推廣站,新疆霍城 835200)
?
新疆薰衣草C-197優選優株快繁體系的建立及快繁
廖 晴1,龔松旺2,瑪爾哈巴·吾斯滿1,沙 紅1,高 燕1
(1.新疆農業科學院園藝作物研究所,烏魯木齊 830091;2.新疆霍城縣農業技術推廣站,新疆霍城835200)
摘要:【目的】選擇新疆薰衣草主栽品種C-197優選優株,并建立快繁體系,研究新疆薰衣草種質資源提純技術的有效途徑,為提高新疆薰衣草產量及質量提供技術支撐。【方法】采用新疆薰衣草C-197優選優株作為外植體材料,進行無菌苗誘導,在培養基中加入不同激素及不同濃度的激素進行叢生苗和生根的誘導,建立其快繁體系。運用快繁體系獲得大量優質新疆薰衣草C-197種苗。【結果】在選取薰衣草外植體誘導時,選用優選優株莖段或莖尖作外植體進行無菌苗誘導,誘導培養基為:MS+BA1.0 mg/L;繼代培養基為:MS+BA1.0 mg/L+IBA0.3 mg/L;生根培養基為:1/2MS+NAA0.5~1.0 mg/L【結論】新疆薰衣草C-197的優選優株快繁體系的建立,提純了薰衣草C-197的品種,可大量快繁C-197優質種苗。
關鍵詞:新疆薰衣草;誘導;激素;快繁
0引 言
【研究意義】薰衣草是新疆特色經濟花卉之一。據統計,我國每年消耗薰衣草精油70 t左右,其中2/3是新疆生產的,目前我國對薰衣草精油需求量以每年15%以上遞增。我國薰衣草雖有幾十年的栽培歷史,栽培技術已相對完善,但栽培品種卻嚴重退化混雜,生產量及質量在逐年下降,需要對薰衣草種質資源的優化。薰衣草是異花授粉植物,該群體異質性復雜,選擇優良個體進行常規繁殖,優良性狀是很難穩定遺傳的。為獲得較穩定的純合后代和保證選擇效果,對新疆主栽品種C-197進行種質的提純和優化,選擇C-197優選優株進行組培快繁試驗,建立快繁體系,為薰衣草種質創新奠定堅實的基礎。【前人研究進展】國外對薰衣草育種一直都很重視,除傳統的系統育種外,還進行基因工程和多倍體育種研究。但我國對薰衣草的育種及優良品種的繁殖技術研究開展甚少。尤其在新疆受經濟條件的制約,育種及優質種苗生產嚴重滯后,極大地限制了精油生產的深層次發展。針對目前新疆薰衣草產業亟待解決的種質混雜問題,通過生物技術手段-組培快繁技術,快速進行種質的提純和優化,為優質種苗的大量生產提供可靠的技術支撐。【本研究切入點】目前對新疆薰衣草C-197進行優選優株的選擇并進行快繁體系的建立研究未見報道。針對目前新疆薰衣草產業亟待解決的種質混雜問題,通過先進的生物技術手段-組培快繁技術,快速進行種質的提純和優化,為優質種苗的大量生產提供可靠的技術支撐。【擬解決的關鍵問題】通過優選優株的組培快繁,提純薰衣草品種的種質,在良好的種質基礎上,通過誘導多倍體進行種質創新,擬解決目前新疆薰衣草產業中栽培品種嚴重退化混雜,生產量及質量在逐年下降的問題。
1材料與方法
1.1 材 料
以新疆薰衣草主栽品種C-197為試材,選取優選優株的莖段或莖尖做外植體。
1.2 方 法
1.2.1取C-197優選優株當年新發枝條的嫩莖部分,剪取7~10個節位,表面清洗干凈后,再進行滅菌處理,消毒時間設5、7、10 min三個處理,將消毒好的材料剪成莖尖和莖段,各接10瓶,每瓶接4個外植體,接種在MS+BA 1.0 mg/L誘導培養基中,每天光照12 h,光照強度為1 600~2 000 lx,培養溫度24~28℃,接種15 d后統計污染率。
1.2.2將外植體誘導出的無菌苗,剪切成3 cm的莖段,接種于MS培養基,添加不同水平的BA(0、0.5、1.0、1.5、2.0 mg/L)和MS+BA 1.0 mg/L加不同水平的IBA(0、0.1、0.3、0.5、1.0 mg/L)中,共10個處理,每瓶5株,設5個重復。每天光照12 h,光照強度為1 600~2 000 lx,培養溫度24~28℃,接種30 d后統計增殖率。
1.2.3將增值后的試管苗,剪切成3 cm莖段,接種于1/2MS培養基,添加不同水平NAA(0、0.1、0.5、1.0、1.5 mg/L)和不同水平IAA(0、0.1、0.5、1.0、1.5 mg/L)及CCC(0、0.1、0.5、1.0、1.5 mg/L)組合,共15個處理,每瓶5株,設5個重復。每天光照12 h,光照強度為3 000~5 000 lx,培養溫度24~28℃,接種25 d后統計生根率。
1.2.4將生根小植株洗去根部附著的殘留培養基,移栽到4種不同基質(泥炭、泥炭與珍珠巖1∶1混合、蛭石、珍珠巖)中,每處理100株,待20~25 d后逐漸撤去薄膜,種苗正常管理并統計成活率。
2 結果與分析
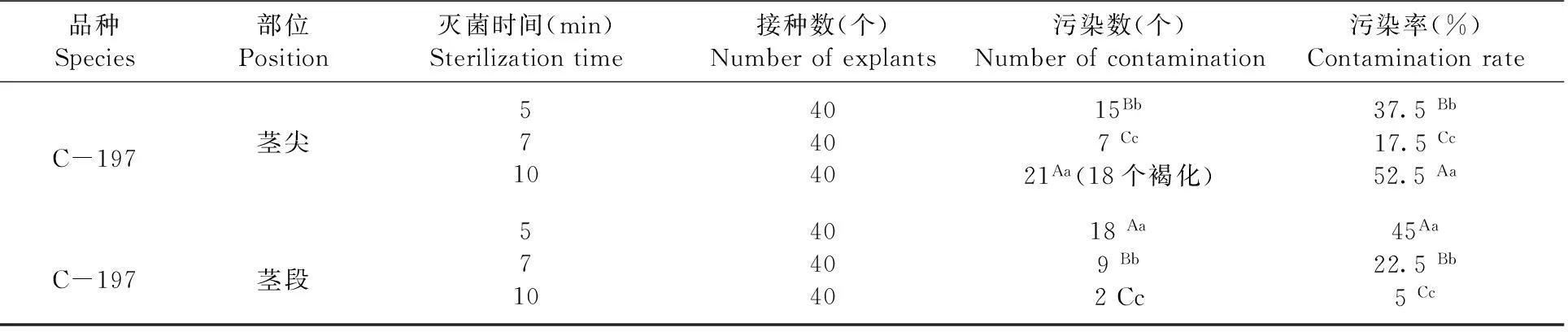
2.1 外植體的滅菌效果
外植體無菌苗誘導15 d后,調查污染率。研究表明,不同滅菌時間對不同部位的滅菌效果有差異,莖尖滅菌7 min與滅菌10 min比較差異極顯著,與滅菌5 min比較差異顯著,莖尖滅菌7 min,污染率為17.5%;而莖段滅菌時間10 min與5 min比較差異極顯著,與滅菌7 min比較差異顯著,莖段滅菌10 min,污染率僅為5%。莖尖滅菌時間為7 min、莖段滅菌時間為10 min為宜。表1
表1不同時間對不同部位外植體滅菌效果
Table 1Effect of sterilizing on different parts of the explants
品種Species部位Position滅菌時間(min)Sterilizationtime接種數(個)Numberofexplants污染數(個)Numberofcontamination污染率(%)ContaminationrateC-197莖尖571040404015Bb7Cc21Aa(18個褐化)37.5Bb17.5Cc52.5AaC-197莖段571040404018Aa9Bb2Cc45Aa22.5Bb5Cc
2.2 不同激素種類和濃度梯度配比對不定芽增殖的影響
將無菌苗的莖段,接種于附加有不同激素種類和濃度梯度的MS培養基中,培養30 d后統計分化總芽數、新稍平均長度、莖平均粗度、愈傷平均直徑、增值率。
研究表明,增殖培養基中添加的BA與IBA水平不同,芽的增殖率與長勢存在著差異。在單因子試驗中與對照比較,不定芽增殖率以添加BA 1.0、1.5 mg/L差異極顯著;在多因子試驗中與對照比較,BA 1.0 mg/L+IBA 0.3 mg/L差異極顯著;對這三種配方的其它指標綜合,以BA 1.0 mg/L+IBA 0.3 mg/L配方為最優,與單因子配方比較,其愈傷平均直徑及新稍平均長度差異不顯著,莖平均粗度差異顯著,說明該配方愈傷組織小,叢芽壯,增殖效果更好。表2
表2不同激素濃度梯度配比下C-197不定芽增殖變化
Table 2Effect of C-197′s proliferation of adventitious on the different concentrations of hormones

培養基(mg/L)Medium接種數Numberofexplants(個)分化芽總數Budsdifferentiatednumber(個)不定芽的增殖率Theincrementrateofadventitiousbud(%)新梢平均長度Averagelengthofnewshoots(cm)莖平均粗度Averagethicknesofstems(cm)愈傷平均直徑AverageDiameterofcallus(cm)MS(CK)MS+BA0.5MS+BA1.0MS+BA1.5MS+BA2.05555510Cc17Bb28Aa28Aa27Aa100Dd240Cc460Aa460Aa440Bb28.698Cd35.191ABb33.064Bc36.378Aa34.567Bbc0.515Dd0.526Cc0.542Bb0.515Dd0.611Aa2.667Dd1.798Cc3.350Bb4.884Aa3.130BbMS+BA1.0(CK)MS+BA1.0+IBA0.1MS+BA1.0+IBA0.3MS+BA1.0+IBA0.5MS+BA1.0+IBA1.05555528Cc36Bb42Aa25Cc21Dd460Cc620Bb740Aa400Dd320Ee33.064Aa27.116Bc21.678Cd29.023Bb22.760Cd0.542Bc0.611Aa0.570Bb0.510Cd0.484Cd3.350Aa2.856Cc1.964Dd3.104Bb1.902Dd
2.3 不同激素濃度梯度對試管苗生根的影響
將增值后的試管苗,剪切成3 cm的莖段,接種于附加有不同激素濃度梯度的1/2MS培養基中,接種20 d后統計生根總數、新稍長度、莖粗及根長度。
研究表明,在1/2MS培養基中添加不同濃度的NAA對生根質量有一定的差異。添加NAA 1.0 mg/L時,除了新梢平均長度與對照相比差異不顯著外,其它幾項指標均為極顯著。實際工作中,根太粗、太長都不利于移栽,因而以添加NAA 0.5 mg/L較適宜。單獨添加CCC也能生根,但除添加CCC 1.5 mg/L時差異顯著外,其他處理差異均不顯著。添加IAA 0.5~1.0 mg/L雖對薰衣草的枝條生長差異顯著,但不能誘導生根。因此,在薰衣草不定根誘導培養中,1/2MS培養基中添加NAA 0.5~1.0 mg/L生根效果好。表3
表3不同激素濃度梯度下C-197試管苗生根變化
Table 3Effect of C-197′s rooting on different concentrations of hormones.

培養基(mg/L)Medium接種數Numberofexplants(個)生根總數Roottotal(條)新梢平均長度Averagelengthofnewshoots(cm)莖平均粗度Averagethicknesofstems(cm)根平均數Averagenumberofroot(條)根平均長度Averagelengthofroot(cm)1/2MS(CK)1/2MS+NAA0.11/2MS+NAA0.51/2MS+NAA1.01/2MS+NAA1.5555558Dd14Cc19Bb27Aa17Bb28.698Dd35.852Cc43.164Bb34.312Cc49.061Aa0.515De0.779Bb0.716Cc0.920Aa0.634Cd2.70Dd3.50Cc6.30Bb6.75Aa3.40Cc1.410Cd2.291Bc2.717Ab2.847Aa2.917Aa1/2MS+CCC0.11/2MS+CCC0.51/2MS+CCC1.01/2MS+CCC1.555555Bb1Cc2BCc11Aa42.066Cc38.998Cd62.805Aa52.143Bb0.619Bb0.705Aa0.595Bb0.685Aa1.0Bb0.2Cc0.4Cc2.2Aa0.94Cd1.20Bc1.50Aa1.31Bb1/2MS+IAA0.11/2MS+IAA0.51/2MS+IAA1.01/2MS+IAA1.55555無無無無31.621Bb38.476Aa39.058Aa40.635Aa0.498Bb0.649Aa0.650Aa0.438Bc無無無無無無無無
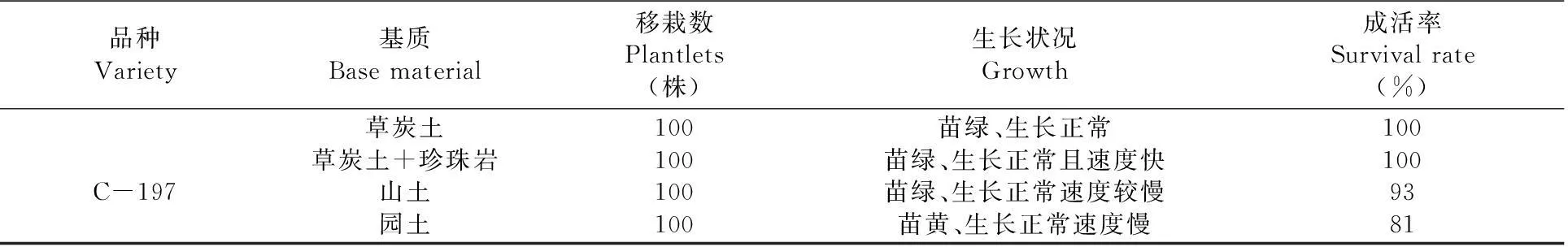
2.4 不同基質對薰衣草C-197移栽成活率的影響
將生根的小植株洗去根部附著的殘留培養基,移栽在不同的基質(泥炭、泥炭與珍珠巖1∶1混合、蛭石、珍珠巖)中,移栽30 d后統計成活率。
在園土中試管苗移栽成活率較低,雖然能正常生長,但苗黃;在山土中試管苗移栽成活率較高,生長正常,但速度較慢;在進口草炭土中試管苗移栽成活率為100%;在草炭土+珍珠巖中試管苗移栽成活率高,苗生長速度快,比純草炭土中要快。用草炭土+珍珠巖移栽是最理想的。表4
表4不同基質下C-197試管苗移栽成活率變化
Table 4 Effect of C-197′s transplanting plantlets from culture vessel on different base materials
品種Variety基質Basematerial移栽數Plantlets(株)生長狀況Growth成活率Survivalrate(%)C-197草炭土草炭土+珍珠巖山土園土100100100100苗綠、生長正常苗綠、生長正常且速度快苗綠、生長正常速度較慢苗黃、生長正常速度慢1001009381
3討 論
3.1在選擇外植體誘導時,取植株的什么部位進行誘導是誘導快慢、成否的決定因素之一,通過對薰衣草C-197不同部位的外植體誘導試驗,發現不同部位滅菌效果有一定的差異:莖尖誘導不定芽速度最快,但滅菌時間不好掌握,時間短消毒不徹底,時間稍長又會使幼嫩的組織被破壞產生褐化,對莖尖滅菌時間為7 min效果較好,污染率為17.5%,滅菌時間到10 min左右,易將幼嫩的組織破壞產生褐化而死亡,污染率高達52.5%;而對莖段滅菌時間為10 min效果較好,污染率最低為5%,滅菌5 min,消毒不徹底,污染率37.5%以上。用幼嫩的莖段作外植體誘導比較好。
3.2在增殖培養中,培養基中添加的BA與IBA水平不同,芽的增殖率與長勢存在顯著差異。增殖率與BA濃度密切相關,在試驗濃度范圍內,增殖率先隨BA濃度的升高呈升高趨勢,但BA濃度過高時,增殖率有所下降,且芽的長勢減弱。后續試驗表明,BA濃度大于2.0 mg/L時,隨繼代次數增加,不定芽易出現玻璃化現象,不利于后期成苗。當BA濃度為1.5 mg/L時雖然分化率、生長高度比BA濃度為1.0 mg/L時高或相當,但其莖的粗度較小、愈傷較大,BA濃度為1.0 mg/L時增殖效果為最優;增殖率與IBA濃度亦表現出一定的相關性,同時添加BA 1.0 mg/L和IBA的梯度試驗中,試驗濃度范圍內,當IBA濃度為0.3 mg/L時增殖率最高,且愈傷小,叢芽壯。因此,薰衣草不定芽增殖培養中,在MS培養基中同時添加BA 1.0 mg/L和IBA 0.3 mg/L增殖效果好。
3.3不同激素及濃度梯度對試管苗生根的影響是不同的,在不添加激素時,C-197也可以生根,但根的質量差,添加NAA有利于根的誘導,隨著添加NAA的濃度升高,試管苗分化出的根條數也隨之增多、增長,但NAA濃度過高時,生根率有所下降,且根的長勢減弱,雖然在添加NAA 1.0 mg/L時,比起添加NAA 0.5 mg/L的各項根生長指標更優,但根粗易斷,根長影響移栽,添加NAA 0.5 mg/L更好一些;只添加CCC雖也能生根,在試驗濃度范圍內生根率比添加NAA的低;只添加IAA是不能誘導薰衣草生根的。因此,在薰衣草不定根誘導培養中,1/2MS培養基中添加NAA 0.5~1.0 mg/L生根效果好。另外,在薰衣草生根試驗中,發現單枝不如3~5枝一叢的生根容易,這可能與枝條的幼嫩程度有關。
3.4在園土中試管苗移栽成活率較低,雖然能正常生長,但苗黃,可能與土的粘重有關,也有可能是缺素的原因或有機質含量低的問題,需進一步研究;在山土中試管苗移栽成活率較高,生長正常,但速度較慢;在草炭土中試管苗移栽成活率為100%;在草炭土+珍珠巖中試管苗移栽成活率高,苗生長速度快,比純草炭土中要快。用草炭土+珍珠巖移栽是比較理想的,但由于進口草炭土價格昂貴,因而,在考慮生產成本時,用山土最為適宜。
4結 論
新疆薰衣草C-197的優選優株快繁體系的建立,提純了薰衣草C-197的品種,從而可大量快繁出C-197的優質種苗,通過該方法可解決目前新疆薰衣草產業中栽培品種嚴重退化混雜,生產量及質量在逐年下降的問題。選用優選優株的莖段作外植體進行無菌苗誘導時,莖尖滅菌時間為7 min、莖段滅菌時間為10 min為宜;誘導培養基為:MS+BA 1.0 mg/L;繼代培養基為:MS+BA 1.0 mg/L+IBA 0.3 mg/L;生根培養基為:1/2MS+NAA 0.5~1.0 mg/L。
參考文獻(References)
[1]孫會兵,孫永竹,劉心力.矮壯素對孟士德薰衣草組培苗的影響[J].山西農業科學,2011,39(11):1 141-1 142,1 145.
SUN Hui- bing, SUN Yong- zhu, LIU Xin-li. (2011). Effect of CCC on Tissue Culture Seedling of L. angustifolia Munstead [J].JournalofShanxiAgriculturalSciences, 39(11): 1,141- 1,142 ,1,145. (in Chinese)
[2]戴麗娜,于志鵬,呂國華,等.薰衣草玻璃化組培苗逆轉技術研究[J].新疆農業科學,2012,49(11):2 054-2 061
DAI Li-na, YU Zhi-peng, LV Guo-hua, et al. (2012).The Study on Reversal Technique of Vitreous Tissue culturing Plantlets of Lavender [J].XinjiangAgriculturalSciences, 49(11): 2,054-2,061. (in Chinese)
[3]蘇琛.薰衣草離體培養技術研究[J].湖北農業科學,2012,51(3):623-625.
SU Chen. (2012). Study on in vitro Cultivation of Lavandula angustifolia [J].HubeiAgricuhuralSciences, 51(3): 623-625. (in Chinese)
[4]江明,夏凱國,易清元.薰衣草的育種研究進展[J].香料香精化妝品,2009,8(4):30-32.
JIANG Ming, XIAKai-guo, YI Qing-yuan. (2009). The Study on Development of Breeding of Lavender [J].FlavourFragranceCosmetics, 8(4): 30-32. (in Chinese)
[5] Urwin, N. A. R., Horsnell, J., & Moon, T. (2007). Generation and characterisation of colchicine-induced autotetraploid lavandula angustifolia.Euphytica, 156(1-2):257-266.
[6] Tsuro, M., Koda, M., & Inoue, M. (1999). Comparative effect of different types of cytokinin for shoot formation and plant regeneration in leaf-derived callus of lavender (lavandula vera dc).ScientiaHorticulturae,81(3): 331-336.
[7] Sudria CPinol, M. T., Palazon, J., Cusido, R. M., Vila, R., Morales, C., & Bonfill, M., et al. (1999). Influence of plant growth regulators on the growth and essential oil content of cultured lavandula dentata plantlets..PlantCellTissue&OrganCulture, 58(3):177-184.
[8]劉珊,陳全家,蘇秀娟,等.英國薰衣草愈傷再生體系的建立[J].新疆農業科學,2010,47(1):73-77.
LIU Shan, CHEN Quan-jia, SU Xiu-juan, et al.(2010). Establishment of Callus Regeneration System of English Lavender [J].XinjiangAgriculturalSciences,47(1): 73-77. (in Chinese)
[9] Tsuro, M., Koda, M., & Inoue, M. (2000). Efficient plant regeneration from multiple shoots formed in the leaf-derived callus of lavandula vera, using the "open culture system".ScientiaHorticulturae, 86(1):81-88.
[10]謝翠蘋,倪孟羽,胡千云,等.薰衣草繁殖技術研究[J].北方園藝,2012,(18):110-111.
XIE Cui-ping, NI Meng-yu, HU Qian-yun, et al. (2012). Research on Breeding Technology of Lavandula angustifol [J].NorthernHorticulture, (18):110-111. (in Chinese)
[11] Andrade, L. B., Echeverrigaray, S., Fracaro, F., Pauletti, G. F., & Rota, L. (1999). The effect of growth regulators on shoot propagation and rooting of common lavender (lavandula vera dc).PlantCellTissue&OrganCulture, 56(2):79-83.
[12]王佳佳,鄭鳳英,王康,等.新西蘭薰衣草快速繁殖技術的研究[J].北方園藝,2010,(12):161-163.
WANG Jia-jia, ZHENG Feng-ying, WANG Kang, et al. (2010).The Technology of Rapid Propagation of New Zealand Lavender [J].NorthernHorticulture, (12): 161-163. (in Chinese)
[13]路結,王樸 ,蔣新明,等.新疆不同品種的薰衣草精油成分及含量研究[J].安徽農業科學,2013,41(4):1 736-1 737,1 739.
LU Zhe, WANG Pu, JIANG xin-ming, et al.(2013). Study on Composition and Content of Essential oil from Three Lavender Varieties in Xinjiang [J].JournalofAnhuiAgriculturalScience, 41(4):1,736-1,737 ,1,739. (in Chinese)
[14]王嬋,陳麗娟,程明華,等.狹葉薰衣草離體培養技術研究[J].海南師范大學學報(自然科學版),2012,25(4):435-437,469.
WANG Chan, CHEN Li-juan, CHENG Ming-hua, et al.(2012). Study on in Vitro Cultivation of Lavandula angustifol [J].JournalofHainanNormalUniversity(NaturalScienceEdition), 25(4):435-437 ,469.(in Chinese)
[15] Teuscher, E., Bauermann, U., Werner, M., Brinckmann, J. A., Lindenmaier, M. P., & Duke, J. A. (2005). Medicinal spices : a handbook of culinary herbs, spices, spice mixtures and their essential oils.Medpharm, CRC Press.
Fund project:Supported the Basic Science and Technology Research Support Funds of Non-profit Research Institutions of Xinjiang Uygur Autonomous Region (KY2014033)
The Establishment of the Fast Propagation System and Rapid
Propagation for the Optimal Strains of C-197 Xinjiang Lavender
LIAO Qing1, GONG Song-wang2, Marbaha Wsman1, SHA Hong1, GAO Yan1
(1.ResearchInstituteofHorticulturalCrops,XinjiangacademyofAgriculturalSciences,Urumgi830091,China: 2.HuochengCountyAgriculturalTechnologyExtensionStation,HuochengXinjiang835200,China)
Abstract:【Objective】 To explore the effective way to purify Xinjiang lavender germplasm resources and establish rapid propagation system in the hope of providing reliable technical support to improve the quality of Xinjiang lavender production through choosing optimal strain of C-197, a major cultivation variety in Xinjiang. 【Method】 The optimal strain of C-197 was used as primal explant, then buds and roots were induced into different medium with different hormones and different concentrations were applied to establish rapid propagation system. A large number of high-quality C -197 plants were quickly got using the rapid propagation system. 【Result】 During selecting lavender explant induction, stem segments and stem tip of optimal plant as explant, adventitious buds induction medium was: MS+BA 1.0 mg/L; subculture medium was: MS + BA 1.0 mg/L + IBA 0.3 mg/L; root induction medium was: 1/2MS+NAA 0.5-1.0 mg/L. 【Conclusion】 Through the establishment of rapid propagation system, C -197 variety was purified and a large number of high-quality C-197 plants were got.
Key words:Xinjiang lavender; induction; hormones; rapid propagation
作者簡介:廖晴(1962-),女,四川安岳人,副研究員,研究方向為花卉引、種、繁及植物組培快繁,(E-mail)lq08270029@sina.com
基金項目:新疆維吾爾自治區公益性科研項目(KY2014033)
收稿日期:2015-09-04
中圖分類號:S68
文獻標識碼:A
文章編號:1001-4330(2016)02-0289-06
doi:10.6048/j.issn.1001-4330.2016.02.014

