阻塞性睡眠呼吸暫停患者外周血內皮祖細胞及促血管生成因子水平研究
薛艷超,孫蓓,王新,馮靖△,曹潔△
?
阻塞性睡眠呼吸暫停患者外周血內皮祖細胞及促血管生成因子水平研究
薛艷超1,孫蓓2,王新1,馮靖1△,曹潔1△
摘要:目的觀察阻塞性睡眠呼吸暫停(OSA)患者外周血內皮祖細胞(EPC)不同亞族和促血管生成因子水平的變化,探討不同程度OSA患者外周血EPC對血管修復的可能性。方法選取90例OSA患者和30例健康志愿者(對照組),根據睡眠呼吸暫停低通氣指數(AHI)將90例OSA患者均分為輕、中、重度OSA組。密度梯度離心法提取單個核細胞,依據乙醛脫氫酶(ALDH)活性對EPC進行分選,流式細胞儀聯合CD133、CD34、含激酶域插入片段受體(PE-KDR)相應細胞表面標志物測定CD133+KDR+EPC及CD133+CD34+EPC、CD34+KDR+EPC、ALDHloCD34+KDR+EPC的水平。酶聯免疫吸附試驗(ELISA)測定患者外周血低氧誘導因子-1α(HIF-1α),血管內皮生長因子(VEGF)及基質細胞衍生因子-1α(SDF-1α)的水平。結果對于外周血CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平,重度OSA組>中度OSA組>輕度OSA組>對照組(均P < 0.05);輕、中度OSA組的外周血ALDHloCD34+KDR+EPC水平高于對照組,重度OSA組低于其他3組(均P < 0.05);血清HIF-1α、VEGF均是重度OSA組>中度OSA組>輕度OSA組>對照組,SDF-1α水平為重度OSA組<中度OSA組<輕度OSA組<對照組(均P < 0.05)。結論OSA患者可能都會誘導動員并招募大量無效EPC,其數量龐大,但直接參與修復內皮的ALDHloCD34+KDR+EPC并未增加,尤其對于重度OSA患者甚至有可能減少,OSA減弱了修復內皮的可能性,加重了內皮損傷,從而增加心血管事件的發生風險。
關鍵詞:阻塞性睡眠呼吸暫停;低氧誘導因子-1α;基質細胞衍生因子-1α;血管內皮細胞生長因子;間歇低氧;內皮祖細胞;乙醛脫氫酶
間歇低氧(IH)是阻塞性睡眠呼吸暫停(OSA)的2個病理生理特征之一。OSA是眾多心血管疾病的獨立危險因素,OSA并發心血管疾病的主要病理生理機制是內皮損傷和功能障礙[1]。研究表明IH激活低氧誘導因子-1α(HIF-1α),誘導血管內皮細胞生長因子(VEGF)、基質細胞衍生因子-1α (SDF-1α)等血管活性物質合成的增加,進而動員并招募內皮祖細胞(EPC)參與受損血管的修復及重建[2]。最近研究發現,依據乙醛脫氫酶(ALDH)的活性可有效分選出功能性EPC,即直接參與修復內皮的EPC為低ALDH活性內皮祖細胞(ALDHloCD34+KDR+EPC)[3]。OSA患者內皮功能的維持與穩定取決于內皮損傷與EPC修復能力間的動態平衡。目前以OSA患者作為研究對象,通過測定AL?DHloCD34+KDR+EPC數量的變化來探討受損血管修復能力的相關研究甚少。因此,本研究通過測定OSA患者外周血HIF-1α、SDF-1α、VEGF和EPC不同亞族的水平,探討不同程度OSA患者外周血EPC對血管修復的可能性。
1 對象與方法
1.1研究對象納入2013年12月—2014年12月于我科睡眠呼吸診療中心經多導睡眠監測儀(PSG)診斷為OSA的患者90例,年齡40~79歲。根據呼吸暫停低通氣指數(apneahypopnea index, AHI)分為輕度OSA組(5次/h≤AHI<15次/h) 30例,男25例,女5例,年齡(54.3±11.1)歲;中度OSA組(15 次/h≤AHI<30次/h)30例,男25例,女5例,年齡(52.3±12.0)歲;重度OSA組(AHI≥30次/h)30例,男26例,女4例,年齡(52.9±11.6)歲。同期納入年齡、性別相匹配的30名健康志愿者(AHI<5次/h)作為對照組,其中男24例,女6例,年齡(51.5±8.9)歲。4組性別(χ2=0.480,P=0.923)、年齡(F=0.343, P=0.794)差異均無統計學意義。OSA診斷標準參考阻塞性睡眠呼吸暫停低通氣綜合征診治指南(2011年修訂版)[4],排除伴有包括高血壓病、糖尿病、進行藥物治療的高脂血癥、動脈粥樣硬化性血管疾病和其他慢性疾病者。本研究獲得本院倫理委員會批準,研究對象均簽署知情同意書。
1.2主要試劑及儀器APC-CD133抗體(Miltenyi公司),PE-cy7-CD34抗體、含激酶域插入片段受體(PE-KDR)抗體(BD公司),人外周血淋巴細胞分離液(Solarbio公司),Aldefluor試劑、人類造血祖細胞富集試劑盒(Stemcell公司),胎牛血清(Gibco公司);酶聯免疫吸附試驗(ELISA)試劑盒(南京建成生物科技公司),流式細胞計數儀(BD公司),多導睡眠監測儀(美國飛利浦公司)。
1.3方法
1.3.1PSG監測所有受試者均使用PSG連續進行7h以上的睡眠呼吸監測,包括心電圖、腦電圖、眼電圖、下頜肌電圖、口鼻氣流、胸腹運動及血氧飽和度。監測指標包括嗜睡分數、AHI、最低血氧飽和度(LSpO2)等。
1.3.2血標本的留取所有患者均于PSG監測結束后,空腹抽取肘正中靜脈血14mL,其中10mL置于含EDTA的真空采血管中,4℃冰箱中保存,24h內用于單個核細胞(mononu?clear cells,MNC)的提取及流式細胞儀檢測;另4mL置于非抗凝管中,室溫靜置30min后,4℃3 000 r/min離心10min,留取血清,標記后于-80℃冰箱中保存。
1.3.3MNC的分離和流式細胞儀檢測向10mL新鮮血液中加入0.5mL人類造血祖細胞富集因子抗體,混勻,靜置20min后,將血液按1∶1稀釋于磷酸鹽緩沖液(PBS),采用密度梯度離心法提取MNC,加入紅細胞裂解液,按照ALDH廠家手冊對MNC進行染色,然后將PE-KDR、PE-cy7-CD34和APC-CD133加入ALDH染色的MNC中,避光孵育,ALDH assay buffer洗滌,用250μL的ALDH assay buffer重懸細胞,上流式細胞儀檢測,測定CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC及ALDHloCD34+KDR+EPC的細胞比例,結果以每微升全血中高乙醛脫氫酶活性/低乙醛脫氫酶活性(ALDHhi/ALDHlo)所占外周血單個核細胞(PBMC)的百分比× EPC百分比表示。
1.3.4HIF-1α、SDF-1α及VEGF水平檢測按照ELISA試劑盒廠家手冊,測定患者血清HIF-1α、SDF-1α及VEGF的水平。
1.4統計學方法采用SPSS 17.0軟件進行數據分析,計量資料采用±s表示。多組間比較采用單因素方差分析(One-Way ANOVA),組間多重比較采用Bonferroni法,計數資料采用χ2檢驗,P < 0.05為差異有統計學意義。
2 結果
Tab.1 Comparison of general data in four groups表1 各組患者一般情況比較 (n=30,±s)
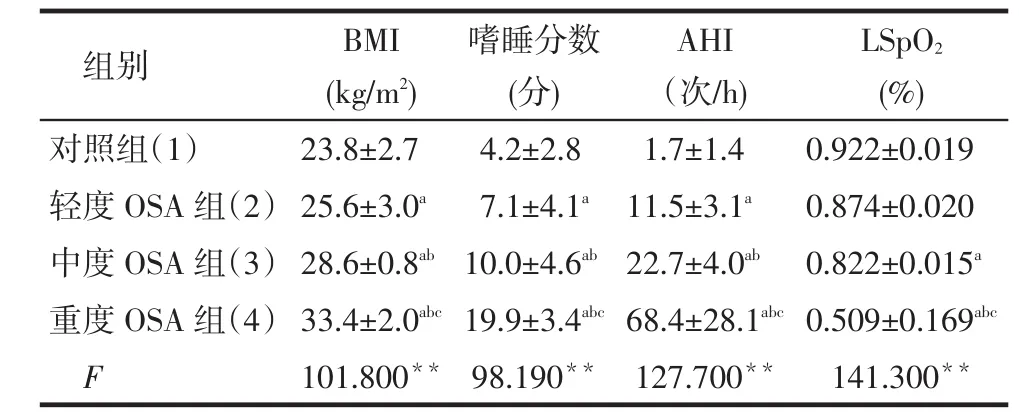
Tab.1 Comparison of general data in four groups表1 各組患者一般情況比較 (n=30,±s)
**P<0.01;a與(1)比,b與(2)比,c與(3)比,P < 0.05
組別對照組(1)輕度OSA組(2)中度OSA組(3)重度OSA組(4)F BMI (kg/m2) 23.8±2.7 25.6±3.0a28.6±0.8ab33.4±2.0abc101.800**嗜睡分數(分) 4.2±2.8 7.1±4.1a10.0±4.6ab19.9±3.4abc98.190**AHI(次/h) 1.7±1.4 11.5±3.1a22.7±4.0ab68.4±28.1abc127.700**LSpO2(%) 0.922±0.019 0.874±0.020 0.822±0.015a0.509±0.169abc141.300**
2.1各組患者一般情況比較見表1。對于體質指數(BMI)、嗜睡分數、AHI,均是重度OSA組>中度OSA組>輕度OSA組>對照組;重度OSA組的LSpO2低于對照組、輕度OSA組、中度OSA組,中度OSA組低于對照組(均P < 0.05)。
2.2各組患者外周血EPC不同亞族的水平比較對于CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平,均是重度OSA組>中度OSA組>輕度OSA組>對照組,而輕、中度OSA組的ALDHloCD34+KDR+EPC水平高于對照組,重度OSA組低于其余3組(均P < 0.05),見表2。
Tab.2 Comparison of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC, ALDHloCD34+KDR+EPC levels in peripheral blood between four groups表2 各組患者外周血CD133+KDR+EPC、CD133+CD34+EPC, CD34+KDR+EPC及ALDHloCD34+KDR+EPC水平比較 (n=30,±s)
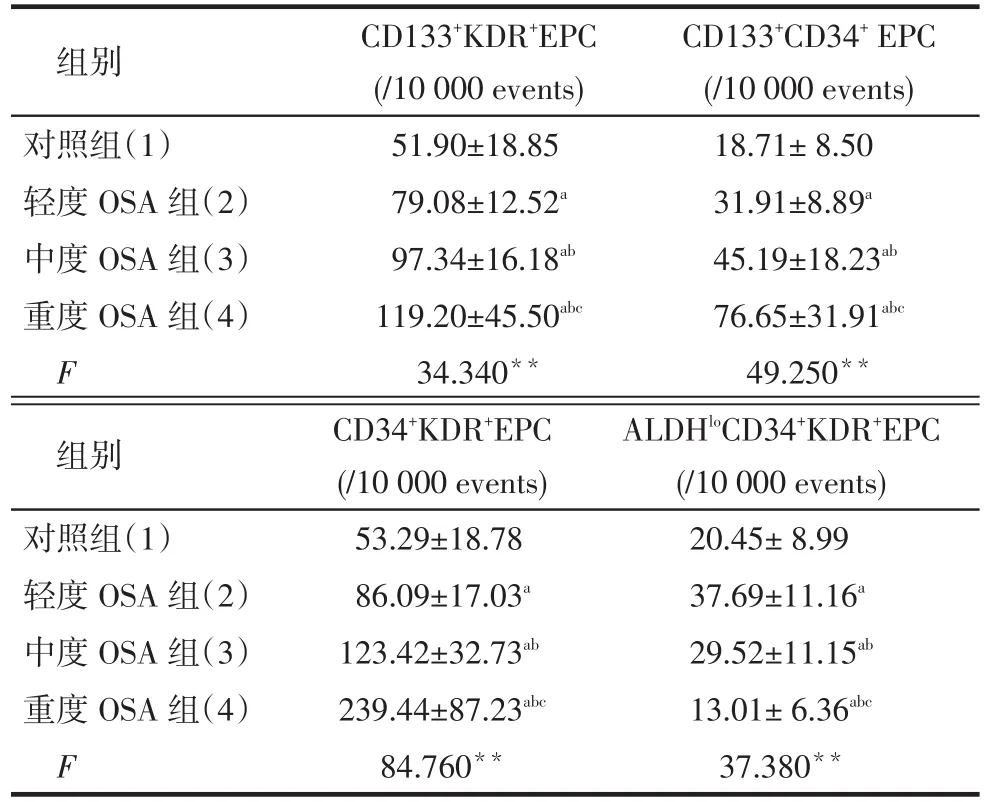
Tab.2 Comparison of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC, ALDHloCD34+KDR+EPC levels in peripheral blood between four groups表2 各組患者外周血CD133+KDR+EPC、CD133+CD34+EPC, CD34+KDR+EPC及ALDHloCD34+KDR+EPC水平比較 (n=30,±s)
**P<0.01;a與(1)比,b與(2)比,c與(3)比,P<0.05
組別對照組(1)輕度OSA組(2)中度OSA組(3)重度OSA組(4)F CD133+KDR+EPC (/10 000 events) 51.90±18.85 79.08±12.52a97.34±16.18ab119.20±45.50abc34.340**CD133+CD34+EPC (/10 000 events) 18.71±8.50 31.91±8.89a45.19±18.23ab76.65±31.91abc49.250**組別對照組(1)輕度OSA組(2)中度OSA組(3)重度OSA組(4)F CD34+KDR+EPC (/10 000 events) 53.29±18.78 86.09±17.03a123.42±32.73ab239.44±87.23abc84.760**ALDHloCD34+KDR+EPC (/10 000 events) 20.45±8.99 37.69±11.16a29.52±11.15ab13.01±6.36abc37.380**
2.3各組血清HIF-1α、SDF-1α及VEGF水平比較HIF-1α和VEGF水平均為重度OSA組>中度OSA組>輕度OSA組>對照組;而SDF-1α水平為重度OSA組<中度OSA組<輕度OSA組<對照組(均P < 0.05),見表3。
Tab.3 Comparison of serum levels ofhIF-1α, SDF-1α and VEGF between four groups表3 各組血清HIF-1α、SDF-1α、VEGF水平比較(n=30,±s)
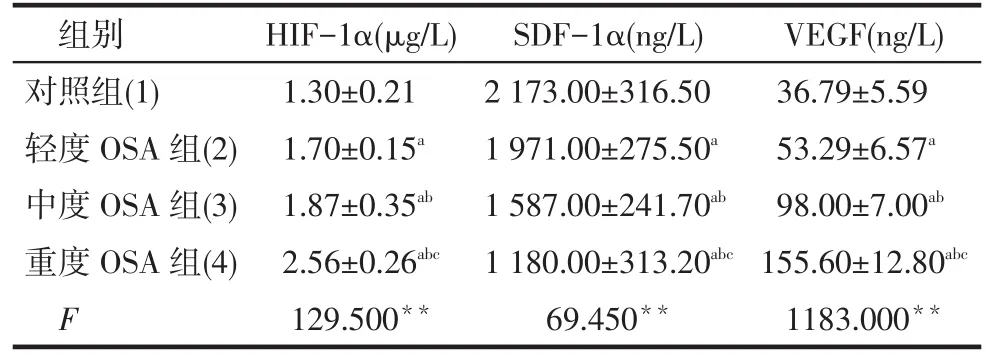
Tab.3 Comparison of serum levels ofhIF-1α, SDF-1α and VEGF between four groups表3 各組血清HIF-1α、SDF-1α、VEGF水平比較(n=30,±s)
**P<0.01;a與(1)比,b與(2)比,c與(3)比,P<0.05
組別對照組(1)輕度OSA組(2)中度OSA組(3)重度OSA組(4) FhIF-1α(μg/L) 1.30±0.21 1.70±0.15a1.87±0.35ab2.56±0.26abc129.500**SDF-1α(ng/L) 2 173.00±316.50 1 971.00±275.50a1 587.00±241.70ab1 180.00±313.20abc69.450**VEGF(ng/L) 36.79±5.59 53.29±6.57a98.00±7.00ab155.60±12.80abc1183.000**
3 討論
OSA是臨床上一種常見的睡眠紊亂性疾病,其特征為上氣道的反復塌陷導致復發性低氧血癥、睡眠片段化和日間嗜睡。OSA并發血管損傷的主要機制是OSA模式IH造成內皮損傷[1]。IH誘導動員并招募EPC歸巢于受損血管區域,從而修復血管內皮的完整性和功能[5],且主要參與受損血管修復的EPC 為ALDHloCD34+KDR+EPC[3]。內皮損傷最終表現為IH激活的內皮損傷過程與EPC修復過程之間的動態平衡,從而促進心血管事件的發生[6]。
本研究結果顯示,輕、中、重度OSA組患者的BMI均高于對照組,表明BMI越高,OSA患者AHI的次數增加越明顯,這與Viswanath等[7]認為BMI可增加OSA的發生率的結論一致。
目前關于OSA與EPC數量關系的文獻報道很多,但研究結果并不一致。本研究結果顯示,重度OSA組患者外周血CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平最高,對照組最低;Berger 等[8]通過對急性心肌梗死(AMI)合并睡眠呼吸紊亂(SDB)患者研究發現,AMI合并SDB患者的EPC水平明顯高于單獨AMI患者,并認為是IH導致了EPC水平的增加,與本研究結果一致。Lui等[9]研究發現,與空白對照組相比,OSA患者的CD133+KDR+EPC水平降低,其認為與晚期糖基化終產物的增加有關。Murri等[10]發現OSA患者CD133+CD34+EPC水平低于對照組,與本研究結果是相反的,他們認為EPC水平與OSA嚴重程度、氧化應激標志物水平呈負相關。而Yun等[11]通過檢測內皮集落形成單位來測定EPC,結果發現OSA組與對照組的EPC水平并無明顯差異。本研究結果表明,OSA患者程度越重,外周血中CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平增加越明顯,提示EPC水平與OSA嚴重程度呈正相關。形成這種差異的原因可能與受試者的數量、男女比例、EPC的表型及EPC評價方法的不同[5]等因素有關。
ALDH是一種對細胞間乙醛起氧化作用的酶[12]。盡管ALDH是一種細胞質基質蛋白,但其表達水平可利用乙醛即丹磺酰氨基乙醛的熒光,通過流式細胞儀檢測[13]。最近,有研究根據ALDH的活性分選兩群EPC,并檢測其表面標志物及其作用,結果發現,ALDHloCD34+KDR+EPC具有較強的修復能力[3]。因此,對于區分所謂的“功能性EPC”來說,ALDH是一種有效的標志物。更有研究表明,ALDHloCD34+KDR+EPC對局部缺血組織有重要的再生能力[14]。本研究依據ALDH活性聯合EPC表面標志物分選EPC,結果發現重度OSA組患者ALDHloCD34+KDR+EPC水平最低,輕度OSA組ALDHloCD34+KDR+EPC水平最高,提示OSA患者動員招募EPC大量增加,但在重度OSA患者中,真正參與修復內皮的ALDHloCD34+KDR+EPC卻降低,減弱了對受損血管的修復能力,加重了內皮損傷,從而增加了心血管疾病發生的可能性,符合OSA是眾多心血管疾病獨立危險因素的結論。
OSA的主要病理生理基礎是睡眠過程中反復發生的IH,誘導相關基因表達及相應活性物質的合成,進而導致心血管疾病的發生,HIF-1α是其中的關鍵調控因子之一。OSA模式的IH激活HIF-1α,誘導SDF-1α及VEGF的表達增加,動員和招募EPC,最終參與新血管的形成[2]。本課題組以往通過建立不同的動物低氧模型,發現HIF-1α的蛋白及mRNA表達水平隨著間歇低氧頻率及程度的增加而升高,且低氧程度越重,HIF-1α的表達水平越高[15]。而本研究進一步對OSA患者研究發現,隨著OSA嚴重程度的加重,血清HIF-1α的蛋白水平增加,這與國內外的研究結果一致,并且符合HIF-1α對低氧具有適應性反應的調控機制。
VEGF是缺血缺氧過程中一種重要的基因產物。缺氧情況下,VEGF的活性增強,動員與招募EPC進入外周血循環,并歸巢至受損血管處,參與血管的修復。本研究結果表明重度OSA組患者血清VEGF增加明顯,其EPC水平也是增加的,與VEGF 對EPC的動員作用是一致的。然而,有報道認為OSA患者血清VEGF水平增加,但EPC水平是減少的,原因可能與EPC在OSA血管內皮損傷中的消耗有關[5]。
SDF-1α是細胞膜半胱氨酸-X-半胱氨酸(CXC)趨化因子家族一員,通過SDF-1α/半胱氨酸-X-半胱氨酸趨化因子受體(CXCR)4軸,進而動員EPC進入外周血循環,并遷移至受損血管部位。SDF-1α在缺血組織的過度表達能促使EPC從外周血聚集并誘導新生血管形成[5]。目前OSA患者的血清與EPC數量及功能之間的關系存在爭議。本研究結果表明,SDF-1α隨著OSA程度的加重逐漸降低,這與Berger等[8]研究一致。筆者認為可能機制為隨著OSA患者嚴重程度的加重,EPC水平增加,SDF-1α 與EPC的表面受體CXCR4結合增加,使得其血漿濃度降低。
參考文獻
[1] Feng J, Zhang D, Chen BY.Endothelialmechanisms of endothelial dysfunction in patients with obstructive sleep apnea[J].Sleep Breath,2012,16(2):283-294.doi:10.1007/s11325-011-0519-8 .
[2] Akita T,murohara T, Ikedah, et al.Hypoxic preconditioning aug?ments efficacy ofhuman endothelial progenitor cells for therapeutic neovascularization[J].Lab Invest,2003,83(1):65- 73.doi: 10.1097/01.Lab.0000050761.67879.E4 .
[3] Naganom, Yamashita T,hamadah, et al.Identification of function?al endothelial progenitor cells suitable for the treatment of ischemic tissue usinghuman umbilical cord blood[J].Blood,2007,110(1):151-160.doi: 10.1182/blood-2006-10-047092.
[4] The Chinesemedical association respiratory neurology, the sleep ap?nea group.Guide of diagnosis and treatment of obstructive sleep ap?neahypopnea syndrom (2011 revision)[J].Chin J Tuberc Respir Dis, 2012,35(1):9-12.[中華醫學會呼吸病學分會睡眠呼吸障礙學組.阻塞性睡眠呼吸暫停低通氣綜合征診治指南(2011年修訂版) [J].中華結核和呼吸雜志,2012,35(1):9-12].
[5] Wang Q, Wu Q, Feng J, et al.Obstructive sleep apnea and endothe?lial progenitor cells[J].Patient Prefer Adher, 2013,7:1077- 1090.doi: 10.2147/Ppa.S51562.
[6] Kheirandish-Gozal L, Bhattacharjee R, Kim J, et al.Endothelial progenitor cells and vascular dysfunction in children with obstruc?tive sleep apnea[J].Am J Resp Crit Care,2010,182(1):92-97.doi: 10.1164/rccm.200912-1845OC.
[7] Viswanath A, Ramamurthy J, Dinesh SP, et al.Obstructive sleep ap?nea: Awakening thehidden truth [J].Niger J ClinPract,2015,18 (1): 1-7.doi: 10.4103/1119-3077.146964.
[8] Berger S, Aronson D, Lavie P, et al.Endothelial progenitor cells in acutemyocardial infarction and sleep-disordered breathing[J].Am J Respir Crit Caremed,2013,187(1):90-98.doi: 10.1164/rccm.201206-1144OC.
[9] LuimMS, TsehF,mak JCW, et al.Altered profile of circulating en?dothelial progenitor cells in obstructive sleep apnea[J].Sleep Breath,2013,17(3):937-942.doi: 10.1007/s11325-012-0781-4.
[10]murrim, Garcia-Delgado R, Alcazar-Ramirez J, et al.Effect of CPAP on oxidative stress and circulating progenitor cell levels in sleep patients with apnea-hypopnea syndrome[J].Resp Care,2011, 56(11):1830-1836.doi: 10.4187/respcare.01081.
[11] Yun CH, Jung KH, Chu K, et al.Increased circulating endothelialmicroparticles and carotid atherosclerosis in obstructive sleep apnea [J].J Clin Neurol,2010,6(2):89-98.doi: 10.3988/jcn.2010.6.2.89.
[12] Storms RW, Trujillo AP, Springer JB, et al.Isolation of primitivehu?manhematopoietic progenitors on the basis of aldehyde dehydroge?nase activity[J].P Natl Acad Sci USA,1999,96(16):9118- 9123.doi: 10.1073/pnas.96.16.9118.
[13] Jones RJ, Barber JP, ValamS, et al.Assessment of aldehyde dehy?drogenase in viable cells[J].Blood,1995,85:2742-2746.
[14] Fukuda S, Naganom, Yamashita T, et al.Functional endothelial progenitor cells selectively recruit neurovascular protectivemonocytederived F4/80(+)/Ly6c(+)macrophages in amousemodel of retinal degeneration[J].Stem Cells,2013,31(10):2149-2161.doi: 10.1002/stem.1469.
[15] Yang QC, Zhou Q, Wang Y, et al.Effects of different degrees of in?termittenthypoxia on inflammatory cytokines and adipokines in3T3-L1A dipocytes[J].Tianjinmed J,2013,41(12):1142-1146.[楊慶嬋,周芹,王彥,等.不同程度間歇低氧對3T3-L1脂肪細胞炎性細胞因子和脂肪因子的影響[J].天津醫藥,2013,41(12):1142-1146].doi:10.3969/j.issn.0253-9896.2013.12.002.
(2015-09-15收稿2015-10-08修回)
(本文編輯閆娟)
T Endothelial progenitor cells (EPCs) and promote angiogenesis factor levels in peripheral blood in patients with obstructive sleep apnea
XUE Yanchao1, SUN Bei2, WANG Xin1, FENG Jing1△, CAO Jie1△
1 Generalhospital of Tianjinmedical University, Tianjin 300052, China; 2 Institute of Endocrinology of Tianjinmedical University
Abstract:Objective To explore the repair possibilities of endothelial progenitor cells (EPCs)in peripheral blood in patients with different extents of obstructive sleep apnea (OSA) throughmeasuring the levels of pro-angiogenic factors and different subgroups EPCs in peripheral blood in patients with OSA.Methods Ninety adult patients with OSA, 30healthy controls withmatched age and gender were enrolled for this study.The subjects performed Polysomnography, were divided in?to four group based on Apneahypopnea Index (AHI).The serum levels ofhIF-1α, SDF-1α and VEGF were assessed by ELISA.Mononuclear cells were isolated from peripheral blood with density gradient centrifugation, and flow cytometry was used to detect levels of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC and ALDHloCD34+KDR+EPC based on AL?DH activity, and CD133, CD34, PE-KDR related cell surfacemarkers.Results The levels of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC werehigher in OSA groups than those of control group, both of which werehigher in severe OSA group than those of inmild andmoderate OSA groups.The levels of ALDHloCD34+KDR+EPC werehigher inmild andmoderate OSA groups than that of the control groups, and the levels of ALDHloCD34+KDR+EPC were significantly lower in se?vere OSA group than those of control,mild andmoderate OSA groups.Serum levels ofhIF-1α.VEGF were significantlyhigh?er in OSA groups compared to those in control groups, both of which werehigher in severe OSA group than those ofmild andmoderate OSA groups.Serum levels of SDF-1α were significantly lower in severe OSA groups than those ofmild,moderate OSA and control groups (P < 0.05).Conclusion Themobilization and recruitment of different subtypes of EPCs are obvious?ly increased in patients with OSA, but ALDHloCD34+KDR+EPC with vascular repair capacity keeps to invariability, even de?book=20,ebook=25creases in patients with severe OSA, which results in endothelial damage, and increases the risk of cardiovascular disease.
Key words:obstructive sleep apnea;hypoxia-inducible factor-1α; stromal cell derived factor-1α; vascular endothelial growth factor; intermittenthypoxia; endothelial progenitor cells; acetaldehyde dehydrogenase
Corresponding Author△E-mail: zyyhxkfj@126.com; tjcaojie@sina.com
通訊作者△E-mail:zyyhxkfj@126.com; tjcaojie@sina.com
作者簡介:薛艷超(1988),女,碩士在讀,主要從事睡眠低氧性疾病研究
基金項目:國家自然科學基金資助項目(81270144,30800507,81570084,2015BAI12B00,2012BAI05B02)
中圖分類號:R56
文獻標志碼:A
DOI:10.11958/20150161
作者單位:1天津醫科大學總醫院呼吸科(郵編300052);2天津醫科大學代謝病醫院內分泌研究所

