腦年齡估值差對健康老齡大腦認知儲備的定量分析
林嵐,張柏雯,吳水才
北京工業大學 生命科學與生物工程學院,北京 100124
腦年齡估值差對健康老齡大腦認知儲備的定量分析
林嵐,張柏雯,吳水才
北京工業大學 生命科學與生物工程學院,北京 100124
認知儲備是指個體自適應地利用神經網絡對神經退行性疾病所造成的腦損傷進行補償的能力。認知儲備一般通過測量靜態代理變量的方式來進行間接估算。神經影像研究的結果表明多種神經退行性疾病的患者,由于其大腦加速老化會具有較高的大腦年齡估值差。本研究將大腦年齡估值差用于認知儲備的間接測量中,并將大腦年齡差估值的概念進一步延伸至健康老年人的認知儲備的研究中。72名健康老年人接受了相同的認知功能的綜合評估和結構磁共振圖像采集。結果表明,大腦年齡估值差分數較低的個體,認知功能可以獲得較好地保護,認知儲備消耗的速度也相對較慢。大腦年齡估值差的變化可能可以捕捉到認知儲備的動態變化,并能夠反映大腦網絡如何通過動態自適應來補償腦損傷的過程。
認知儲備;腦連接組;大腦年齡估值差;彌散張量成像
據2015年世界阿爾茨海默癥(Alzheimer’s Disease, AD)報告,全球共有4600萬已被確診的AD患者,預計今年全球約有990萬例新發現的AD患者將被診斷。如果沒有有效的治療或緩解措施,預計在2050年,AD患者總數將達到1.32億。如果存在可以將AD發病時間延長五年的治療方案,新患病人數將減少40%。相比其他領域新藥物研發的進展,神經科學領域的新藥研發更為艱難,尤以AD為最。近年來,僅有4種AD藥物獲批上市,臨床失敗率高達99.6%。提高或改善認知儲備能力被認為是一種預防和推遲AD發生的關鍵非藥物療法[1-3]。
腦儲備模型的概念源于Katzman等[4]基于阿爾茨海默病AD的一項研究。在此研究中,他們發現 一些重度的AD患者直到死亡,仍可以保持著較完整的認知能力。這一發現解釋了為什么同等程度的腦損傷對于個體認知能力的影響存在著差異。Stern等[1,5-6]進一步把腦儲備模型分為消極模型和積極模型。消極模型[7]主要強調人腦組織結構 (如大腦的尺寸、神經的密集程度等)對大腦認知的保護作用;而積極模型[1,6]所指的認知儲備則強調當個體在遇到腦損傷時,能夠通過提高神經網絡的效率以及發展其它神經網絡來進行積極代償的能力。認知儲備的水平被發現與多種因素高度相關:如不同個體的受教育的程度[5]、職業類型的復雜度[8-9]、休閑活動的參與度[10]和社交網絡的完整性[11]等。具有較高認知儲備的老年人可以更好抵抗大腦老化所帶來的認知損傷。
大量流行病學的研究和實驗結果證實了認知儲備的存在。認知儲備包括神經儲備和神經代償兩種神經機制。神經儲備機制表明較高的認知儲備水平有助于提高大腦網絡的能力和利用效率,以更好地應對腦病理的損傷效應;神經代償機制則表明較高的認知儲備水平有助于提高募集補償性腦網絡的能力,以保持較好的行為表現。認知儲備不僅可以降低AD的患病風險[12],保持老年人較為完整的認知能力[13],并且可以減緩多種神經系統疾病(如外傷性腦損傷[14]、帕金森氏病[15]、多發性硬化癥[16]和HIV相關性癡呆[17]等)帶來的認知損傷。學者們一般將認知儲備的靜態的代理指標作為量化認知儲備的基礎(如受教育的年限)[18]。Soto-Anari等[19]利用語言能力的評估對認知儲備進行了間接測量。Nucci等[20]提出了通過認知儲備指數調查問卷的形式,該方法通過教育、工作和休閑時間三個部分的得分,綜合WAIS詞匯測試等認知成績來測量認知儲備。Irene等[21]根據受試者在整個生命周期中的生活狀態提出了認知儲備尺度的概念。神經影像學技術也被用于認知儲備的間接研究中。Murray等[22]在研究腦血管病患者和AD患者的磁共振影像標記物(白質高信號和海馬體積萎縮)時,發現患者受教育程度對這些影像標記物有著正面的影響。
但當前對于上述認知儲備代理指標的估測還存在著一些缺陷[23-24]:首先,當前對認知儲備的幾種間接測量方法都是通過分析與認知儲備有關的高危因素,再利用問卷調查和認知量表評估而實現的。所以存在其結果不夠客觀、不同測量方法所得到的結果不完全一致等問題。其次,認知儲備在人的一生中是在持續不斷地變化,是一個動態指標。在青年、中年階段,人類通過學習、工作以及健康的生活方式都可以使認知儲備得到增長。而在老年期,與年齡相關的大腦老化和各種神經系統疾病則在不斷的消耗著我們的認知儲備,盡管此時健康生活方式可以減緩這種消耗,但整體的認知儲備是隨著年齡的增長而不斷下降的。對于未受任何神經系統及相關疾病影響的健康老年人,主要通過認知儲備來對抗與年齡相關的認知退化。在認知儲備還存在余度時,不會出現明顯的認知能力衰退。因此,一個好的認知儲備代理指標應該可以客觀、動態地預測隨年齡增長而發生變化的認知儲備。
大腦年齡估值差(Brain Age Gap Estimation,BrainAGE)的概念是由Franke等[25]于2010年提出的(圖1)。BrainAGE指的是受試者腦年齡預測模型所獲得的預測年齡與其真實年齡之間的差值。他們認為對于神經退行性疾病的患者組,BrainAGE對應于加速的大腦老化;而對于健康受試組,BrainAGE的均值趨近于0。研究發現AD早期患者組的平均BrainAGE大于10年[26],成人發病型糖尿病組的平均BrainAGE為4.6年[27],高血壓組的平均BrainAGE為4.1年[28],多類精神疾病患者組的BrainAGE從1.7年到5.5年[29]。根據這個概念,對于健康受試組,BrainAGE的標準差過去被認為是由于模型固有誤差造成的。但Franke等人最近對于健康個體的一項研究[30]顯示代謝綜合征(如高血壓、肥胖、高尿酸)以及肝功能受損最大可增加9年的BrainAGE。Luders等對于冥想者的研究[31]顯示,長期冥想者的大腦會比實際年齡平均年輕7.5歲。
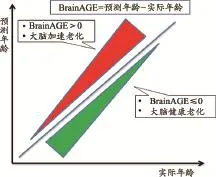
圖1 BrainAGE
認知儲備反映的是如何在大腦中建立一個緩沖減緩大腦老化退行等疾病對大腦性能的影響,而BrainAGE反映的是大腦老化的相對程度。因此,我們在這里將兩個概念聯系起來,對BrainAGE概念進行了進一步推廣:對于個體健康受試者,BrainAGE反映的不僅是模型的預測誤差,還包含了基因、環境、生活學習習慣等多種因素對于認知儲備的綜合影響。對于認知儲備下降的對象組,BrainAGE>0。BrainAGE的分數值可以用來評估認知儲備的損失程度。BrainAGE應該分解為兩個部分:一是健康生活習慣、體力活動、認知活動帶來的認知儲備能力的改善,以及大腦老化和各類疾病對認知儲備的傷害;二是其他因素的擾動和預測模型的誤差。

由于認知儲備這個概念反映的是腦網絡對大腦損傷的一種補償機制,因此從腦網絡分析的角度可以更好反映這種補償機制。定量認知儲備指標的一個基本前提是要求個體的具有較高認知儲備的個體,大腦的預測性能應該優于實際性能好;而具有較低認知儲備的個體的大腦預測性能往往比實際性能差。對于健康老年人,由于大腦老化的影響,其認知儲備水平總體隨年齡增長是呈下降趨勢的,同一大腦在人生不同發展階段認知儲備水平也存在不同。所以本研究采用大腦連接組的網絡特征來構建腦年齡預測模型。通過將預測年齡與真實年齡相減得到每個個體的BrainAGE,BrainAGE測量的是相對認知儲備可以用來判斷個體認知儲備相對同其它同齡個體的不同。
1 材料與方法
1.1 研究對象與數據獲取
本研究受試對象為72名健康右利手老年人(其中男性33名,女性39名),平均年齡為60.7±5.2歲。受試者均在實驗前簽署了知情同意書。受試對象的納入標準為:無臨床神經及精神病史(如癲癇、腦炎、抑郁癥等),MRI常規檢查未發現腦內病變,簡易精神狀態量表(Mini-Mental State Examination,MMSE)檢查評分均≥28分,漢密爾頓抑郁評定量表≤10分。正式數據采集前有藥物濫用史者、酗酒史者,或是無法配合完成磁共振檢查者均被排除。實驗對象具體特征見表1。

表1 實驗對象特征表
本實驗所有受試者均同時采集腦部T1和DTI圖像。實驗所有圖像采集均通過3.0T GE Signa Excite scanne(rGeneral Electric,Milwaukee,WI)磁共振成像系統完成。采集過程如下:首先通過SPGR掃描序列獲得204張連續的冠狀面T1加權像。T1掃描參數為:TR/TE=5.3 ms/2 ms,T1=500 ms,翻轉角=15°,層厚=1 mm,體素大小=1 mm×1 mm×1 mm,矩陣為256×256,FOV為256 mm×256 mm。接下來采用單次激發平面回波成像(Echo-Planar Imaging,EPI)序列獲得58層DTI圖像,將8個方向無擴散敏感梯度b值設置為0 s/mm2,51個方向施加擴散敏感梯度b值設置為1000 s/mm2。DTI圖像采集參數為:TR/TE =12500 ms/71 ms,矩陣為128×128,FOV為250 mm×250 mm,層厚2.6 mm。本次實驗所用成像數據均采集于美國亞利桑那州大學附屬醫院。受試者被要求回答修正的Baecke體力活動問卷(Modif ed Baecke Physical Activity Questionnaire)[32],認知功能采用韋克斯勒成人智力量表修訂版:WAIS-IV全套,連線測驗(Trail making test)A和B進行測試。
1.2 腦年齡預測模型和BrainAGE
腦年齡預測模型的建立過程主要分為腦網絡的構建與分析和預測模型的構建兩大部分,具體詳細過程見文獻[33]。下面我們對這兩個部分分別進行簡單描述。腦網絡構建與分析的工作為以下幾個步驟,第一步:DTI重建。首先使用FDT工具箱對DTI圖像進行渦流與頭動的校正,每幅DTI圖像通過仿射變換被配準到b0 圖像上,然后對校正后的DTI 圖像中的每個體素進行張量重建,并對獲得的張量矩陣進行對角化處理,最終得到特征值及對應的特征向量。第二步:網絡構建。此過程所用的90個大腦網絡節點模板來自于蒙特利爾神經研究所(Montreal Neurological Institute, MNI)的AAL模板(Automated Anatomical Labeling)。不同腦區間的白質連接(終止條件為FA<0.2,或者彎曲率>45°)是運用連續跟蹤纖維一致性(Fiber Assignment by Continuous Tracking,FACT)方法實現的。網絡構建可以得到三個無向的網絡連接矩陣:纖維數量(Fiber Number,FN)矩陣、各向異性(Fractional Anisotropy,FA)矩陣和纖維長度(Fiber Length,FL)矩陣。之后對這三個矩陣再進行消除虛假連接處理后可得到4個連接矩陣:預處理后的FA、FN、FL加權矩陣和二值化的FN矩陣。以上所描述的DTI影像預處理和大腦結構網絡構建工作都是基于北京師范大學認知神經科學與學習國家重點實驗室開發的PANDA軟件(a Pipeline for Analysing braiN Diffusion imAges,http://www.nitrc.org/projects/panda/)來實現的。第三步:對所得矩陣進行分析。通過Brain Connectivity Toolbox (BCT,http://www.brain-connectivity-toolbox.net)網絡分析軟件,可以獲取節點度、節點強度、節點的局部效率、節點的集群系數、最短路徑長度和節點的中心度拓撲網絡參數。由于這些參數并不是適用于所有矩陣,所以需要根據不同的參數要求選擇合適的連接矩陣。最終可以得到關于節點度(FN二值化矩陣)、節點強度(FN,FL,FA加權矩陣)、局部效率(FA加權矩陣)、集群系數(FN,FL,FA加權矩陣)、最短路徑(FL加權矩陣)和中心度(FL加權矩陣)的10種網絡拓撲參數(90個腦區),共900個特征。
腦年齡預測模型采用尺度子配置模型(Scaled Subprof le Model,SSM[34],http://www.fil.ion.ucl.ac.uk/spm/ext/#SSM)來構建。SSM是一種通過捕捉組間和組內差異為主要來源,產生一系列主要成分的協方差分析的統計方法。SSM模型在應用主成分分析之前,需先對數據進行了自然對數變換與雙中心均值去除的處理。網絡拓撲特征協方差矩陣的奇異值被分解成一組獨立正交的主成分。最后根據Akaike信息判據保留最能反映年齡變化的主成份,創建一個線性組合模式,最大程度地預測腦年齡。本研究中每個老年人的腦年齡是通過其余71個數據為訓練對象進行建模構建,共建立72個預測模型。BrainAGE通過預測年齡與真實年齡相減獲得。
2 結果
由于前3個主成分的線性組合與大腦年齡直接相關,被用來建立腦年齡預測模型。結果顯示實際腦年齡與預測年齡的相關系數r=0.88,均方根誤差為2.41年。健康老年人模型的95%的置信區間為±4.86年(圖2)。健康老年組的平均BrainAGE為0.09年,所以可以得出本實驗受試的健康老年組作為一個整體,并不存在大腦的加速老化現象。
對于健康老年組中的個體對象,由于認知儲備的不同,有的個體出現減緩的大腦老化,而有的個體則會出現加速的大腦老化。所以這里所得出的平均BrainAGE接近于0更多反映的是健康老年人的一個群體特性。我們認為個體的BrainAGE并不僅僅是模型的誤差,高BrainAGE代表認知儲備的損傷,而低BrainAGE代表認知儲備被較好的保留。如果將BrainAGE通過回歸分析去除年齡的影響后,將其與認知儲備的一些相關的因素進行分析。本研究發現BrainAGE和多項認知儲備因素存在顯著相關。與體重(r=0.31,雙邊t檢驗P=0.007)、BMI(Body Mass Index)(r=0.37,P=0.001)存在正相關,與休閑活動參與度(r= -0.30,P=0.01)、體力活動參與度(r=-0.26,P=0.03)存在負相關(圖3)。同時,較低的BrainAGE能夠反映較強的視覺搜索速度、掃描處理速度,以及較強視覺工作記憶和執行功能連線測試A(Trail Making Test A,TMTA)(r=0.31,P=0.006)和WAIS加工速度指數(r=-0.24,P=0.04)。但同時發現BrainAGE與個體受教育年限不存在顯著相關(雙邊t檢驗P=0.08)。
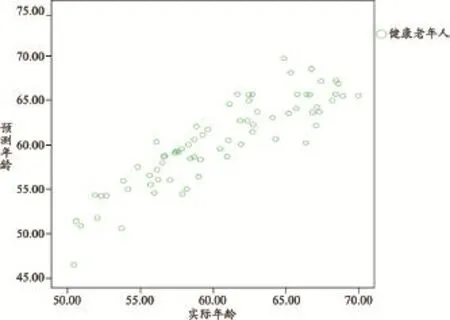
圖2 預測年齡與真實年齡的關系
3 討論
研究發現,BrainAGE和健康老年受試對象的體重及BMI顯著相關。中老年期的高體脂率一般對大腦有著負面影響。這主要是因為脂肪細胞及其相關荷爾蒙可以通過血腦屏障影響大腦。較高的體脂率不僅會導致心腦血管疾病,同時肥胖也會影響人的生活習慣從而進一步影響大腦網絡。影像學的研究結果顯示高BMI會改變大腦的結構和功能[35-37],包括灰質的萎縮、白質結構的損傷以及腦功能連接的下降等。大量學者的研究也顯示了AD與高BMI的顯著相關,特別是AD發病前10年的BMI[38-39]。體力活動[40-42],特別是休閑活動對老年 大腦認知儲備具有保護性作用,盡管這種保護性作用比較溫和。這與本研究結果中顯示BrainAGE與休閑活動參與度、體力活動參與度存在負相關的結論相一致。WAIS加工速度指數考察的是心理操作與動作的速度/視知覺信息的處理能力。TMTA是評定執行功能的三大量表之一,主要用于檢查認知加工速度。加工速度與工作記憶是高度相關的。加工速度比較快的個體可以減少對工作記憶的負載,而加工速度比較慢的個體會損害工作記憶的有效性,也更容易引起大腦的疲勞。結果顯示,BrainAGE與工作記憶無關,但與加工速度指數負相關。工作記憶是老年人認知最容易受損的方面,當加工速度指數不斷下降,最終會損傷工作記憶。Kirton等[43]最近的一項研究也顯示了認知儲備與年齡、BMI、加工速度、執行功能及工作記憶間的關系,其結果與本文研究結果基本一致。BrainAGE與認知儲備的多個相關因素都存在一定相關關系,但并不存在一個決定性因素完全影響認知儲備,這和認知儲備的多因素影響完全一致。
受教育程度是最常用的認知儲備估測的指標。本研究中的BrainAGE和受教育程度不存在顯著相關,這與其它文獻的結果存在一定矛盾。受教育程度是一個非常復雜的變量。受教育程度往往與心臟病、高血壓、糖尿病、高血脂等慢性疾病的患病幾率呈負相關,這些慢性疾病都會增加AD的致病風險。本次研究中的受試者大都受過比較高的教育,其中70%以上的受試者接受過本科以上教育。而受教育程度對認知儲備的提高可能更多體現在教育程度比較低的情況下。但受教育年限超過一定范疇,則對認知儲備的提高可能是有限的。其次,受教育程度并不能完全由受教育的年限來表達。一方面,受教育程度還與兒童期的智商、社會經濟地位、疾病的風險高低和健康行為與否高度相關。另一方面,即便同樣的受教育的年限,不同個體所獲得的學習經驗也會存在不小的差異[44-45]。
4 結論
個體的認知儲備能力是由生活習慣、體力活動、腦力活動、年齡、疾病等各種因素綜合決定的,在人的一生中是不斷變化的。傳統認知儲備的代理指標可以在一定程度上反映與認知儲備有關的高危因素對其影響,但往往不能反映在人的一生中儲備能力的動態變化。在本研究中將BrainAGE這一用來衡量疾病導致的大腦加速老化的概念擴展到認知儲備的動態評估。前人和目前的研究結果顯示,這個指標可以滿足對于認知儲備指標的幾個假設。首先,認知儲備的度量必須能反映疾病對于認知儲備的消耗。前人[26-27,29-30]和筆者的前期研究成果[28]顯示BrainAGE可以反映疾病對于大腦的消耗作用,如健康個體的BrainAGE<MCI患者的BrainAGE<AD患者的BrainAGE。其次,認知儲備的代理指標應該與認知儲備其它代理指標間存在相關性。BrainAGE與體重、BMI正相關,而與休閑活動參與度、體力活動參與度呈負相關。最后,認知儲備能力的程度必須能反映大腦對AD的延緩作用,BrainAGE被發現相對于神經心理測驗可以更好地預測MCI患者的AD轉化率[46]。相對于傳統認知儲備評估指標,BrainAGE可以在一定程度上捕捉認知儲備的動態變化。BrianAGE這個變量隨年齡而變化,而且這個變化有著顯著的個體差異。這種差異直接與大腦的加速老化關聯。對于健康老年人,可以在一定程度上反映因生活、社會、環境等多種因素所導致的大腦加速老化對大腦的認知儲備的一種消耗。
當然,筆者的研究尚存一些缺陷。首先,本次研究的受試者的受教育年限都比較高,因此不能很好地確定BrainAGE與受教育程度的關系。其次,盡管BrainAGE和認知儲備的一些高危因素顯著相關,但相關性還比較弱,這非常可能是由于實驗采用的數據對象還比較少造成的。未來可以通過采用Alzheimer's Disease Neuroimaging Initiative (ADNI)[47-48](http://adni.loni.usc.edu/)和 Human Connectome Project (HCP)[49](http://www.humanconnectome.org/data/)中的大規模神經影像數據進行分析來解決受教育程度偏高和試驗數據較少這兩個方面的問題。最后,認知儲備與遺傳和環境也高度相關,基于人腦的分析無法消除這些因素的影響。未來筆者計劃通過設計動物實驗消除這方面的影響。
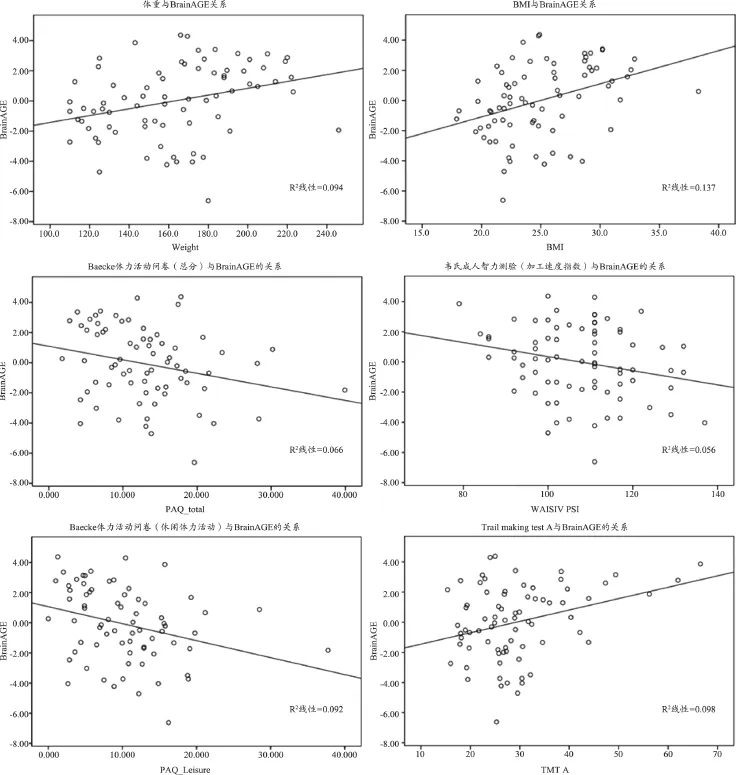
圖3 回歸分析去除去除年齡影響后的BrainAGE與多項認知儲備高相關因子間的關系
[1]Stern Y.Cognitive reserve and Alzheimer disease[J].Alz Dis Assoc Dis,2006,20:S69-S74.
[2]Gutchess A.Plasticity of the aging brain: new directions in cogniti ve neuroscience[J].Science,2014,346(6209):579-582.
[3]Marx J.Neuroscience.Preventing Alzheimer’s: a lifelong commitment?[J].Science,2005,309(5736):864-866.
[4]Katzman R,Terry R,Deteresa R,et al.Clinical,pathological,and neurochemical changes in dementia: a subgroup with preserved mental status and numerous neocortical plaques[J].Ann Neurol, 1988,23:138-144.
[5]Stern YP,Alexander GE,Prohovnik I,et al.Inverse relationship between education and parietotemporal perfusion deficit in Alzheimer’s disease[J].Ann Neurol,1992,32:371-375.
[6]Stern Y.What is cognitive reserve? Theory and research application of the reserve concept[J].J Int Neuropsych Soc,2002,8:448-460.
[7]Satz P.Brain reserve capacity on symptom onset after brain injury: a formulation and review of evidence for threshold theory[J].Neur opsychology,1993,7(3):273-295.
[8]Richards M,Sacker A.Lifetime antecedents of cognitive reserve[J].J Clin Exp Neuropsychology,2003,25(5):614-624.
[9]Staff RT,Murray AD,Deary IJ,et al.What provides cerebral reserve?[J].Brain,2004,127:1191-1199.
[10]Scarmeas N,Zarahn E,Anderson KE,et al.Association of life activities with cerebral blood flow in Alzheimer disease: implications for the cognitive reserve hypothesis[J].Arch Neurol, 2003,60:359-365.
[11]Bennett DA,Schneider JA,Tang Y,et al.The effect of social networks on the relation between Alzheimer’s disease pathology and level of cognitive function in old people: a longitudinal cohort study[J].Lancet Neurol,2006,5:406-412.
[12]Wilson RS.Elderly women with larger social networks are less likely to develop dementia[J].Evid Based Ment Health,2009, 12(1):22.
[13]Suchy Y,Kraybill ML,Franchow E.Instrumental activities of daily living among community-dwelling older adults: discrepancies between self-report and performance are mediated by cognitive reserve[J].J Clin Exp Neuropsychol,2011,33(1):92-100.
[14]Fay TB,Yeates KO,Taylor HG,et al.Cognitive reserve as a moderator of postconcussive symptoms in children with complicated and uncomplicated mild traumatic brain injury[J].J Int Neuropsychol Soc,2010,16(1):94-105.
[15]Poletti M,Emre M,Bonuccelli U.Mild cognitive impairment and cognitive reserve in Parkinson’s disease[J].Parkinsonism Relat Disord,2011,17(8):579-586.
[16]Sumowski JF,Chiaravalloti N,Deluca J.Cognitive reserve protects against cognitive dysfunction in multiple sclerosis[J].J Clin Exp Neuropsychol,2009,31(8):913-926.
[17]Foley JM,Ettenhofer ML,Kim MS,et al.Cognitive reserve as a protective factor in older HIV-positive patients at risk for cognitive decline[J].Appl Neuropsychol Adult,2012,19(1):16-25.
[18]何燕,余林,閆志民,等.認知儲備的測量及其在認知老化中的應用[J].心理科學進展,2015,23(3):430-438.
[19]Soto-a?ari M,Flores-valdivia G,Fernández-guinea S.Level of reading skills as a measure of cognitive reserve in elderly adults[J].Revista De Neurologia,2013,56(2):79-85.
[20]Nucci M,Mapelli D,Mondini S.Cognitive Reserve Index questionnaire (CRIq): a new instrument for measuring cognitive reserve[J].Aging Clin Exp Res,2012,24(3):218-226.
[21]León I,García-garcía J,Roldán-tapia L.Estimating cognitive reserve in healthy adults using the Cognitive Reserve Scale[J].PloS One,2014,9(7):e102632.
[22]Murray AD,Staff RT,Mcneil CJ,et al.The balance between cognitive reserve and brain imaging biomarkers of cerebrovascular and Alzheimer’s diseases[J].Brain,2011,134(Pt 12):3687-3696.
[23]Jones RN,Manly J,Glymour M,et al.Conceptual and measurement challenges in research on cognitive reserve[J].J Int Neuropsychol Soc, 2011,17(4):593-601.
[24]Satz P,Cole MA,Hardy DJ,et al.Brain and cognitive reserve: mediator(s) and construct validity,a critique[J].J Clin Exp Neuropsychol,2011,33(1):121-130.
[25]Franke K,Ziegler G,Kl?ppel S,et al.Estimating the age of healthy subjects from T1-weighted MRI scans using kernel methods: exploring the influence of various parameters[J].Neuroimage,2010,50(3):883-892.
[26]Gaser C,Franke K,Kl?ppel S,et al.BrainAGE in mild cognitive impaired patients: Predicting the conversion to alzheimer’s disease[J].PLoS One,2013,8(6):e67346.
[27]Franke K,Gaser C,Manor B,et al.Advanced BrainAGE in older adults with type 2 diabetes mellitus[J].Front Aging Neurosci,2013, 17(5):90.
[28]林嵐,張柏雯,付振榮,等.高血壓對大腦年齡估值差的影響[J].中國醫療設備,2015,30(6):7-11.
[29]Koutsouleris N,Davatzikos C,Borgwardt S,et al.Accelerated brain aging in schizophrenia and beyond: a neuroa natomical marker of psychiatric disorders[J].Schizophr Bull,2014,40(5):1140-1153.
[30]Franke K,Ristow M,Gaser C,et al.Gender-specific impact of personal health parameters on individual brain aging in cognitively unimpaired elderly subjects[J].Front Aging Neurosci, 2014,23(6):94.
[31]Luders E,Eherbuin N,Gaser C.Estimating brain age using highresolution pattern recognition: Younger brains in long-term meditation practitioners[J].Neuroimage,2016,134:508-513.
[32]Voorrips LE,Ravelli AC,Dongelmans PC,et al.A physical activity questionnaire for the elderly[J].Med Sci Sports Exer,1991,23(8):974-979.
[33]林嵐,靳聰,付振榮,等.健康老年人腦年齡預測:基于尺度子配置模型的大腦連接組分析[J].北京工業大學學報,2015,41 (6):955-960.
[34]Moeller JR,Strother SC,Sidtis JJ,et al.Scaled subprofile model: a statistical approa ch to the analysis of functional patterns in positron emission tomographic data[J].J Cereb Blood Flow Metab,1987,7(5):649-658.
[35]李方波,李英華,孫思偉,等.我國5省市18~60 歲城鄉居民超重肥胖現狀調查及影響因素分析[J].中國健康教育,2012,28(5):367-371.
[36]鄭翠紅,李華萍,寧曉東,等.城鎮成年居民超重與肥胖的現狀調查及分析[J].中國社區醫師,2010,12(249):231-233.
[37]張娜,邵永強,張沛綺,等.溫州市區成年居民超重和肥胖流行現況調查[J].浙江預防醫學,2015,27(9):893-896.
[38]Milgram NW,Siwak-tapp CT,Araujo J,et al.Neuroprotective effects of cognitive en richment[J].Ageing Res Rev,2016,5:354-369.
[39]Hayden K,Zandi P,Lyketsos C,et al.Vascular risk factors for incident Alzheimer disease and vascular dementia: the Cache County study[J].Alzheimer Dis Assoc Disord,2006,20:93-100.
[40]Foubert-samier A,Catheline G,Amieva H,et al.Education, occupation,leisure activities,and brain reserve: a population-based study[J].Neurobiol Aging,2012,33(2):423.
[41]Fabrigoule C.Do leisure activities protect against Alzheimer’s disease?[J].Lancet Neurol,2002,1(1):11.
[42]Rolland Y,Abellan van kan G,Vellas B.Healthy brain aging: role of exercise and physical activity[J].Clin Geriatr Med,2010, 26(1):75-87.
[43]Kirton JW,Dotson VM.The interactive effects of age,education,and BMI on cognitive functioning[J].Neuropsychol Dev Cogn B Aging Neuropsychol Cogn,2016,23(1):263-262.
[44]Manly JJ,Jacobs DM,Touradji P,et al.Reading level attenuates differences in neuropsychological test performance between African American and White elders[J].J Int Neuropsychol Soc, 2002,8(3):341-384.
[45]Jone RN.Racial bias in the assessment of cognitive functioning of older adults[J].Aging Ment Health,2003,7(2):83-102.
[46]L?we LC,Gaser C,Franke K,et al.The Effect of the APOE Genotype on Individual BrainAGE in Normal Aging,Mild Cognitive Impairment,and Alzheimer’s Disease [J].PLoS One,2016,11(7): e0157514.
[47]齊志剛,李坤成,王軍.為更早識別阿爾茨海默病:阿爾茨海默病神經影像學計劃簡介[J].中國現代神經疾病雜志,2014, 14(4):277-280.
[48]靳聰,林嵐,付振榮,等.MRI在阿爾茨海默氏病中的應用研究進展[J].智慧健康,2015,1(1):52-56.
[49]Glasser MF,Smith SM,Marcus DS,et al.The Human Conne ctome Project’s neuroimaging approach[J].Nat Neurosci,2016,19(9): 1175-1187.
Quantitative Analysis of Cognitive Reserve of the Healthy Elder Brain Based on BrainAGE
Cognitive reserve interprets individual differences in susceptibility to deterioration of cognitive functions in the dementia and other brain degradation of brain substance. Traditionally, cognitive reserve is estimated indirectly by measuring static proxy variables. Imaging studies have shown that subjects with neurodegenerative disease have higher brain age gap estimation (BrainAGE) scores due to advanced brain ageing. The present study extends BrainAGE to evaluate cognitive reserve on a cohort of 72 healthy older adults who underwent several neuropsychological tests and structural magnetic resonance imaging (MRI). The result showed that people with lower BrainAGE scores are more resilient than others. These suggest that changes in BrainAGE may capture how brain network dynamically adapts itself to compensate brain damage, and BrainAGE could be an alternative proxy for cognitive reserve than other static cognitive reserve proxies.
cognitive reserve; connectome; BrainAGE; diffusion tensor imaging
LIN Lan, ZHANG Bai-wen, WU Shui-cai
College of Life Science and Bioengineering, Beijing University of Technology, Beijing 100124, China
R445.2
A
10.3969/j.issn.1674-1633.2016.12.003
1674-1633(2016)12-0010-07
2016-11-15
國家科技支撐計劃課題(2015BAI02B03);北京市自然科學基金資助項目(7143171)。
林嵐,副教授。
通訊作者郵箱:lanlin@bjut.edu.cn

