賴氨酸在Maillard 反應中形成有害產物AGEs的研究
李 普 夏秋琴 劉貴梅 盧永翎 呂麗爽
(南京師范大學金陵女子學院,江蘇 南京 210097)
賴氨酸在Maillard 反應中形成有害產物AGEs的研究
李 普 夏秋琴 劉貴梅 盧永翎 呂麗爽
(南京師范大學金陵女子學院,江蘇 南京 210097)
模擬食品加工條件,構建賴氨酸—還原糖和精氨酸—賴氨酸—還原糖體系,分析各影響因素在體系發生Maillard反應中產生有害AGEs(晚期糖基化終末產物)的作用,比較兩個體系添加和不添加黃酮條件下對AGEs形成量的影響。用熒光光譜法(λex /λem =370 / 440 nm)測定AGEs的含量,考察不同因素如還原糖種類、濃度、金屬離子、溫度、pH和染料木素對有害AGEs形成的影響,以及賴氨酸/精氨酸并存對AGEs形成量的影響。結果表明:在賴氨酸發生Maillard反應過程中,溫度越高、還原糖中核糖,糖濃度越大、pH 9.2,形成的AGEs越多;不同的金屬離子對AGEs的作用各異,Mg2+和Fe2+能促進AGEs的形成,Ca2+抑制AGEs的形成;抑制劑染料木素濃度越大(9 mmol/L),AGEs抑制效果越好;賴氨酸/精氨酸混合體系中AGEs形成量主要由賴氨酸來決定。各影響因素對賴氨酸Maillard反應過程中產生AGEs均有一定作用,時間是最主要因素,其次是pH和溫度;而賴氨酸/精氨酸混合體系中AGEs的形成量取決于賴氨酸的含量。
熒光性晚期糖基化終末產物;賴氨酸;美拉德反應;熒光光譜法
加工和貯藏過程中所發生的一些化學變化不僅改變了食品的結構和功能,同時也會產生一些有害物質。美拉德反應(又稱非酶糖基化)對于食品風味、色澤的形成皆具重要作用[1];但是非酶糖基化反應也會產生不可逆轉的晚期糖基化終末產物[2],AGEs是一類物質的總稱,目前已發現20多種AGEs,在體內以多種不同的形式存在,包括羧甲基賴氨酸(CML)、吡咯素、戊糖素、羧乙基賴氨酸(CEL)等[3-4]。AGEs通過在體內蓄積[5-6]可以導致一些疾病的發生,如阿茲海默癥、動脈粥樣硬化、糖尿病病癥、慢性心臟衰竭等[7-9]。人體試驗[10]研究發現,高AGEs膳食與低AGEs膳食相比,能更為嚴重地損傷II型糖尿病患者的血管功能。
Goldberg等[11]研究表明,肉類以及肉類替代品中AGEs的含量平均可以達到43 kU/g;脂肪類食品中AGEs可達到100 kU/g(1 U≈1.660×10-27kg),平均含量最高,碳水化合物類食品中AGEs僅為3.4 kU/g,平均含量最低。房紅娟等[12]研究發現油炸類食品(如麻花、油條等)的AGEs含量均在100 AU之上,麻花、油條分別達到(186.365±1.337),(100.553±1.981) AU。Koschinsky等[13]研究認為,大約10%的食源性AGEs與體內循環系統和組織中的AGEs有著密切聯系。其中賴氨酸含有兩個氨基(伯),因此由賴氨酸及蛋白質賴氨酸殘基引發的糖基化反應最為普及,廣泛引起食品界關注,所以,構建賴氨酸還原糖體系并研究不同因素對該體系中熒光性AGEs形成的影響,具有一定的現實意義。
部分AGEs具有一定的熒光吸收,其熒光強度隨著體系中AGEs濃度的增大而增大[14]。熒光光譜法(λex = 340~370 nm和λem = 420~440 nm)可以較為直觀地表征Maillard反應中熒光性AGEs的總含量。本試驗針對還原糖濃度、金屬離子、溫度、pH和染料木素等各影響因素,分析各因素對賴氨酸—還原糖體系中AGEs形成的影響,并確定主要因素。進而結合實驗室前期精氨酸—還原糖試驗結果[15],分析賴氨酸—精氨酸—還原糖體系中決定AGEs形成關鍵因素。
1 材料與方法
1.1 試驗試劑與儀器
1.1.1 試劑
精氨酸、賴氨酸:分析純,上海生物生工有限公司;
果糖、半乳糖、葡萄糖、核糖:分析純,上海國藥化學試劑有限公司;
染料木素:分析純,南京廣潤生物制品有限公司
1.1.2 儀器
數字式pH計:PHS-3C型,上海三信儀表廠;
TECAN多孔酶標儀:Infinite 200Pro型,瑞士帝肯貿易有限公司;
微型漩渦混合儀:XW-80A型,上海滬西分析儀器廠有限公司。
1.2 試驗方法
1.2.1 糖的種類和濃度對賴氨酸引發的Maillard反應中有害產物AGEs的影響 參照文獻[15]建立賴氨酸—還原糖體系,測定不同還原糖種類和濃度條件下,λex/λem=370 nm/440 nm處熒光值。
1.2.2 溫度對賴氨酸引發的Maillard反應中有害產物AGEs的影響 參照文獻[15]的方法模擬食品加工條件構建賴氨酸—還原糖反應,測定不同溫度條件下λex/λem=370 nm/440 nm處熒光值,即AGEs的量。
1.2.3 金屬離子對賴氨酸引發的Maillard反應中有害產物AGEs的影響 參照文獻[15]的方法模擬食品加工條件構建賴氨酸—還原糖反應,測定5種金屬離子各自存在時體系中AGEs量。
1.2.4 pH對賴氨酸引發Maillard反應中有害產物AGEs的影響 參照文獻[15]的方法模擬食品加工條件構建賴氨酸—還原糖反應,測定不同pH條件下,體系中AGEs量。
1.2.5 染料木素含量對賴氨酸引發Maillard反應中有害產物AGEs的影響 參照文獻[15]的方法模擬食品加工條件構建賴氨酸—還原糖體系,測定添加不同濃度(1.5~9.0 mmol/L)染料木素時,體系中AGEs的量。
1.2.6 賴氨酸/精氨酸—葡萄糖體系中有害產物AGEs的測定 用0.2 mol/L pH 7.4的磷酸鹽緩沖液分別配置濃度為1,2,3 mmol/L的賴氨酸和精氨酸溶液各25 mL,配置濃度為4 mmol/L的葡萄糖溶液50 mL。在不同的10 mL試管中分別加入最終摩爾濃度比為1∶1∶4,1∶2∶4,1∶3∶4,2∶1∶4,3∶1∶4的賴氨酸、精氨酸和葡萄糖溶液各2 mL,再加2 mL PBS。以磷酸鹽緩沖液代替氨基酸溶液做空白對照,參照文獻[15]的方法測定體系中AGEs量。
1.2.7 染料木素抑制賴氨酸/精氨酸—葡萄糖體系中有害產物AGEs的測定 根據1.2.6的試驗結果,選取其中熒光值最高的一組濃度(賴氨酸∶精氨酸∶葡萄糖=3∶1∶4)進行本組實驗。分別將賴氨酸、精氨酸和葡萄糖溶解于0.2 mol/L pH 7.4的磷酸鹽緩沖液中,分別取2 mL賴氨酸,2 mL精氨酸,2 mL葡萄糖于10 mL樣品管中,使賴氨酸、精氨酸和葡萄糖的最終濃度分別為3,1,4 mmol/L,加入2 mL染料木黃酮溶液,使其濃度為1.5,3,6,9 mmol/L。參照文獻[15]的方法測定體系中AGEs量。
1.3 數據分析方法
采用Excel2010、Minitab16分析數據。
2 結果與討論
2.1 賴氨酸—糖體系發生Maillard反應產生有害產物AGEs的研究
2.1.1 糖的種類和濃度對賴氨酸-還原糖體系中有害產物AGEs的作用 圖1結果表明,反應240 min時,在4種賴氨酸—還原糖體系中,還原糖的濃度越大,體系中熒光性AGEs的形成量就越多。其中在賴氨酸—核糖模型中形成的熒光性AGEs的量最高,而果糖、半乳糖、葡萄糖誘導產生AGEs的量相差不大;核糖在糖濃度為3 mmol/L時體系中,產生的AGEs量大約是另外3種糖分別與賴氨酸反應形成AGEs量的2倍。原因推測核糖為五碳糖,果糖、半乳糖、葡萄糖為六碳糖,而五碳糖的反應活性和速率遠大于六碳糖[16]。Bunn等[17]研究表明,葡萄糖99%以上的六元環結構是高度穩定的,相對于其它糖類不容易受到來自其他分子的親和攻擊;與此同時,葡萄糖以其環狀結構高度穩定性,限制蛋白質發生潛在有害的非酶糖基化反應。Jalbout等[18]也證實開環的核糖更易形成Amadori產物,因而比環狀的六碳糖反應要快。
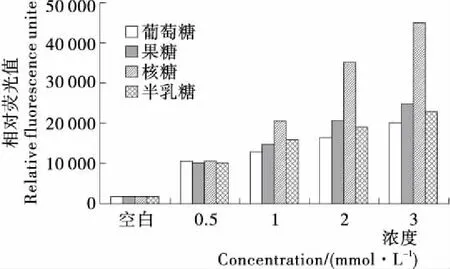
圖1 糖的種類和濃度對賴氨酸—還原糖體系中有害產物AGEs的作用
將該試驗結果與本課題組[15]前期報道的Arg還原糖體系的結果相對比,盡管AGEs的總量偏高,但還原糖濃度和種類的變化對兩種氨基酸體系熒光性AGEs的量帶來的影響,差異性不顯著。
2.1.2 溫度對賴氨酸—還原糖體系中有害產物AGEs的作用 圖2是反應時間為240 min時,溫度對賴氨酸—還原糖模擬體系產生熒光性AGEs的影響。由圖2可知,溫度對賴氨酸—還原糖模型中熒光性AGEs的形成有很大的影響;且溫度越高,產生的熒光性AGEs越多。在較低溫度(37,60 ℃)下,熒光性AGEs形成量無明顯變化;當溫度≥85 ℃時,隨著溫度的升高,體系中熒光性AGEs的形成量顯著增加,并在121 ℃時達到最高值。很顯然是因為高溫促進了美拉德反應的進程。對比4種不同的還原糖可知,核糖體系產生的熒光性AGEs最多,其他3種還原糖產生的AGEs量差別不大。相比前期發表的Arg還原糖模型[15],Lys還原糖模型相同條件下產生的熒光性AGEs含量均高于Arg模型,最高差別約1倍以上;且不同還原糖之間差異較大。
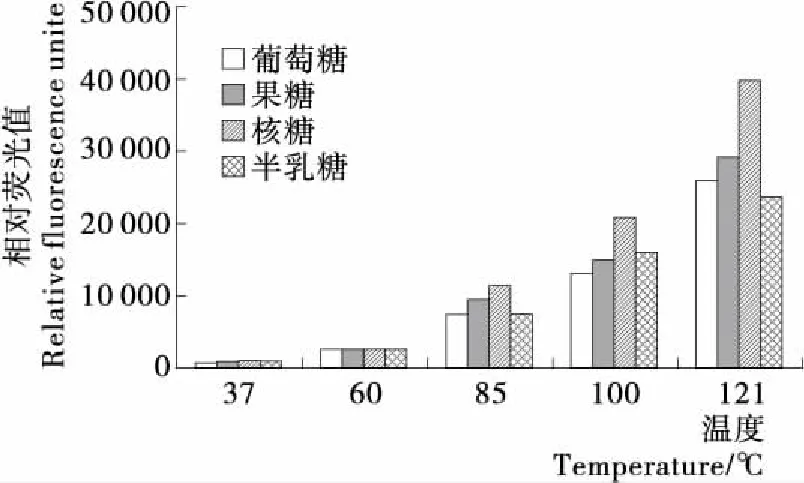
圖2 溫度對賴氨酸—還原糖體系中有害產物AGEs的作用
2.1.3 金屬離子對賴氨酸—還原糖體系中有害產物AGEs的作用 圖3為賴氨酸—還原糖模擬體系中,金屬離子對熒光性AGEs形成的影響。由圖3可知,不同金屬離子對體系中熒光性AGEs的形成影響不同。其中,Ca2+會抑制體系熒光性AGEs的產生,Mg2+和Fe2+會促進熒光性AGEs的形成,而其他金屬離子的作用效果則不明顯。這是因為金屬離子可以促進氫過氧化物的降解,從而促進自由基生成,而自由基在AGEs的生成中起著重要的作用[19]。Ramonaityte等[20]的研究表明過渡金屬離子如Fe3+、Fe2+等會通過催化作用形成自由基而促進AGEs的產生。
但在本課題組[15]前期研究的Arg—還原糖模型中,5種金屬離子均會增加體系中熒光性AGEs產生的量,而且不同金屬離子在不同還原糖模型體系中的作用效果不同。在核糖和果糖體系中,金屬離子誘導產生的熒光性AGEs量比較大,其次是半乳糖,葡萄糖體系影響最低。金屬離子對兩種氨基酸糖基化反應的差異性原因有待進一步研究。
2.1.4 pH對賴氨酸—還原糖體系中有害產物AGEs的作用 圖4為反應240 min時,pH對賴氨酸—還原糖模擬體系熒光性AGEs的影響。由圖4可知,在本研究設定的4種pH(4.0,6.5,7.4,9.2)條件下,pH越偏堿性,體系的熒光性AGEs的形成量就越高,pH 9.2時產生的熒光性AGEs含量最高,而pH 4.0時產生量較少。這是由于在偏酸性條件下,Maillard的前體物質N-葡萄糖胺容易被水解,從而導致反應速率降低[21];堿性條件能顯著促進美拉德反應尤其是其后期反應的進行[22]。在4種還原糖模型中,形成熒光性AGEs量最大的體系為賴氨酸—核糖,反應強度最大,其他糖反應活性依次排序為果糖、半乳糖和葡萄糖。該反應趨勢與前期精氨酸試驗[15]結果相一致。
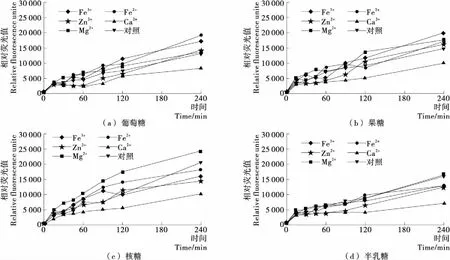
圖3 金屬離子對賴氨酸—還原糖體系中有害產物AGEs的影響
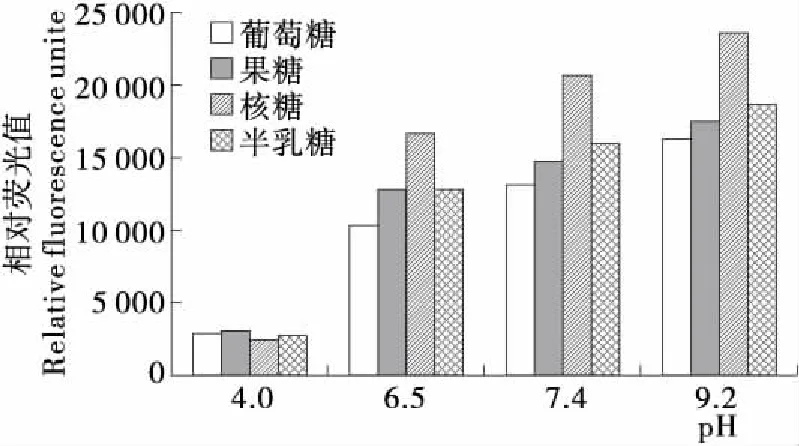
圖4 pH對賴氨酸—還原糖體系中有害產物AGEs的影響
2.1.5 染料木素對賴氨酸—核糖體系中有害產物AGEs的影響 圖5為賴氨酸—還原糖模擬體系中,染料木素對熒光性AGEs形成的影響。由圖5可知,染料木黃酮的濃度越大、反應的時間越長,其抑制效果越好。當時間為240 min、染料木素濃度為9 mmol/L時,熒光性AGEs的抑制率達到96%,效果良好。該試驗結果與前期研究[15]精氨酸—糖體系的抑制率95%相一致。表明黃酮對不同的糖基化體系均能達到顯著的抑制效果。Jung D. H等[23]研究發現染料木素能阻斷AGEs與多種不同的細胞表面受體RAGE的結合,AGE—RAGE交聯導致病變。染料木素含量越高,阻斷效果越好。2.1.6 各影響因素對體系中有害產物AGEs的貢獻值分析 如表1所示,在賴氨酸—還原糖模擬體系中,影響熒光性AGEs產生的因素,第一位是時間,其次是pH,第三是溫度。而其他因素對體系熒光性AGEs的形成所占比例較低且相差不大。對照前期研究[15]精氨酸—還原糖體系,前3個主要影響因素依次為時間、還原糖種類和pH。由此,不同氨基酸發生糖基化反應過程中,對比各影響因素的貢獻值發現,時間是關鍵因素,其次是對pH的敏感性,而溫度和還原糖種類相差較大。
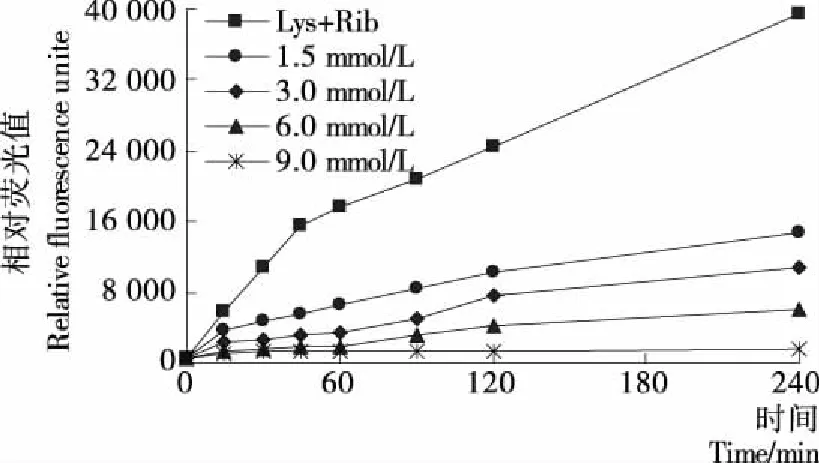
圖5 染料木素對賴氨酸—核糖體系中有害產物AGEs的影響
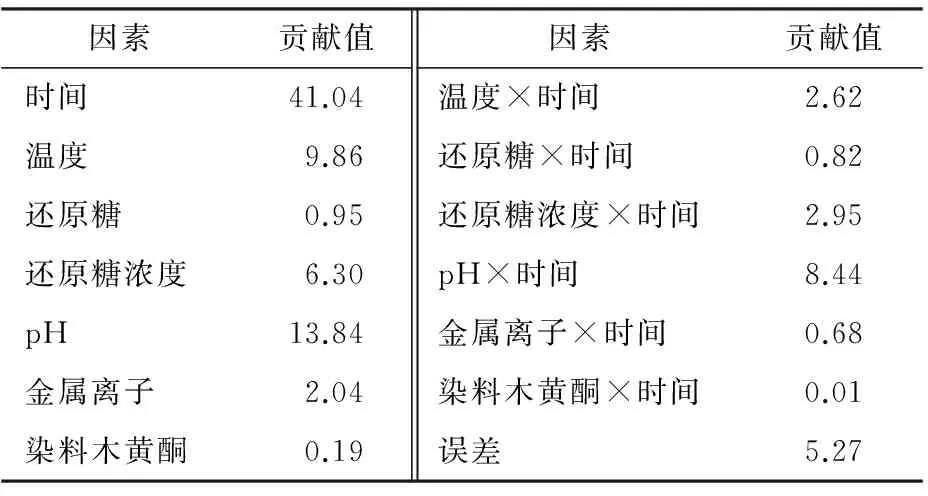
因素貢獻值因素貢獻值時間41.04溫度×時間2.62溫度9.86還原糖×時間0.82還原糖0.95還原糖濃度×時間2.95還原糖濃度6.30pH×時間8.44pH13.84金屬離子×時間0.68金屬離子2.04染料木黃酮×時間0.01染料木黃酮0.19誤差5.27
2.2 賴氨酸/精氨酸—葡萄糖體系產生熒光性AGEs的研究
2.2.1 賴氨酸/精氨酸—葡萄糖體系熒光性AGEs的產生情況 鑒于不同氨基酸發生糖基化反應的差異性,以及在食品體系中多種氨基酸的共存,選取兩種易于與還原糖發生美拉德反應的氨基酸,賴氨酸(兩個伯氨基)、精氨酸(多氨基),建立賴氨酸/精氨酸—葡萄糖體系。由圖6可知,賴氨酸/精氨酸—葡萄糖體系中,相對熒光值RFU隨著賴氨酸比例的增大而提高,但精氨酸比例提高則幾乎沒變化。本課題的前期研究[15]表明在精氨酸—葡萄糖體系中,隨著時間的延長,相對熒光值RFU在240 min即可達到20 000。而當兩種氨基酸共存發生Maillard反應時,體系中AGEs的產生主要由賴氨酸的含量來決定,推測其原因可能是,兩分子賴氨酸可以發生交聯作用(賴氨酸—賴氨酸—糖)[24],另外賴氨酸與精氨酸也進行交聯反應(賴氨酸—精氨酸—糖)[24]。
2.2.2 染料木素對賴氨酸/精氨酸—葡萄糖體系AGEs形成的影響 圖7是染料木素對賴氨酸/精氨酸—葡萄糖體系產生熒光性AGEs的影響。由圖7可知,在添加染料木素后,賴氨酸/精氨酸—葡萄糖體系中相對熒光值RFU明顯下降,3組試驗的RFU在反應前2 h均下降到了半值以下。且其抑制率與染料木素的添加量呈量效關系,染料木素的濃度越大,抑制率越高,說明染料木素對賴氨酸/精氨酸共存體系中熒光性 AGEs的產生有明顯的抑制作用。
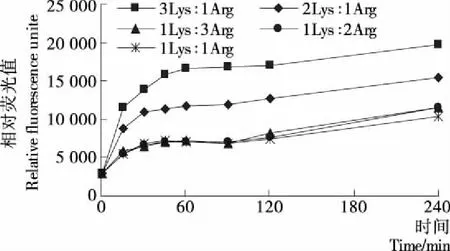
圖6 賴氨酸/精氨酸—葡萄糖體系AGEs的產生
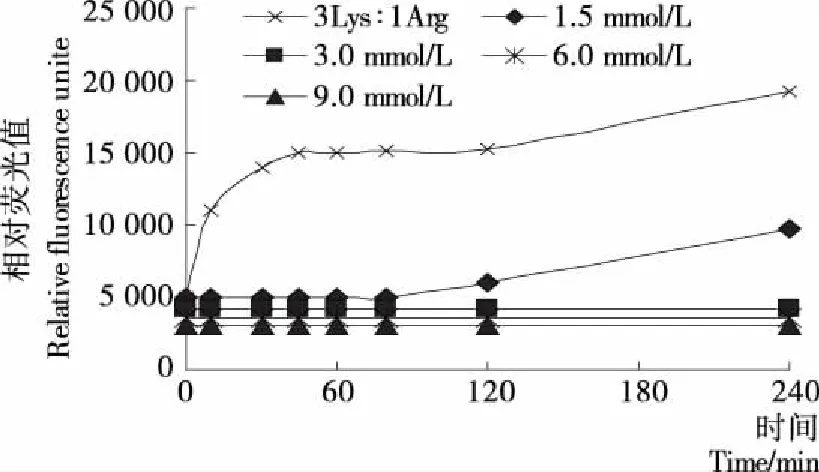
圖7 染料木素對賴氨酸/精氨酸—葡萄糖體系AGEs形成的影響
3 結論
各種影響因素對于賴氨酸—還原糖體系中熒光性AGEs的產生皆有明顯的影響。當反應時間為定值時,溫度、還原糖濃度和pH越高,產生熒光性AGEs的量就越高;染料木素的濃度越大對熒光性AGEs的抑制效果越好,且有顯著抑制作用。通過分析各個影響因素的貢獻值,反應時間是賴氨酸—還原糖體系產生熒光性AGEs的決定性因素,其次為pH;第三為溫度,其他因素對熒光性AGEs產生的影響較小且差別不大。當賴氨酸和精氨酸共存時,賴氨酸含量決定混合體系精氨酸/賴氨酸—葡萄糖反應中產生AGEs的量,精氨酸含量的高低影響不大。
[1] WALLER G R, FEATHER M S, MILTON S. The Maillard reaction in foods and nutrition [M]. Washington D C, USA: ACS, 1983: 1-15.
[2] LUEVANO-CONTRERES C, CHAPMAN-NOVAKOFSKI K. Dietary advanced glycation end products and aging[J]. Nutrients, 2010, 2(12): 1 247-1 265.
[3] AHMED M U, THORPE S R, BAYNES J W. Identification of Nε-(carboxymethyl)lysine as a degradation product of fructoselysine in glycated protein[J]. The Journal of Biological Chemistry, 1986, 261: 4 889-4 894.
[4] HENLE T. Protein-bound advanced glycation endproducts (AGEs) and bioactive amino acid derivatives in foods[J]. Amino Acids, 2005, 29(4): 313-322.
[5] URIBARRI J, WOODRUFF S, GOODMAN S. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of the American Dietetic Association, 2010, 110(6): 911-916.
[6] KRAJCOVICOVA-KUDLACKOVA M, SEBEKOVA K, SCHINZEL R, et al. Advanced glycation end products and nutrition[J]. Physiological Research, 2002, 51(3): 313-316.
[7] SMIT A J, HARTOG J W, VOORS A A, et al. Advanced glycation endproducts in chronic heart failure[J]. Annals of the New York Academy of Sciences, 2008, 1 126(1): 225-230.
[8] MEERWALDT R, LINKS T, ZEEBREGTS C, et al. The clinical relevance of assessing advanced glycation endproducts accumulation in diabetes[J]. Cardiovasc Diabetol, 2008, 7(1): 29-29.
[9] BAYNES J W, THORPE S R. Role of oxidative stress in diabetic complications: a new perspective on an old paradigm[J]. Diabetes, 1999, 48(1): 1-9.
[10] NEGREAN M, STIRBAN A, STRATMANN B, et al. Effects of low- and high-advanced glycation endproduct meals on macro- and microvascular endothelial function and oxidative stress in patients with type 2 diabetes mellitus[J]. The American journal of clinical nutrition, 2007, 85(5): 1 236-1 243.
[11] Goldberg T, CAI Wei-jing, PEPPA M, et al. Advanced glycoxidation end products in commonly consumed foods[J]. Journal of the American Dietetic Association, 2004, 104(8): 1 287-1 291.
[12] 房紅娟. 食品加工過程中晚期糖基化末端產物形成及控制研究[D]. 西安: 西北農林科技大學, 2013: 1-46.
[13] KOSCHINSKY T, HE Ci-jiang, MITSUHASHI T, et al. Orally absorbed reactive glycation products (glycotoxins): an environmental risk factor in diabetic nephropathy[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(12): 6 474-6 479.
[14] BOSCH L, ALEGRIA A, FARRE R, et al. Fluorescence and color as markers for the Maillard reaction in milk-cereal based infant foods during storage[J]. Food chemistry, 2007, 105(3): 1 135-1 143.
[15] 夏秋琴, 呂麗爽. 影響精氨酸-還原糖模擬體系熒光性晚期糖基化終末產物形成的因素[J]. 食品科學, 2015, 36(15): 50-55.
[16] DELPHINE L, CLAUDE I, CELINE B, et al. Kinetic study on the Maillard reaction. Consideration of sugar reactivity[J]. Food Chemistry, 2008, 111(4): 1 032-1 042.
[17] BUNN H F, HIGGINS P J. Reaction of monosaccharides with proteins: possible evolutionary significance[J]. Science, 1981, 213(4 504): 222-224.
[18] JALBOUT A F, MAH S, NAVARRO J L. Density functional computational studies on ribose and glycine Maillard reaction: Formation of the Amadori rearrangement products in aqueous solution[J]. Food Chemistry, 2007, 103(3): 919-926.
[19] 房紅娟, 李紅姣, 張雙鳳, 等. 加工條件對 BSA-Glucose 模擬體系中晚期糖基化末端產物形成的影響[J]. 食品科學, 2012, 33(21): 6-10.
[20] RAMONAITYTE D, KERIENE M, ADAMS A, et al. Theinteraction of metal ions with Maillard reaction products in a lactose-glycine model system[J]. Food Research International, 2009, 42(3): 331-336.
[21] 肖懷秋, 李玉珍, 林親錄. 美拉德反應及其在食品風味中的應用研究[J]. 中國食品添加劑, 2005, 69(2): 27-30.
[22] NAGAI R, IKEDA K, KAWASAKI Y, et al. Conversion of Amadori product of Maillard reaction toN-(carboxymethyl)lysine in alkaline condition[J]. FEBS Letters, 1998, 425(2): 355-360.
[23] JUNG D H, KIM Y S, KIM J S. Screening system of blocking agents of the receptor for advanced glycation endproducts in cells using fluorescence[J]. Biological and Pharmaceutical Bulletin, 2012, 35(10): 1 826-1 830.
[24] TESSIER F, MONNIER V M, KORNFIELD J A. Characterization of novel chromophores, fluorophores and cross-links from glyceraldehyde, lysine and arginine[J]. International Congress, 2002, 1 245(6): 303-311.
Studies on formation of AGEs by lysine in maillard reaction
LI PuXIAQiu-qinLIUGui-meiLUYong-lingLULi-shuang
(GinlingCollege,NanjingNormalUniversity,Nanjing,Jiangsu210097,China)
[Purpose] The different influencing factors are investigated on producing AGEs by Lysine in Maillard reaction, and the different between single amino acid (Lysine, or Argine) -reducing and mixed Lys- Arg -reducing sugar system are compared. [Method] Fluorescence spectrometry (λex /λem =370 / 440 nm) is used to detect the amount of AGEs, the factors of sort and concentration of sugar, metal ion, temperature, pH and genistein concentration in Maillard reaction and proportion of lysine and arginine in Lys/Arg-reducing sugar system was discussed. [Result] The increasing of sugar concentration, pH, or temperature, the more amounts of AGEs was produced. Fe2+and Mg2+could promote the formation of AGEs. But metal ion (Ca2+) could inhibit the formation of AGEs; at the present of 9 mmol/L genistein, the inhibitory ratio is the best. The lysine played an important role on the Lys-Arg cross-linking with glucose in Lys/Arg-reducing sugar system. [Conclusion] All the factors have a little bit impact on the formation of AGEs, and genistein can significantly suppress the formation of AGEs. The reaction time is the main point on the formation of AGEs, the second is pH and temperature. Additionally, the lysine played an important role on the formation of fluorescent AGEs in Lys-Arg-glucose system.
advanced glycation end products; lysine; maillard reaction; fluorescence spectrometry
10.13652/j.issn.1003-5788.2016.12.006
國家自然科學基金項目資助(編號:31571783)
李普,男,南京師范大學在讀碩士研究生。
呂麗爽(1969—),南京師范大學副教授,博士。 E-mail: lishuanglv@126.com
2016-09-26

