縫隙連接與神經病理性痛的研究進展
彭力超,梁尚棟
(南昌大學基礎醫學院生理學教研室,江西 南昌 330006)
縫隙連接與神經病理性痛的研究進展
彭力超,梁尚棟
(南昌大學基礎醫學院生理學教研室,江西 南昌330006)
中國圖書分類號:R-05;R322.8;R329.24;R441.1;R741.02
摘要:縫隙連接是介導相鄰細胞間物質轉運、化學或電信號傳遞的專用跨膜通道,維持著細胞內環境的穩定。在神經系統中,縫隙連接不僅介導神經元和膠質細胞的胞間偶合,還參與病理條件下繼發性損害。目前,研究證明縫隙連接在由神經系統損傷引起的神經病理性痛中發揮作用。對縫隙連接與神經病理性痛的關系進行研究有助于更深層次的了解神經病理性痛的發病機制,為治療神經病理性痛提供新的研究方向。
關鍵詞:縫隙連接;連接蛋白;神經系統;膠質細胞;神經病理性痛;縫隙連接阻斷劑
梁尚棟(1957-),男,博士,教授,博士生導師,研究方向:神經生理學與神經藥理學, 通迅作者,E-mail: liangsd88@163.com
縫隙連接(gap junction,GJ)最早由Karrer在1960年發現。經過許多學者的多年研究,對GJ的結構和功能已經有了較深的認識。GJ幾乎存在于所有動物的細胞膜上,由每個細胞提供一個半通道(連接子)緊密結合形成相鄰細胞間的通訊通道,每個半通道由6個相同或相似的跨膜連接蛋白呈環狀排列構成,中央形成一個直徑約1.5~2.0 nm的親水性通道,這是細胞間進行直接交流胞質成分的唯一通訊通道。GJ的通道允許相對分子質量小于1 ku的分子通過,如細胞內的無機鹽離子、糖、氨基酸、核苷酸、維生素、三磷酸腺苷(ATP)、環磷酸腺苷(cAMP)和肌醇三磷酸(IP3)等小分子物質能從一個細胞通過GJ的通道進入另一個細胞,從而實現代謝偶聯或電偶聯[1]。GJ既可以存在于兩種相同類型的細胞間,也能連接兩種不同類型的細胞。例如,在中樞神經系統中,神經元之間、膠質細胞之間(包括星型膠質細胞之間、少突膠質細胞之間和星形膠質細胞與少突觸細胞之間)[2]。與中樞神經系統中的GJ相似,在外周神經系統中,神經元之間和膠質細胞之間也存在GJ。這些細胞通過GJ相互連接形成功能合胞體,在神經沖動信息傳遞及各種反應過程中,通過調節細胞外離子濃度,神經元與神經膠質細胞間的電活動等作用維持著細胞內環境的穩定和神經元功能的實現[3-4]。近年來對于神經膠質細胞與神經元的GJ研究發現,在神經病理性疼痛模型中上述細胞間的GJ明顯增加,并且相關區域的GJ蛋白表達也增加,使用GJ阻斷劑后,疼痛有所緩解。這使得許多研究工作者開始將治療神經病理痛的注意力從神經元轉移到膠質細胞之間的GJ上,這將為后續開發治療神經病理痛的藥物提供一個新靶標。
1縫隙連接的結構、分布和功能
1.1縫隙連接的結構與分布縫隙連接是相鄰細胞間細胞膜上的一種特殊結構,允許細胞間直接進行物質和信息交換,實現相鄰細胞間直接通訊,這種通訊也叫做縫隙連接細胞通訊(gap junctional intercellular communication,GJIC)。縫隙連接通道是由相鄰的兩個細胞各提供一個連接子(connexon)對接形成,兩個連接子之間存在2~3 nm的間隙,因而縫隙連接也稱間隙連接。每個連接子含6個跨膜蛋白質亞單位,即縫隙連接蛋白(connexin,Cx)。由相同Cx組成的連接子稱為同聚體連接子,不同的連接子組成異聚體連接子,同聚體連接子參與構成同型縫隙連接,異聚體連接子參與構成異型縫隙連接[1-2]。每個Cx都具有4個保守的ɑ螺旋跨膜區(M1-M4)、2個胞外環(C1-C2)和3個胞內成分(1個胞內環、1個氨基末端和1個羧基末端)。2個胞外環是Cx最為保守的結構,每個胞外環含有3個半胱氨酸殘基,保證連接子的正確對接。胞內成分中,N端相對比較保守,而C端差異性比較大,攜帶某些磷酸化調節位點。Cx是由多基因家族編碼的一大類膜蛋白,目前已從不同動物和組織中分離出20余種Cx,它們有近50%的氨基酸序列相同。其相對分子質量26 000~60 000不等。Cx是根據它們的分子質量不同來命名的,如Cx43因其分子質量為43 ku而得名[1,3]。
研究表明,除了在精母細胞、紅細胞、血小板、成人骨骼肌上和某些成年神經元群體沒有連接蛋白基因分布外,其他幾乎所有的哺乳動物細胞上均有其分布[1]。在不同的細胞和(或)細胞的不同發育階段,所表達的Cx類型及表達的量都有所不同,有些Cx表達于單一的組織中,而有些組織和細胞同時表達多種類型的Cx。迄今為止,已經確定至少有11種Cx在哺乳動物的神經系統中表達,Cx26、Cx29、Cx30、Cx31、Cx32、Cx33、Cx36、Cx37、Cx40、Cx43、Cx45 均在神經系統中大量表達[3]。其中神經元上表達的主要是Cx26、Cx32 和Cx36,分布尤為廣泛的是Cx32;星形膠質細胞和衛星膠質細胞中表達最多、分布最廣的是Cx43;而在少突膠質細胞中主要表達Cx32[2]。近幾年神經系統的研究表明,除了神經元外,膠質細胞也在神經病理痛中發揮重要的作用。本篇綜述著重于神經系統中的縫隙連接,特別是神經病理性疼痛時外周初級感覺神經節和脊髓膠質細胞上的縫隙連接。
1.2神經系統中縫隙連接的功能
1.2.1神經元中縫隙連接的作用中樞和外周神經系統的神經元大部分區域存在縫隙連接,允許神經元之間進行離子交換,是神經元之間的電突觸結構,具有單向或雙向傳遞神經沖動的功能。哺乳動物中樞神經系統發育過程中 ,通常在出生后2周內,神經元之間的間隙連接偶合和Cx36的表達會瞬時增加,在神經元發育中起到重要的作用[5]。神經元損傷后,代謝型谷氨酸受體激活導致神經元間縫隙連接增加,神經元間的縫隙連接參與了神經元死亡機制,但具體機制仍不明確[6]。GJ是神經活動同步化的關鍵因素之一。大腦中許多功能是以GJ介導的神經活動同步化為基礎的,包括認知功能,例如記憶的鞏固、感知和學習,海馬體中Cx36組成的縫隙連接通道參與短期記憶,并通過改變神經干細胞的分化參與神經元重構[7-8]。此外,神經元之間的GJ允許第二信使在細胞間流動,保證功能區內的細胞生物效應協調一致。
1.2.2膠質細胞中縫隙連接的作用在神經系統中,星形膠質細胞間的縫隙連接研究較多,超微結構顯示這些GJ大部分包圍著神經元的胞體、樹突和軸突。腦類糖原主要貯存在星形膠質細胞中,由于GJ允許小分子代謝物和信號分子通過,由GJ實現細胞間的偶聯,保證正常的生命活動。研究證明,神經沖動時,神經元中大量的K+外流,此時星形膠質細胞K+通道激活,K+大量流入星形膠質細胞內,并迅速通過GJ運送到相鄰細胞內,達到清除細胞外K+,維持神經元外環境K+的穩態的功能,保證神經元電活動的正常進行[9]。神經損傷后,誘發脊髓中星形膠質細胞K+通道關閉,導致其縫隙連接蛋白功能中斷,從而誘發神經性疼痛[10]。此外,星形膠質細胞間的GJ是膠質細胞長距離信號傳播的生物基礎。膠質細胞受刺激后,細胞內的Ca2+濃度發生改變,通過GJ使其它偶聯的膠質細胞內的Ca2+濃度也發生改變,即形成Ca2+波(calcium wave) 。膠質細胞通過Ca2+波調節神經系統的功能[11]。對衛星膠質細胞間的縫隙連接研究發現其功能大部分與脊髓中的星形膠質細胞相似,包括調節外周神經系統的外環境,維持神經元的穩態和功能[12],由于對其研究較少,具體的功能還有待進一步的研究確定。
1.2.3神經元與膠質細胞之間縫隙連接的作用神經元與膠質細胞之間是否存在GJ一直存在爭議。Rash等[13]運用免疫細胞化學、電鏡等技術發現,在成年大鼠大腦內神經元只與其它神經元存在GJ,與膠質細胞不存在GJ。在體外共同培養神經元與膠質細胞的實驗發現膠質細胞內刺激產生的Ca2+波能傳遞到神經元內,使神經元興奮,且GJ阻斷劑-辛醇可減弱這種信號的傳遞[14],此研究提示神經元與膠質細胞間存在GJ。在免疫電鏡下觀察戊四氮點燃大鼠海馬組織發現,神經元與星形膠質細胞之間存在Cx43構成的半通道[15],這與劉煜等對實驗性自身免疫性腦脊髓炎豚鼠的研究結果一致。但由于實驗技術的局限性,這些結果未完全使人信服,神經元與膠質細胞之間是否存在縫隙連接以及其存在的意義,仍有待進一步的研究探明。
2縫隙連接與神經病理痛
2.1神經病理性痛國際疼痛研究協會(IASP)將神經病理性疼痛(neuropathic pain)定義為由軀體感覺系統的損傷或疾病而直接引起的疼痛[16],包括痛性糖尿病神經系統病變、三叉神經痛、坐骨神經痛和脊髓損傷性疼痛等。神經病理痛,簡稱神經痛,分為外周性和中樞性兩種,屬于慢性疼痛。神經痛的發病率較高,最近一項流行病學調查顯示其發病率在普通人中已經超過8%。神經病理痛患者感到異常疼痛,常伴有睡眠障礙、焦慮、抑郁、精神萎靡、注意力分散、食欲減退,嚴重影響病人的生活質量。目前,神經病理痛發病的分子機制仍不夠清楚,導致多種因素引發的神經病理痛得不到有效的治療。近幾年發現縫隙連接參與神經病理痛,關于這方面的研究仍比較少,從縫隙連接方面來研究神經病理痛的防治,將為神經病理痛的治療帶來一個新的研究方向。
2.2縫隙連接與神經病理痛周圍神經損傷可能導致機械和熱痛敏,并增強背角神經元的興奮性。神經損傷后,鄰近的神經膠質細胞也可能在脊髓傷害信號的傳遞中發揮重要作用[17]。膠質細胞間交流的基本機制是通過縫隙連接,允許第二信號(如環磷酸腺苷、三磷酸肌醇)、離子和小親水性分子(如ATP)在細胞之間自由通過。大量的研究表明,膠質細胞間的縫隙連接可能在神經病理性疼痛中發揮重要作用[18]。縫隙連接在神經病理痛中的作用機制見Fig 1[3]。
神經損傷可以誘發感覺神經元和膠質細胞的異常活動而產生疼痛。損傷后,膠質細胞最明顯的變化是膠質細胞間縫隙連接數目增加以及對ATP的敏感性增強。人們普遍認為,活化的神經膠質細胞誘導中樞敏化并釋放一些化學物質,如促炎性細胞因子(IL-1β、IL-6、TNF-α)加劇疼痛。ATP作用的P2X受體如小膠質細胞上的P2X7受體的活化是促炎細胞因子釋放的必不可少因素[18]。最初認為星形膠質細胞和小膠質細胞的活化是對脊髓損傷(spinal cord injury)所造成傷害的一種神經保護性反應,但激活如果一直持續,激活的神經膠質細胞就會發生繼發性損害,誘發神經元和膠質細胞死亡,將神經損傷作用蔓延。在外周損傷區域,繼發性損傷與ATP高水平持續釋放一致。雖然ATP的來源仍然有爭議,但已證明細胞外高水平的ATP能激活小膠質細胞和白細胞上的P2X嘌呤受體,尤其是激活P2X7受體后可促進宿主細胞因子和促炎分子的分泌(如ROS、IL-1β、 IL-6、TNF-α)[19]。這些細胞因子是脊髓中神經細胞的致敏源,有助于形成神經病理性疼痛[20]。此外,用藥物阻斷和基因缺失方法抑制P2X受體能減輕動物疼痛行為。因此,活化細胞的P2X受體是神經病理性疼痛形成過程中的一個重要環節。早期的研究顯示,脊髓損傷后有大量釋放的ATP[19]。然而,如Cx43的基因缺失,脊髓損傷后的脊髓星形膠質細胞外ATP的濃度明顯降低。由于縫隙連接通道的結構顯示它們有外排高濃度的ATP的作用,由此認為縫隙連接通道是ATP釋放的重要途徑。研究表明嘌呤信號在神經病理性疼痛中發揮重要作用,因此縫隙連接在神經病理性疼痛中的作用需要進一步深入研究。
2.2.1脊髓中縫隙連接與神經病理痛越來越多的研究表明,脊髓中的膠質細胞,特別是星形膠質細胞中的GJ可以在各種病理性疼痛病癥(包括神經性疼痛)中發揮重要作用[17,21]。在病理條件下,一些化合物如神經遞質、生長因子、肽和細胞因子的異常釋放可影響連接蛋白的表達并影響縫隙連接通道的通透性。研究顯示,活化的脊髓星形膠質細胞可能有助于維持背角神經元的過度興奮,導致在組織和神經損傷后痛覺信息在脊髓中的傳遞加強[20]。脊髓損傷后,星形膠質細胞出現的一個顯著特征是高表達Cx43。患者化療引起的神經病變表現為星形膠質細胞活化增多和Cx43的表達增加。大鼠L5脊髓神經節結扎(spinal nerve ligation,SNL)建立的神經病理痛模型實驗顯示,給SNL大鼠鞘內注射Cx43蛋白的siRNA后能緩解SNL大鼠的機械性痛覺超敏反應[22]。神經損傷后,Cx43的表達迅速上調,引發通過GJ偶聯的細胞內Ca2+大量內流,并釋放谷氨酸,從而增強神經的敏感受性,導致神經細胞過度興奮而死亡。發生在脊髓背角內的這些效應有助于形成神經病理痛。此外, Cx43可密集地分布在參與痛覺傳導的脊髓背角膠質細胞內[23]。由于Cx43蛋白是星形膠質細胞間縫隙連接的主要連接蛋白,并能夠協調膠質細胞網絡的同步活動,損傷后Cx43半通道過度表達和星形膠質細胞間縫隙連接偶合增強,可能影響神經元的活動誘發疼痛。雖然已經明確在神經病理痛條件下脊髓星形膠質細胞中Cx43表達和功能會發生變化,但對于Cx43變化的機制仍不清楚。
2.2.2背根神經節中縫隙連接與神經病理痛哺乳動物的感覺神經節,特別是背根神經節(dorsal root ganglia,DRG)在傳遞感覺信號的過程中有重要的作用而受到研究者的關注。目前已有較多研究證明,感覺神經受損后導致DRG神經元形態和電活動等發生變化而產生神經病理痛。而DRG中衛星膠質細胞間的GJ參與神經病理痛的發生的研究到最近才受到重視。
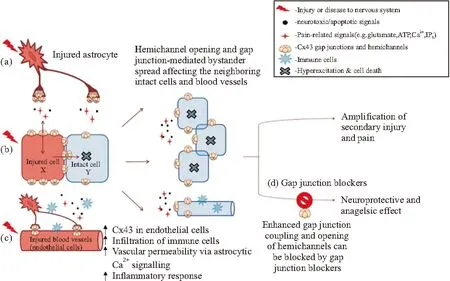
Fig 1 Role of gap junctions in chronic pain following nervous system injury. Injury to the nervous system leads
A: Upregulation of cell-to-cell coupling and of gap junction hemichannels, in particular Cx43 channels, in glial cells (e.g., astrocytes in spinal cord and satellite glial cells in dorsal root ganglion) is commonly seen following nervous system injury and inflammation and can contribute to neuronal cell death, expansion of secondary injury, and pain responses by transmission of metabolic stress and pain-related substances. b: Opening and upregulation of hemichannels following injury may facilitate rapid bidirectional transmission of neurotoxic substances in and out of the injured cells, thereby affecting healthy neighboring cells, whereas direct cell-cell coupling can pass death signals. c: Injury-induced opening and upregulation of endothelial gap junction channels increases vascular permeability and hemorrhage, subsequently facilitating infiltration of immune cells and exacerbation of inflammatory reactions. d: The enhanced gap junction coupling can be modulated via gap junction blockers, which disrupt channel permeability and prevent the spread of secondary injury and amplification of pain. (Color figure can be viewed in the online issue, which is available at wileyonlinelibrary.com.)
Hanani等[4]第一次證明神經損傷可引起外周神經節的一種特殊的膠質細胞-衛星膠質細胞(satellite glia cells,SGCs)間的GJ增多。這種外周神經膠質細胞通過縫隙連接通道高度偶合,大部分SGCs緊密的包繞著感覺神經節神經元的胞體,包繞數量與神經元胞體大小成正比。SGCs通過縫隙連接成對存在,并且表達嘌呤受體。SGCs可以釋放細胞因子、ATP和其他化學信使,它與星形膠質細胞有許多共同點,包括調節外周神經元的穩態,從而保證神經元的正常活動[24]。SGCs主要是通過調控縫隙連接、鉀離子通道和衛星膠質細胞攝取細胞外谷氨酸的能力來維持神經元外環境穩態的。SGCs與外周神經元的信息交流主要通過興奮性神經遞質谷氨酸和ATP信號通路與嘌呤受體進行的,神經損傷后,這些功能活動紊亂,導致疾病發生[25]。如神經損傷后SGCs上的P2X7受體激活,ATP信號通路開放,進而調節DRG神經元P2X3受體影響痛覺[24]。化療引起的外周神經病變能引發神經病理痛,Warwick等[26]用奧沙利鉑或紫杉醇等抗癌藥物注射至大鼠體內建立神經病理痛模型,結果發現,SGC的標志物膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)表達增加,SGCs間的GJ比正常狀態增加了2~5倍。 這與在實驗性自身免疫性腦脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠模型中觀察到的結果一致[27]。
有證據表明,在神經系統受損后,GJ的增加參與了膠質細胞活化的部分過程(Fig 1)。GJ的增加實現了DRG中衛星膠質細胞和神經元之間的遠距離連接通訊,并影響神經元的興奮性和相鄰的感覺神經元的自發放電。神經受損后使SCGs激活,進而釋放炎性細胞因子(IL-1β、IL-6和TNF -α)、一氧化氮和前列腺素等,GFAP表達上調,這與受損后星形膠質細胞的變化類似[28]。初級感覺神經節中神經膠質細胞間傳輸信號的一種方式是形成細胞間鈣波,SGCs和神經元之間這種信號傳遞是雙向的。鈣波的傳遞依賴于偶聯的細胞間第二信使(如IP3、ATP)的擴散,而第二信使的擴散需要借助于縫隙連接通道來完成。神經受損后,激發神經元動作電位的改變,誘發神經元釋放ATP, ATP激活神經元以及包繞著神經元的SGCs上的嘌呤受體,誘發這些細胞內的Ca2+濃度增加。Ca2+濃度增加誘發SGCs釋放更多的ATP[26]。受損后間縫隙連接增加,細胞釋放的ATP將能通過縫隙連接通道更多的作用于周圍細胞的嘌呤受體,影響Ca2+通道的開放,從而調節細胞內外的Ca2+濃度,造成更強的鈣波在神經節間傳播,這將導致初級感覺神經節的神經元過度興奮,而引發疼痛。另一方面,神經受損后,神經元興奮性增加,導致細胞外鉀離子(K+)濃度升高,SGCs間縫隙連接增加是一種神經元的保護措施,可使K+更有效的再分配,起到緩沖作用,不至于激增的K+改變細胞外環境,同時能使有害物質遠離神經元[9]。
近年來,已對Cx43表達的變化和疼痛之間的關聯進行過較為詳細的研究。研究表明,損傷能誘導 Cx43蛋白表達的變化,Cx43介導神經元的敏化作用。研究證明,缺血后Cx43表達受抑制是一種神經保護方式,神經損傷后Cx43表達減少能鎮痛。有趣的是,減少非損傷大鼠中Cx43的表達可增加大鼠的疼痛行為[28],出現這種情況可能是正常的縫隙連接功能出現紊亂,使其對細胞內K+的緩沖能力降低,導致神經元過度興奮而自發放電。因此,沉默Cx43的表達對神經受傷的動物具有鎮痛作用,而對于正常動物卻能誘發早期疼痛。CX43參與疼痛的機制還需要進一步的研究。
2.3縫隙連接阻斷劑與神經病理痛隨著縫隙連接在神經病理痛中重要作用的發現,研究人員致力于縫隙連接阻斷劑對神經病理疼痛治療作用的研究。目前,用于此研究的膠質細胞間的GJ阻斷劑主要有甘珀酸(carbenoxolone,CBX)、甲氯滅酸(meclofenamic acid,MFA)和棕櫚油酸(palmitoleic acid,PA)等。在內臟痛模型中,注射上述3種藥物后,能阻滯SGCs和神經元間由于損傷而誘發的病理變化,并可明顯地緩解疼痛[20]。縫隙連接阻斷劑中研究最多的是CBX(18-甘草次酸的衍生物),它能消除SGC和神經元之間由于損傷而引起的縫隙連接偶合,減弱由損傷引起的周圍炎性疼痛行為,在持續性疼痛的各種動物模型中產生鎮痛作用[20]。在SNL模型建模成功2~3周后鞘內注射CBX可減弱SNL大鼠的熱痛敏反應。電生理方法研究顯示,與鞘內藥物相似,SNL大鼠脊髓局部注射CBX也能減弱神經元對機械刺激和反復性皮內電刺激的反應。故SNL模型大鼠鞘內注射CBX對神經病理性疼痛的抑制作用可能涉及縫隙連接通道的抑制,進而減弱背角神經元的電活動[22]。同樣,眶下神經部分切斷誘發疼痛和中樞敏化的疼痛模型中,鞘內注射CBX能影響神經切斷引起的機械激活閾值,改變延髓背角中樞敏感參數,這些結果表明,縫隙連接可能與口面部神經性疼痛機制有關[23]。在對化療引起神經病理痛的小鼠注射CBX后,幾乎完全阻斷SGCs間的縫隙連接通道,結果觀察到染色的42個SGCs間的縫隙連接通道中只有一個偶合。同時,注射CBX后能提高化療處理小鼠的疼痛閾值,與注射棕櫚油酸產生同樣的鎮痛作用。因此,縫隙連接阻滯劑對化療引起的神經病理性疼痛具有治療作用[26]。
CBX是Cx43縫隙連接和半通道的有效阻斷劑,它可結合縫隙連接通道,并誘導其構象發生變化以關閉通道[18]。研究表明,CBX還可以阻止其他通道,如脊髓星形膠質細胞中與P2X7受體相關的pan-1通道[29]。此外,新近的研究顯示,CBX可以調節突觸傳遞和神經元膜的通透性,并增加神經元中活性氧的形成,通過調節陰離子通道控制星形膠質細胞的體積,抑制小膠質細胞中IL-23的表達[30]。CBX影響疼痛的一種機制可能是通過抑制半通道,進而抑制神經膠質介質(如促炎性細胞因子,ATP和谷氨酸鹽)的釋放產生鎮痛作用(Fig 1)。盡管CBX有上述的作用,但由于注射的阻斷劑分布至全身,很難確定它們精確的作用位置,對此尚待進一步的研究確定。
3結語
綜上所述,膠質細胞縫隙連接參與了神經損傷后引起的神經病理痛過程。越來越多的研究表明,阻斷背根神經節和脊髓的縫隙連接通訊和半通道開發有助于緩解神經病理疼痛。但目前對縫隙連接在痛覺調制中的作用機制尚未完全清楚,這需要我們對縫隙連接蛋白的調控和功能做更深入的研究,損傷后縫隙連接蛋白在背根神經節和脊髓表達增加,縫隙連接阻斷劑可阻斷縫隙連接蛋白對持續性疼痛產生抑制作用。因此,探尋縫隙連接的新阻斷劑有助于開發治療神經病理痛的新藥物。
參考文獻:
[1]Eugenin E A, Basilio D, Saez J C, et al. The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system[J].JNeuroimmunePharmacol, 2012, 7(3): 499-518.
[2]Cui Y, Masaki K, Yamasaki R, et al. Extensive dysregulations of oligodendrocytic and astrocytic connexins are associated with disease progression in an amyotrophic lateral sclerosis mouse model[J].JNeuroinflammation, 2014, 11: 42.
[3]Wu A, Green C R, Rupenthal I D, et al. Role of gap junctions in chronic pain[J].JNeurosciRes, 2012, 90(2): 337-45.
[4]Hanani M, Huang T Y, Cherkas P S, et al. Glial cell plasticity in sensory ganglia induced by nerve damage[J].Neuroscience, 2002, 114(2): 279-83.
[5]Park W M, Wang Y, Park S, et al. Interplay of chemical neurotransmitters regulates developmental increase in electrical synapses[J].JNeurosci, 2011, 31(16): 5909-20.
[6]Belousov A B. The regulation and role of neuronal gap junctions during neuronal injury[J].Channels(Austin), 2012, 6(5): 390-2.
[7]Allen K, Fuchs E C, Jaschonek H, et al. Gap junctions between interneurons are required for normal spatial coding in the hippocampus and short-term spatial memory[J].JNeurosci, 2011, 31(17): 6542-52.
[8]Hartfield E M, Rinaldi F, Glover C P, et al. Connexin 36 expression regulates neuronal differentiation from neural progenitor cells[J].PLoSOne, 2011, 6(3): e14746.
[9]Hibino H, Inanobe A, Furutani K, et al. Inwardly rectifying potassium channels: their structure, function, and physiological roles[J].PhysiolRev, 2010, 90(1): 291-366.
[10]Wu X F, Liu W T, Liu Y P, et al. Reopening of ATP-sensitive potassium channels reduces neuropathic pain and regulates astroglial gap junctions in the rat spinal cord[J].Pain, 2011, 152(11): 2605-15.
[11]Nedergaard M, Rodriguez J J, Verkhratsky A. Glial calcium and diseases of the nervous system[J].CellCalcium, 2010, 47(2):140-9.
[12]Jasmin L, Vit J P, Bhargava A, et al. Can satellite glial cells be therapeutic targets for pain control[J].NeuronGliaBiol, 2010, 6(1): 63-71.
[13]Rash J E, Yasumura T, Dudek F E, et al. Cell-specific expression of connexins and evidence of restricted gap junctional coupling between glial cells and between neurons[J].JNeurosci, 2001, 21(6):1983-2000.
[14]Nedergaard M. Direct signaling from astrocytes to neurons in cultures of mammalian brain cells[J].Science, 1994, 263(5154): 1768-71.
[15]蘭莉, 蘭怡, 段麗,等.戊四氮致(癎)大鼠海馬神經元與星形膠質細胞間關系的超微結構觀察[J].中華實用兒科臨床雜志, 2013, 28(5): 373-6.
[15]Lan L,Lan Y,Duan L, et al. Observation of ultrastructure of morphological relationship between neurons and astrocytes in hippocampi of pentylenetetrazol-kindled epileptic rats[J].ChinJApplClinPediatr,2013, 28(5): 373-6.
[16]Jensen T S, Baron R, Haanpaa M, et al. A new definition of neuropathic pain[J].Pain, 2011, 152(10):2204-5.
[17]Ji R R, Berta T, Nedergaard M. Glia and pain: is chronic pain a gliopathy[J].Pain, 2013, 154 (Suppl 1): S10-28.
[18]Yoon S Y, Robinson C R, Zhang H, et al. Spinal astrocyte gap junctions contribute to oxaliplatin-induced mechanical hypersensitivity[J].JPain, 2013, 14(2):205-14.
[19]Peng W, Cotrina M L, Han X, et al. Systemic administration of an antagonist of the ATP-sensitive receptor P2X7improves recovery after spinal cord injury[J].ProcNatlAcadSciUSA, 2009, 106(30):12489-93.
[20]Roh D H, Yoon S Y, Seo H S, et al. Intrathecal injection of carbenoxolone, a gap junction decoupler, attenuates the induction of below-level neuropathic pain after spinal cord injury in rats[J].ExpNeurol, 2010, 224(1):123-32.
[21]Ji X T, Qian N S, Zhang T, et al. Spinal astrocytic activation contributes to mechanical allodynia in a rat chemotherapy-induced neuropathic pain model[J].PLoSOne, 2013, 8(4): e60733.
[22]Xu Q, Cheong Y K, Yang F, et al. Intrathecal carbenoxolone inhibits neuropathic pain and spinal wide-dynamic range neuronal activity in rats after an L5 spinal nerve injury[J].NeurosciLett, 2014, 563: 45-50.
[23]Wang H, Cao Y, Chiang C Y, et al. The gap junction blocker carbenoxolone attenuates nociceptive behavior and medullary dorsal horn central sensitization induced by partial infraorbital nerve transection in rats[J].Pain, 2014, 155(2): 429-35.
[24]彭海英,梁尚棟.外周神經節衛星膠質細胞的研究進展[J].神經解剖學雜志, 2012, 28(6): 631-5.
[24]Peng H Y, Liang S D. Research progress on satellite glia cells in peripheral ganglia[J].ChinJNeuroanatomy, 2012, 28(6):631-5.
[25]焦曉翠,張會然,張璇,等.衛星膠質細胞對外周神經元作用的研究進展[J].中國藥理學通報, 2014,30(5):612-4.
[25]Jiao X C, Zhang H R, Zhang X, et al. Research progress in interactions between neuron and satellite glial cell[J].ChinPharmacolBull, 2014,30(5): 612-4.
[26]Warwick R A, Hanani M. The contribution of satellite glial cells to chemotherapy-induced neuropathic pain[J].EurJPain, 2013, 17(4): 571-80.
[27]Warwick R A, Ledgerwood C J, Brenner T, et al. Satellite glial cells in dorsal root ganglia are activated in experimental autoimmune encephalomyelitis[J].NeurosciLett, 2014, 569: 59-62.
[28]Jasmin L, Vit J P, Bhargava A, et al. Can satellite glial cells be therapeutic targets for pain control[J]?NeuronGliaBiol, 2010, 6(1): 63-71.
[29]Shoji K F, Saez PJ, Harcha P, et al. Pannexin1 channels act downstream of P2X receptors in ATP-induced murine T-cell death[J].Channels(Austin), 2014, 8(2):142-56.
[30]Endong L, Shijie J, Sonobe Y, et al. The gap-junction inhibitor carbenoxolone suppresses the differentiation of Th17 cells through inhibition of IL-23 expression in antigen presenting cells[J].JNeuroimmunol, 2011, 240-1: 58-64.
網絡出版時間:2015-1-9 13:37網絡出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.02.003.html
Recent research progress on the role of gap junction in neuropathic pain
PENG Li-chao,LIANG Shang-dong
(DeptofPhysiology,BasicMedicalCollegeofNanchangUniversity,Nanchang330006,China)
Abstract:Gap junctions are specialized transmembrane channels that enable the direct exchange of materials and transfer chemical or electrical signaling between adjacent cells, thus maintaining cellular homeostasis. In the nervous system, gap junction channels not only mediate intercellular coupling between neurons and between glial cells, but also can be involved in secondary damage under pathological conditions. Recently, some studies have shown that gap junctions play an important role in neuropathic pain caused by nervous system damage. Research on the role of gap junctions in neuropathic pain can contribute to a deeper understanding of the pathogenesis of neuropathic pain, providing a new research direction for the treatment of neuropathic pain.
Key words:gap junction; connexin; nervous system; glial cells; neuropathic pain; gap junction blocker
作者簡介:彭力超(1990-),女,碩士生,研究方向:神經生理學與病理生理學, E-mail: 836615177@qq.com;
基金項目:國家自然科學基金資助項目(No 81171184, 31060139, 30860086);第二批江西省“贛鄱英才555工程”領軍人才項目;江西省自然科學基金資助項目(No 20142BAB205028);江西省教育廳科技項目(No GJJ13155)
收稿日期:2014-10-27,修回日期:2014-11-25
文獻標志碼:A
文章編號:1001-1978(2015)02-0157-06
doi:10.3969/j.issn.1001-1978.2015.02.003

