水溶液中電化學還原CO2的研究進展
張現萍,黃海燕,靳紅利,俞英,陳英敦
(1中國石油大學(北京)理學院,北京 102249;2中國石油塔里木油田分公司,新疆 庫爾勒 841000)
水溶液中電化學還原CO2的研究進展
張現萍1,黃海燕1,靳紅利1,俞英1,陳英敦2
(1中國石油大學(北京)理學院,北京 102249;2中國石油塔里木油田分公司,新疆 庫爾勒 841000)
CO2作為一種潛在的碳資源,尋找一種有效的方法轉移利用 CO2一直是社會關注的焦點。水溶液中電化學方法轉化固定 CO2可在室溫和常壓下進行,通過選擇不同電極和電極電勢來改變產物、調控反應速率和選擇性,因而具有潛在的優勢。本文綜述了水溶液中電化學還原CO2的發展現狀,介紹了水溶液中電還原CO2的基本原理和電極上發生的主要反應;總結了水溶液中金屬電極、氣體擴散電極(GDEs)和復合電極等不同電極材料對 CO2還原產物的種類、選擇性以及電流效率的影響;討論了溫度、CO2分壓等還原反應條件對反應速率和電流效率的影響。展望了水溶液中電還原CO2技術的發展前景,認為利用水基溶液中豐富的[H],增強CO2還原產物的燃料化程度,將在環境保護、資源利用和經濟效益方面具有極大價值,符合綠色化學發展理念。
二氧化碳;電化學;還原;電極材料
CO2的固定與轉化能有效緩解社會對化石燃料的依賴和CO2減排之間的矛盾[1-6]。通過傳統的方式CO2可以用于生產尿素、水楊酸和碳酸酯等,也可通過水汽變換生產CO和甲醇等[7-9]。由于CO2化學性質穩定,需采用高溫、高壓或使用催化劑才能使其反應,因此從能源和經濟角度來考慮,選擇溫和條件下利用電化學方法還原固定CO2具有更大發展潛力[10-11]。電還原轉化CO2能將其轉化為燃料和一些有機化合物,如 CO、HCOOH、CH4、C2H4和CH3OH等[10-11]。目前,電還原 CO2體系的電解質主要分為水溶液體系和非水溶性體系兩大類。非水溶性介質的研究方向主要有甲醇等有機溶劑[12]和離子液體[13]。離子液體作為綠色溶劑受到廣泛關注,具有較寬的電化學窗口和良好的導電性,對CO2的溶解能力良好,為CO2電化學還原制取有機酯類提供了一種新型綠色合成方法。在水溶液電解質體系中,利用水溶液中豐富的氫源將CO2加氫轉化成低碳燃料或低碳化工原料,是CO2資源化利用的重要途徑之一,但CO2在水中的溶解度非常小(標準狀態下為0.033mol/L),因此,選擇合適的電極、優化電極組成和結構、研究CO2在電極上的吸附和還原過程是CO2燃料化的重要研究方向。本文將主要介紹水溶液中CO2電還原的研究現狀。
1 水溶液中電還原CO2的反應機理
目前被普遍接受的水溶液中電還原CO2的反應機理如圖1所示[14-16]。
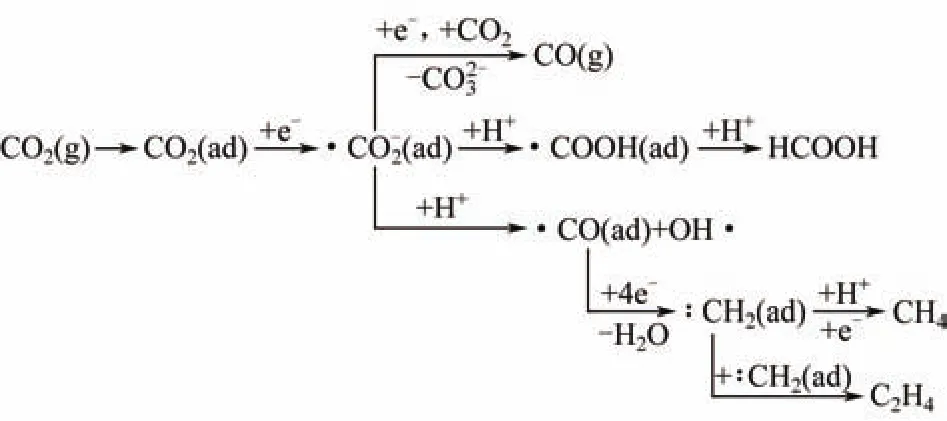
圖1 水溶液中CO2電化學還原機理
電還原CO2第一個階段是吸附。通過吸附,游離的CO2變成吸附態的CO2(ad),然后經過一系列的還原過程生成不同的還原產物。將 CO2(ad)還原為?CO2?的單電子過程,也就是還原活化過程的第一步,所需要的還原電壓為?1.9V,這一步被認為是電還原CO2的速度控制步驟。研究人員普遍認為電還原 CO2的還原階段主要分為 3種情況[14]:①?CO2?(ad)和CO2(g)發生歧化反應生成CO(g);②形成自由基負離子?CO2?后,若電極表面對?CO2?吸附能力較弱的話,?CO2?會發生解吸生成?COOH(ad),最終會生成甲酸;③形成自由基負離子?CO2?后,若電極材料對?CO2?的吸附能力較強,則?CO2?經過后面一系列的還原過程后會生成一系列的終產物,包括CO、烴類和CH3OH。因此,電極材料對CO2的吸附能力較差的話,最終主要產物是H2。同樣若電極表面對中間物種?CO2?(ad)的吸附能力較弱的話,?CO2?(ad)就會容易發生解吸,最終生成 HCOOH。因此,若希望得到一些高附加值的烴類燃料產物,則需要選擇對CO2和?CO2?(ad)吸附能力均較強的電極材料并加強后續的還原過程。
其中電還原 CO2主要發生的反應見式(1)~式(7)(vs. SHE)[17-18]。

CO2是碳元素的最高價氧化物,化學性質非常穩定,還原的過電勢較大,通常還伴有析氫反應。在電還原過程中,電極材料在還原反應中起著至關重要的作用。
2 電極材料
電還原CO2反應的產物分布及選擇性受到很多因素的影響,如反應物濃度、電極電勢、溫度、電極材料和電解質溶液等。其中,電極材料被認為起著決定性作用。Grace等[19-20]認為電極材料之所以能夠起到如此重要的作用,主要是因為不同的電極材料對反應物以及CO2(ad)和?CO2?等中間產物的吸附能力不同。因此在電解實驗中,選擇恰當的電極材料極為重要。目前為止,研究人員已經探索過的電極主要有簡單金屬電極、氣體擴散電極和復合電極三大類。
2.1 簡單金屬電極
自1870年在NaCO3水溶液中用Zn電極電化學還原CO2得到了HCOOH以來,水溶液中CO2在各種金屬電極上的電化學還原反應已被廣泛地研究。金屬材料具有結構簡單、傳導性好、易制備和易獲得等特點。金屬電極電解的產物主要有CH4、C2H4、CO、H2、HCOOH以及各種簡單醇類等。同時,電解反應還原產物還取決于實驗時的溫度、壓強、電極、電勢和電流密度等因素。Azuma等[21-25]在水溶液環境中對多種金屬電解還原CO2的反應進行了研究。研究結果表明:Cd、In、Sn、Pb、Tl、Hg、Zn、Pd、Ti、Ni、Ag、Au和Cu等金屬在電解反應中電流效率較高,其中Cd、In、Sn、Pb、Tl析氫過電位較高,同時對CO吸附能力極弱,因此還原產物主要為HCOOH;Ag、Au和Zn具有中等的析氫電位,對CO的吸附能力較弱,還原產物主要為CO;Al、Si、V、Cr、Mn、Fe、Co、Zr、Nb、Mo和Pt等金屬具有較低的析氫電位,同時對CO的吸附能力較強,因此主要發生析氫反應,其產氫率在90%以上。根據析氫電勢高低將金屬電極的分類結果如表1所示。Azuma等[21]還指出:除了Ti以外,絕大多數的輕金屬都不能有效地還原CO2;ⅡB、ⅢB和ⅣB族的重金屬主要將CO2還原生成HCOOH;ⅧB和ⅠB族的一些金屬可以高效地將CO2還原生成CO。高析氫電位的金屬,如Hg,會抑制氫氣的生成,但同時也會帶來能量的消耗。Cu在電還原CO2時效果很好,Cu可以在5~10mA/cm2的電流密度下將CO2還原為烴類產物(主要是CH4和C2H4),同時獲得了極高的電流效率(>69%)[22-24]。

表1 根據析氫電勢劃分的金屬電極類別[21-25]
2.2 氣體擴散電極(gas diffusion electrodes,GDEs)
在電解還原CO2過程中,電流密度普遍偏低。研究人員發現,CO2在從電解質中轉移到陰極上的傳質過程是造成限制CO2電解轉化的重要因素,尤其當使用對CO2溶解度較小的溶劑為電解質時,如水溶液。采用GDEs在很大程度上可以克服這一難題。GDEs是多孔電極,其具有的孔隙結構有利于氣體擴散,能夠加快傳質過程。Shoichiro等[26]將Cu、Cu和ZnO混合粉末、CuO和ZnO混合粉末分別鍍到氣體擴散電極(GDEs)上作為催化劑,以K2SO4溶液為電解質電解CO2。在Cu-GDEs電極上的產物主要是CH4、C2H4、C2H5OH、CO和HCOOH等。Cu粉末在催化生成CO和烴類時顯示出較高的活性和效率,相較于普通的銅箔電極,利用Cu-GDEs電極催化電解CO2時反應速率提高了100倍左右。Prakash等[27]將市售的Sn顆粒和Nafion溶液混合后與氣體擴散支撐層結合制備Sn-GDEs,然后將獲得的實驗結果與在 Sn金屬圓盤電極和涂覆有錫粉末的石墨盤電極上所得的結果進行比較,發現在Sn-GDEs上的電流密度比金屬Sn圓盤電極上的高出兩個數量級;電解過程中,在?1.6 V時獲得了最大的電流密度為 27mA/cm2,甲酸的法拉第效率為70%,這是在同類文獻報道中對Sn電極在環境條件下電還原CO2電流密度的最高值。Centi等[28]在Pt/CNT結構的GDEs電極上電還原CO2時還檢測到了長碳鏈(>5)的有機物分子,如異丙醇等,雖然含量很低,但是卻讓人們認識到電還原CO2生產液體燃料的應用潛力。經過數十年的研究,GDEs在燃料電池領域和氯堿工業的應用已經相當成熟了,取得的研究成果及相關技術對電還原CO2的研究可以起到很大的啟發作用[29]。
2.3 復合電極(修飾電極)
簡單金屬電極和GDEs在電還原CO2過程中普遍存在過電勢較高、產物選擇性較差和電流效率較低等缺點,新型電極材料或者擁有復合功能的電極材料亟需開發。研究人員發現,通過對電極某種程度上的復合和修飾可以大大改善電極性能,加快反應速率,降低過電勢,提高選擇性,并且達到控制還原產物分布的目的。
近二十年來,導電聚合物,如聚苯胺、聚吡咯、聚噻吩等,由于其質量輕、易成型、電導率范圍寬且可調控等特殊的性質在各個領域得到了極大程度的發展,同時也受到了從事電還原CO2的科研人員的廣泛關注。在利用金屬電極電解還原CO2時還原電勢一般較高,在以往的研究中所需還原電勢一般在?1.7VSCE左右,但是利用導電聚合物電極進行還原反應可以極大地降低還原電勢。Fatih等[30]在PAn/Pt電極上進行電還原CO2時更是將還原電勢降低到?0.4VSCE,產物主要是甲酸和乙酸,法拉第效率分別為12%和78%。Koleli等[31]在聚吡咯電極上以 CH3OH/LiClO4為電解質,在?0.445V電勢下便能將CO2還原成甲酸和乙酸。大量的科研工作表明,用導電聚合物修飾電極能降低CO2的還原電位,而且一般會生成甲酸,同時還獲得了極高的法拉第效率。Grace等[19]在用PAn/Cu2O納米顆粒電極上電還原CO2,在電勢為?0.3V時便得到了還原產物甲酸和乙酸(飽和KCl溶液)。一般情況下大家認為電還原CO2的第一步是先生成COO·?,但是這一過程需要?2.144V(SCE,sat.KCl),試驗中顯然沒有滿足這一條件,即試驗中并沒有生成COO·?。對此,Grace[19]和Rezzan[32]等認為在此反應中PAn中的基團—NH與CO2形成氫鍵,然后在?0.3V時,催化產生的Had與活化了的CO2結合生成HCOOads·,繼而HCOOads·又與Had結合生成HCOOH;HCOOH再被溶劑CH3OH攻擊,反應生成CH3COOH。Ogura等[33]在用PB/Pan(PB=Prussian blue,Pan=polyaniline)電極上僅在?0.845V(SCE,sat.KCl)便可將 CO2還原,反應產物是乳酸、乙酸、甲酸、甲醇和乙醇。同樣Ogura等也認為PB在催化反應中生成的Had轉而促進了CO2的還原,活化后的CO2與Had反應生成有機酸和醇。
為了解決CO2在水溶液中的低溶解度造成的傳質問題,研究人員考慮將固體電解質應用到該領域的研究。相對于液體電解質,固體電解質有很多優勢,比如一定程度的抗壓性能、易于處理、降低對電極的腐蝕、避免泄露等。固體電解質還可以應用于氣相實驗,相較于將CO2溶于液體電解質中,這樣可以加強反應的傳質過程。此外,固體電解質的應用還可以降低電極催化劑的中毒程度。目前已經有4類固體聚合物電解質被應用于電還原CO2的研究中,分別為Nafion、堿摻雜的PVA、磺化聚醚醚酮(SPEEK)和大孔樹脂修飾的SPEEK。其中Nafion和SPEEK被用作陽離子固體電解質,堿摻雜的PVA被用作陰離子固體電解質,一些離子交換樹脂分散在 SPEEK中以抑制析氫反應。同時,科研人員還嘗試將各種金屬負載到固體聚合物電解質薄膜(solid polymer electrolyte,SPE)上制成SPE復合電極,進行電還原CO2研究。
Hori等[34]將 Au包覆在陽離子交換膜(cation exchange membrane,CEM)制備成Au/SPE復合電極,在其上進行電還原CO2實驗,獲得了還原產物為CO,但是實驗中電流效率要比在常規Au電極上的要低;由陰離子交換膜制成的陰離子交換膜(SPE/AEM)SPE電極系統中,電極電位會向更負的方向發生偏移,局部電流密度有所提高,達到60mA/cm2。Dewulf等[35]用自制Cu/SPE復合電極在1mol/L H2SO4溶液中進行電還原CO2實驗,獲得的最大電流效率僅為傳統Cu電極上的19%。同樣,Cook等[36]在類似的實驗中獲得的最大電流密度僅為30mA/cm2,生成C2H4的電流效率低于6.5%。 Aeshala[37]利用不同的固體聚合物作電解質電化學還原CO2,將Nafion膜和磺化聚醚醚酮(SPEEK)結合作為陽離子固體聚合物電解質,而堿金屬摻雜的PVA和大孔樹脂/SPEEK復合材料處理用作陰離子型固體聚合物電解質。將銅電鍍到多孔碳紙上用作陰極,負載有Pt/C的碳紙用作陽極。除了副產物氫氣,產物主要是HCOOH、CH3OH、HCHO、CO和CH4。
此外,通過修飾金屬晶體結構得到的電極材料也可以有效地改善電極電化學性能。Frese等[38]在相關文獻中提到Cu表面晶體結構對產物分布的影響。在 0.5mol/L的 KHCO3水溶液中將電壓設置為?1.85V,CH4在Cu(100)面上的生成速率是0.5× 10?5mol/(cm2?h),在 Cu(110)上的生成速率是 1.0× 10?5mol/(cm2?h),在 Cu(111)上的生成速率是 5.8× 10?5mol/(cm2?h)。同類的研究成果還有很多,Durand等[39]對此進行了更深入的理論研究,發現在反應過程中,不同的晶型結構對相同的中間產物的吸附自由能不同,具體研究結果如表2所示。在對主要的中間產物進行的研究分析中發現,晶型排列方式較為疏松的(211)晶面結構對絕大部分的中間產物所需要的吸附自由能最低,其次是(100),需要的吸附自由能最高的是(111)晶面結構;同時研究還發現,反應中為了達到恒定的 5mA/cm2的電流,在(211)晶面結構上所需要施加的電壓最小,(111)晶面結構所需要的電壓最大。可見在不同晶型結構的催化劑上發生的反應,其反應結果也會不同。在電鍍Cu的相關研究工作中,電鍍電流密度較高時CH4產量會降低;相反,電鍍電流密度較低時會導致較高的CH4產量。這被認為是因為低電流密度電鍍時會產生較為光滑規則的表面結構,有利于反應的進行。此外,Alexander等[40]在非質子溶劑乙腈(AN)和碳酸亞丙酯(PC)中將Cu/Pt(hkl)[copper deposited on Pt(hkl)]電極用于實驗,發現Cu/Pt(hkl)電極比單純的Cu和Pt電極具有更高的活性,其中Cu/Pt(110)要比Cu/Pt(111)和Cu/Pt(100)的活性要高。對此研究人員解釋主要是因為經過修飾后Cu電極表面出現大量非整齊缺陷位點,從而導致表面有效反應面積的增加以及電極表面結構的變化。大量研究表明,通過對金屬晶面結構的修飾可以改變電極活性以及影響電化學反應產物分布。

表2 3種不同晶型結構的Cu對主要中間產物的吸附自由能[39]單位:eV
由于標準狀態下CO2在水溶液中的溶解度僅為0.033mol/L,這在很大程度上限制了CO2在水溶液電解質中的轉化。除了通過增加CO2的壓力和降低反應溫度增加CO2溶解度以外,研究人員為降低傳質問題對反應的影響主要采取的措施是上文提到的采用GDEs和研究開發SPE復合電極。采用GDEs加快了反應速率,但是并沒有改變產物的種類,因此GDEs的應用實質上是加強了電解質與電極材料間的傳質過程,并沒有改變產物分布。在GDEs上,析氫反應在很大程度上被削弱了,但依舊存在。SPE復合電極是以固體聚合物電解質代替傳統的液體電解質,并將電極和聚合物膜融為一體,從而減小正負極距離,使氣體直接與固體聚合物接觸,降低能耗,而且不需要加支持電解質,使氣體反應和產物分離一體化,有利于產物的分離提純。從實驗的目的上來看,這兩種復合電極有些相似,都是以其特殊的結構來促進CO2氣體的傳質過程,提高反應速率,從而優化實驗結果。而從結構上來看,這兩種電極又有其自身的特殊性和各自優勢,GDEs可以創造大面積的氣-液-固三相界面,減小氣體在液體中的擴散層厚度,其多孔結構又可以增大催化劑的催化表面積,從而加快反應速度。
目前,GDEs和SPE復合電極已經成為電化學還原 CO2領域比較熱門的研究方向,但是,GDEs和SPE復合電極也有其自身的局限性,如GDEs電極容易產生剝離和滲漏現象,且其長時間運行后電極性能會下降,導致電極壽命降低;SPE復合電極中聚合物薄膜的使用周期會直接影響到電極壽命,且電極與薄膜的結合方式也會影響到電極性能的優劣。因此,通過復合修飾改性后的電極在電流密度、電流效率和還原電位等各個方面都有所改善。
3 溫度和CO2分壓對反應的影響
反應溫度會在一定程度上對反應的選擇性和產物分布造成影響,在 0~40℃范圍內,較低的溫度對生成HCOOH的電流密度的影響較小,但是析氫反應和乙烯的生成受到了抑制,同時CH4的電流效率較高(0℃時CH4的電流效率達65%)[41]。類似的實驗結果也曾被報道過,以0.65mol/L的NaHCO3水溶液為電解質在?2.0V 電壓(參比電極為Ag/AgCl,置于飽和KCl溶液中)、溫度范圍為?2~15℃的條件下進行電解實驗,研究人員同樣發現較低溫度下CH4電流密度較高[42]。同樣,低溫條件下反應速率也較高,因為水溶液中電還原CO2主要的制約因素是CO2的傳質,低溫會增大CO2在電解質水溶液中的溶解度,以及影響后續一系列的吸附過程[43]。因此,水溶液中電還原CO2,較低溫度下的反應速率較高。
增加CO2分壓能增加其溶解度,會對還原反應帶來影響。Azuma[21]和 Hara[43]等在 163mA/cm2恒定電流密度條件Cu電極上電還原CO2時,將電解還原的 CO2壓力從 0增加到 60atm(1atm= 101325Pa),發現CO2壓力從0增加到10atm時,主要產物從開始的 H2逐漸轉變為烴類;繼續增加CO2壓力到20atm的過程中,烴類產物的電流效率降低12%,但是HCOOH和CO的電流效率升高到大約30%;繼續加大CO2的壓力時,HCOOH和CO是主要產物;當CO2壓力為30atm時,HCOOH的電流效率達到最大值54%。對于其中的原理,研究人員并沒有進行深入闡述。
4 結 語
將CO2電化學還原轉化為低碳燃料和化工原料對環境保護和能源的循環開發利用具有積極的意義,也有研究和應用前景。CO2電還原過程是一個氣-液-固三相復雜催化反應過程,研究報道的電極還存在著傳質效果差、電還原選擇性和轉化率不高、活性反應面積有限等問題,因此水溶液中電化學還原 CO2的研究還處于實驗室研究階段。今后研究CO2電還原的研究將更多集中在以下4個方面。
(1)復合電極(修飾電極)的制備和優化。優選具有高析氫過電位的金屬,同時配以對CO2具有強吸附性的催化劑組分,將擴散層、電催化劑相接合,制備結構合理的復合電極,提供較好的氣-液-固三相接觸性能及CO2電催化反應場所,將有效地減小氣相、液相的傳質阻力,降低電極極化,從而有利于生成小分子的碳氫化合物,增強還原產物的選擇性。
(2)導電聚合物電極在 CO2電還原體系的反應特性和應用研究。
(3)水溶液中 CO2電還原的反應機理研究,研究多電子轉移反應中異相介質間電荷傳輸規律及其對CO2還原產物的影響。
(4)積極借鑒燃料電池及相關領域已經相對成熟的研究成果,例如將燃料電池領域GDEs和催化劑活性組分與電極基底材料的有效負載結合等研究成果改進后用于電還原CO2的研究領域。
[1]Mitrovic M,Malone A. Carbon capture and storages(CCS) demonstration projects in Canada[J]. Energy Procedia,2011,4:5685-5691.
[2]Sahu G C,Bandyopadhya S,Foo D C Y,et al. Targeting for optimal grid-wide deployment of carbon capture and storage (CCS) technology[J]. Process Safety and Environmental Protection,2014,92(6):835-848.
[3]Pravat K,Swain L,Das M,et al. Biomass to liquid:A prospective challenge to research and development in 21st century[J]. Renewable and Sustainable Energy Reviews,2011,15(9):4917-4933.
[4]Baliban R C,Elia J A,Floudas C A. Novel natural gas to liquids processes:Process synthesis and global optimization strategies[J]. AIChE Journal,2013,59(2):505-531.
[5]Salkuyeh Y K,Adams T A. Combining coal gasification,natural gas reforming,and external carbonless heat for efficient production of gasoline and diesel with CO2capture and sequestration[J]. Energy Conversion and Management,2013,74:492-504.
[6]Zhang Wennan. Automotive fuels from biomass via gasification[J]. Fuel Processing Technology,2009,91(8):866-876.
[7]Mignard D,Sahibzada M,Duthie J M,et al. Methanol synthesis from flue-gas CO2and renewable electricity:A feasibility study[J]. Hydrogen Energy,2003,28(4):455-464.
[8]Duthie J M,Whittington H W. Securing renewable energy supplies through carbon dioxide storage in methanol[J]. Power. Eng. Soc.,2002,1:145-150.
[9]Cifre P G,Badr O. Renewable hydrogen utilisation for the production of methanol[J]. Energy Conversion and Management,2007,48(2):519-527.
[10]陶映初,吳少輝,張曦. CO2電化學還原研究進展[J]. 化學通報,2001(5):272-277.
[11]Whipple Devin T,Kenis Paul J A. Prospects of CO2utilization via direct heterogeneous electrochemical reduction[J]. Journal of Physical Chemistry Letters,2010,1(24):3451-3458.
[12]靳治良,錢玲,呂功煊. 二氧化碳化學——現狀及展望[J]. 化學進展,2010(6):1102-1115.
[13]劉卉,陶國宏,邵元華,等. 功能化的離子液體在電化學中的應用[J]. 化學通報,2004(11):795-801.
[14]Chaplin R P S,Wragg A A. Effects of progress conditions and electrode material on reaction pathways for carbon dioxide electroreduction with particular reference to formate formation[J]. Journal of Applied Electrochemistry,2003,33(12):1107-1123.
[15]Javier A,Chmielowiec B,Sanabria J,et al. A DEMS study of the reduction of CO2,CO,and HCHO pre-adsorbed on Cu electrodes:Empirical inferences on the CO2RR mechanism[J]. Electrocatalysis,2015,6(2):127-131.
[16]趙晨辰,何向明,王莉,等. 電化學還原 CO2陰極材料研究進展[J]. 化工進展,2013,32(2):373-380.
[17]Innocent B,Pasquier D,Ropital F. FTIR spectroscopy study of the reduction of carbon dioxide on lead electrode in aqueous medium[J]. Appl. Catal. B,2010,94(3):219-224.
[18]魏文英,尹燕華,韓金玉. 水溶性介質中 CO2電催化還原研究進展[J]. 化工進展,2007,26(2):158-163.
[19]Grace A N,Choi S Y,Vinoba M,et al. Electrochemical reduction of carbon dioxide at low overpotential on a polyaniline/Cu2O nanocomposite based electrode[J]. Applied Energy,2014,120:85-94.
[20]Li H,Oloman C. The electro-reduction of carbon dioxide in a continuous reactor[J]. Appl. Electrochem.,2005,35(10):955-965.
[21]Azuma M,Hashimoto K,Hiramoto M. Cabon dioxide reduction at low temperature on various metal-electrodes[J]. Journal of Electroanalytical Chemistry,1989,260(2):441-445.
[22]Gattrell M,Gupta N. A review of the aqueous electrochemical reduction of CO2to hydrocarbons at copper[J]. Journal of Electroanalytical Chemistry,2006,594(1):1-19.
[23]Satoshi K,Yousuke U,Hideyuki K,et al. Electrochemical reduction of CO2in copper particle-suspended methanol[J]. Chemical Engineering Journal,2006,119(2):107-112.
[24]Hori Y,Takahashi I,Koga O,et al. Electrochemical reduction of carbon dioxide at various series of copper single crystal electrodes[J]. Journal of Molecular Catalysis A:Chemical,2003,199(1):39-47.
[25]Kohjiro H,Akihiko K,Tadayoshi S. Electrochemical reduction of carbon dioxide under high pressure on various electrodes in an aqueous electrolyte[J]. J. Electrochem. Soc.,1995,391:141-147.
[26]Shoichiro Ikeda,Kaname Ito,Hidetomo Noda. Electrochemical reduction of carbon dioxide using gas diffusion electrodes loaded with fine catalysts[J]. Nanoscience and Nanotechnology,2008,1136(1):108-113.
[27]Prakash G K S,Viva F A,Olah G A,et al. Electrochemical reduction of CO2over Sn-Nafion coated electrode for a fuel-cell-like device[J]. Journal of Power Sources,2013,223:68-73.
[28]Centi Gangeri,Siglinda Perathoner,Miriam Gangeri. Electrocatalytic conversion of CO2to long carbon-chain hydrocarbons[J]. Green Chemistry,2007,9(6):671-678.
[29]張娟娟. 金屬表面上CO2的電化學還原[D]. 曲阜:曲阜師范大學,2013.
[30]Fatih K,Thorsten R,Carl H. The reduction of CO2on polyaniline electrode in a membrane cell[J]. Synthetic Metals,2004,140(1):65-68.
[31]Aydin R,Dogan H O,Koleli F. Electrochemical reduction of carbon dioxide on polypyrrole coated copper electro-catalyst under ambient and high pressure in methanol[J]. Appl. Catal. B,2013,140:478-482.
[32]Rezzan A,Fatih K. Electrochemical reduction of CO2on a polyaniline electrode under ambient conditions and at high pressure in methanol[J]. Journal of Electroanalytical Chemistry,2002,535(1):107-112.
[33]Ogura K,Endo N,Nakayama M. Mechanistic studies of CO2reduction on a mediated electrode with conducting polymer and inorganic conductor films[J]. J. Electrochem. Soc.,1998,145(11):3801-3109.
[34]Hori Y,Ito H,Okano K,et al. Silver-coated ion exchange membrane electrode applied to electrochemical reduction of carbon dioxide[J]. Electrochimica Acta,2003,48(18):2651-2657.
[35]Dewulf D W,Jin T,Bara A J. Electrochemical and surfaces studies of carbon dioxide reduction to methane and ethylene at copper electrodes in aqueous-solutions[J]. Journal of the Electrochemical Society,1989,136(6):1686-1691.
[36]Cook R L,Macduff R C,Sammells A F. High-rate gas-phase CO2reduction to ethylene and methane using gas-diffusion electrodes[J]. J. Electrochem. Soc.,1990,137(2):607-608.
[37]Aeshala L M. Effect of solid polymer electrolyte on electrochemical reduction of CO2[J]. Separation and Purification Technology,2012,94:131-137.
[38]Frese K W,Sullivan B P,Krist K,et al. Electrochemical and Electrocatalytic Reactions of Carbon Dioxide[M]. New York:Elsevier,1993:145.
[39]Durand W J,Andrew A P,Studt F,et al. Structure effects on the energetics of the electrochemical reduction of CO2by copper surfaces[J]. Surface Science,2011,605(15):1354-1359.
[40]Alexander V,Elena B,Alexey I. CO2electroreduction on Cu-modified platinum single crystal electrodes in aprotic media[J]. Electrocatalysis,2015,6(1):42-50.
[41]Hori Y,Kikuchi K,Suzuki S. Production of CO and CH4in electrochemical reduction of CO2at metal electrodes in aqueous hydrogencarbonate solution[J]. Chem. Lett.,1985,14:1695-1698.
[42]Kaneco S,Hiei N H,Xing Y. Electrochemical conversion of carbon dioxide to methane in aqueous NaHCO3solution at less than 273K[J]. Electrochemical Acta,2002,48(1):51-55.
[43]Hara K,Tsuneto A,Kudo A,et al. Electrochemical reduction of CO2on a Cu electrode under high-pressure-factors that determine the product selectivity[J]. Journal of the Electrochemical Society,1994,141(8):2097-2103.
Progress of the electrochemical reduction of CO2in aqueous electrolyte
ZHANG Xianping1,HUANG Haiyan1,JIN Hongli1,YU Ying1,CHEN Yingdun2
(1College of Science,China University of Petroleum(Beijing),Beijing 102249,China;2PetroChina Tarim Oilfield Company,Korla 841000,Xinjiang,China)
As CO2is a vital reagent for the production of useful chemicals,it is high time to find an efficient way to make use of it. The electrochemical reduction of CO2,which can be conducted under the ambient conditions and converse CO2into various products,provides a promising future both for the utilization of CO2and for the human beings. The products,the reaction rate and the selectivity of the reaction can be adjusted by conducting the reaction on different electrodes and at different over potentials. This paper highlights the progress of the electrochemical reduction of CO2in aqueous electrolyte and summarizes the mechanism of electrochemical reduction of CO2proposed by various workers and introduces the main reactions occurred during the reduction process. Studies carried out on different kinds of electrodes,such as metal electrodes,gas diffusion electrodes (GDEs) and composite electrodes and so on,have also been reviewed. The products,the selectivity of the reaction and the currency during the process of reduction,also vary with the materials of the electrodes. Besides,the reaction conditions,such as the pressure and the temperature,also affect the reaction rate and the currency. Finally,the applicative prospects of the technology of the electrochemical reduction of CO2are proposed and the aqueous electrolytes can provide profuse [H]and then there will be more CO2molecules reduced into fuel molecules,which is of great value both in environmental protection and resource utilization and economic development.
carbon dioxide;electrochemistry;reduction;electrodes
O 646
A
1000-6613(2015)12-4139-07
10.16085/j.issn.1000-6613.2015.12.002
2015-04-30;修改稿日期:2015-09-01。
張現萍(1990—),女,碩士研究生。聯系人:黃海燕,副教授,主要從事電化學儲氫研究。E-mail hhy@cup.edu.cn。

