碳源對煙曲霉WHSW-01產殼聚糖酶的誘導條件優化
閻賀靜,劉暢,時月,李潤豐
(河北科技師范學院食品科技學院,河北昌黎,066600)
殼聚糖降解后理化性質和生理活性都發生了變化,所得殼寡糖不僅易于被人體吸收利用,還具有許多獨特的生理活性和功能,例如:能提高機體免疫力、抑制腫瘤細胞生長、活化增殖人體腸道內雙歧桿菌等[1-2]。同時還具有抗菌防腐、保水保濕等功能,在醫藥、食品、化妝品、保健品等方面的應用前景令人矚目[3-4]。由殼聚糖制備殼寡糖可通過化學降解、物理降解和酶降解進行[5-6]。與目前常用的化學降解法相比,酶法生產殼寡糖的反應條件溫和易控,寡糖得率高、功能性更強,不易造成環境污染,是殼寡糖最理想的制備方法。
殼聚糖酶(chitosanase)又稱殼聚糖-N-乙酰-氨基葡糖苷水解酶,對殼聚糖降解具有專一性是殼聚糖制備殼寡糖最理想的酶制劑[7-8],在工業上已有用于制備殼寡聚糖(Chitooligosaccharides,簡稱 COSs)的實例。雖然目前殼聚糖酶已經商品化,但由于原始菌株產殼聚糖酶能力仍然普遍偏低,使得殼聚糖酶的來源有限,生產成本高,導致商品殼聚糖酶價格居高不下[9-10]。同時目前的商品殼聚糖酶在熱穩定性等方面還不足以適應大規模工業化降解殼聚糖的生產。目前的研究重點是采用不同的生物技術來提高殼聚糖酶生產菌的產酶能力。
本實驗首先確定了煙曲霉WHSW-01產殼聚糖酶受碳源的誘導,通過不同碳源對煙曲霉WHSW-01細胞生長和產酶的影響,確定對煙曲霉WHSW-01產殼聚糖酶起最佳誘導作用的碳源,并進一步確定該最佳誘導碳源的添加量和添加時間來提高煙曲霉WHSW-01產殼聚糖酶的能量,在節約成本的前提下提高殼聚糖酶的產量。
1 材料與方法
1.1 實驗材料與試劑
菌種:煙曲霉WHSW-01(由武漢生物工程學院酶工程教研室提供)[11];
試劑:瓊脂粉,NaCl、MgSO4·7H2O 等其他試劑均為國產分析純。
1.2 培養基
斜面(平板)培養基:膠體殼聚糖 1%,(NH4)2SO40.5%,K2HPO40.2%,NaCl 0.5%,Mg-SO4·7H2O 0.1%,瓊脂2.0%,pH6.5。1%膠體殼聚糖的配制:每100 mL pH5.0的醋酸緩沖液中溶解1 g粉末殼聚糖。
搖瓶發酵基本培養基:NH4NO31.0%,K2HPO40.07%,KH2PO40.03%,MgSO4·7H2O 0.05%,NaCl 0.5%,酵母提取物0.5%,碳源(根據實驗需求而變)。
1.3 研究方法
1.3.1 殼聚糖酶的搖瓶發酵
培養基為自然pH,搖瓶裝液量70 mL/250 mL,接種量2%,培養溫度30℃,轉速180 r/min,振蕩培養。
1.3.2 還原糖的測定
采用 3,5-二硝基水楊酸(DNS)法[12]。
1.3.3 DNS法測殼聚糖酶活力
先將加有1 mL的pH 5.6醋酸緩沖液和0.9 mL的1%標準膠體殼聚糖溶液的試管在50℃保溫5 min,再加入0.1 mL的4 000 r/min離心15 min后的初酶液,于50℃下水浴保溫15 min,加入1.5 mL的DNS終止酶促反應,顯色沸水浴5 min,自然冷卻,然后加入21.5 mL的蒸餾水,平衡后于4 000 r/min離心15 min,取上清液在可見光520 nm處測吸光度,根據氨基葡萄糖鹽酸鹽標準曲線求出反應液中的還原糖含量。酶活定義:1 mL酶液1 min催化產生1 μmol還原糖所需的酶量為1個單位(U/mL)。
1.3.4 殼聚糖水解液的制備
用1%膠體殼聚糖作搖瓶發酵基本培養基的碳源,取發酵到第3天的粗酶液10 mL,于50℃下水解450 mL的1%標準殼聚糖溶液50 min。
1.3.5 殼聚糖酶生物合成調節模式的考察
分別以1%殼聚糖膠體、0.5%膠體殼聚糖和0.5%葡萄糖、1%葡萄糖作為發酵培養基中的基本碳源進行殼聚糖酶的搖瓶發酵,每隔24 h測發酵液中殼聚糖酶的酶活。
1.3.6 不同碳源對WHSW-01產殼聚糖酶的影響
在基本發酵培養基中,分別以1%葡萄糖和1%氨基葡萄糖鹽酸鹽、2%氨基葡萄糖鹽酸鹽、1%葡萄糖和1%殼聚糖膠體、1%葡萄糖和1%粉末殼聚糖、2%葡萄糖、1%葡萄糖和1%殼聚糖水解液為碳源進行發酵培養,每隔24 h測發酵液中殼聚糖酶酶活,考察不同碳源對WHSW-01產殼聚糖酶的影響。
1.3.7 最佳誘導劑添加量對WHSW-01產殼聚糖酶的影響
將最佳誘導劑按照發酵液總體積的10%、20%、40%、60%的量在發酵初始添加,每隔24 h測殼聚糖酶的酶活和細胞生物量,考察最佳誘導劑的不同添加量對煙曲霉WHSW-01產殼聚糖酶的影響。
1.3.8 最佳誘導劑添加時間對WHSW-01產殼聚糖酶的影響
將最佳劑量的誘導劑分別在發酵進行的0、12、24、48、72、96 h 添加到發酵液中,每隔 24 h 測發酵液中殼聚糖酶的酶活和細胞的生物量,考察最佳誘導劑添加時間對煙曲霉WHSW-01產殼聚糖酶的影響。
1.3.9 生物量的測定方法
采用細胞干重測量法[13]。
2 結果和分析
2.1 煙曲霉WHSW-01中殼聚糖酶生物合成的調節模式
酶生物合成的調節模式主要有分解代謝物阻遏作用、誘導作用、反饋阻遏作用[14]。根據文獻報道,大多數真菌中殼聚糖酶的合成模式以誘導型為主[15]。按照1.3.5方法確定煙曲霉WHSW-01合成殼聚糖酶是否受殼聚糖誘導,結果如圖1所示。
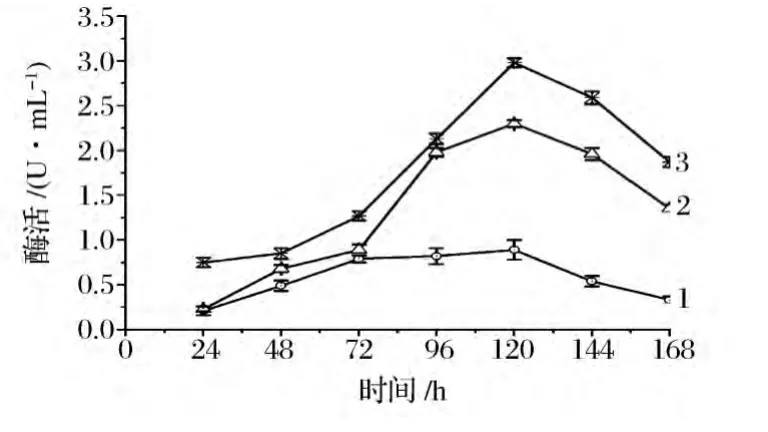
圖1 不同碳源對殼聚糖酶生物合成的影響Fig.1 Effects of different carbon on chitosanase biosynthesis
由圖1可見,不同碳源對煙曲霉WHSW-01產殼聚糖酶的影響不同。當以葡萄糖為唯一碳源時,殼聚糖酶的合成量較低,最高酶活為0.89 U/mL。當培養基中存在膠體殼聚糖時,煙曲霉WHSW-01產殼聚糖酶的量較高。例如,以膠體殼聚糖為唯一碳源以及以葡萄糖和殼聚糖為碳源時,殼聚糖酶酶活最高分別為2.3 U/mL和2.89 U/mL。由此可見,煙曲霉WHSW-01產殼聚糖酶是受殼聚糖的誘導的。僅以葡萄糖作為碳源,不利于殼聚糖酶的合成,以葡萄糖為基礎碳源,添加殼聚糖有利于該煙曲霉的產生。
2.2 不同誘導劑對煙曲霉WHSW-01產殼聚糖酶的誘導作用
以不同物質及不同形式的殼聚糖作為碳源,對微生物的生長和產酶有不同的影響。按1.3.6所示的方法分別添加不同碳源進行發酵。每隔24 h測發酵液中殼聚糖酶的酶活,考察不同碳源對煙曲霉WHSW-01產殼聚糖酶的誘導作用,結果如圖2所示。
由圖2可見,不同碳源對殼聚糖酶的合成有不同的影響。分別以葡萄糖、氨基葡萄糖鹽酸鹽以及葡萄糖和氨基葡萄糖鹽酸鹽為碳源時,最高酶活分別為0.95、3.4和1.6 U/mL;分別以葡萄糖和殼聚糖水解液、葡萄糖和殼聚糖粉末以及葡萄糖和膠體殼聚糖為碳源時,最高酶活分別為4.75、1.59和2.81 U/mL。并且碳源不同,該曲霉發酵產酶周期不同,以氨基葡萄糖鹽酸鹽及葡萄糖和殼聚糖粉末為碳源時,產酶高峰期出現在發酵的96 h,其他碳源發酵至120 h達產酶高峰期。由此可見,碳源不僅影響產酶酶量的高低,同時影響產酶周期,其中以殼聚糖水解液為碳源時殼聚糖酶產量最高。推測可能是由于殼聚糖水解液中含有某低聚殼寡糖對該曲霉的生長和產酶都有促進作用。但由于殼聚糖水解液由殼聚糖水解獲得,水解液組成成份十分復雜,對殼聚糖酶產生誘導作用的具體原因需要進行進一步的研究。
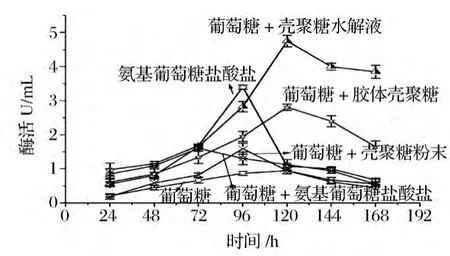
圖2 不同碳源對殼聚糖酶的誘導作用Fig.2 Induction of different carbon resources on chitosnase production
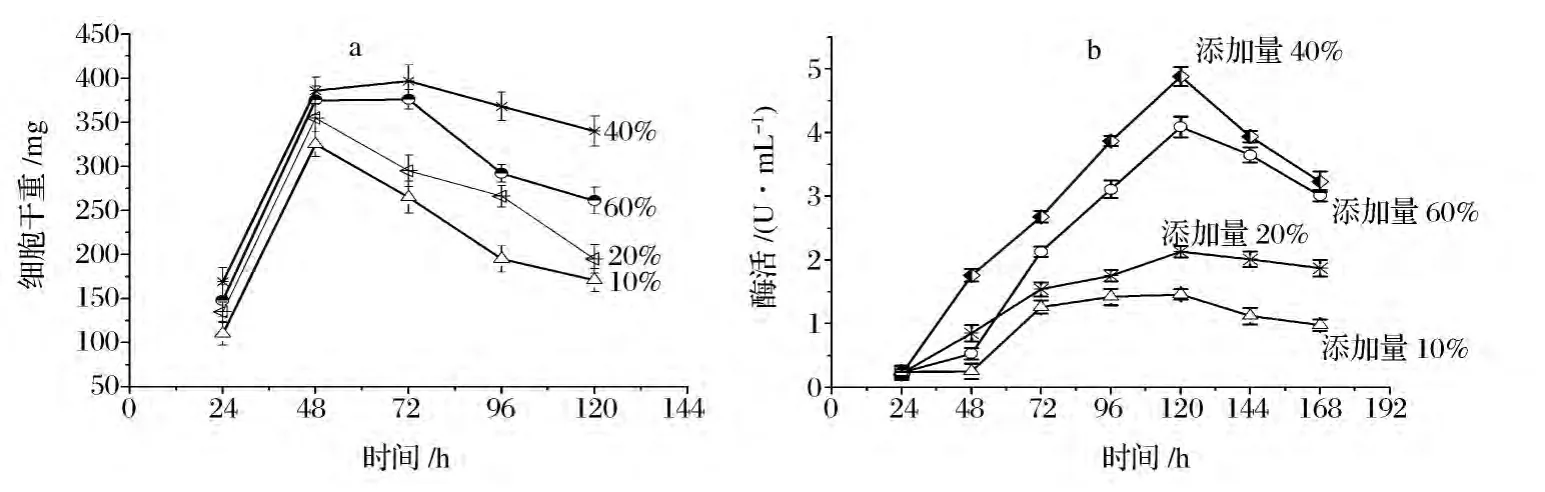
圖3 殼聚糖水解液添加量對煙曲霉生長和產酶的影響Fig.3 Effects of different chitosan hydrozate amount on A.fumigates WHSW-01growth and chitosanase production
2.3 殼聚糖水解液對煙曲霉WHSW-01產殼聚糖酶的誘導作用
為進一步提高該煙曲霉產殼聚糖酶的量,需要進一步確定殼聚糖水解液添加量,按照1.3.7的方法進行發酵,每隔24 h測發酵液中細胞干重和殼聚糖的酶活力,結果如圖3a和圖3b所示。
由圖3b可知,殼聚糖水解液添加量不同,對殼聚糖酶的合成影響也不同。其中添加占發酵液總體積40%的殼聚糖水解液進行發酵,其殼聚糖酶酶活產量最高,發酵至120 h達最高酶活4.88 U/mL。當繼續增加殼聚糖水解液添加量至60%殼聚糖酶產量降低(圖3b所示)。分析原因可能是由于殼聚糖水解液添加量較高時,某種殼聚糖水解產物含量較高,對殼聚糖酶的合成產生了抑制作用。此外,根據圖3a和3b所示,發現煙曲霉WHSW-01發酵產殼聚糖酶的開始時間與細胞的生長同步,但當發酵至72 h后細胞生物量開始減少,而殼聚糖的酶活卻繼續增加,直至發酵至120 h酶活達到最大值。由此可以說明,以殼聚糖水解液為誘導碳源時,煙曲霉WHSW-01產殼聚糖酶的合成模式為延續合成型。此類型的合成模式特點是細胞停止生長而酶仍在繼續合成,因此會積累大量的目的酶,這是酶生物合成的最佳合成模式[14]。
2.4 殼聚糖水解液添加時間對煙曲霉WHSW-01產殼聚糖酶的誘導作用
為進一步提高殼聚糖酶的產量,按照1.3.8所示的方法考察了殼聚糖水解液的添加時間,每隔24 h測殼聚糖酶的活力,結果如圖4所示。
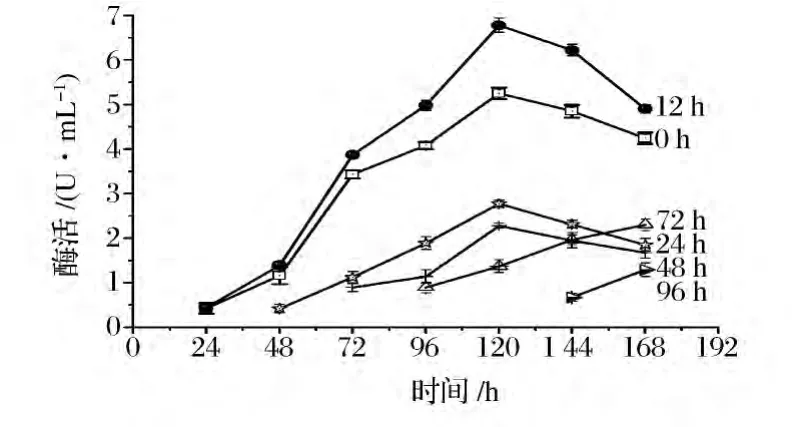
圖4 殼聚糖水解液加時間對煙曲霉產殼聚糖酶的影響Fig.4 Effects of chitosan hydrozate addition time on chitosanase production
由圖4可見,在不同時間添加殼聚糖水解液,對WHSW-01產殼聚糖酶的影響不同。其中發酵0 h和12 h時添加殼聚糖水解液產酶效果最佳。兩者在發酵至120 h均達到產酶高峰,最高酶活分別為5.25 U/mL和6.78 U/mL。隨著殼聚糖水解液添加時間的滯后,該菌株的產酶量逐漸降低,由此可見殼聚糖水解液的添加最好在發酵初期進行。
圖5為發酵12 h時添加殼聚糖水解液時細胞生長和產酶情況。在發酵至48 h時細胞生物量達到最大,即細胞生長進入穩定期,發酵至72 h以后細胞生長進入了衰亡期。然而發酵產酶高峰期卻出現在發酵進行至120 h時,最高酶活達到6.78 U/mL。分析酶產量增加的原因可能如下,(1)發酵進行至12 h添加殼聚糖水解液,有利于發酵初期煙曲霉利用速效碳源迅速繁殖,使細胞大量積累,而后誘導劑的添加使細胞大量產酶;(2)由圖5可以判斷,此條件下煙曲霉WHSW-01殼聚糖酶的合成模式為延續合成型,即細胞停止生長后酶繼續合成,酶的合成時間較其他類型的合成模式長,因此殼聚糖酶的產量增加;(3)由于煙曲霉為絲狀真菌,搖瓶振蕩發酵時,菌絲相互纏繞而形成菌絲球,發酵期間菌絲球內會包裹大量的酶液,當發酵后期菌絲球出現自溶,包裹在菌絲球中的殼聚糖酶被釋放到發酵也中,這在表觀上體現在發酵液酶活的提高[15]。綜上所述,煙曲霉 WHSW-01在基礎培養基(基礎碳源為1%的葡萄糖)發酵至12 h時間添加殼聚糖水解液最佳,有利于微生物細胞的繁殖和積累,殼聚糖酶的合成模式為延續合成型,合成時間比較長,產酶量較高。
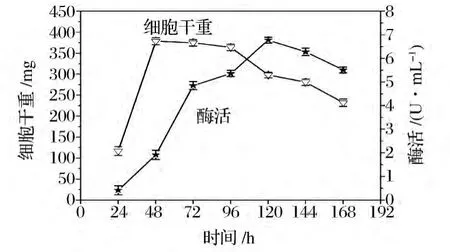
圖5 發酵12 h添加殼聚糖水解液條件下細胞生長及產酶Fig.5 Curves of A.fumigates WHSW-01growth and chitosanase production in condition of chitosan hydrozate additon after fermentation continued 12 h
3 討論與結論
殼聚糖酶是高效、特異降解殼聚糖的酶。關于殼聚糖酶的研究,國內外學者做了大量的工作。一方面利用現代分子生物學技術挖掘新型殼聚糖酶基因并進行高效表達[16-19];另一方面通過傳統方法進行高產菌株的篩選及發酵條件的優化[20-25],在一定程度上提高了殼聚糖酶的產量。本研究發現煙曲霉WHSW-01在只含有葡萄糖的培養基中細胞生長較好,但產酶量極低;而在含有葡萄糖和殼聚糖的培養基中產酶量大大增加,說明該菌種產殼聚糖酶受殼聚糖的誘導作用。進一步的研究發現,殼聚糖水解液對殼聚糖酶的產生具有更大的誘導作用,比使用膠體殼聚糖做誘導劑時最高酶活提高1.35倍。本文研究確定,WHSW-01在基礎培養基發酵至12 h時添加占發酵液總體積40%的殼聚糖水解液產酶量最高為6.78 U/mL,與前期煙曲霉WHSW-01基礎培養條件下最高酶活3.7 U/mL相比提高了83.24%[26]。其實,對于酶的發酵生產,在確定基本培養條件基礎上,還可通過多種手段提高細胞產酶能力。曾有學者在培養過程中采用熱激作用提高了殼聚糖酶的產量[27-28]。Sinha等利用蝦蟹殼來源的幾丁質水解物作培養基進行殼聚糖酶發酵生產,也達到了提高殼聚糖酶產量的目的[29]。也有人在發酵過程中通過分階段控制營養物質、pH等策略提高發酵產物的產量,確實得到了不錯的效果[30-31]。有研究表明,微生物產殼聚糖酶受不同碳源的誘導作用[15,32]。對于既定的殼聚糖酶生產菌,考察誘導物及其誘導條件,在一定程度上可以提高酶的產量。本文的研究正是基于此目的進行的,結果表明使用殼聚糖水解液可以進一步提高酶的產量。雖然本研究并未使酶產量提高很大,與基因工程菌殼聚糖酶的產量無法相比[18],但與菌種誘變及發酵基本條件優化等對殼聚糖酶產量的提高相比[21-24],本研究中殼聚糖酶產量的提高還是比較明顯的;此外,碳源的誘導策略應用于基因工程菌,也很有可能使產酶有較大的提高;同時本研究也為下一步的研究提供了方向,例如:可以進一步考察殼聚糖水解成分如低聚合度殼聚糖對殼聚糖酶的誘導作用,由此進一步提高產酶;此外還可以展開低聚殼聚糖對煙曲霉誘導作用機理的研究,為煙曲霉產殼聚糖酶發酵過程的進一步優化提供參考。
[1] 高維,丁文平.低分子量殼聚糖的制備及其應用研究[J].武漢工業學院學報,2007,26(3):28-31.
[2] Yeon Jin Choi,Eun Jung Kim,Zhe Piao,et al.Purification and characterization of chitosanase from Bacillus sp.strain KCTC 0377BP and its application for the production of chitosan oligosaccharides[J].Applied and Environmental Microbiology,2004,7(8):4 522-4 531.
[3] 張長梅,于抒含,張良栓,等.不同分子量殼寡糖的制備及其生物活性研究[J].哈爾濱醫科大學學報,2013,47(6):486-489.
[4] 朱玉霞.殼寡糖的制備、分離分析及抑菌活性研究[D].無錫:江南大學碩士論文,2013:1-3.
[5] Monaghan R L,Eveleigh D E,Tewari R P,et al.Chitosanase,a novel enzyme[J].Nature New Boil,1973,245(142):78-80.
[6] Takashi Kuroiwa,Yohei Noguchi,Mitsutoshi Nakajima,et al.Production of chitosan oligosaccharides using chitosanase immobilized on amylose-coated magnetic nanoparticles[J].Process Biochemistry,2008,43(1):62-69.
[7] 陽麗,楊萍,王曼瑩.殼聚糖酶的研究進展[J].化學工程與設備,2010(5):118-119.
[8] Yu-Mi Park,Sa-Youl Ghim.Enhancement of the activity and pH-performance of chitosanase from Bacillus cereus strains by DNA shuffling[J].Biotechnol Letters,2009,31(9):1 463-1 467.
[9] YANG Li,YANG Ping,WANG Man-ying.Expression of chitosanase gene from Aspergillus fumigatus JXSD-97 in Pichia pastoris[J].African Journal of Biochemistry Research,2010,4(8):204-209.
[10] Ho-Geun Yoon,Kyung-Han Lee,Hee-Yun,et al.Gene cloning and biochemical analysis of thermostable chitosanase(tch-2)from Bacillus coagulans CK108[J].Biosci Biotechnol Biochem,2002,66(5):986-995.
[11] 閻賀靜,周念波,涂紹勇,等.殼聚糖酶生產菌篩選、鑒定及其酶學性質[J].廣東農業科學,2012(24):161-164.
[12] 趙凱,許鵬舉,谷廣燁.3,5-二硝基水楊酸比色法測還原糖含量的研究[J].食品科學,2008,29(8):534-536.
[13] 諸葛健,王正祥.工業微生物實驗技術手冊[M].北京:中國輕工業出版社,1994:219.
[14] 郭勇.酶工程[M].北京:科學出版社,2009:31-40.
[15] SUN Yu-ying,HAN Bao-qin,LIU Wan-shun,et al.Substrate induction and statistical optimization for the production of chitosanase from Microbacterium sp.OU01[J].Bioresource Technology,2007,98(8):1 548-1 553.
[16] 費忠,李恒,龔勁松,等.基于宏基因組學殼聚糖酶挖掘研究[J].應用環境生物學報,2014,20(4):597-601.
[17] 盧華定,連禮熠,陳明偉,等.曲霉菌內切型殼聚糖酶基因克隆及在大腸桿菌中的表達[J].中國組織工程研究,2014,18(34):5 490-5 496.
[18] 裘梁,楊萍,董德剛,等.重組煙曲霉殼聚糖酶在畢赤酵母中高密度發酵表達及性質研究[J].江西師范大學學報(自然科學版),2013,37(6):607-610.
[19] Dong-Jun Seo,Ji-Hae Lee,Yong-Su Song,et al.Expression patterns of chitinase and chitosanase produced from Bacillus cereus in suppression of phytopathogen[J].Microbial Pathogenesis,2014(73):31-36.
[20] 趙有璽,龔平,王科力,等.產殼聚糖酶菌株選育及產酶條件研究[J].食品科技,2014,39(5):2-5.
[21] 石會會,高艷艷,王秀英,等.產殼聚糖酶菌株的篩選、鑒定及發酵條件優化[J].食品工業,2014,35(2):54-57.
[22] 馬靖峰,郭曉鳳,劉歡,等.海洋細菌 Renibacterium sp.QD1產殼聚糖酶發酵培養基的統計優化[J].食品工業科技,2014,35(21):146-149.
[23] 劉杰,王延鵬,許晶,等.響應面法優化殼聚糖酶產生菌Mitsuaria sp.K1的產酶發酵條件[J].化工進展,2013,32(12):2 946-2 951.
[24] 譚海剛,李靜,付均鵬.響應面法優化放線菌L012產殼聚糖酶培養基[J].中國食品學報,2013,13(10):73-79.
[25] WANG Chuan-lu,SU Jien-wei,LIANG Tzu-wen,et al.Production,purification and characterisation of a chitosanase from Bacillus cereus[J].Research on Chemical Intermediates,2014,40(6):2 237-2 248.
[26] 韓曉紅,閻賀靜.煙曲霉WHSW-01產殼聚糖酶基本培養條件及發酵過程分析[J].貴州農業科學,2013,41(3):80-83.
[27] Kien Xuan Ngo,Hiroshi Umakoshi,Toshinori Shimanouchi,et al.Heat-Enhanced production of chitosanase from Streptomyces griseus in the presence of liposome[J].Journal of Bioscience and Bioengineering,2005,100(5):495-501.
[28] Kien Xuan Ngo,Hiroshi Umakoshi,Haruyuki Ishii,et al.Oxidative/heat stress enhanced production of chitosanase from Streptomyces griseus cells through its interaction with liposome [J].Journal of Bioscience and Bioengineering,2009,108(6):471-476.
[29] Sinha S,Chand S,Tripathi P.Microbial degradation of chitin waste for production of chitosanase and food related bioactive compounds[J].Applied Biochemistry and Microbiology,2014,50(2):125-133.
[30] LIU Long,DU Guo-cheng,CHEN Jian,et al.Influence of hyaluronidase addition on the production of hyaluronic acid by batch culture of Streptococcus zooepidemicus[J].Food Chemistry,2008,110(4):923-926.
[31] LIU L,WANG M,DU G,et al.Enhanced hyaluronic acid production of Streptococcus zooepidemicus by an intermittent alkaline-stress strategy[J].Letters in Applied Microbiology,2008,46(3):383-388.
[32] Kwang Kim,Hong-Seok Ji.Effect of chitin sources on production of chitinase and chitosanase by Streptomyces griseus HUT 6037[J].Biotechnology and Bioprocess Engineering,2001,6(1):18-24.

