山西道地藥材連翹組織培養快速繁育技術研究
吳 瀟,劉陽,張咪咪,師慧麗,楊忠義(山西農業大學園藝學院,山西晉中030801)
連翹[Forsythia suspensa(Thunb.)Vahl],木犀科連翹屬植物,園林中常應用于公園綠地、庭院和街道,可叢植、孤植,病蟲害較少,易于管理[1-2]。同時連翹具有清熱止吐、清肝利膽、除濕退黃、通調三焦、暢達血脈、保肝護心等作用[3],含有金絲桃素類等重要藥用價值和具有抗病毒、抗癌和治療AIDS 的應用前景[4]。
隨著人們對連翹藥用價值研究的不斷深入和園林綠化建設事業的快速發展,連翹傳統的繁殖方式越來越不能滿足市場的需求,再加上培育出了許多觀賞價值更高的新品種,有些新品種用傳統的繁殖方法繁殖比較困難。山西省憑借在道地藥材黨參、黃芪和苦參3個品種藥材的研究利用,獲得國家中藥材GAP基地認證。目前全國近年來已公布共有63家企業48個品種得到GAP認證,山西在48個品種中占有三席位置,這為山西從事中藥材工作的同仁提供了堅定道地藥材品種選育的信心,加快了培育道地資源品種,提升了山西道地藥材品種繁育及推廣進程,也為山西道地藥材連翹進一步開發利用提供方向。該研究利用組織培養的無性繁殖技術擬篩選出一種高效的連翹快繁方法,通過正交試驗法利用不同激素種類和濃度水平進行比較,最終通過方差分析篩選出最適宜連翹的組織培養體系,從而為連翹的大規模發展提供技術支持。
1 材料與方法
1.1 試驗材料及處理 從春季品種純正、生長健壯、無病蟲害的連翹采集所萌發抽生的一年生嫩枝,將剪取的嫩枝蘸取適量洗衣粉仔細清洗2遍,再用流水沖洗后,放入無菌水中浸泡備用。在超凈臺上將枝條切成3~4 cm的含有2個腋芽的嫩莖莖段,放置在70%的酒精中消毒30 s,用無菌水沖洗3次,每次3 min。轉入0.1% 氯化汞溶液中消毒7 min[5],用無菌水漂洗3次,每次3 min,然后接種到培養基上。
1.2 培養條件 溫度為22~26℃,培養基pH為5.8,光照度為1 500~2 000 lx,光照周期為10~12 h/d。
1.3 試驗方法
1.3.1 初代培養。采用四因素三水平L9(34)正交試驗設計[6]。每個處理接種20瓶,重復3次。接種21 d后,開始統計結果。
1.3.2 增殖培養。以MS為基本培養基,加入不同濃度水平的6-BA、IBA和蔗糖,將經過初代培養篩選出來的最佳培養基的植物材料轉接,采用三因素三水平L9(34)進行增殖培養。每個處理接種20瓶,重復3次。接種23 d后,統計試驗結果。
1.3.3 生根培養。由于激素水平對連翹生根起著主要作用[7-8],所以生根培養以 MS、25 g/L 的蔗糖為基本培養基,加入不同濃度的6-BA和IBA作為生根培養基。將增殖培養篩選出來的最適培養基生長良好的芽轉接到生根培養基中進行生根培養。每個處理接種20瓶,重復3次。接種27 d后,統計生根率,對生長出的根進行長度測定。
2 結果與分析
2.1 初代培養 接種7 d,培養基上莖段開始萌芽生長。在接種21 d后,統計成活率,結果表明(表1),以MS為基本培養基(試驗序號a4、a5、a6號培養基)的植株在初代培養成活率較高,均超過了70%,其中a5號培養基的成活率最高,達80.0%。
將初代培養的統計結果通過SAS軟件進行方差分析[9-10],方差分析結果(表2)顯示,1MS培養基對連翹初代培養成活率的影響極顯著高于3/2MS、1/2 MS培養基;1.0 mg/L 6-BA對連翹初代培養成活率的影響極顯著高于1.5、0.5 mg/L 6-BA;0.3 mg/L IBA對連翹初代培養成活率的影響極顯著高于0.2、0.1 mg/L IBA;25 g/L蔗糖對連翹初代培養成活率的影響極顯著高于35、30 g/L蔗糖。
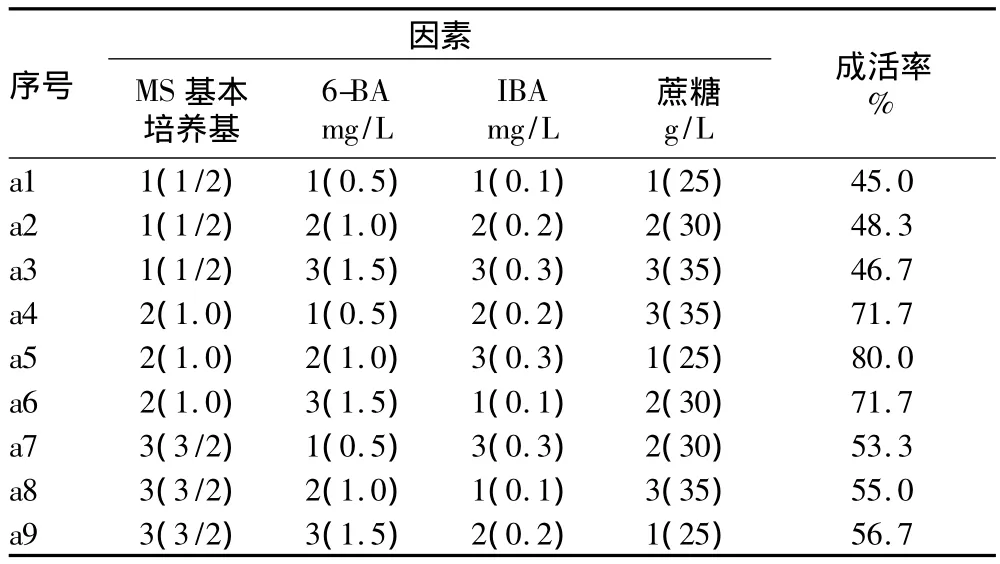
表1 初代培養正交試驗結果
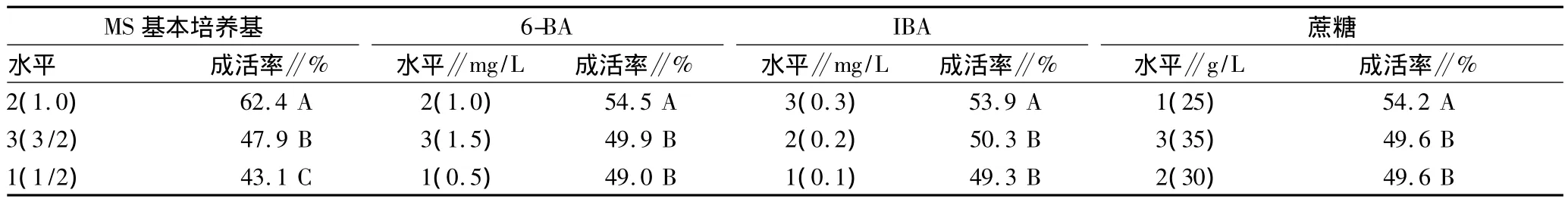
表2 各因素各水平之間初代培養成活率的多重比較
2.2 增殖培養 接種23 d后,統計試驗結果(表3)顯示,加入1.0 mg/L 6-BA的MS基本培養基(試驗序號b4、b5、b6號培養基)的植株在增殖培養成活率較高,均超過了70%,試驗序號b4培養基的成活率最高,達88.3%。
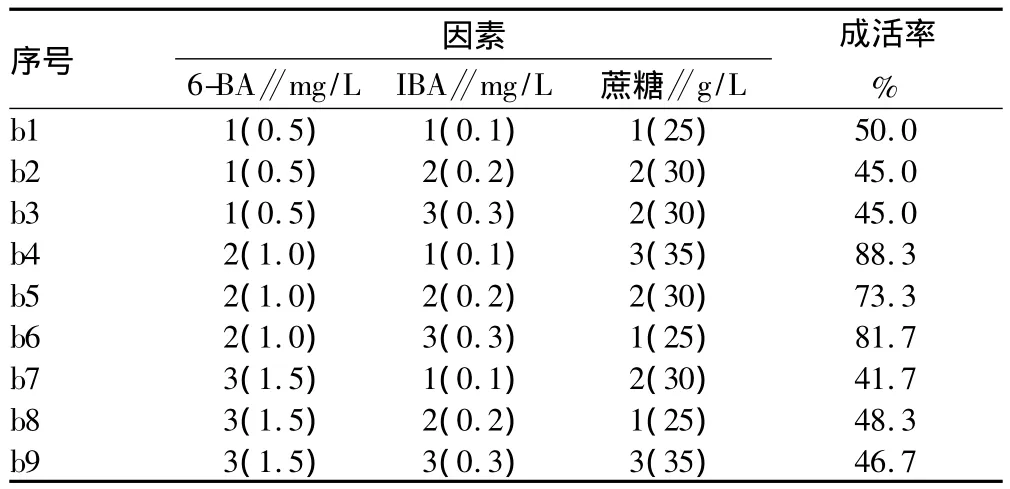
表3 增殖培養正交試驗結果
增殖培養方差分析結果(表4)顯示,1.0 mg/L 6-BA對連翹增殖培養成活率的影響極顯著高于0.5、1.5 mg/L 6-BA;0.1 mg/L IBA對連翹增殖培養成活率的影響極顯著高于0.2 mg/L IBA;35、25 g/L蔗糖對連翹增殖培養成活率的影響極顯著高于30 g/L蔗糖。

表4 各因素各水平之間增殖培養成活率的多重比較
2.3 生根培養 接種7 d后,部分培養基芽基部開始出現白色小突起。接種27 d后,統計生根率,然后對部分根進行長度測定。結果表明(表5),試驗序號c1、c4、c5和c6號培養基的植株生根率較高,均超過了80%,試驗序號c4培養基的成活率和平均根長均是最高的,分別達93.3%、9.7 mm。
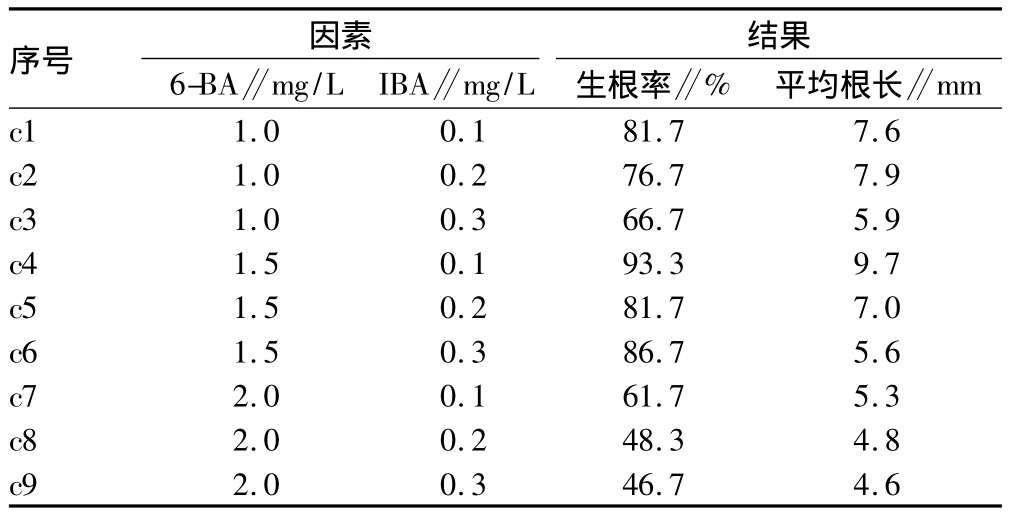
表5 生根培養試驗結果
各因素各水平之間誘導生根率和平均根長的多重比較結果(表6)顯示,1.5 mg/L的6-BA對連翹組織誘導根形成的影響極顯著高于 1.0和 2.0 mg/L的 6-BA,0.1 mg/L 的IBA對連翹組織誘導根形成的影響極顯著高于0.2和0.3 mg/L的IBA。1.5 mg/L的6-BA對連翹組織平均根長形成的影響極顯著高于 1.0和2.0 mg/L的6-BA,0.1 mg/L的IBA對連翹組織平均根長形成的影響極顯著高于0.2和0.3 mg/L的IBA。
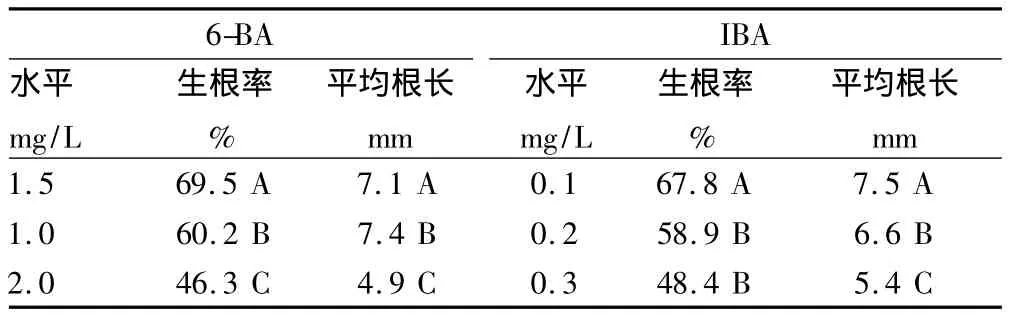
表6 各因素各水平之間誘導生根率和平均根長的多重比較
3 結論
通過不同激素種類及濃度水平配比,經過正交試驗法以及方差分析篩選出連翹的最佳組織培養體系為初代培養基(MS+6-BA 1.0 mg/L+IBA 0.3 mg/L+ 蔗糖 25 g/L)、增殖培養基(MS+6-BA 1.0 mg/L+IBA 0.1 mg/L+蔗糖 35 g/L)、生根培養基(MS+6-BA 1.5 mg/L+IBA 0.1 mg/L+蔗糖25 g/L),生根率可達90%以上,生根根數較多,適合大規模栽植。張紅梅等研究表明MS+6-BA 1 mg/L+IBA 0.1 mg/L+3%蔗糖的培養基是最適合花葉連翹的增殖培養基,能夠誘導出大量叢生苗[11],該研究與其在激素濃度配比以及在基本培養基選擇上的結果均相同。孫海龍研究認為6-BA的濃度對連翹分化影響很大,濃度過低會使分化效果差,而濃度過高則會導致玻璃化現象嚴重[12]。該研究篩選出來三類培養基的6-BA的濃度均在其研究的適宜范圍內,能夠與其保持一致。
[1]白雅鵑,章林,陳建軍,等.金葉連翹組培快繁技術的研究[J].吉林林業科技,2006,35(1):15 -19.
[2]王金玲,杜鳳國.金鐘連翹組織培養與快速繁殖[J].北方園藝,2012(8):138 -139.
[3]李衛建,李先恩.連翹有效成分含量與土壤養分的量化關系研究[J].中國中藥雜志,2005,30(20):1577 -1580.
[4]徐皓.貫葉連翹的化學成分及藥理作用研究[J].安徽農業科學,2011,9(2):48-49.
[5]王桂榮.植物組織培養中的常見問題與對策[J].宿州學院學報,2010,25(11):54-57.
[6]任露泉.試驗優化設計與分析[M].2版.北京:高等教育出版社,2003.
[7]肖關麗,楊清輝.植物組織培養過程中內源激素研究進展[J].云南農業大學學報,2001,16(2):136 -138.
[8]李代麗,康向陽.植物愈傷組織培養中內外源激素效應的研究現狀與展望[J].生物技術通訊,2007,17(3):546 -548.
[9]明道緒.田間試驗與統計分析[M].3版.北京:科學出版社,2013.
[10]王玉順.試驗統計與統計分析SAS實踐教程[M].西安:西安電子科技大學出版社,2012.
[11]張紅梅,肖小琴,及華,等.花葉連翹的組織培養和快速繁殖[J].植物生理學通訊,2002,38(5):453 -454.
[12]孫海龍.金葉連翹組培快繁技術研究[J].黑龍江農業科學,2014(5):38-41.

