脂肪酶催化單油酸甘油酯制備功能性1,3-甘油二酯
黃楚楚,熊輝煌,龔 斌,喻 蕓,馮 越,梁 媛,朱雪梅*
(南昌大學食品學院,食品科學與技術國家重點實驗室,江西 南昌 330047)
脂肪酶催化單油酸甘油酯制備功能性1,3-甘油二酯
黃楚楚,熊輝煌,龔 斌,喻 蕓,馮 越,梁 媛,朱雪梅*
(南昌大學食品學院,食品科學與技術國家重點實驗室,江西 南昌 330047)
研究固定化脂肪酶TLIM催化單油酸甘油酯(glycerol monooleate,GMO)制備1,3-甘油二酯(sn-1,3-diacylglyerol,sn-1,3-DAG)。比較了游離脂肪酸(共軛亞油酸)和脂肪酸乙酯(共軛亞油酸乙酯)兩種不同類型酰基供體、反應時間、底物物質的量比對酰基遷移和sn-1,3-DAG的影響。通過對實驗結果的判定及分析得到最佳反應條件為采用20%(質量分數)脂肪酶TLIM、底物物質的量比(共軛亞油酸乙酯和GMO)3∶1、在50 ℃的220 r/min水浴搖床中反應2 h,最后得到sn-1,3-DAG轉化率為65%。本研究利用GMO而不是常規的甘油或者甘油三酯來制備sn-1,3-DAG,并比較了不同酰基供體對酰基遷移和sn-1,3-DAG轉化率的影響,旨在為脂肪酶催化法制備功能性sn-1,3-DAG的研究提供一定參考。
酰基遷移;共軛亞油酸;共軛亞油酸乙酯;單油酸甘油酯;脂肪酶TLIM
甘油二酯(diacylglycerol,DAG)是由兩分子脂肪酸分別結合到甘油的兩個端羧基上形成的二酯,包含1,3-甘油二酯(sn-1,3-DAG)和1,2-甘油二酯(sn-1,2-DAG)兩種同分異構體[1]。1,3-DAG具有良好的乳化作用,可作為乳化劑廣泛應用于食品、藥品、化妝品等行業;另外,其生理功能具有多樣性,研究表明sn-1,3-DAG具有減少內臟脂肪、抑制體重增加、降低血脂的作用,且起到預防動脈血栓形成、緩解糖尿病、腎病的效果[2-6],對肥胖、高血脂癥、脂肪肝等多種脂肪代謝紊亂疾病患者及潛在患者來說,以功能性的sn-1,3-DAG作為一種新型保健食用油代替常規油脂是該類消費群體的不二選擇[7-9]。
目前,制備sn-1,3-DAG的方法主要是化學法和酶法。化學法得到高純度的產品比較困難,往往需要多步驟的反應以及繁瑣的純化操作,而酶法反應條件溫和,且酶的選擇性高,較易得到高純度的1,3-DAG[10-11]。近年來國內外已有一些文獻報道利用sn-1,3脂肪酶合成和富集sn-1,3-DAG的方法。日本花王集團所生產的Enova oil就是利用sn-1,3位脂肪酶催化大豆油和加拿大菜籽油,經過一系列優化合成條件,來獲得80%純度的sn-1,3-DAG。至于具體轉化技術一直處于商業保密狀態。就國內而言,一些知名高校及研究所也對DAG食用油進行了研究開發,但至今未取得sn-1,3-DAG高純度合成技術的突破性進展。目前為止,sn-1,3-DAG生產中存在的主要問題是目標產品轉化率低(目前實驗條件下最理想結果僅為50%左右)、底物利用率低,且產生空間異構體(sn-1,2-DAG)、甘油單酯等多種副產物[12]。這些難題制約sn-1,3-DAG的生產和應用。研究發現導致這些問題的主要原因是酶催化合成DAG過程中存在副反應-酰基遷移[13]。酰基遷移為脂肪酸從sn1或sn3位轉移至sn2位,反之亦然。本實驗組曾對酰基遷移的控制進行初步研究,如升高反應溫度、非極性反應體系等會促進酰基遷移,反之則抑制酰基遷移[14]。本實驗利用固定化脂肪酶TLIM催化酰基供體和單油酸甘油酯(glycerol monooleate,GMO),在無溶劑體系中發生轉酯交換反應制備sn-1,3-DAG,旨在通過探究不同酰基供體、反應時間、底物物質的量比對酰基遷移和sn-1,3-DAG的影響,來優化sn-1,3-DAG的提取條件,提高sn-1,3-DAG的轉化率。圖1為反應原理示意圖。
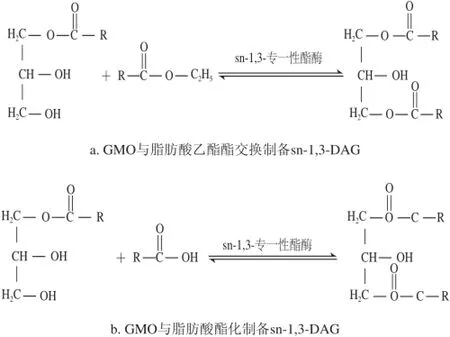
圖1 兩種酰基供體與GMO反應制備sn-1,3-DAG的原理圖Fig.1 Reactions of two acly donors with glycerol monooleate for synthesizing sn-1,3-DAG
1 材料與方法
1.1 材料與試劑
共軛亞油酸 韓國Livemax公司;共軛亞油酸乙酯、游離共軛亞油酸通過堿法催化實驗室自制;sn-1(3)-GMO 韓國ⅡShin Wells公司;14% BF3甲醇溶液、sn-1,3-DAG標準品 美國Sigma公司;脂肪酶TLIM 丹麥諾維信公司;正己烷、異辛烷、甲基叔丁基醚、乙醚(色譜純) 美國Burdick & Jackson公司;其他試劑均為分析純。
1.2 儀器與設備
SHA-C恒溫水浴振蕩器 榮華儀器制造有限公司;AR1140電子分析天平 美國奧豪斯貿易公司;DSY-Ⅲ氮吹儀 金科精華苑科技有限公司;GF254硅膠板 德國Merck公司;1200高效液相色譜(high performance liquid chromatography,HPLC)儀(配備Hypersil BDS CPS型色譜柱(250 mm×4.6 mm,5 μm)和Model 300S蒸發光散射檢測器)、6890N氣相色譜(gas chromatography,GC)儀 美國Agilent公司。
1.3 方法
1.3.1 脂肪酶催化酰基供體酯交換反應單因素試驗
在反應條件為50 ℃、20%脂肪酶TLIM、220 r/min條件下,考察酰基供體(共軛亞油酸和共軛亞油酸乙酯)、反應時間(0.5、1、2、3、4、6、12、24、48、 96 h)、酰基供體與GMO物質的量比(2∶1、3∶1、4∶1)對sn-1,3-DAG轉化率和酰 基遷移的影響,以確定以sn-1(3)-GMO為底物合成sn-1,3-DAG的最佳方法,為合成高質量的sn-1,3-DAG奠定理論基礎。
1.3.2 脂肪酶催化酰基供體酯交換反應產物中甘油酯組成測定
參照朱雪梅等[15]實驗方法,采用NP(正相)-HPLC法對產物中甘油酯組成進行分析。采用正己烷和甲基叔丁基醚(均含有體積分數0.4%的乙酸)進行二元梯度洗脫分離,流速為1 mL/min。具體洗脫條件為100%的己烷洗脫5 min;隨后在10 min內線性增加甲基叔丁基醚的比例至甲基叔丁基醚-己烷體積比80∶20,保持7 min;然后在5 min內線性減少甲基叔丁基醚的含量至100%的己烷,保持5 min。整個分析過程中,氮氣為霧化氣體,壓力為2.2 Pa,蒸發光散射檢測器的溫度設為400 ℃[16]。參照Maurelli[17]、鐘南京[18]等實驗中峰總面積表示甘油酯含量。
1.3.3 脂肪酸組成及位置組成分析
游離共軛亞油酸與共軛亞油酸乙酯分別和GMO直接經BF3法甲酯化進GC分析[19],而游離共軛亞油酸-GMO與共軛亞油酸乙酯-GMO反應后的合成的sn-1,3-DAG的脂肪酸組成是經過薄層層析(thin layer chromatography,TLC)硅膠板分離再甲酯化,即反應后產物經過TLC分離后再刮板,TLC展開條件為:正己烷-乙醚-乙酸體積比50∶50∶1,即將sn-1,3-DAG條帶刮下經BF3甲醇法甲酯化。甲酯化的方法具體如下:上述刮板分離得到的sn-1,3-DAG和準確稱取游離共軛亞油酸、共軛亞油酸乙酯、GMO(各50 mg)分別加入1.5 mL 0.5 mol/L甲醇鈉,充分混合后在95 ℃反應3 min,冷卻,再加入2 mL體積分數14%的BF3甲醇溶液并充分混勻,繼續在95 ℃條件下反應2 min,冷卻后加入1 mL飽和氯化鈉和2 mL正己烷,提取脂肪酸甲酯的正己烷溶液經過無水硫酸鈉干燥后用于GC分析。配有自動進樣器和火焰離子化檢測器,色譜柱為SP-2560石英毛細管柱(100 m×0.25 mm,0.2 μm)。實驗重復操作2 次。GC分析條件:柱溫先在100 ℃保溫5 min,采用程序升溫以4 ℃/min升至220 ℃保持20 min。載氣為N2,總氣體流速為52 mL/min,進樣口和檢測器溫度分別為250 ℃和260 ℃。
1.3.4 酰基遷移程度的計算
酰基遷移為脂肪酸從甘油三酯的sn1或sn3位轉移至sn2位,反之亦然。TLIM是sn-1,3專一性脂肪酶,在酯化和轉酯交換的反應過程中,脂肪酶TLIM把脂肪酸鍵入到甘油骨架的sn-1,3位或把甘油骨架上sn-1,3位脂肪酸水解為游離脂肪酸,而HPLC分析結果顯示有sn-1,2-甘油二酯和甘油三酯,說明發生了酰基遷移。酰基遷移程度即酰基遷移的量,本實驗中,合成1 mol的sn-1,2-DAG或甘油三酯(triacylglycerol,TAG)說明有1 mol的脂肪酸發生了酰基遷移,因此,在本研究中酰基遷移程度由HPLC分析的甘油酯成分計算的,即酰基遷移的甘油酯與合成的總DAG和TAG的含量百分比,計算公式如下:

1.4 統計分析
采用數據分析系統軟件(Statistical Analysis System Software 8.2,SAS,Cary,NC)進行方差分析。在α=0.05的水平上對數據進行顯著性分析,當P<0.05時,說明差異顯著。
2 結果與分析
2.1 反應底物和sn-1,3-DAG的脂肪酸組成分析
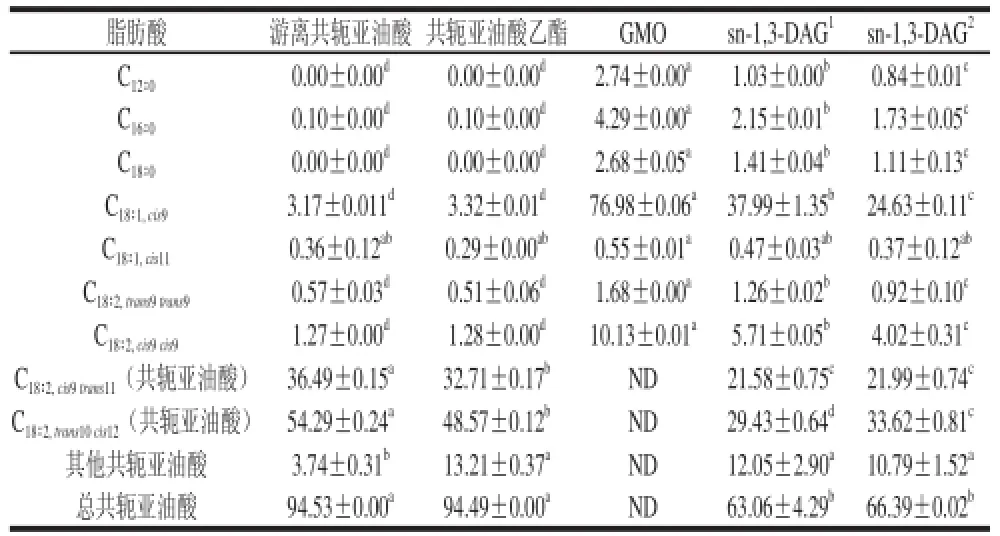
表1 游離脂肪酸(游離共軛亞油酸)、脂肪酸乙酯(共軛亞油酸乙酯)、GMO及反應后sn-1,3-DAG的脂肪酸組成Table1 Fatty acid composition of free fatty acids, fatty acid esters, GMO and the produced sn-1,3-DAG %
如表1所示,游離共軛亞油酸和共軛亞油酸乙酯中總共軛亞油酸含量在94%以上,純度較高。GMO中油酸含量最高為76.98%,其次為亞油酸(10.33%)和硬脂酸(4.29%)。不同類型的酰基供體即游離脂肪酸型(游離共軛亞油酸)和脂肪酸酯(共軛亞油酸乙酯)與GMO經脂肪酶催化酯化后,經TLC板分析得到sn-1,3-DAG進行脂肪酸成分分析,結果顯示,與游離共軛亞油酸為酰基供體的反應相比,共軛亞油酸乙酯為酰基供體的sn-1,3-DAG與相同物質的量比(3∶1)的共軛亞油酸含量更高,而油酸等其他脂肪酸含量較少。
2.2 酰基供體和反應時間對脂肪酶催化酯交換反應制備sn-1,3-DAG的影響

圖2 NP-HPLC分析甘油酯組分的色譜圖Fig.2 NP-HPLC liquid chromatogram of glyceride components
脂肪酶催化后混合物通過NP-HPLC分析,如圖2所示,此分離條件可以很好地將各種成分分離,出峰順序依次為共軛亞油酸乙酯、游離共軛亞油酸、TAG、sn-1,3-DAG、sn-1,2-DAG和GMO。
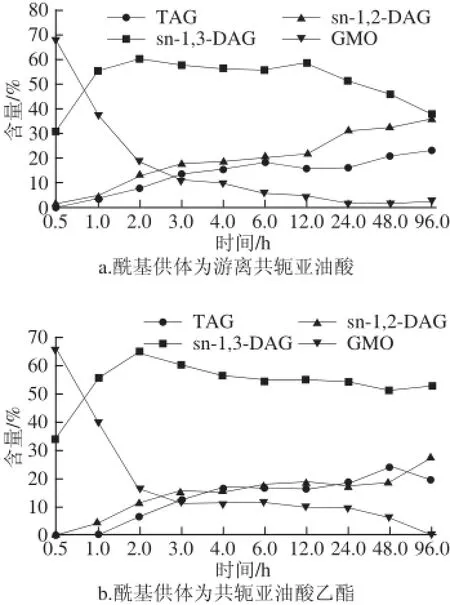
圖3 脂肪酶TLIM催化GMO與不同酰基供體反應得到甘油酯含量變化Fig.3 The amount of glycerides from TLIM-catalyzed reaction of GMO with different acyl donors
如圖3所示,反應2 h獲得sn-1,3-DAG含量最高,在圖3a中,實際測得sn-1,3-DAG,sn-1,2-DAG和TAG為60.56%、13.35%和7.84%;而在圖3b中,sn-1,3-DAG、sn-1,2-DAG和TAG分別為65.41%、11.57%和7.02%。隨著反應時間的延長sn-1,3-DAG的含量逐漸減少,相反sn-1,2-DAG和TAG的含量隨著反應時間的延長而增加。在游離共軛亞 油酸為酰基供體的反應體系(圖3a)中,在96 h的反應后,體系中sn-1,2-DAG的量與sn-1,3-DAG的量接近。與之不同的是,在以共軛亞油酸乙酯為酰基供體的反應中(圖3b),TAG含量在0.5~48 h之間是緩慢增加,而48~96 h之間TAG的含量減少,相應的sn-1,2-DAG的含量迅速增加,說明48 h后sn-1,3專一性脂肪酶催化部分TAG發生水解生成sn-1,2-DAG;特別值得一提的是,在整個反應中sn-1,3-DAG的含量遠遠高于sn-1,2-DAG的量。Nikolaus等[20]研究了脂肪酸與單甘酯(monoacylglycerol,MAG)的酯化反應,在優化條件下MAG與脂肪酸的酯化反應可得到70%的DAG,其中1,2-DAG與1,3-DAG含量相當;劉艷豐[21]研究了單甘脂與脂肪酸在以叔丁醇為溶劑的反應中,MAG到DAG的轉化率達到75%,其中sn-1,3-DAG占90%,即sn-1,3-DAG的轉化率為67.5%。在本實驗的反應體系中,酰基供體共軛亞油酸乙酯的sn-1,3-DAG的轉化率最高達65%(反應2 h),而此時得到的sn-1,2-DAG為11%。相比較劉艷豐[21]方法,本實驗采用綠色環保的無溶劑體系,且重點研究控制酰基遷移程度。
TLIM為sn-1,3專一性脂肪酶,在假設酶的1,3-特異性完全專一和不考慮反應過程中的酰基轉移時[22],反應過程中接入的酰基供體理應全部接入GMO骨架的sn-3位上,所以不會產生sn-1,2-DAG和TAG,但檢測結果表明合成了sn-1,2-DAG和TAG,說明發生了酰基遷移,酰基遷移在本反應中為不利的副反應,因此需要抑制酰基遷移,而圖3表明合理控制反應時間可以一定程度上抑制酰基遷移。本實驗通過對不同反應時間(0.5、1、2、3、4、6、12、24、48、96 h)進行采樣,結果如圖3所示,在反應初期,以游離共軛亞油酸和共軛亞油酸乙酯的兩個反應體系中sn-1,3-DAG、sn-1,2-DAG含量隨著反應時間的延長而增加,2 h之后,sn-1,3-DAG含量達到最大,其中共軛亞油酸乙酯體系比游離共軛亞油酸體系所得sn-1,3-DAG的含量更高。之后隨著反應時間的延長,sn-1,3-DAG含量逐漸下降,但sn-1,2-DAG和TAG含量隨著反應時間的延長繼續增加,由此確定最佳反應時間為2 h。反應時間的延長能夠增加酰基遷移已被多次報道,研究者普遍認為隨著時間延長反應體系趨近于動力學平衡,副反應的幾率增加。
2.3 底物物質的量比對脂肪酶催化酯交換反應制備sn-1,3-DAG的影響
隨著反應底物物質的量的改變,反應體系的穩定性及產物的擴散速率與含量都將受到影響[23-24]。為此,本實驗通過控制變量法改變底物物質的量比為2∶1、3∶1、4∶1,分析底物物質的量比對脂肪酶催化酰基供體酯交換反應的影響。
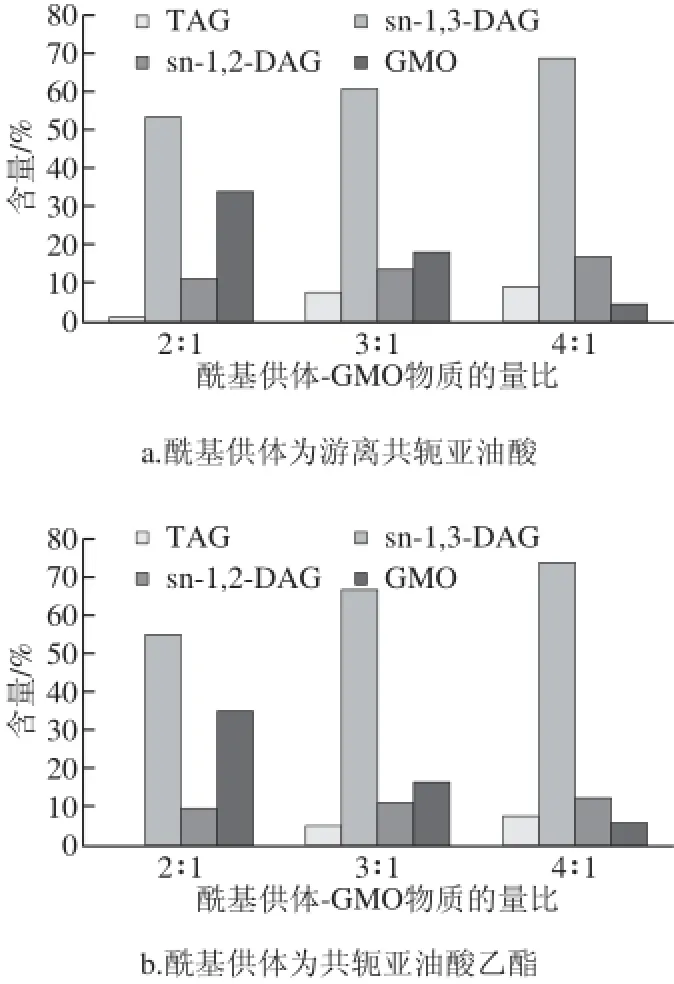
圖4 不同底物物質的量比的對甘油酯含量影響Fig.4 Infl uence of different substrate ratios on the amount of glycerides
如圖4所示,在相同條件下,sn-1,3-DAG的產量隨著反應底物物質的量比的增加而逐漸增加,共軛亞油酸乙酯作為酰基供體時的反應的產量更大,考慮到生產成本等因素,本實驗確定選擇最終底物物質的量比例為3∶1。
2.4 酰基供體和底物物質的量比對酰基遷移程度的影響
為探究其對目標產物的影響機制,本實驗通過同一底物物質的量比(3∶1)的游離共軛亞油酸與共軛亞油酸乙酯與GMO的反應所得數據對其進行分析,結果如圖5所示。
由圖5、6可知,在相同條件下,以游離共軛亞油酸作為酰基供體比共軛亞油酸乙酯作為時酰基遷移程度更大,且反應時間的越長、酰基供體的比例越多酰基遷移程度越高。就游離共軛亞油酸和共軛亞油酸乙酯這兩種不同酰基供體而言,游離共軛亞油酸的極性大于共軛亞油酸乙酯。極性酰基供體與添加極性的溶劑促進酰基遷移的原理相似,盡管本實驗所用脂肪酶為空間位置專一性,脂肪酶也會促進酰基遷移的發生,而且酰基遷移幾乎發生在脂肪酶的活性中心附近。因為在極性弱的體系中,體系中的水分集中在酶的活性中心,體系的極性增強,不利于反應過渡態電荷的分散,因此過渡態的能量狀態提高,反應的能壘提高,不利于酰基遷移的發生[25]。所以酰基供體極性更小的共軛亞油酸乙酯的反應體系中酰基遷移發生率更小。因此,在合成sn-1,3-DAG更宜采用脂肪酸酯作為酰基供體,降低酰基遷移副反應,提高目標產品的轉化率。
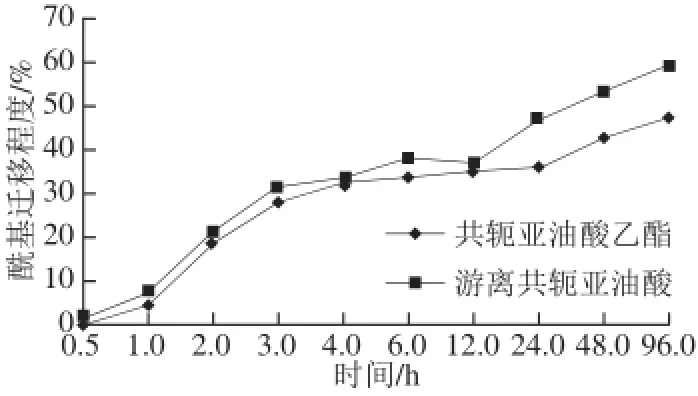
圖5 不同酰基供體對酰基遷移程度的影響Fig.5 Effect of different acyl donors on the degree of acyl migration
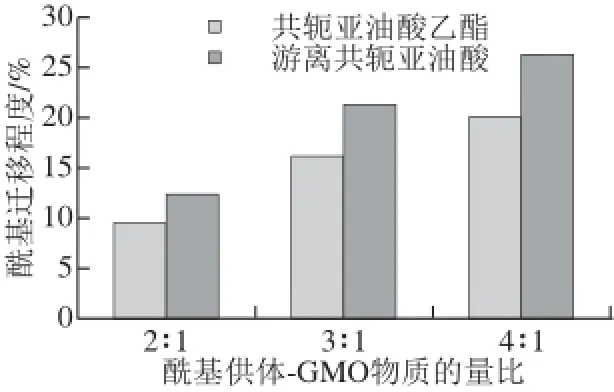
圖6 不同底物物質的量比對酰基遷移程度的影響Fig.6 Infl uence of different substrate ratios on the degree of acyl migration
3 結 論
通過單因素試驗探究酰基供體(游離共軛亞油酸和共軛亞油酸乙酯)與GMO物質的量比對催化反應產物轉化率的影響。再以共軛亞油酸乙酯為酰基供體對時間等條件優化,得到脂肪酶催化法制備功能性sn-1,3-DAG的最優條件為:共軛亞油酸乙酯與GMO物質的量比3∶1、酶加入量20%、反應溫度50 ℃、反應時間2 h。采用上述反應條件,與游離共軛亞油酸相比,以共軛亞油酸乙酯為酰基供體的反應實際測得sn-1,3-DAG含量更高(65.41%),酰基遷移程度更低,在將來中式生產中,經過分子蒸餾等純化手段,分離除去未反應的MAG和重餾分的TAG,sn-1,3-DAG的理論純度可以達到85%以上,可以用于生產高純度sn-1,3-DAG。所制備的sn-1,3-DAG中共軛亞油酸含量達到66.39%。
通過比較游離脂肪酸和脂肪酸乙酯兩種不同酰基供體,用極性更低的共軛亞油酸乙酯代替游離共軛亞油酸可以降低酰基遷移程度,降低副產物sn-1,2-DAG的得率不僅提高sn-1,3-DAG的純度和轉化率,還降低后續產物的純化難度。因此以脂肪酸酯為酰基供體制備sn-1,3-DAG和其他的高附加值的位置異構體是更理想的選擇。本實驗對共軛亞油酸乙酯為酰基供體的研究嘗試奠定了利用脂肪酸酯為酰基供體制備高附加值的位置異構體制備的理論依據。
[1] 孟祥河, 毛忠貴. 甘油二酯的應用現狀[J]. 中國食品添加劑, 2002(4): 58-64.
[2] IJIRI Y, NAEMURA A, YAMASHITA T, et al. Dietary diacylglycerol extenuates arterial thrombosis in apoE and LDLR deficient mice[J]. Thrombosis Research, 2006, 117(4): 411-417.
[3] YASUTAKE K, NAKAMUTA M, SHIMA Y, et al. Nutritional investigation of non-obese patients with non-alcoholic fatty liver disease: the signifi cance of dietary cholesterol[J]. Scandinavian Journal of Gastroenterology, 2009, 44(4): 471-477.
[4] YAMAMOTO K, TOMONOBU K, ASAKAWA H, et al. Diet therapy with diacylglycerol oil delays the progression of renal failure in type 2 diabetic patients with nephropathy[J]. Diabetes Care, 2006, 29(2): 417-419.
[5] KAMPHUIS M M J W, MELA D J, WESTERTERP-PLANTENGA M S. Diacylglycerols affect substrate oxidation and appetite in humans[J]. The American Journal of Clinical Nutrition, 2003, 77(5): 1133-1139.
[6] LIU Ning, WANG Yong, ZHAO Qiangzhong, et al. Fast synthesis of 1,3-DAG by Lecitase? Ultra-catalyzed esterification in solvent-free system[J]. European Journal of Lipid Science and Technology, 2011, 113(8): 973-979.
[7] TAGUCHI H, NAGAO T, WATANABE H, et al. Energy value and digestibility of dietary oil containing mainly 1,3-diacylglycerol are similar to those of triacylglycerol[J]. Lipids, 2001, 36(4): 379-382.
[8] MARTIN D, MORAN-VALERO M I, VáZQUEZ L, et al. Comparative in vitro intestinal digestion of 1,3-diglyceride and 1-monoglyceride rich oils and their mixtures[J]. Food Research International, 2014, 64: 603-609.
[9] REYES G, YASUNAGA K, ROTHENSTEIN E, et al. Effects of a 1,3-diacylglycerol oil-enriched diet on postprandial lipemia in people with insulin resistance[J]. Journal of Lipid Research, 2008, 49(3): 670-678.
[10] 朱順達, 高紅林. 酶法合成甘油二酯的研究進展[J]. 糧食與食品工業, 2006, 13(6): 12-14.
[11] 段章群, 杜偉, 劉德華. 生物酶法制備1,3-甘油二酯[J]. 化學進展, 2009, 21(9): 1939-1944.
[12] MENG Z, LU S, GENG W, et al. Preliminary study on acyl incorporation and migration in the production of 1,3-diacylglycerol by immobilized lipozyme RM IM-catalyzed esterification[J]. Food Science and Technology Research, 2014, 20(2): 175-182.
[13] 魯珊, 黃健花, 王興國. 無溶劑體系酶催化酯化反應合成1,3-甘油二酯的研究[J]. 食品與生物技術學報, 2013, 32(4): 358-361.
[14] ZHU Xuemei, HU Jiangning, XUE Chenglian, et al. Physiochemical and oxidative stability of interesterified structured lipid for soft margarine fat containing Δ5-UPIFAs[J]. Food Chemistry, 2012, 131(2): 533-540.
[15] JIN Juan, LI Dan, ZHU Xuemei, et al. Production of diacylglycerols from glycerol monooleate and ethyl oleate through free and immobilized lipase-catalyzed consecutive reactions[J]. New Biotechnology, 2011, 28(2): 190-195.
[16] CHIAVARO E, RODRIGUEZ-ESTRADA M T, BARNABA C, et al. Differential scanning calorimetry: a potential tool for discrimination of olive oil commercial categories[J]. Analytic Chimica Acta, 2008, 625(2): 215-226.
[17] MAURELLI S, BLASI F, COSSIGNANI L, et al. Enzymatic synthesis of structured triacylglycerols containing CLA isomers starting from sn-1,3-diacylglycerols[J]. Journal of the American Oil Chemists’ Society, 2009, 86(2): 127-133.
[18] 鐘南京, 李琳, 李冰, 等. 甘油酯的液相色譜分析[J]. 現代食品科技, 2012, 28(1): 123-126.
[19] 朱雪梅, 阮霞, 胡蔣寧, 等. α-生育酚、VC硬脂酸酯和槲皮素在含松籽油酸結構脂中抗氧化作用的研究[J]. 食品科學, 2013, 34(1): 88-92.
[20] NIKOLAUS W, KUMAR D M. Solvent-lipase-catalyzed preparation of diacylglycerols[J]. Journal of Agricultural and Food Chemistry, 2004, 52(17): 5347-5353.
[21] 劉艷豐. 富含α-亞麻酸的偏甘油酯的酶法制備及其理化性質研究[D].廣州: 華南理工大學, 2012.
[22] 韋偉, 馮鳳琴. sn-1,3位專一性脂肪酶在食品中的應用[J]. 中國糧油學報, 2012, 27(2): 122-128.
[23] JULIA S, PATRICK A. Effect of acyl migration in lipozyme TLIM-catalyzed interesterifi cation using a triacylglycerol model system[J]. European Journal of Lipid Science and Technology, 2011, 113: 1258-1265.
[24] 魯珊. 高純1,3-二油酸甘油酯的制備[D]. 無錫: 江南大學, 2013.
[25] 李人望. 溶劑和水活度對脂肪酶1,3-位置選擇性和酰基轉移的影響研究[D]. 北京: 清華大學, 2010.
Production of Functional 1,3-Diacylglyerol from Monoacylglycerol by Lipase-Catalyzed Transesterifi cation
HUANG Chuchu, XIONG Huihuang, GONG Bin, YU Yun, FENG Yue, LIANG Yuan, ZHU Xuemei*
(State Key Laboratory of Food Science and Technology, School of Science and Technology, Nanchang University, Nanchang 330047, China)
sn-1,3-Diacylglycerol (sn-1,3-DAG) was synthesized from glycerol monooleate (GMO) by the immobilized Thermomyces lanuginosus lipase (Lipozyme TLIM)-catalyzed esterifi cation in a solvent-free system. The effects of different types of acyl donors such as conjugated linoleic acid (CLA-FA) and conjugated linoleic acid ethyl ester (CLA-EE), reaction time and molar ratio of substrates on acyl migration and glyceride concentration were investigated to improve the yield of sn-1,3-DAG. of the yield of sn-1,3-DAG was 65% when the reaction proceeded at a TLIM concentration of 20% by mass with a molar ratio of conjugated linoleic acid ethyl ester (CLAEE):GMO of 3:1 for 2 h at 50 ℃ in a water bath shaker at 220 r/min. Also, the effects of two types of acyl donors (free acid and ethyl ester) on acyl migration and the yield of sn-1,3-DAG were compared. This study can provide a reference for the industrial production of sn-1,3-DAG.
transesterifi cation; conjugated linoleic acid; conjugated linoleic acid ethyl ester; glyceryl monooleate; lipase TLIM
TQ225.24
A
1002-6630(2015)22-0001-05
10.7506/spkx1002-6630-201522001
2015-03-21
國家自然科學基金地區科學基金項目(31460427);南昌大學國家級創新創業訓練計劃項目(201310403012)
黃楚楚(1993—),女,碩士研究生,研究方向為食品質量與安全。E-mail:huangchuchu93@163.com
*通信作者:朱雪梅(1982—),女,副教授,博士,研究方向為油脂化學、功能性食品。E-mail:zhuxuemei2005@hotmail.com

