提高具有高起泡性大豆蛋白水解物得率的研究
鄧辰辰 陳 潔 何志勇 秦 昉 曾茂茂
(江南大學食品科學與技術國家重點實驗室,江蘇 無錫 214122)
大豆蛋白氨基酸組成平衡、營養品質優良,同時具有良好的溶解性、乳化性、起泡性和凝膠性等加工性質,是食品工業中重要的蛋白質之一。天然大豆蛋白盡管有著不錯的各種性質,然而其起泡性遠不如蛋清蛋白、乳化性遠不如酪蛋白、凝膠性也遠不如肌纖維蛋白,總體而言,天然大豆蛋白尚不足以滿足實際應用的需要[1]。通過對大豆蛋白進行物理、化學及酶法改性可以有效提高其功能性質[2,3],并使之具有作為功能性食品配料的應用潛力。其中酶法改性因其溫和、自然和無害的特點,受到重點關注。
酶法改性是利用酶制劑對大豆蛋白進行有限水解,通過蛋白酶部分水解蛋白質,降低分子量、增加其帶電基團并讓更多的疏水基團暴露出來,從而達到改變蛋白質功能性質的目的,例如提高乳化性、起泡性、溶解性等[2]。但是,大豆蛋白經過酶解會產生大量沉淀,得到的大豆蛋白產物得率也較低[4,5]。有研究[6,7]表明,沉淀的聚集體可能是通過疏水相互作用和二硫鍵形成的。
前人研究[8]以及本實驗室前期研究[9,10]顯示,采用木瓜蛋白酶水解大豆蛋白,在水解度約為3%時,產物起泡性較好,但是得率低下(<45%)。本研究針對酶解大豆蛋白產物得率低的問題,以木瓜蛋白酶水解大豆分離蛋白(SPI)獲得的高起泡性產物為研究對象,通過在酶解或滅酶時添加還原劑Na2SO3、表面活性劑吐溫80、大豆卵磷脂,尋找緩解疏水作用和二硫鍵導致的聚集體和沉淀問題的途徑。研究過程通過測定各自的酶水解進程曲線、產物得率、產物起泡性和穩定性以及上清液和沉淀氨基酸分析來判斷聚集體形成的阻斷效應。本研究旨在為尋找提高酶水解大豆蛋白得率的途徑提供理論和技術依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
大豆:東北毛豆王,黑龍江尚志市慶美種業有限公司;
木瓜蛋白酶:250U/mg,上海如吉生物有限公司;
亞硫酸鈉、吐溫80:分析純,國藥集團化學試劑有限公司;
大豆卵磷脂:分析純,美國Sigma公司;
其他試劑:分析純,國藥集團化學試劑有限公司。
1.1.2 主要儀器設備
家用粉碎機:9FZ-15B型,臺州余國電器有限公司;
高速冷凍離心機:Avanti J-26型,美國Beckman公司;
數顯恒溫水浴鍋:HH-4型,江蘇金壇市榮華儀器制造有限公司;
機械攪拌器:RW20D型,上海IKA儀器有限公司;
磁力攪拌器:C-MAG MS10型,廣州儀科實驗儀器有限公司;
循環水式多用真空泵:SHB-III型,鄭州長城科工貿有限公司;
酸度計:DELTA 320型,梅特勒-托利多儀器(上海)有限公司;
高速乳化均質機:T18型,英國IKA公司。
1.2 方法
1.2.1 SPI的制備 采用堿提酸沉法[3]。大豆去皮碾碎成粉(60目),加入正己烷乙醇溶液(9︰1,V︰V)脫脂(料液比1︰3,m︰V),室溫攪拌30min,浸提,抽濾后平鋪于托盤中揮發過夜。脫脂豆粉與水(料液比1︰10,m︰V)混合后,用2mol/L的NaOH調pH到8.0,室溫下攪拌2h,雙層紗布過濾,濾液15 900×g離心25min。取上清液用2mol/L的HCl液調pH到4.5,3 300×g離心15min,得到沉淀;加水復溶并調到中性,微量凱氏定氮法測其濃度(m/V),加入0.03%疊氮化鈉于4℃保藏。
1.2.2 木瓜蛋白酶水解大豆分離蛋白 高起泡性大豆蛋白水解物制備參考文獻[11]。調節SPI溶液濃度至5%(m/V),取150mL加入酶反應器,調節pH 為7.0,溫度55℃,攪拌30min,加入木瓜蛋白酶(酶與底物的比為1%)進行酶反應,反應過程中利用0.2mol/L的NaOH溶液滴定,保持pH恒定,并記錄每分鐘NaOH溶液的消耗量。通過pH-stat法計算水解度為3%時NaOH的消耗量,當水解度達到3%時,沸水浴加熱10min終止反應,冷卻后以4 360×g離心20min,收集上清液和沉淀。采用Lowry法測定上清液中蛋白質含量。起泡劑得率為上清液中蛋白質含量除以水解大豆分離蛋白量。樣品S1為空白,S2為在酶解前加入0.1%Na2SO3,S3為在滅酶前加入0.1%Na2SO3,S4為在酶解前加入0.1%吐溫80,S5為在滅酶前加入0.1%吐溫80,S6為在酶解前加入0.1%大豆卵磷脂,S7為在滅酶前加入0.1%大豆卵磷脂,S8為在酶解前加入0.1%Na2SO3和大豆卵磷脂,S9為在滅酶前加入0.1%Na2SO3和大豆卵磷脂,S0為原始未酶解的SPI。
1.2.3 水解度的測定 根據文獻[11],通過pH-stat法計算蛋白質的水解度。
1.2.4 起泡性和泡沫穩定性的測定 根據文獻[10]。
1.2.5 氨基酸分析 根據文獻[9]和[10]。
2 結果與討論
2.1 SPI的酶解曲線
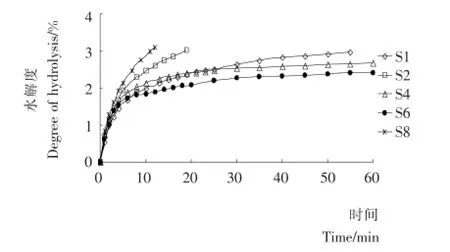
圖1 木瓜蛋白酶水解大豆分離蛋白的酶解速率曲線Figuer 1 Digestion rate curve of hydrolysis of SPI by papain
采用pH-stat法測定木瓜蛋白酶水解SPI的進程曲線,結果見圖1。其中S1、S3、S5、S7的酶解曲線相同,統一用S1代表。由圖1可知,隨著酶解時間的延長,蛋白質的水解度逐漸增大,尤其在最初的20min水解速率很大,之后逐漸平緩下來。添加還原劑Na2SO3的樣品S2,其酶解速率明顯快于空白樣品S1;添加表面活性劑吐溫80或大豆卵磷脂的樣品S4和S6,其酶解速率在前10min略快于樣品S1,而后速率明顯下降,明顯慢于樣品S1;同時添加Na2SO3和大豆卵磷脂的樣品S8,其酶解速率最快。通常而言,還原劑Na2 SO3可以還原二硫鍵,抑制二硫鍵引起的聚集,而表面活性劑則有可能破壞蛋白質中的疏水鍵、氫鍵和鹽鍵[3]。上述結果暗示,還原劑Na2SO3和吐溫80可以部分抑制SPI在水解過程中聚集,幫助蛋白質分子基團展開,從而促進底物和酶的結合并加快水解速率;然而水解后期表面活性劑則難以起到進一步抑制聚集促進水解的效應。
2.2 SPI酶解上清液的得率
樣品S1~S9酶解上清液的得率見圖2。樣品S2和S3的得率比空白提高了10%,且酶解前后加入得率幾乎無差別,該結果暗示酶解產物得率下降可能產生于加熱滅酶階段,二硫鍵的還原有助于該階段聚集體成長和沉淀的緩解。
樣品S4和S5的得率差別顯著,酶解時加入表面活性劑吐溫80可以有效提高得率,而酶解后加熱前加入,盡管也能提升得率,但是效果遠不如酶解時加入,該結果說明,酶解過程由于打開了SPI分子結構,促進了由于疏水相互作用產生的聚集體沉淀,而表面活性劑吐溫80可以有效抑制這種聚集;而在加熱滅酶前加入吐溫80盡管可以部分抑制加熱過程引發的疏水聚集,但是無法使水解階段已經聚集的體系解離,因而S5的得率顯著低于S4的。
由樣品S6和S7的得率可以看出,具有還原性的兩性離子型表面活性劑——大豆卵磷脂無法有效抑制疏水聚集,在酶解前的加入甚至還促進了沉淀的產生。
由于卵磷脂是目前制造大豆蛋白的常用分散劑,而吐溫80有異常風味,很少在工業中使用,因此樣品S8和S9疊加使用了還原劑Na2SO3和表面活性劑卵磷脂。從結果可以看出,同時添加還原劑的表面活性劑能夠很好地抑制沉淀的產生,顯著提升酶解產物得率。該結果暗示如果能夠有效抑制酶解過程和加熱滅酶階段的疏水聚集、二硫鍵結合效應,酶解產物的得率是可以有效提升的。
2.3 SPI酶解上清液的起泡性和穩定性
為了考察各種聚集抑制劑對產物功能性的影響,試驗同步測定了各種產物的起泡性和泡沫穩定性,樣品S1~S9酶解上清液的起泡性和穩定性結果見圖3。相比較而言,未酶解的樣品S0,其起泡性和穩定性最差。還原劑Na2SO3的加入,可以部分提高產物起泡性,但對穩定性影響不顯著;而表面活性劑吐溫80的加入則使產物起泡性和泡沫穩定性均顯著下降;卵磷脂的加入降低了產物起泡性,但不影響穩定性。還原劑Na2SO3和表面活性劑卵磷脂的疊加使用使產物的起泡性和穩定性均輕微下降。產物起泡性和泡沫穩定性的改變,可能是體系中還原劑和表面活性劑導致,也可能是還原劑和表面活性劑的加入不僅影響了聚集體的生成還影響了酶解過程產物的水解模式,從而導致產物性質改變。
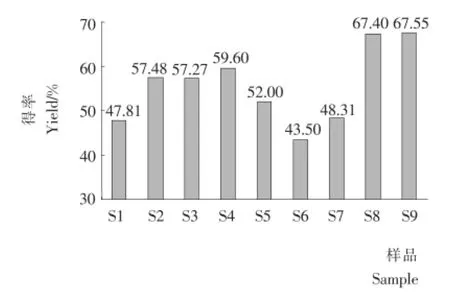
圖2 大豆分離蛋白酶解上清液的得率Figuer 2 Yield of supernatant fluid of enzymatic hydrolysis of SPI
2.4 酶解上清液和沉淀的氨基酸組成
為了進一步了解酶解產物性質改變的原因,將各個條件下水解的樣品(S1~S9)酶解后的上清液和沉淀進行了氨基酸分析,結果見表1、2。由于采用酸法測定,色氨酸無法測得。由表1可知,上清液中各個樣品之間氨基酸組成差別不是非常顯著;但沉淀中除了谷氨酸以外,各個樣品之間其他氨基酸組成也差異不大,沉淀中S2、S3、S8和S9 4個樣品中谷氨酸含量顯著低于其他樣品。值得注意的是,將表1和表2進行對照可以發現,上清中的谷氨酸和賴氨酸含量顯著高于沉淀中的;而異亮氨酸、纈氨酸、亮氨酸、苯丙氨酸、酪氨酸等疏水性氨基酸含量均低于沉淀中的。該結果與Tomotake等[12]的研究結果基本一致。這些結果進一步說明了水解過程沉淀的產生與疏水相互作用有較大關聯性。
3 結論
本研究主要針對酶解大豆蛋白產物得率低下的問題,在木瓜蛋白酶水解大豆蛋白的不同階段加入還原劑Na2SO3、表面活性劑吐溫80、大豆卵磷脂以及它們的組合,尋找緩解由于酶水解及隨后的加熱滅酶過程中由于疏水作用和二硫鍵導致的聚集體和沉淀問題的途徑。結果顯示,在木瓜蛋白酶水解大豆分離蛋白時,加入適量的還原劑Na2SO3和表面活性劑大豆卵磷脂,不僅能夠顯著加快水解進程,同時能夠顯著提高酶解產物得率,得率提高了50%以上;而酶解過程單獨加入還原劑Na2SO3,則可以獲得最好的產物性質,即產物起泡性和泡沫穩定性最佳。水解產物上清液和沉淀的氨基酸分析結果表明,沉淀中的疏水性氨基酸含量高于上清液,說明水解過程聚集和沉淀的產生與疏水相互作用有重要關聯。本研究為更好地生產酶改性大豆蛋白產品提供了理論參考。
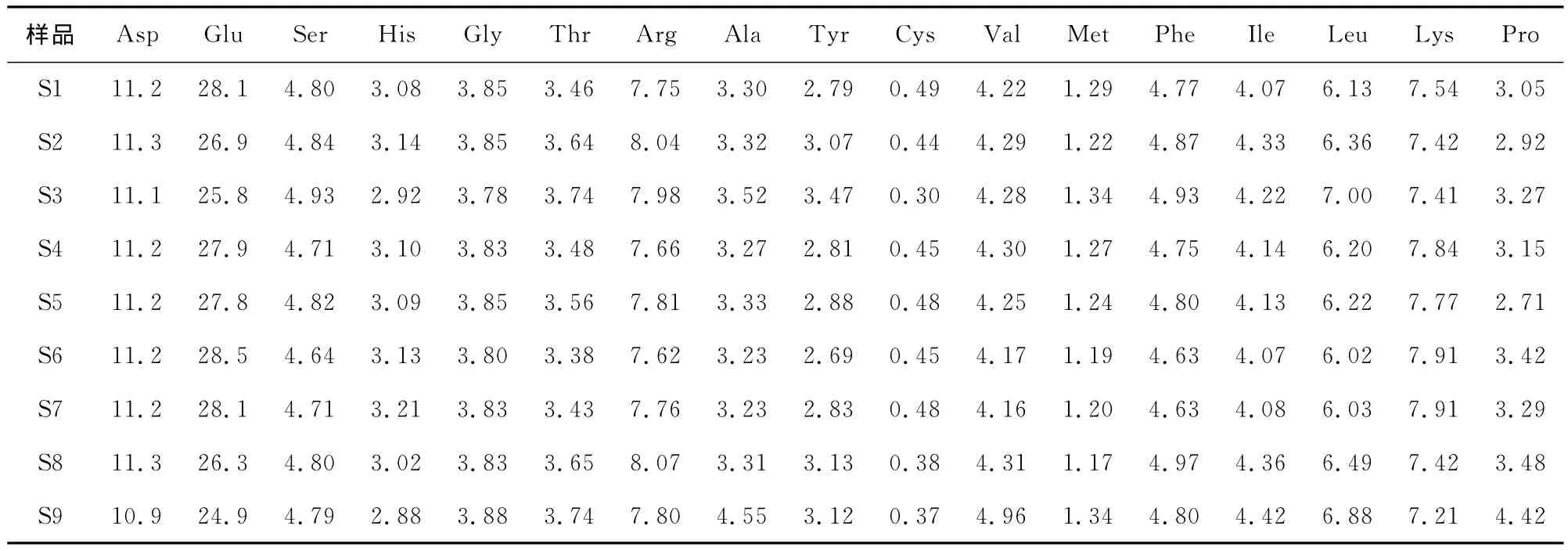
表1 大豆分離蛋白酶解上清液的氨基酸組成Table 1 Amino acid in supernatant fluid of enzymatic hydrolysis of SPI %
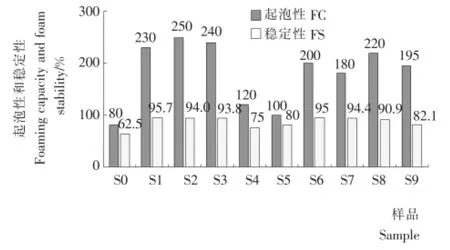
圖3 大豆分離蛋白酶解上清液的起泡性和穩定性Figuer 3 Foaming capacity and stability of enzymatic hydrolysis of SPI
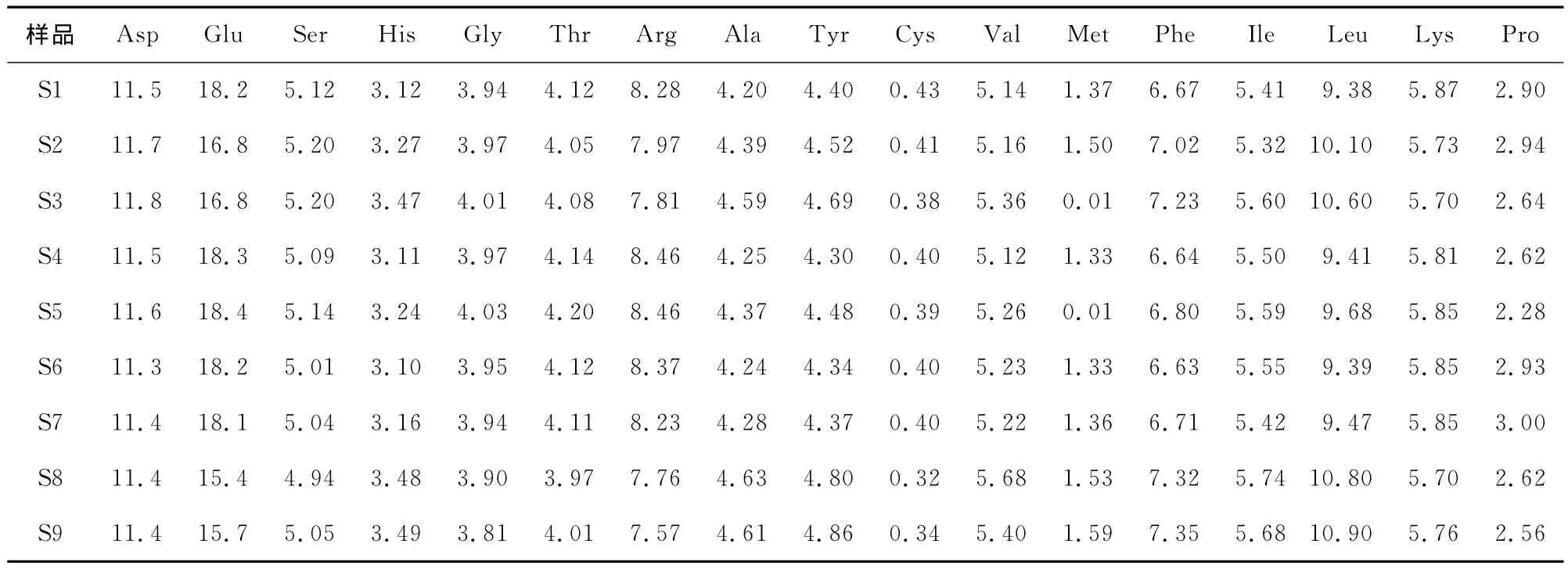
表2 大豆分離蛋白酶解沉淀的氨基酸組成Table 2 Amino acid in sediment of enzymatic hydrolysis of SPI %
1 黃友如,華欲飛.大豆分離蛋白的改性及其對功能性質的影響[J].中國油脂,2003,28(4):35~38.
2 Molina Ortiz S E,Wagner J R.Hydrolysates of native and modified soy protein isolates:structural characteristics,solubility and foaming properties[J].Food Research International,2002,35(6):511~518.
3 遲玉杰,朱秀清,李文濱,等.大豆蛋白質加工新技術[M].北京:科學出版社,2008.
4 Were L,Hettiarachchy N S,Kalapathy U.Modified soy proteins with improved foaming and water hydration properties[J].Journal of Food Science,1997,62(4):821~824.
5 徐紅華,劉欣.復合酶法改善大豆分離蛋白起泡性的工藝優化[J].食品與發酵工業,2007,33(1):51~54.
6 于泓鵬,唐傳核,曾慶孝,等.大豆分離蛋白水解多肽聚集物的組成及相互作用[J].華南理工大學學報,2006,34(8):105~109.
7 Creusot N,Gruppen H.Hydrolysis of whey protein isolate with bacillus licheniformis protease:aggregating capacities of peptide fractions[J].Journal of Agricultural and Food Chemistry,2008,56(21):10 332~10 339.
8 于鴻鵬.大豆蛋白水解多肽的聚集機理及其調控[D].廣州:華南理工大學,2005.
9 李維瑤.高起泡性大豆分離蛋白的研究及其在蛋糕中的應用[D].無錫:江南大學,2010.
10 劉瑾.酶法改善大豆分離蛋白起泡性和乳化性的研究[D].無錫:江南大學,2008.
11 Adler-Nissen J.Determination of the degree of hydrolysis of food protein hydrolysates by rinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry,1979,27(6):1 256~1 262.
12 Tomotake H,Shimaoka I,Kayashita J,et al.Physicochemical and functional properties of buck wheat protein product[J].Journal of Agricultural and Food Chemistry,2002,50(7):2 125~2 129.

