苦苦菜發酵過程中主要發酵菌種及滋味物質的變化
張 婷 楊 波 羅瑞明 王萬銀
(1.寧夏大學農學院,寧夏 銀川 750021;2.寧夏大學生命科學學院,寧夏 銀川 750021;3.平羅縣農副產品流通服務中心,寧夏 石嘴山 753400)
苦苦菜,屬菊科菊苣族,又名苦苣菜、苣荬菜等,在中藥中稱之為敗醬草,是一種藥食兼具的無毒野生植物,屬一年生或兩年生草本植物。苦苦菜具有明目和胃、破瘀活血、消炎利尿、益氣養陽、排膿去淤消腫的功效,對預防心臟病、恢復腦細胞功能和預防癌癥均具有一定療效。
對食品發酵后微生物菌群和風味物質變化的研究有助于實現該發酵食品的工業化生產,如對糟魚[1]、香腸[2]、冬瓜[3]等發酵后的研究,但尚未發現有對發酵苦苦菜及其發酵菌種和滋味物質的研究。本試驗著重研究苦苦菜自然發酵過程中,主要菌群和典型發酵菌株的變化,并對其發酵過程中的總酸、pH值和腌制液鹽濃度進行了動態檢測。此外,評價山野菜腌制后的風味主要從質地、顏色、香氣、滋味等方面。氨基酸是一種高含量呈味物質,其含量與類型是影響風味很重要的因素[4],不同的氨基酸呈現的味道不同[5]。本試驗測定了苦苦菜發酵過程中游離氨基酸含量的變化,按其呈味分類,檢測各類呈味氨基酸含量隨發酵時間的變化,分析其變化規律,為苦苦菜的開發利用和產業發展提供依據。
1 材料與方法
1.1 試驗材料
苦苦菜、食鹽、辣椒、生姜、茴香、花椒等:市售;
MRS瓊脂培養基:在MRS液體培養基中加入1.5%~2.0%的瓊脂,121℃滅菌20min;
MRS分離培養基:在MRS培養基的基礎上加入2~5g無水碳酸鈣,121℃滅菌20min,用于乳酸菌的分離與鑒定。
1.2 主要儀器與試劑
氨基酸自動分析儀:L-8900型,上海仁特檢測儀器有限公司;
手動控制壓力蒸汽滅菌器:GMSX-280,北京市永光明醫療儀器有限公司;
精密pH計:PHS-3C型,上海精密科學儀器有限公司;
生化培養箱:LRH系列,上海一恒科技有限公司;
恒溫干燥箱:101-3型,上海東星建材試驗設備有限公司;
葡萄糖、牛肉膏、瓊脂粉、胰蛋白胨、酵母浸粉:生化試劑,國藥集團化學試劑有限公司;
乙醇:分析純,浙江雙林有限公司;
氫氧化鈉:分析純,天津化學試劑三廠;
硝酸銀:分析純,國藥集團化學試劑有限公司。
1.3 試驗方法
1.3.1 腌制工藝流程
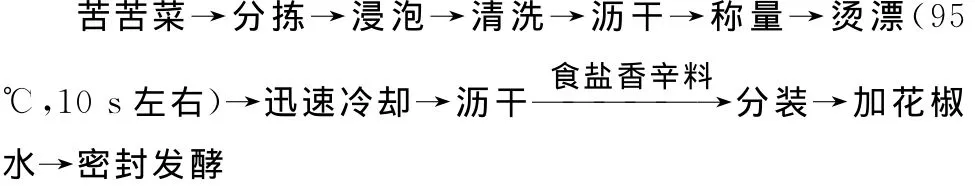
食鹽放入量5%,菜放入量70%,香辛料(辣椒∶生姜∶茴香=6∶3∶1)放入量4%(均為占菜水總重百分比),花椒水中花椒放入量為所用水3‰~4‰。
1.3.2 發酵過程指標檢測
(1)菌落總數計數:采用平板培養計數法。
(2)酵母菌、霉菌菌落總數:采用平板培養計數法。
(3)乳酸菌總數:采用液體培養法和平板培養計數法。
(4)pH值的測定:采用pH計測定。
(5)總酸含量(以乳酸計)測定:采用直接滴定法,按GB/T 12456—90執行。
(6)腌制液鹽濃度的測定:硝酸銀溶液滴定法[6]。
(7)感官評價:請10位有經驗的評定人員對苦苣菜腌制期間的色澤、外觀組織、香氣、質地、滋味、口感等計分(滿分100分),取平均值。評比計分標準見表1。
1.3.3 游離氨基酸樣品前處理 參照文獻[5]。
1.3.4 乳酸菌的分離及純化 分別取0,3,7,14,21,28d的苦苦菜自然發酵菜汁,按10倍稀釋到合適梯度,涂布于用MRS分離培養基平板,在生化培養箱中于30℃培養48h,挑取長勢好且有明顯較大鈣溶圈的菌落,在MRS瓊脂培養基平板上反復劃線分離至純菌落,然后進行革蘭氏染色和接觸酶反應,挑選出革蘭氏陽性、接觸酶陰性的菌株[7],轉移至MRS斜面培養基上,編號并于4℃保存,待鑒定用。

表1 感官評分標準Table 1 Standard of sensory evaluation
1.3.5 乳酸菌菌體的鑒定 乳酸菌按常規接種方法培養,挑取典型菌落革蘭氏染色,油鏡下觀察。生理生化鑒定具體包括[8,9]:① 過氧化氫酶試驗;② 吲哚試驗;③ 明膠液化試驗;④ 硫化氫產生試驗;⑤ 糖發酵產酸試驗;⑥ 運動性檢查。
1.4 數據處理
試驗結果數據統計分析采用軟件SPSS 19.0和Excel 2007。
2 結果與分析
2.1 微生物學指標測定結果
2.1.1 主要微生物菌落總數的變化 由圖1可知,苦苦菜發酵液中細菌總數隨發酵天數的增加呈現出先上升后下降再緩慢上升的趨勢,第3天左右達到最大值后迅速下降,到第20天左右數量又開始上升。發酵液中乳酸菌總數在0~3 d就出現了增長的高峰,隨之增長平緩,6~14d乳酸菌總數維持在最大值范圍,之后隨著發酵的進行緩慢降低,整個發酵過程中乳酸菌生長情況較好,菌落總數基本維持在107CFU/mL以上。酵母菌數量在發酵剛開始時較少,隨著腌制的進行在發酵初期較大量繁殖后又減少,發酵14d左右總數趨于穩定。
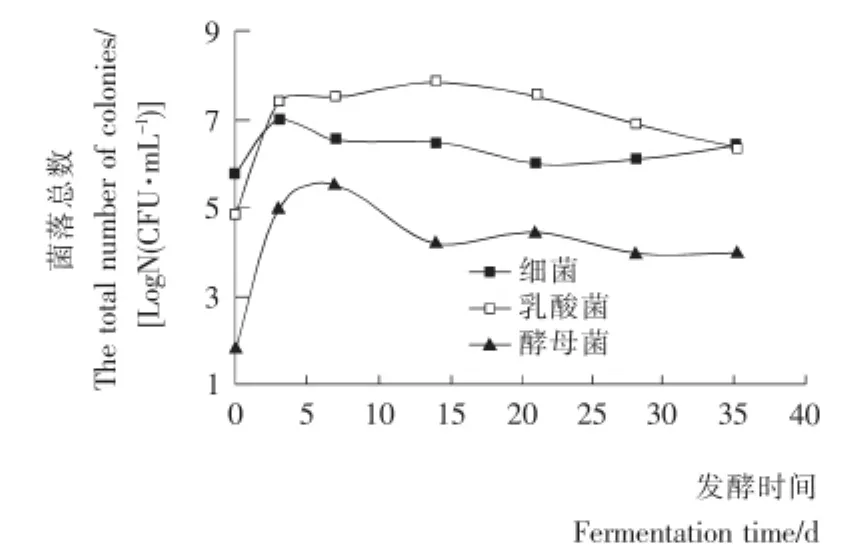
圖1 細菌、乳酸菌和酵母菌總數隨發酵時間的變化Figure 1 The total number of bacteria,lactic acid bacteria and yeast changes along with the fermentation time
2.1.2 霉菌的檢測 圖2為苦苦菜腌制前進行燙漂和不燙漂處理,腌制后感官品質的對比,以及不燙漂的情況下霉菌生長情況。由圖2可知,隨著發酵天數的增加,苦苦菜燙漂和不燙漂處理后的感官品質雖均有所下降,但整體上燙漂后苦苦菜的色澤、香氣、滋味等品質要高于不燙漂處理,并且下降趨勢平緩,發酵第30天感官品質仍保持在80分左右,這主要是因為燙漂溫度達到95℃時,會導致苦苦菜中的葉綠素酶失活,時間適當延長,苦苦菜的變色程度越輕,但考慮到菜要腌制,對苦苦菜進行10s左右的燙漂處理,這樣的處理不僅可以獲得很好的護色效果,還能祛除苦澀味[10],提高腌菜品質。此外,苦苦菜在腌制時極易出現霉變問題,腌制前將菜燙漂還能有效地減少苦苦菜自然發酵前的雜菌,燙漂處理過的苦苦菜中未檢測出霉菌的出現,未燙漂苦苦菜中霉菌總數檢測見圖2,并伴有不良氣味。
2.2 乳酸菌的分離及鑒定
2.2.1 自然發酵苦苦菜中乳酸菌的分離 自然發酵苦苦菜汁中乳酸菌經培養、分離純化后,一共挑出10株可疑菌株進行液體發酵,利用酸堿滴定法測定發酵液中的產酸量,最終共篩選出4株產酸較多的菌株,分別記為L1、L2、L3和L4。
2.2.2 乳酸菌的鑒定 對4株產酸量高的乳酸菌(L1、L2、L3、L4)進行進一步的菌種鑒定,對菌株進行形態學分析和生化特征鑒定等,結果見圖3和表2、3。通過運動性檢查結果顯示4菌株均無運動性。
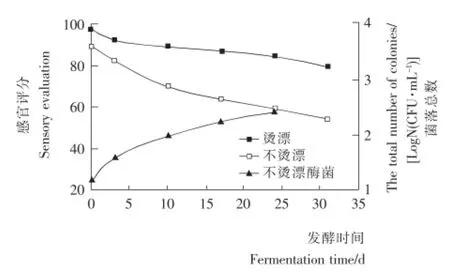
圖2 預處理方式對苦苦菜腌制品品質的影響Figure 2 The influence of different treatments on quality of dandelion before pickled processing
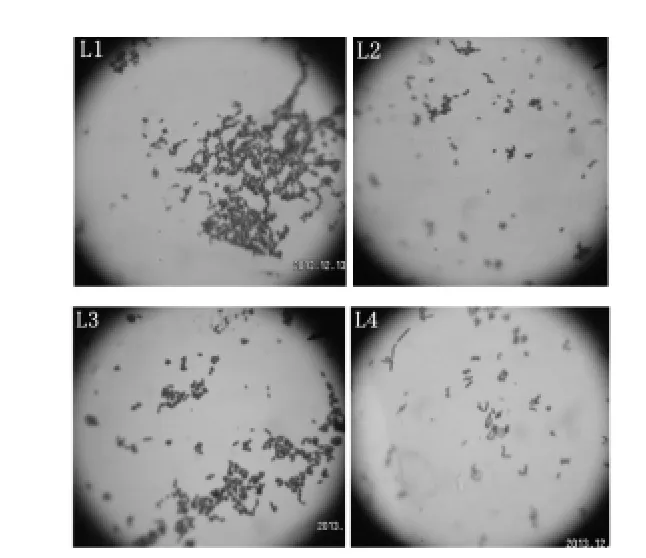
圖3 菌株L1、L2、L3、L4的革蘭氏染色結果Figure 3 Gram staining results of strain L1,L2,L3and L4
表2 生化鑒定結果Table 2 The biochemical test results
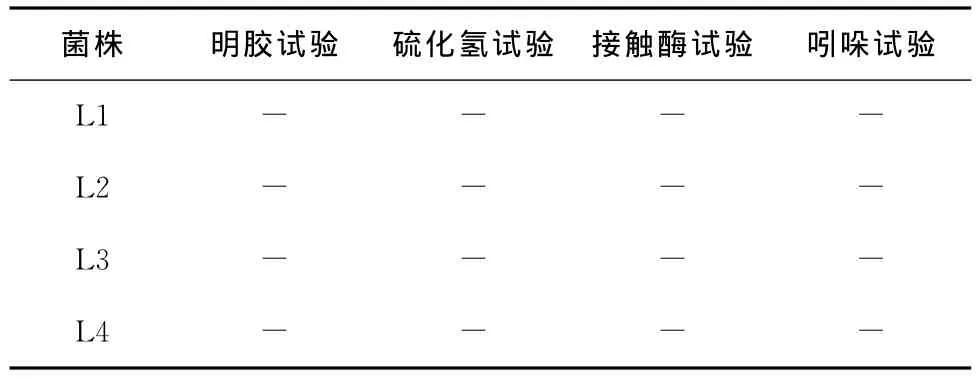
表2 生化鑒定結果Table 2 The biochemical test results
“-”為陰性反應。
菌株 明膠試驗 硫化氫試驗 接觸酶試驗 吲哚試驗L1----L2----L3----L4----
表3 糖發酵試驗結果Table 3 The result of sugar fermentation
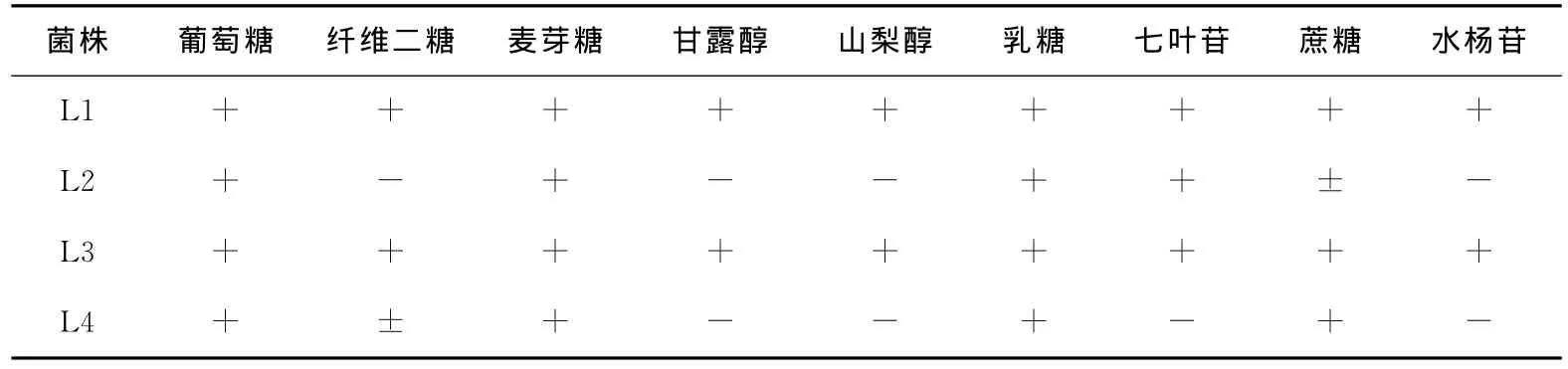
表3 糖發酵試驗結果Table 3 The result of sugar fermentation
“+”為陽性反應,“-”為陰性反應,“±”為不確定性反應。
菌株 葡萄糖 纖維二糖 麥芽糖 甘露醇 山梨醇 乳糖 七葉苷 蔗糖 水楊苷L1+++++++++L2+-+--++±-L3+++++++++L4+±+--+-+-
由圖3和表2、3可知,這4株菌均為革蘭氏陽性,氧化酶陰性,接觸酶陰性桿菌,根據《伯杰氏細菌學手冊》[11],這4株菌都屬于乳酸桿菌Lactobacillus。在這4株菌中,L1和L3菌落圓形突起,表面光滑呈白色,邊緣整齊不透明,菌體形態為短桿或圓端直桿,單個或成對或呈鏈狀排列,兩者的生理生化試驗結果也基本相同,試驗用的糖、醇都能進行發酵,可以判斷這兩株菌均為植物乳桿菌(Lactobacillusplantarum)。菌株L2圓形邊緣整齊,表面粗糙呈灰白色,菌體形態為短桿,單個或成對存在,糖醇發酵試驗結果表示其不能利用纖維二糖、甘露醇、山梨醇和水楊苷,可判定為短乳桿菌(Lactobacillusbreris)。L4菌株呈白色圓形,邊緣整齊,表面光滑半透明,菌體形態為桿狀,單生或短鏈,對比其生化鑒定結果可判定該菌為發酵乳桿菌(Lactobacillusfermentum)。
L1、L2、L3和L4隨苦苦菜發酵天數變化的生長曲線如圖4所示。蔬菜的發酵主要有發酵初期、中期和后期3個階段[6]。由圖4可知,發酵初期0~3d,苦苦菜發酵液中的3種乳酸菌均快速地增長,其中主要以植物乳桿菌為優勢乳酸菌,短乳桿菌和發酵乳桿菌的數量不多,隨著發酵時間的延長,植物乳桿菌仍較快地增長,而短乳桿菌和發酵乳桿菌呈現出緩慢的增長趨勢。7~14d進入主發酵階段,由于初期發酵進行一段時間后,酸度增加pH下降,一些不抗酸的微生物不能存活,各種乳酸菌數量則不斷增長,這時植物乳桿菌仍占優勢,短乳桿菌菌落總數在這個階段迅速地增長,植物乳桿菌和短乳桿菌分別達到各自增長的最大值,而發酵乳桿菌的數量仍增長緩慢。乳酸菌的大量繁殖,發酵后期15d后發酵液中乳酸含量猛增開始反饋抑制乳酸菌的生長,植物乳桿菌和短乳桿菌菌落總數開始不斷減少,發酵乳桿菌的數量繼續增加后也開始減少,為苦苦菜發酵后期的優勢乳酸菌。
2.3 理化指標測定結果
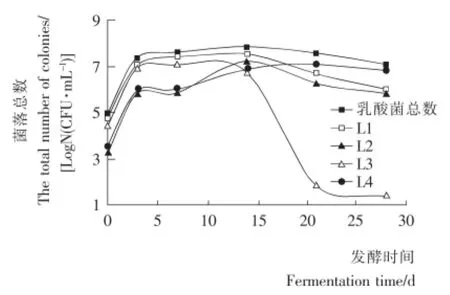
圖4 L1、L2、L3和L4菌株生長曲線Figure 4 Growth curve of L1、L2、L3and L4
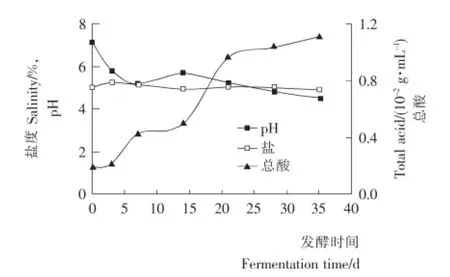
圖5 發酵過程中pH、總酸和鹽度變化曲線Figure 5 Changes curve of pH,total acid and salinity during fermentation
由圖5可知,前3d苦苦菜啟動發酵,發酵初期隨著異型乳酸菌發酵的進行,生成的乳酸、醋酸等物質使苦苦菜發酵液的總酸含量不斷增加,同時導致發酵液的pH值迅速下降,苦苦菜在前3dpH值下降最快。主發酵期間隨著乳酸菌的大量繁殖,總酸度增長最快,pH值呈現出不斷下降的趨勢。發酵后期體系進入過酸階段,可發酵碳水化合物耗盡,乳酸菌群受到抑制,這種反饋抑制使總酸含量的增長趨于平穩,pH值也趨于穩定。此外隨著發酵天數的增加,苦苦菜發酵液中的鹽度經歷先上升后下降的趨勢,在發酵初期鹽度比初始鹽度高,因為在發酵初期會產生使鹽度上升的亞硝酸鹽,但亞硝酸鹽會隨著發酵液pH的降低逐漸消失,整個發酵過程中,鹽度變化浮動在0.3%以內。
2.4 苦苦菜中呈味氨基酸隨發酵時間的變化
食品中所含的游離氨基酸對食品的滋味貢獻大,所以測定游離氨基酸的組成與含量是研究氨基酸對食品滋味的影響時十分必要的內容。氨基酸分為D-型氨基酸和L-型氨基酸,主要按照其側鏈基團分類,同時也影響了氨基酸的口味感官。甜味氨基酸大多為D-型氨基酸;L-型氨基酸中,呈苦味的主要為側基較大并帶堿基的氨基酸;當側基很小時一般為甜感,當側基帶有芳香基團時通常具有香味[12]。按照味覺強度,可以大致把氨基酸分為甜味、苦味、鮮味和芳香族氨基酸(甜味:絲氨酸Ser、甘氨酸Gly、蘇氨酸Thr、丙氨酸Ala、脯氨酸Pro、組氨酸His;苦味:纈氨酸Val、亮氨酸Leu、異亮氨酸Ile、精氨酸Arg、蛋氨酸Met、色氨酸Trp;鮮味:谷氨酸Glu、賴氨酸Lys、天冬氨酸Asp;芳香族:酪氨酸Tyr、苯丙氨酸Phe、半胱氨酸Cys)。苦苦菜腌制發酵各個時期呈味氨基酸隨發酵時間的變化見圖6。
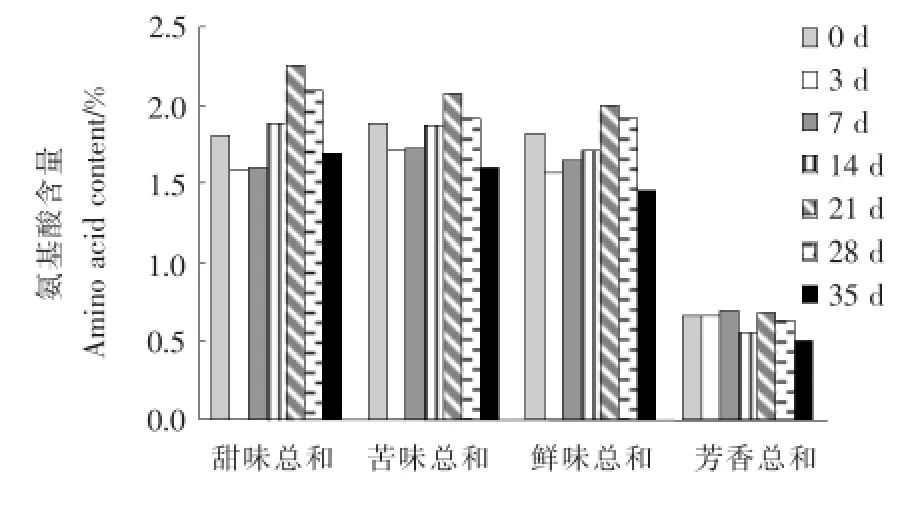
圖6 苦苦菜中呈味氨基酸隨發酵時間的變化Figure 6 Flavor amino acids in dandelion change along with the fermentation time
由圖6可知,整個發酵過程中苦苦菜的氨基酸含量變化明顯。甜味、苦味、鮮味氨基酸含量相差不大,變化的平均值分別為1.84%,1.82%,1.72%,變化趨勢也基本一致,都呈現出先減少后增加再減少的變化,芳香族氨基酸含量變化的平均值為0.63%,僅約為其他呈味氨基酸的1/3。除芳香族氨基酸外,甜味、苦味、鮮味的氨基酸含量的變化為:發酵中期含量減少,發酵中后期含量增加,發酵末期含量減少,并均在發酵中后期20d左右達到最高值,含量分別為2.24%,2.08%,1.99%。從發酵時間看各呈味氨基酸含量的變化,發酵初期苦苦菜中氨基酸以苦味氨基酸居多,含量為1.88%,高于甜味1.80%和鮮味1.82%,同時由于苦苦菜中含有許多具有生物活性的倍半萜、三萜及黃酮類化合物[13],萜類化合物一般以含有內酯、內氫鍵、內縮醛、糖苷基等能形成螯合物的結構而具有苦味,所以這個階段的苦苦菜發酵滋味一般。隨著發酵的進行苦味氨基酸含量逐漸減少,甜味和鮮味氨基酸的含量逐漸增加。苦味氨基酸的減少與乳酸菌的代謝有關,如Liu等[14]研究發現精氨酸(Arg)可以被發酵乳桿菌、短乳桿菌等乳酸桿菌代謝。
此外,感官試驗表明,主發酵期間的苦苦菜苦味、咸味、酸味都比較均衡,滋味最好。發酵后期苦味氨基酸含量為1.91%,低于甜味氨基酸2.09%和鮮味氨基酸1.92%的含量,發酵乳桿菌逐漸成為優勢乳酸菌,可代謝氨基酸的乳酸菌中短乳桿菌和發酵乳桿菌代謝氨基酸能力強,除了可以利用精氨酸(Arg)外,還可以利用絲氨酸(Ser)、谷氨酸(Glu)、天門冬氨酸(Asp)和支鏈氨基酸[14],各種呈味氨基酸的含量都逐漸減少。整個發酵過程中芳香族氨基酸的含量變化不大,只出現平均為0.08%小幅度的增減。
乳酸菌在自然生長環境中有完善的蛋白代謝系統,因其不能同化無機氮源,所以必須通過降解蛋白質和多肽來滿足細胞合成代謝對氨基酸的需要。苦苦菜在整個發酵過程中菜中的蛋白質會被蛋白酶降解形成氨基酸,形成的氨基酸滲透進入發酵液中,有些氨基酸又會被微生物生長繁殖利用,各氨基酸含量的增減也與苦苦菜原料本身所含可溶性蛋白質的含量及種類都有關系。
3 結論
苦苦菜在自然發酵過程中,6~14d乳酸菌總數維持在最大值范圍,整個發酵過程中乳酸菌生長情況較好,菌落總數基本維持在107CFU/mL以上,發酵初期和主發酵期以植物乳桿菌為優勢乳酸菌,發酵后期以發酵乳桿菌為優勢菌。發酵初期,總酸增長緩慢,呈味氨基酸中尤以苦味氨基酸含量較多,主發酵期,總酸含量快速上升,苦味氨基酸含量逐漸減少,甜味和鮮味氨基酸的含量逐漸增加,發酵后期,總酸含量趨于穩定,苦味氨基酸含量低于甜味和鮮味氨基酸,發酵中后期7~20d苦苦菜的滋味最好。
苦苦菜的發酵風味除了添加的輔料的作用外,還有微生物酶降解碳水化合物、蛋白質等形成的風味物質,以及苦苦菜中各種呈味物質與氨基酸通過拮抗、協同或掩蓋[15]等作用下共同產生的結果,限于本文篇幅與研究重點,此問題有待進一步研究。
1 李改燕.糟魚發酵過程中微生物菌群和風味變化的研究[D].寧波:寧波大學,2009.
2 許繼春.發酵香腸中風味物質的研究[J].中國食品,2011(23):31~33.
3 袁曉陽,陸勝民,郁志芳.自然發酵腌制冬瓜主要發酵菌種及風味物質鑒定[J].中國食品學報,2009,9(1):219~225.
4 Yvon M,Rijnen L.Cheese flavour formation by amino acid catabolism[J].International Dairy Journal,2001,11(4/7):185~201.
5 蘇丹,朱偉偉,王齊,等.云南會澤引種瑪卡中氨基酸組成與含量對營養與風味的影響[J].天然產物研究與開發,2013(7):940~944.
6 陳希.蔬菜低鹽腌制微生物群落多樣性的分析[D].寧波:寧波大學,2011.
7 James Owusu-Kwarteng,Fortune Akabanda,Dennis S Nielsen,et al.Identification of lactic acid bacteria isolated during traditional fura processing in ghana[J].Food Microbiology,2012,32(1):72~78.
8 Sneath P H A,Mair N S,Sharpe M E,et al.Manual of systematic bacteriology vol(2)[M].Baltimore:Williams and Wilkins,1986:1 209~1 234.
9 巨曉英,韓燁,周志江.自然發酵泡菜中乳酸菌的分離鑒定[J].食品與機械,2008,24(5):29~31.
10 胡望資,譚興和,王鋒,等.芋頭葉柄泡菜泡制過程中主要成分的變化研究[J].食品與機械,2012,28(4):1~8.
11 布坎南R E.伯杰氏細菌鑒定手冊[M].第8版.北京:科學出版社,1984:696~810.
12 Bassoli A,Borgonovo G,Caremoli F,et al.The taste of D-and L-amino acids:in vitro binding assays with cloned human bitter(TAS2Rs)and sweet(TAS1R2/TAS1R3)receptors[J].Food Chemistry,2014,150(13):27~33.
13 蔣雷,王國榮,姚慶強.苦苣菜屬植物化學成分及藥理活性研究進展[J].齊魯藥事,2007,26(11):670~671.
14 Liu S-Q,Holland R,Crow V L.The potential of dairy lactic acid bacteria to metabolise amino acids via non-transaminating reactions and endogenous transamination[J].International Journal of Food Microbiology,2003,86(3):257~269.
15 Labuda I.Flavor compounds[M].Encyclopedia of Microbiology(Third Edition).USA:Academic Press,2009:305~320.

