中黃13大豆發芽期間異黃酮類成分變化規律的研究
王慧芳 來吉祥 王東暉 方 芳 王鳳忠 吳 韜
(農業部農產品加工重點實驗室中國農業科學院農產品加工研究所,北京 100193)
中黃13大豆發芽期間異黃酮類成分變化規律的研究
王慧芳 來吉祥 王東暉 方 芳 王鳳忠 吳 韜
(農業部農產品加工重點實驗室中國農業科學院農產品加工研究所,北京 100193)
以中黃13大豆中異黃酮β-糖苷、糖苷配基、游離多酚及總黃酮為指標,觀察上述功能成分在發芽期間的動態變化,從而明確發芽時間對功能成分的影響規律。采用比色法及超高效液相(UPLC)法,分析大豆在發芽第1天至第7天內上述功能成分的變化情況。結果表明:發芽時間對大豆中糖苷配基、游離多酚及總黃酮的含量影響顯著(P<0.05),大豆苷元、游離多酚及總黃酮于發芽第7天時含量達到最高,分別為286.40μg/g、0.47 mg GAE/g d.m.和11.86 mg RE/g d.m.;黃豆黃素和染料木素于發芽第5天時含量達到最高,分別為353.22和336.14μg/g。發芽期間β-糖苷含量先上升后逐漸下降,而糖苷配基則主要呈增加趨勢。因此,發芽有助于中黃13大豆中異黃酮類成分的提高,其可作為功能性大豆產品進一步被開發。
大豆 發芽 異黃酮 β-糖苷 糖苷配基
大豆(Glycinemax(L).Merr.)是我國四大油料作物之一,因其富含蛋白質、異黃酮等多種功能性活性成分而在我國傳統飲食中扮演著重要角色。異黃酮的化學結構與人類雌激素結構相似,因此又被稱為植物雌激素[1]。眾多研究表明[2-6],大豆異黃酮是一種對人體天然、安全高效的調節劑,其具有改善皮膚水分及彈性狀況、緩解更年期綜合癥、改善骨質疏松、降低血液膽固醇、預防心血管疾病、抗癌抗氧化等多重生理功能。然而在大豆種子中,異黃酮含量僅為 1~5 mg/g[7],遠不能滿足人體需求;發芽作為一種經濟有效的加工方式,能夠打破大豆種子的休眠狀態,將其內源酶激活[8-9],使其生理生化代謝反應加快,提高大豆種子中異黃酮含量[10]。大豆中異黃酮的形成受多重因素的影響,除遺傳因素外,大豆品種及發芽時間都會對異黃酮含量的累積產生一定的影響[11]。在我國,通過國家及各省區域試驗審定的大豆品種已逾千種,其化學成分因品種不同而存在差異。中黃13大豆具有高蛋白、多抗性、高產穩產、適應性廣等優良特性,是近年來我國大面積推廣栽培的大豆主導品種之一[12-14]。目前,對于中黃13大豆的研究主要集中在蛋白質等基本營養素方面,有關發芽條件對其異黃酮單體的種類及含量的影響鮮有深入研究。因此,本研究以我國優質大豆中黃13為試驗材料,對其進行發芽處理,分析其發芽過程中游離多酚、總黃酮及6種異黃酮單體的變化情況,為今后開發功能性大豆產品奠定基礎。
1 材料與方法
1.1 材料與試劑
中黃13大豆:中國農業科學院作物科學研究所,2013年采收。
沒食子酸(Gallic Acid,GA)、蘆丁(Rutin,R)標準品:美國Sigma公司;大豆苷、黃豆黃苷、染料木苷、大豆苷元、黃豆黃素、染料木素(純度≥98%)標準品:上海阿拉丁試劑公司;乙腈、甲醇為色譜純;其余試劑均為分析純。
1.2 主要儀器
RXZ人工氣候箱:寧波市江南儀器廠;LGJ-25C冷凍干燥機:北京市四環科學儀器廠有限公司;高速多功能粉碎機(SL-100型):浙江省永康市松青五金廠;CR22G II日立高速冷凍離心機:日本HITACHI公司;酶標儀Spectra Max 190:美國Molecular Devices公司。
1.3 試驗方法
1.3.1 發芽大豆樣品的制備
挑選籽粒飽滿且無病蟲害的大豆種子1 000 g,分別用蒸餾水清洗5次,除去大豆表面雜質和懸浮癟粒;用0.25%NaClO溶液室溫下處理30 min后,1 000 mL蒸餾水清洗5次,再用1∶5(W∶V)的蒸餾水30℃下浸泡10 h[15]。將浸泡后的大豆種子表面水分瀝干,置于墊有2層紗布的培養盤(底部有孔)中,均勻攤開,放于溫度為30℃,RH為95%的人工氣候箱中避光培養,因發芽7 d后易出現腐敗現象,故對其發芽限制在7 d內,并每隔24 h取出樣品100 g,立即用液氮進行速凍后,放于冷凍干燥機中真空干燥。將干燥樣品粉碎,過60目篩得發芽樣品,放于-20℃下保存備用。
1.3.2 發芽樣品提取液的制備
稱取20 g發芽樣品,置于錐形瓶中,加入適量正己烷,封口膜密封后,室溫200 r/min下水浴振蕩脫脂4 h,通風條件下將正己烷完全揮發,再冷凍干燥,得脫脂樣品[16]。稱取0.5 g脫脂樣品,按料液比1∶20加入10 mL甲醇,渦旋充分混合,室溫下超聲提取2次,每次30 min,然后10 000 r/min高速離心10 min,取上清液,合并2次上清后放于4℃下保存,備用。
1.3.3 游離多酚含量的測定
采用 Folin-Ciocalteu法[17],以沒食子酸為標準品對其游離多酚進行測定。分別移取25μL各質量濃度標準溶液(0、25、50、100、200、300μg/mL)及稀釋10倍的樣品溶液于96孔板中,加入125μL福林酚試劑;10 min后,加入125μL 7.5%Na2CO3;反應30 min后,用酶標儀在765 nm下測其吸光值。游離多酚含量以沒食子酸當量表示,即mg GAE/g d.m.。
1.3.4 總黃酮含量的測定
采用AlCl3比色法[17],以蘆丁為標準品對其總黃酮進行測定。移取20μL NaNO2于96孔板中,分別加入50μL各濃度標準溶液(0、31.25、62.5、125、250、500μg/mL)以及樣品溶液于室溫下反應5 min后,加20μL 0.3 mol/L AlCl3溶液室溫下反應6 min,加200μL 0.5 mol/L NaOH;反應30 min,用酶標儀在510 nm下測其吸光值。總黃酮含量以蘆丁當量表示,即 mg RE/g d.m.。
1.3.5 UPLC分析提取液中異黃酮組分
1.3.5.1 色譜條件
美國Waters公司AcquityTMUPLC液相色譜系統(配AcquityTMPDA檢測器);色譜柱:Acquity UPLC BEH C18色譜柱(100×2.1 mm,1.7μm);流動相A:甲醇,流動相B:0.1% 三氟乙酸;梯度洗脫程序:0~1 min,15%~20%A;1~2 min,20%~30%A;2~5 min,30%~70%A;5~6 min,70%~100%A;6~7 min,100%~100%A;7~8 min,100%~15%A;8~12 min,15%A。流速:0.3 mL/min;檢測波長:260 nm;柱溫:25℃;樣品溫度:10℃;進樣量:2μL。
1.3.5.2 對照品溶液的制備
精密稱量6種異黃酮組分標品各10 mg,分別用甲醇定容于10 mL容量瓶中,搖勻,得1.0 mg/mL對照品儲備溶液;分別移取對照品儲備液0.5 mL,用初始流動相定容于同一10 mL容量瓶中,得50μg/mL大豆異黃酮混合對照品中間溶液,4℃下避光保存備用;分析測定時稀釋到相應濃度[18]。
1.3.5.3 樣品中異黃酮組分的分析測定
分別移取1.3.2中樣品提取液及大豆異黃酮混合對照品中間溶液,過0.22μm有機膜,UPLC分析。
1.4 數據分析
應用Excel 2007及SAS 9.1軟件進行數理統計及方差分析,由Duncan檢驗分析均值差異顯著性(P<0.05)。每個試驗均重復3次,結果均表示為:平均值±標準差。
2 結果與分析
2.1 發芽對大豆中游離多酚的影響
由圖1知,30℃下發芽時,中黃13大豆中游離多酚含量呈上升趨勢。發芽前,多酚含量為0.10 mg GAE/g d.m.;隨著發芽時間的延長,大豆中多酚含量逐漸上升,第1天至第5天增加緩慢,第6天至第7天增加較快,且第7天時含量達到最高(0.47 mg GAE/g d.m.),與發芽前相較,游離多酚含量增加了370.0%。可能原因為,發芽期間大豆種子中結合態多酚轉化為游離態多酚從而使其含量增加;本研究第7天多酚含量高于相關人員對大豆發芽5 d后分析出的最高多酚含量(0.44 mg GAE/g d.m.)[19],這可能由于大豆品種不同所致。此外,發芽時間對游離多酚的含量影響顯著(P<0.05),且發芽第7天對游離多酚含量影響極顯著(P<0.01)。可見,發芽有助于中黃13大豆中游離多酚的累積,且發芽第7天為中黃13大豆富集游離多酚的最佳時間。

圖1 中黃13大豆發芽過程中游離多酚動態變化
2.2 發芽對大豆中總黃酮的影響
由圖2知,30℃下發芽時中黃13大豆中總黃酮含量呈上升趨勢。發芽前,總黃酮含量為6.90 mg RE/g d.m.;隨著發芽時間的延長,大豆中總黃酮含量逐漸上升,發芽初期增加緩慢,第6天至第7天時增加較快,且第7天時,總黃酮含量達到最高(11.86 mg RE/g d.m.),與發芽前相較,總黃酮含量增加了71.9%。本結果與前人[7]研究相較,總黃酮含量略高,原因可能為大豆品種不同所致。此外,發芽時間對大豆中總黃酮含量影響顯著(P<0.05),且發芽第7天對中黃13大豆中總黃酮含量影響極顯著(P<0.01)。可見,發芽有利于大豆中總黃酮含量的提高,且發芽第7天為中黃13大豆富集黃酮的最佳時間。
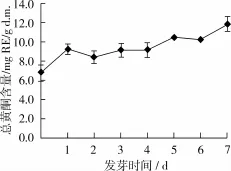
圖2 中黃13大豆發芽過程中總黃酮動態變化
2.3 發芽對大豆中6種異黃酮單體的影響
中黃13大豆發芽期間6種異黃酮單體發芽前后變化色譜圖見圖3。異黃酮作為大豆中的一類重要生物活性物質,包括糖苷配基和糖苷2大類組分[20]。本研究分析了大豆發芽過程中6種異黃酮單體(3種糖苷單體和3種糖苷配基單體)的動態變化,如圖3所示,β-糖苷單體(大豆苷、黃豆黃苷、染料木苷)的保留時間分別為4.535、4.650及5.479 min,糖苷配基單體(大豆苷元、黃豆黃素、染料木素)的保留時間分別為6.088、6.174及6.500 min;各組分分離度均大于1.2,實現了組分之間的很好分離。因此,該色譜方法適于分析大豆中異黃酮單體的變化情況。
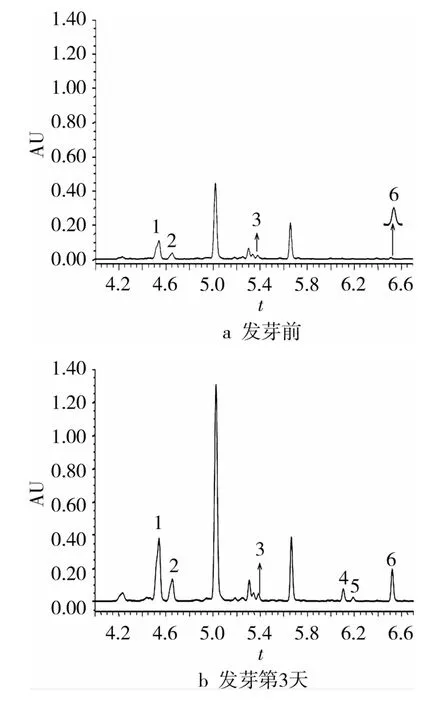
圖3 中黃13大豆發芽前后6種異黃酮單體UPLC色譜圖
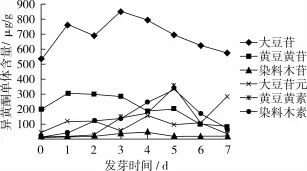
圖4 中黃13大豆發芽過程中6種異黃酮單體的動態變化
6種異黃酮單體含量動態變化見圖4。發芽期間,大豆苷和黃豆黃苷在6種單體中含量相對較高,是中黃13大豆的2種主要異黃酮β-糖苷單體。發芽前,大豆苷及黃豆黃苷的含量分別為535.9、200.2μg/g;發芽第1天時,黃豆黃苷含量達到最高(308.04μg/g),第3天時大豆苷含量達到最高(852.12μg/g);到后期,2種單體含量逐漸下降,并均于第7天降至最低。大豆種子吸水萌發后,染料木苷含量先增加后逐漸下降,到第5天時,含量降至最低(18.38μg/g),且與發芽前相較,下降了17.9%。大豆苷元、黃豆黃素及染料木素,三者具有相似的化學結構,是大豆中3個重要的異黃酮糖苷配基單體。發芽第7天,大豆苷元含量達到最高(286.40μg/g),是發芽前的507.3倍;第3天時含量最低(59.05μg/g),但與發芽前相較,仍增加了25.2%。黃豆黃素及染料木素在第5天時含量均達到最高,較發芽前,分別增加了2 924.1%、2 448.4%。在發芽過程中,大豆苷元的合成累積早于染料木素,而發芽第2天至第7天,染料木素累積速度大于大豆苷元,這可能由于大豆苷元與染料木素的合成累積與其各自合成路徑有關[21];發芽第6天至第7天,染料木素及黃豆黃素含量均有所下降,原因可能為其在發芽后期轉化為其他異黃酮組分[10]。
大豆發芽過程中異黃酮總量、β-糖苷及糖苷配基含量動態變化見圖5。
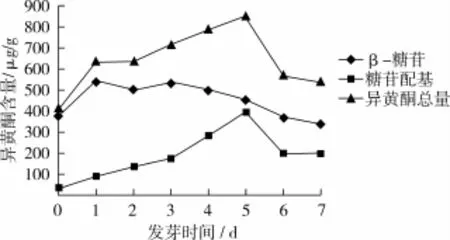
圖5 中黃13大豆發芽過程中異黃酮糖苷及糖苷配基動態變化
發芽前,異黃酮總量為829.79μg/g;隨著發芽時間的延長,異黃酮總量逐漸升高,且于第5天時含量達到峰值(1 705.86μg/g),并與發芽前相較,提高了105.6%。β-糖苷和糖苷配基作為異黃酮的2類組分,在中黃13大豆發芽期間,含量均呈現先增加后下降趨勢,且β-糖苷含量一直高于糖苷配基。發芽前,β-糖苷含量為757.76μg/g;發芽期間,含量變化范圍為682.39~1 182.49μg/g;其中第3天時,含量最高(1 082.49μg/g),與發芽前相較,增加了55.5%;第4天至第7天,β-糖苷量逐漸下降。該結果表明,隨著發芽時間的延長,β-糖苷總量不斷降低。糖苷配基在發芽前,含量為72.03μg/g;發芽期間,其含量變化范圍為179.74~791.01μg/g,其中第5天時含量最高(791.01μg/g),與發芽前相較,增加了998.2%。雖在發芽第6天至第7天,糖苷配基含量有所下降,但在發芽7 d中,整體趨勢是增加的。發芽第1天,糖苷配基含量最低,但仍比發芽前高65.8%,即發芽期間糖苷配基的最低量均要高于發芽前的含量。由此說明,發芽有利于糖苷配基含量的增加。
綜上所述,30℃下發芽有利于中黃13大豆中異黃酮含量的累積,且發芽期間異黃酮β-糖苷含量先上升后下降,糖苷配基則主要表現為增加,可能原因是在發芽過程中發生了β-糖苷向糖苷配基的轉化,且與苯丙烷類代謝[22]和丙二酸代謝[8]途徑中的三羧酸循環及輔酶A循環密切相關。此外,本研究中異黃酮最高含量高于Akitha等[23]對大豆發芽5 d后分析所得最高異黃酮含量(602~794μg/g),說明中黃13大豆在富集異黃酮方面有較強優勢。
3 結論
通過研究發現,發芽能夠顯著提高中黃13大豆中大豆苷元、游離多酚及總黃酮的含量(P<0.05),且發芽第7天時三者含量均達到最高,分別為286.40μg/g,0.47 mg GAE/g d.m.和 11.86 mg RE/g d.m.;第5天時黃豆黃素和染料木素含量達到峰值,分別為353.22和 336.14μg/g;發芽過程中β-糖苷含量先增加后逐漸下降,而糖苷配基則主要呈上升趨勢,并于發芽第5天,與異黃酮總量同時達到最高。因此,發芽有助于異黃酮類成分的提高,且在發芽過程中發生了β-糖苷向糖苷配基的轉化,從而實現了中黃13大豆中異黃酮含量的增加;同時說明富含異黃酮類成分的發芽中黃13大豆可作為被開發為功能性大豆產品的潛在品種。
[1]Hwang SH,Thavarajah P,Thavarajah D.Phytoestrogen enriched tofu from soybean meal[J].American Journal of Plant Sciences,2014,5(3):256-261
[2]Pandey A,Misra P,Khan M P,et al.Co-expression of Arabidopsis transcription factor,AtMYB12,and soybean isoflavone synthase,GmIFS1,genes in tobacco leads to enhanced biosynthesis of isoflavones and flavonols resulting in osteoprotective activity[J].Plant Biotechnology Journal,2014,12(1):69-80
[3]Miguez A C,Francisco JC,Barberato SH,et al.The functional effect of soybean extract and isolated isoflavone on myocardial infarction and ventricular dysfunction:the soybean extract on myocardial infarction[J].Journal of Nutrtional Biochemistry,2012,23(12):1740-1748
[4]Mujic'I,?ertovi c'E,Jokic'S,et al.Isoflavone content and antioxidant properties of soybean seeds[J].Croatian Journal of Food Science and Technology,2011,3(1):16-20
[5]Wang Q L,Ge X Y,Tian X W,et al.Soy isoflavone:the multipurpose phytochemical[J].Biomedical Reports,2013,1(5):697-701
[6]Badole S L,Mahamuni S P.Soybean:Key Role in Skin Cancer[C]//Bioactive Dietrary Factors and Plant Extracts in Dermatology[M],USA:Humana Press,2013:315-320
[7]Paulina P,Robert S,Dorota G,et al.Phenolic profile and antioxidant activity in selected seeds and sprouts[J].Food Chemistry,2013,143:300-306
[8]Hahlbrock K,Scheel D.Physiology and molecular biology of phenylpropanoid metabolism[J].Annual Review of Plant Physiology and Plant Molecular,1989,40:347-369
[9]BouchéN,Fromm H.GABA in plants:just a metabolite?[J].Trends in Plant Science,2004,9(3):110-115
[10]Zhu D H,Hettiarachchy N S,Horax R,et al.Isoflavone contents in germinated soybean seeds[J].Plant Foods for Human Nutrition(Dordrecht,Netherlands),2005,60(3):147-151
[11]Teekachunhatean S,Hanprasertpong N,Teekachunhatean T.Factors Affecting Isoflavone Content in Soybean Seeds Grown in Thailand[J].International Journal of Agronomy,2013:1-11
[12]付廣輝,沈維良,趙開兵,等.中黃13在宿州市的種植情況及高產栽培技術措施[J].大豆科技,2012,(3):49-51
[13]孫君明.“中黃13的選育與應用”獲得國家科技進步一等獎[J].大豆科學,2013,(2):215
[14]趙德珠.中黃13大豆新品種高產栽培技術[J].中國農業信息,2013(5):61
[15]Donkor O N,Stojanovska L,Ginn P,et al.Germinated grains--Sources of bioactive compounds[J].Food Chemistry,2012,135(3):950-959
[16]Guajardo-Flores D,Serna-Saldivar S O,Gutiérrez-Uribe JA.Evaluation of the antioxidant and antiproliferative activities of extracted saponins and flavonols from germinated black beans(Phaseolus vulgaris L.)[J].Food Chemistry,2013,141(2):1497-1503
[17]Wu T,McCallum JL,Wang S,et al.Evaluation of antioxidant activities and chemical characterisation of staghorn sumac fruit(Rhus hirta L.)[J].Food Chemistry,2013,138(2-3):1333-1340
[18]GB/T 26625—2011,大豆異黃酮含量測定[S]
[19]Huang X Y,Cai W X,Xu B J.Kinetic changes of nutrients and antioxidant capacities of germinated soybean(Glycine max L.)and mung bean(Vigna radiata L.)with germination time[J].Food Chemistry,2013,143:268-276
[20]Fiechter G,Raba B,Jungmayr A,et al.Characterization of isoflavone composition in soy-based nutritional supplements via ultra performance liquid chromatography[J].Analytica Chimica Acta,2010,672(1-2):72-78
[21]郭遠,楊柳,王園清,等.大豆種子發育過程中異黃酮含量的動態分析[J].農學學報,2012,2(11):1-5
[22]Yu O,Jung W,Shi J,et al.Production of the isoflavones genistein and daidzein in non-legume dicot and monocot tissues[J].Plant physiology,2000,124(2):781-794
[23]Akitha Devi M K,Gondi M,Sakthivelu G,et al.Functional attributes of soybean seeds and products,with reference to isoflavone content and antioxidant activity[J].Food Chemistry,2009,114(3):771-776.
Kinetic Changes of Isoflavone Components During Germination in Zhonghuang 13 Soybean
Wang Huifang Lai Jixiang Wang Donghui Fang Fang Wang Fengzhong Wu Tao
(Key Laboratory of Agro-Products Processing,Ministry of Agriculture,Institute of Agro-Products Processing Science and Technology,Chinese Academy of Agricultural Sciences,Beijing 100193)
β-Glucosides,aglycones,free phenolic and total flavonoid was took as indexes to observe and define the kinetic changes of functional ingredients during germination period by colorimetric method,using ultra performance liquid chromatography(UPLC)on selected Zhonghuang 13 soybean.The results showed that germination time had a significant influence on the accumulation of aglycones,free phenolic and total flavonoid within soybean(P<0.05).The contents of the elements above had reached the maximum on 7 d as follows:286.40μg/g,0.47 mg GAE/g d.m.and 11.86 mg RE/g d.m.,respectively;and the contents of glycitein and genistein had reached the maximum as follows:353.22μg/g and 336.14μg/g respectively on 5 d.The content ofβ-glucoside first increased and gradually decreased;while the aglycone showed a trend of increasing mainly during germination.Therefore,germination is conducive to the improvement of isoflavone components of the Zhonghuang 13 soybean,which can be used as functional soybean products to be developed furthering the future.
soybean,germination,isoflavone,β-glucosides,aglycones
TS201.2
A
1003-0174(2015)09-0013-05
中國農業科學院基本科研業務(2014ZL042)
2014-04-17
王慧芳,女,1990年出生,碩士,營養健康與功能食品
王鳳忠,男,1972年出生,研究員,功能食品與生物活性物質
吳韜,男,1973年出生,研究員,天然產物化學結構鑒定及功能食品評價開發

