濕法煉鋅凈化除鈷工藝研究現狀
容 蓉,何厚華,曾 睿
(廣西冶金研究院,廣西 南寧 530023)
鋅濕法冶煉過程包括焙燒、浸出、凈化、電解沉積。鋅精礦經過氧化焙燒得到鋅焙砂,鋅焙砂經浸出得到中性硫酸鋅浸出液,凈化過程就是把浸出液中不利于電解鋅的雜質除去。鈷、鎳的去除是凈化過程中的難點,從熱力學角度分析,鈷、鎳可以被鋅粉置換除去,但實際上用幾十倍甚至幾百倍理論量的鋅粉都無法將鈷降至允許濃度以下。目前,國內外采用的除鈷方法主要有鋅粉置換法和特殊試劑(黃藥、β-萘酚)法,這2種方法各有優缺點。許多科研工作者都致力于尋求一種清潔、高效、經濟的除鈷方法,現今主要的研究方向有氧化還原法、錫鹽凈化法和新型高效試劑除鈷法等。
1 鋅粉置換法
鋅粉置換法是在硫酸鋅溶液中用電位較負的活潑金屬鋅將電位較正的惰性金屬鈷還原成金屬,從而沉淀去除。用鋅粉不會引入新雜質。Zn2+的標準電極電位為-0.76V,Co2+的標準電極電位為-0.27V,從熱力學角度考慮,溶液中的Co2+應該可以被鋅粉置換,但實際上用大量的鋅粉也無法把鈷凈化至允許值以下。究其原因,目前尚無統一的結論。國內外較多的研究者解釋為過渡元素的鐵族(Fe、Co、Ni)還原析出時具有較高的超電壓,致使還原不徹底;還有人認為置換反應速率可能受擴散過程控制,也可能受化學反應控制。而通常情況下,鈷在硫酸鋅溶液中的含量很低,活度很小,鋅粉顆粒很難捕捉到Co2+,因此需要加入活化劑(如砷鹽、銻鹽)提高鋅粉和Co2+的反應活性,同時還要提高溫度來實現此過程。
1.1 砷鹽凈化法
砷鹽除鈷是用砷鹽(As2O3或Na3AsO4)作活化劑,先在較高溫度(85~95℃)下加入鋅粉和砷鹽除去銅、鈷及部分鎘,再在較低溫度(60~65℃)下加入鋅粉和微量硫酸銅除鎘[1]。銅很容易被鋅粉置換出來并附著在鋅粉表面,與鋅形成微電池,銅作為陰極,電極反應為
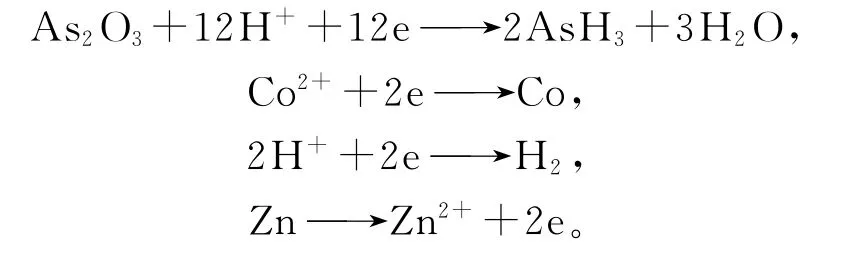
加入硫酸銅能使置換出來的鈷與Cu、As、Zn形成金屬間化合物。該金屬間化合物較純金屬或與Cu、Zn形成的金屬間化合物的電位更正,能使鈷更易于被鋅粉置換,從而沉積析出。同樣,難以直接被鋅粉置換出來的鎳也能被置換得很徹底。
砷鹽凈化法可去除鈷、鎳,使其達到電解要求并得到高質量新液,適于處理鈷濃度較低的溶液。但該法也存在一些缺點:得到的Cu-Co渣被砷污染;反應在高溫下進行,會產生AsH3劇毒氣體;不及時分離鈷渣易導致某些雜質返溶;因為鎘的復溶問題,砷鹽凈化法必須要有除鎘步驟。
1.2 銻鹽凈化法
銻鹽除鈷反應機制是溶液中共存的雜質在鋅粉表面上析出后或鋅粉中含有的其他金屬作為陰極,鋅粉作為陽極,形成微電池,通過電化學作用促使二價鈷離子還原析出。除Sb2O3之外,其他含銻物料,如酒石酸銻鉀、Pb-Sb合金鋅粉等都可以作銻活化劑。
銻鹽凈化法包括第1段低溫(55℃)加鋅粉除Cu、Cd,第2段高溫(85℃)加鋅粉和銻鹽凈化劑除鈷及其他雜質[2]。
銻鹽凈化法較砷鹽凈化法有許多優點:不需要添加銅,第1段中已除去鎘,進入鈷渣中的鎘大大減少,鎘回收率較高;SbH3容易分解,避免了有毒氣體的產生;適用于含鈷較高的原料。
2 特殊試劑除鈷法
2.1 黃藥除鈷法
黃藥是一種有機試劑,其中的功能團是黃原酸基團(-C2H5OCSS),能與許多重金屬和貴金屬離子形成難溶化合物。黃藥除鈷原理是在有Cu2+存在條件下,加入的黃原酸鉀(C2H5OCSSK)和黃原酸鈉(C2H5OCSSNa)與待凈化液中的Co2+發生反應,形成難溶的黃酸鈷沉淀[3]。加入CuSO4是為了使Co2+氧化為Co3+,也可由空氣、硫酸鐵、高錳酸鉀等其他氧化劑替代。三價鈷的黃原酸鹽的溶度積較二價鈷離子的更小,即三價鈷離子更易于與黃藥反應,形成的沉淀也更穩定。反應式為:
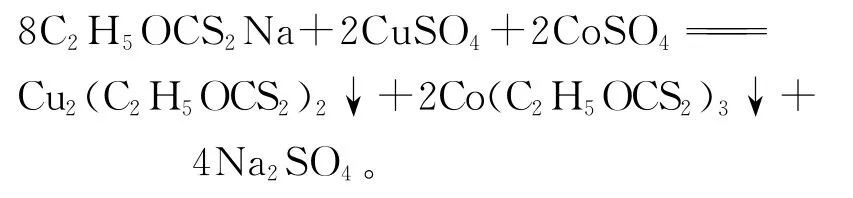
黃藥在高溫、酸性條件下很容易分解成二硫化碳和醇,其功能基團被破壞,導致黃藥消耗量很大且除鈷效率低,所以,用黃藥除鈷時要控制反應在低溫、中性溶液中進行,黃藥一般按溶液中鈷含量的10~15倍加入,硫酸銅則按黃藥加入量的1/3~1/5加入。
黃藥價格昂貴且不能再生,生產過程中有臭氣逸出,勞動環境相對較差;溶液凈化后仍含有一定量鈷;黃酸鈷渣難以處理;凈化后液殘留的黃藥對電解有不利影響,需采用活性炭吸附。該法在國內外采用的極少。
2.2 β-萘酚凈化除鈷法
β-萘酚也是一種有機試劑。向待凈化液中加入堿性β-萘酚、NaOH和HNO2,稍作攪拌后再加入廢電解液使溶液中H2SO4質量濃度為0.5g/L,攪拌1h后過濾,分離出鈷渣[4]。主要反應為
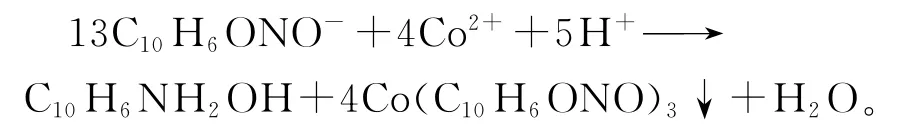
溶液中的鈷以亞硝基-β-萘酚鈷形式沉淀下來,能達到深度凈化效果,但試劑昂貴,且殘余的β-萘酚對電解沉積有不良影響,還需要用活性炭吸附,所以目前應用的較少。
3 硫酸鋅溶液凈化除鈷新方法
現行的各種除鈷方法都不夠理想。隨著對鋅冶金產品質量要求的提高,必須尋求清潔、高效、適用范圍廣的新型除鈷方法。
3.1 氧化還原法
氧化還原,即將溶液中的Co2+氧化成Co3+或還原成金屬鈷。Co3+在水溶液中非常不穩定,只能以沉淀或絡合物形式存在。Co3+可以水解沉淀,但如果能加入沉淀劑,沉淀效果會更好[5]。Co2+在偏酸性條件下比較難被氧化,同時Co3+又容易被還原為Co2+,所以在氧化前要調節pH并使用強氧化劑,如高錳酸鉀,卡洛酸,臭氧,過硫酸鈉,氯氣等。氧化過程中會產生酸,為了保持體系pH,反應過程中需要加入中和物質。
3.1.1 高錳酸鉀氧化法
高錳酸鉀氧化除鈷反應為
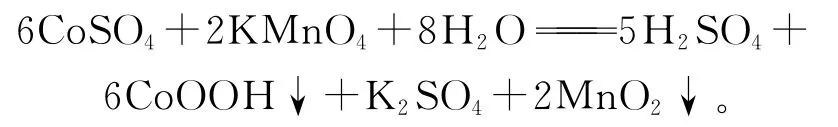
高錳酸鉀氧化水解除鈷時,pH和溫度是影響鈷沉積效果的2大因素。pH低于2時,幾乎不反應;pH在5~5.5范圍內,大部分鈷可以沉淀出來;pH大于5.5時,主金屬鋅也會大量沉積。溫度為20℃時,沉鈷不徹底,隨溫度升高,鈷沉積率升高。利用高錳酸鉀氧化水解鈷在1h左右反應完全,再延長反應時間也無法提高除鈷效率[6]。
高錳酸鉀氧化法除鈷效果好,高效,并能產出高品位鈷渣,易于與現有的鋅冶煉流程相結合。
3.1.2 卡洛酸氧化法
卡洛酸,也稱過一硫酸,過氧硫酸,化學式為H2SO5,具有強氧化性,可由氯磺酸和過氧化氫制備而成,也可由濃硫酸和過氧化氫制得。
卡洛酸氧化沉鈷反應為
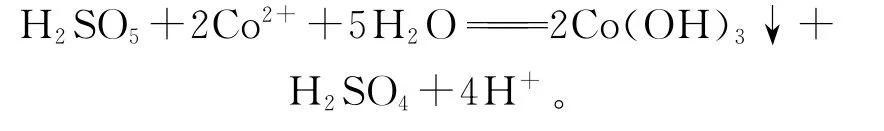
與高錳酸鉀氧化水解鈷的原理一樣,將卡洛酸加入到待凈化液中,卡洛酸把Co2+氧化成Co3+,然后Co3+水解沉淀[6]。
反應需要pH在4左右:pH過低,Co3+無法水解沉淀;pH越高,鈷越容易水解沉淀;但pH過高,主金屬鋅也會水解沉淀,當pH>5.5時,鋅將大量水解并形成膠體,反應無法進行。
3.1.3 臭氧氧化法
以臭氧作氧化劑可以去除硫酸鋅溶液中的微量鈷[7]。臭氧氧化沉淀鈷總反應為
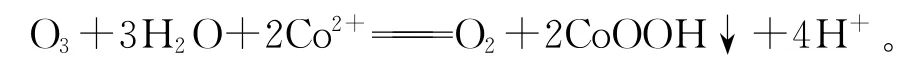
試驗結果表明:鈷的初始濃度、反應溫度、溶液中鋅離子濃度對臭氧氧化除鈷效率沒有影響;提高攪拌速度和加大臭氧量,使臭氧擴散速度加快,從而加快氧化速率,使除鈷效率明顯提高;溶液pH越高,除鈷效果越好,但是為了不使主金屬鋅沉淀,pH以控制在5.0為最佳。
強氧化劑氧化鈷的同時也會氧化溶液中的Mn2+,使其以MnO2形式沉淀下來,消耗大量氧化劑并降低溶液中Mn2+的濃度。實際生產中,電解沉積鋅需要電積液中存在一定量的Mn2+,若電積液中Mn2+濃度過低,則會降低電鋅質量,若在凈化后補加 Mn2+,生產成本會大大增加。氧化沉鈷法現在還未實現工業應用。
3.1.4 NaBH4還原法
除氧化法外,還可以用強還原劑將鈷還原成金屬鈷,從而沉淀除去。如用NaBH4將硫酸鋅溶液中的所有比鋅電位正的離子還原沉淀:
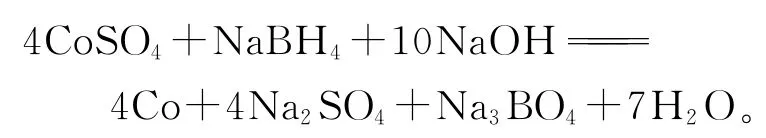
NaBH4具有強還原性,固體,在干燥氣氛、300℃下是穩定的。NaBH4的二水化物在36~37℃時熔融,其水溶液不穩定,加熱或酸化可快速分解。NaBH4在pH>9的堿性溶液中可穩定存在。
在溫度20~40℃、pH為3~4、還原劑用量為理論量的1.1倍、加入一定量表面活性劑條件下,再將堿性NaBH4溶液均勻地加入到溶液中,稍加攪拌,鈷即以金屬鈷形式沉淀出來[8]。過濾得到的渣中,鋅和鐵分別以Zn3(BO3)2和Fe3(BO3)2形式沉淀,而其他元素均以單質形式沉淀。
NaBH4還原法能深度凈化硫酸鋅溶液中電位比鋅高的雜質,如鈷、鎳、鐵、鎘、銅、砷、銻、鉛,具有工藝簡便、反應速度極快、選擇性好等優勢。
NaBH4價格昂貴,且性狀很不穩定,所以該法目前只處于實驗室研究階段,對其反應機制、條件控制、反應選擇性等方面還需要進行更多的研究,但該法是很有前景的研究方向之一。
3.2 錫鹽凈化法
用硫酸亞錫作活化劑,同時加入CuSO4和鋅粉可以凈化硫酸鋅溶液[8]。凈化除鈷條件為:溫度70℃,鋅粉加入量2.5g/L,m(Sn)∶m(Co+Ni)=2∶1,ρ(Cu2+)=100mg/L,pH=5.2,反應時間為40min。1998年,中南工業大學與株洲冶煉廠合作,以硫酸亞錫作添加劑,采用中溫(60℃)一段鋅粉與硫酸亞錫置換凈化、二段低溫除鎘工藝凈化硫酸鋅溶液,半工業試驗結果表明,全部雜質都可達到深度凈化要求[9]。
用硫酸亞錫作活化劑的鋅粉置換除鈷工藝,具有操作溫度較低、除鈷效果好的優點,但凈化過程中對錫的用量控制還需要更多的試驗研究。
3.3 新型除鈷劑
鐘長庚[10]研究出一種以稻草、氫氧化鈉和二硫化碳為原料制成黃原酸鹽,并用以去除濕法煉鋅廠硫酸鋅溶液中鈷的方法,可使鈷質量濃度降至0.5mg/L以下,鋅損失率約為1%。該沉淀劑含有黃原酸基團,能與鈷離子反應生成沉淀而將鈷除去。由于三價鈷鹽的溶度積是二價鈷鹽的105倍,為了使鈷沉淀得更徹底,需要加入氧化劑把溶液中的二價鈷氧化成三價鈷。有2種方案:一是先加入氧化劑把Co2+氧化成Co3+,再加入沉淀劑;二是先加入沉淀劑再加入氧化劑。
黃守義等[11]研究了采用一種新型除鈷劑AnBm去除硫酸鹽溶液中的鈷。該除鈷劑AnBm中含有黃原酸基團,能與溶液中的鈷離子生成沉淀,但也需要先加入氧化劑將二價鈷氧化成三價鈷,再加入沉淀劑沉鈷,以使鈷沉淀的更完全。
試驗結果表明:在氧化劑加入量42mg/L、沉淀劑 AnBm加入量2.4g/L、反應時間50~60 min、溫度70~80℃、pH為4.1~5.0條件下,除鈷率可達97%,除鈷效果優于鋅粉置換法。
4 結語
目前,濕法煉鋅工業中采用的各種除鈷方法各有優缺點:鋅粉置換法除鈷不徹底,但操作簡單且不引入新雜質;黃藥和β-萘酚等有機試劑的除鈷效果較好,但操作環境相對較差,殘余有機物需要活性炭吸附。其他除鈷新方法也有難以克服的問題:氧化法由于錳的存在需要消耗大量氧化劑;還原法所用還原劑價格高昂;黃原酸鹽法除鈷效率高,原料廉價易得,但會造成主金屬鋅的損失。這些除鈷新方法都需要進一步試驗探究。目前來看,銻鹽除鈷法發展得比較成熟,仍是國內外采用的主流方法。
[1]劉永帥,張旭.濕法煉鋅凈化除鈷工藝現狀及發展趨勢[J].礦冶,2012,21(3):65-69.
[2]彭容秋.重金屬冶金學[M].長沙:中南大學出版社,2004:295-297.
[3]梅光貴,王德潤,周敬元,等.濕法煉鋅學[M].長沙:中南大學出版社,2001:321-323.
[4]張訓鵬.冶金工程概論[M].長沙:中南大學出版社,2009:118-119.
[5]藍德均.高錳酸鉀氧化沉鈷的研究及應用[D].昆明:昆明理工大學.2003:6-9.
[6]侯曉波,李國江,王帆.電鋅冶煉貧鎘液除鈷研究進展[J].云南冶金,2011,40(4):29-31.
[7]田慶華,辛云濤,姚標,等.鋅濕法冶金過程中臭氧氧化沉淀除去微量鈷[J].中國有色金屬學報,2012,23(4):1140-1144.
[8]陳世倌.硫酸鋅溶液凈化除鈷的理論分析和工藝進展[J].上海有色金屬,1996,17(4):161-169.
[9]劉自力,朱曉云.硫酸鋅溶液深度凈化除鈷的現狀與發展[J].云南冶金.2003,32(3):16-21.
[10]鐘長庚.用稻草黃原酸酯凈化鋅液的新方法[J].離子交換與吸附,2003,19(1):72-76.
[11]黃守義,張旭,包紅偉.從濕法煉鋅硫酸鹽溶液中去除鈷的試驗研究[J].濕法冶金,2010,29(1):37-39.

