傳統(tǒng)發(fā)酵食品中乳酸菌生態(tài)演替研究進(jìn)展*
繆璐歡,白鳳翎,勵(lì)建榮
(渤海大學(xué)食品科學(xué)研究院,遼寧省食品安全重點(diǎn)實(shí)驗(yàn)室,“食品貯藏加工及質(zhì)量安全控制工程技術(shù)研究中心”遼寧省高校重大科技平臺(tái),遼寧錦州,121013)
傳統(tǒng)乳酸發(fā)酵食品是以天然乳酸菌為主體微生物發(fā)酵原料中的碳水化合物和蛋白質(zhì)等大分子物質(zhì),形成以乳酸為主要代謝產(chǎn)物的具有酸、香、鮮風(fēng)味的食品,主要包括酸奶、干酪和開(kāi)菲爾等發(fā)酵乳制品,泡菜、酸菜、橄欖等發(fā)酵果蔬制品,火腿、香腸等發(fā)酵肉制品以及酵頭發(fā)酵面制品等。傳統(tǒng)乳酸發(fā)酵食品中具有豐富而龐雜的微生物區(qū)系,通過(guò)微生物種群與基質(zhì)的相互作用,不僅使食品獲得了良好的風(fēng)味,改善食品的品質(zhì),提高食品的營(yíng)養(yǎng)價(jià)值,而且提升了食品的安全性,延長(zhǎng)產(chǎn)品的保藏期。
乳酸菌是傳統(tǒng)乳酸發(fā)酵食品的主體微生物類群,分為同型和異型乳酸發(fā)酵乳酸菌,前者降解碳水化合物后產(chǎn)物為乳酸,后者除產(chǎn)生乳酸外,產(chǎn)生醇類、酮類、醛類等揮發(fā)性化合物,賦予發(fā)酵食品特有的口味和香味。同時(shí),乳酸菌通過(guò)生態(tài)位競(jìng)爭(zhēng),形成酸性環(huán)境和產(chǎn)生拮抗性代謝產(chǎn)物,較好地控制了產(chǎn)品中的腐敗和致病微生物。因此,傳統(tǒng)乳酸發(fā)酵食品中乳酸菌對(duì)產(chǎn)品的品質(zhì)和安全性具有十分突出的作用。本文對(duì)傳統(tǒng)乳酸發(fā)酵食品發(fā)酵過(guò)程中乳酸菌的發(fā)生、發(fā)展和演替過(guò)程和分析方法進(jìn)行綜述,分析各種傳統(tǒng)乳酸發(fā)酵食品中乳酸菌與基質(zhì)之間、乳酸菌與他種微生物之間、乳酸菌與乳酸菌之間的相互作用關(guān)系,進(jìn)而闡明乳酸菌在傳統(tǒng)發(fā)酵食品中的地位和作用,為實(shí)現(xiàn)傳統(tǒng)乳酸發(fā)酵食品的技術(shù)改造,開(kāi)發(fā)乳酸菌資源提供借鑒與參考。
1 傳統(tǒng)發(fā)酵食品中乳酸菌的生態(tài)演替
傳統(tǒng)乳酸發(fā)酵食品充分體現(xiàn)了乳酸菌多樣性和多變性的生態(tài)學(xué)特點(diǎn),乳酸菌的豐度(種群數(shù)量)和均勻度(種群量的大小)與演替過(guò)程主要受發(fā)酵原料、時(shí)間、溫度、地理環(huán)境以及其他微生物等因素的影響。
1.1 韓國(guó)泡菜
傳統(tǒng)韓國(guó)泡菜(kimchi)是以蔬菜為主要原料經(jīng)天然微生物發(fā)酵而成的食品,蔬菜中可溶性物質(zhì)和部分浸出物為乳酸菌為主體的微生物生長(zhǎng)提供營(yíng)養(yǎng)需求,乳酸菌的生長(zhǎng)較好地抑制了腐敗菌的繁殖。根據(jù)酸度變化,一般可將發(fā)酵過(guò)程分為初始階段(酸度<0.2)、未成熟階段(酸度0.2~0.4)、成熟階段(酸度0.4 ~0.9)和過(guò)熟階段(酸度 >0.9)[1]。
Lee等[2]應(yīng)用PCR-DGGE技術(shù)研究發(fā)現(xiàn),傳統(tǒng)韓國(guó)泡菜中主要乳酸菌類群為Weissella confusa、Leuconostoc citreum、Lactobacillus sakei和 Lb.curvatus。Cho等[3]應(yīng)用多重 PCR技術(shù)研究發(fā)現(xiàn),Leu.mesenteroides是泡菜未成熟期和成熟期的優(yōu)勢(shì)菌,Lb.sakei從初始發(fā)酵階段到過(guò)發(fā)酵階段一直存在。Park等[4]研究泡菜整個(gè)發(fā)酵過(guò)程中乳酸菌菌群為Weissella、Lactobacillus、Pediococcus 和 Leuconostoc。Jung等[5]應(yīng)用焦磷酸測(cè)序技術(shù)分析表明,在不考慮泡菜類型和發(fā)酵劑的條件下,泡菜的主要乳酸菌類群為 Leuconostoc、Lactobacillus 和 Weissella,其 中 Leu-conostoc數(shù)量最多,Lactobacillus和Weissella次之。綜上研究結(jié)果表明,雖然不同品種和地域的傳統(tǒng)韓國(guó)泡菜產(chǎn)品中的乳酸菌類群構(gòu)成不同,但主要乳酸菌類群為 Leuconostoc、Lactobacillus、Weissella 和 Pediococcus。
從韓國(guó)泡菜發(fā)酵過(guò)程中乳酸菌的菌相演替來(lái)看,發(fā)酵早期的優(yōu)勢(shì)菌群為L(zhǎng)euconostoc和 Weissella,隨后Lb.sakei替代 Leuconostoc和Weissella占優(yōu)勢(shì),到發(fā)酵后期,主體乳酸菌為L(zhǎng)b.plantarum。韓國(guó)泡菜中乳酸菌來(lái)源于附著在蔬菜表面上的天然微生物類群,在發(fā)酵早期,pH在5.64~4.27,相對(duì)較高,乳酸菌主要為L(zhǎng)euconostoc、Lactobacillus和 Weissella[6-7]。Jeong 等研究發(fā)現(xiàn),Leuconostoc、Lactobacillus和 Weissella是發(fā)酵開(kāi)始階段的乳酸菌類群,可能由于 Leuconostoc和Weissella是原料蔥和蒜中的優(yōu)勢(shì)乳酸菌[8]。Cho等[9]研究發(fā)現(xiàn),15℃預(yù)發(fā)酵2 d,然后在-1℃下進(jìn)行主發(fā)酵,第一發(fā)酵階段泡菜中主要優(yōu)勢(shì)菌為 Leu.citreum 和 Leu.gasicomitatum,第 二 發(fā) 酵 階 段W.koreensis占主要優(yōu)勢(shì)。到發(fā)酵后期,當(dāng)pH低于4.0 時(shí),Hong 等[6]研 究 發(fā) 現(xiàn),乳 酸 菌 主 要 為L(zhǎng)b.plantarum,可能是由于泡菜中Leuconostoc、Weissella和Pediococcus耐酸性較弱的緣故。
1.2 酵頭
酵頭是東西方各種發(fā)酵面制品(面包和饅頭等)的天然母發(fā)酵劑,按工藝酵頭分為I、II和III三種類型。I型為傳統(tǒng)酵頭,需經(jīng)每天翻新保持微生物處于活性狀態(tài),II型為高溫條件下制作含有多種微生物的酵頭,III型酵頭為含有乳酸菌的干燥粉狀物[10]。酵頭中具有豐富多樣的微生態(tài)體系,酵母和乳酸菌是主要的微生物類群。其中,乳酸菌對(duì)面團(tuán)結(jié)構(gòu)和風(fēng)味形成具有十分重要的作用,同時(shí)還具有提高營(yíng)養(yǎng)價(jià)值和延長(zhǎng)保質(zhì)期的作用。
面團(tuán)是營(yíng)養(yǎng)豐富而全面的生態(tài)系統(tǒng),微生物發(fā)酵作用將蛋白質(zhì)、糖類等大分子物質(zhì)水解成氨基酸、單糖等容易被乳酸菌生長(zhǎng)吸收的小分子代謝產(chǎn)物,因此酵頭中乳酸菌呈現(xiàn)種類豐富而多樣的特點(diǎn)。Vuyst等[11]研究表明,酵頭中乳酸菌包括 Lactobacillus、Leuconostoc、Pediococcus和Weissella等菌屬。其中,Lactobacillus是傳統(tǒng)酵頭中最常見(jiàn)的乳酸菌類群,主要包括 Lb.brevis、 Lb.plantarum、 Lb.paralimentarius、Lb.rossiae 和 Lb.sanfranciscensis 等[12]。Robert 等[13]研究發(fā)現(xiàn),Lactobacillus(39%)、Pediococcus(38%)、Leuconostoc(17%)、Weissella(4%)、Lactococcus(1%)和Enterococcus(<1%)是法國(guó)傳統(tǒng)酵頭中的乳酸菌菌群。Corsetti等[12]分析酵頭中乳酸菌菌群的構(gòu)成為 Enterococcus、Lactococcus、Leuconostoc、Pediococcus、Streptococcus和 Weissella。Moroni等[14]研究低溫持續(xù)自主發(fā)酵的buckwheat和teff傳統(tǒng)I型酵頭中乳酸菌組成,結(jié)果表明乳酸菌主要為L(zhǎng)actobacillus、Pediococcus、Leuconostoc。
總之,傳統(tǒng)酵頭具有豐富的乳酸菌微生態(tài)系統(tǒng),最常見(jiàn)的是 Lactobacillus,Lactococcus、Enterococcus、Leuconostoc和Weissella廣泛存在于谷物和面粉中,但其耐受酸化環(huán)境的能力弱而在酵頭中處于弱勢(shì)地位[12]。與其他發(fā)酵食品相比,酵頭中發(fā)揮顯著作用的主要是專性異型發(fā)酵乳酸菌,這是由于它們能夠發(fā)酵糖類產(chǎn)生乙酸以及乳酸等代謝產(chǎn)物[15]。酵頭發(fā)酵過(guò)程中乳酸菌的演替主要與菌株對(duì)酸的適應(yīng)機(jī)制和耐受性以及碳水化合物和氮代謝有關(guān)。Moroni等[14]應(yīng)用PCR-DGGE技術(shù)研究buckwheat和teff酵頭中乳酸菌的演替過(guò)程,結(jié)果表明,初始發(fā)酵12 h主要有Lb.sakei、Lb.graminis 和 P.pentosaceus,12h 后 為L(zhǎng)b.plantarum、W.cibaria、Leu.holzapfelii,最后階段Lb.plantarum和W.cibaria的數(shù)量減少。Weckx等[16]研究發(fā)現(xiàn)黑麥酵頭發(fā)酵經(jīng)過(guò)3個(gè)主要階段,初期乳酸菌主要為 Lactococcus和 Enterococcus,中期被 Leuconostoc和 Weissella所取代,第 5天后主要為L(zhǎng)b.fermentum和Lb.plantarum。
1.3 發(fā)酵香腸
發(fā)酵香腸是經(jīng)乳酸菌、霉菌、酵母、微球菌等多種微生物共同發(fā)酵的肉制品,乳酸菌對(duì)產(chǎn)品的風(fēng)味形成、營(yíng)養(yǎng)價(jià)值提升和安全性保障都具有十分重要的作用。Urso等[17]研究意大利東北部 Friuli-Venezia-Giulia地區(qū)3種自然發(fā)酵香腸乳酸菌組成,發(fā)現(xiàn)Lb.curvatus(14.4%)和Lb.sakei(75.9%)數(shù)量最多。Bonomo等[18]對(duì)意大利南部Basilicata地區(qū)傳統(tǒng)發(fā)酵香腸進(jìn)行研究,發(fā)現(xiàn)Lb.sakei(67%)是優(yōu)勢(shì)乳酸菌,其次是P.pentosaceus(16%)和Leu.carnosum(8%),然后是 Lb.plantarum(4%)、Lb.brevis(2%)和 Leu.pseudomesenteroides(2%)等。Cocolin 等[19]對(duì)意大利北部不同省份的3種發(fā)酵香腸乳酸菌生態(tài)學(xué)進(jìn)行研究,發(fā)現(xiàn)優(yōu)勢(shì)乳酸菌主要為 Lb.sakei和Lb.curvatus。
從乳酸菌在發(fā)酵香腸的菌群演變來(lái)看,發(fā)酵早期主要為L(zhǎng)b.sakei和Lb.curvatus,成熟階段的優(yōu)勢(shì)乳酸菌為 Lb.sakei。Danilovi等[20]分析了傳統(tǒng) Petrovac香腸整個(gè)發(fā)酵過(guò)程的乳酸菌菌相演替情況,結(jié)果表明,E.caseliflavus在開(kāi)始第2天占主要優(yōu)勢(shì)地位,從第2天至第 90天 Leu.mesenteroides、P.pentosaceus和Lb.sakei共存,并形成優(yōu)勢(shì)菌群。Greco等[21]分析意大利干發(fā)酵香腸的乳酸菌菌相,結(jié)果表明主要由Lb.sakei、Lb.plantarum 和 Lb.curvatus構(gòu)成。Tran等研究發(fā)現(xiàn),Lb.plantarum和P.pentosaceus是nem chua香腸成熟階段中的優(yōu)勢(shì)菌群,這兩種菌產(chǎn)酸和耐酸能力較強(qiáng),隨著pH減低,代替了初始發(fā)酵時(shí)期的耐酸性較弱的異型發(fā)酵乳酸菌[22]。
1.4 開(kāi)菲爾
開(kāi)菲爾(Kefir)是源于高加索地區(qū)由多種微生物協(xié)同作用而成的復(fù)合型發(fā)酵乳,其中開(kāi)菲爾粒(Kefir grains,KG)是富含天然乳酸菌、酵母和醋酸菌等微生物的共發(fā)酵體系。乳酸菌是KG的主體微生物類群,數(shù)量約為108~109CFU/g,主要包括 Lactococcus、Lactobacillus和 Leuconostoc。Simova 等[23]對(duì)保加利亞地區(qū)開(kāi)菲爾粒中菌相研究發(fā)現(xiàn),乳酸菌占總微生物的83% ~ 90%,主 要 為 Lc.lactis subsp.lactis、Streptococcus thermophilus、Lb.delbrueckii subsp.bulgaricus、Lb.helveticus、Lb.casei subsp.pseudoplantarum和Lb.brevis;酵母占10% ~17%,主要為 Kluyveromyces marxianus var.lactis、Saccharomyce cerevisiae、Candida inconspicua 和 Candida maris。Nalbantoglu等[24]分析了土耳其開(kāi)菲爾粒的乳酸菌菌相構(gòu)成,結(jié)果表明,Lactobacillus的數(shù)量最多,包括Lb.kefiranofaciens、 Lb.buchneri 和 Lb.helveticus。ZHOU等[25]對(duì)我國(guó)西藏開(kāi)菲爾粒的細(xì)菌菌相分析,Leu.mesenteroides、 Lb.helveticus、 Lb.kefiranofaciens、Lc.lactis、Lb.kefiri和Lb.casei為優(yōu)勢(shì)菌種。
圖1是 Witthuhn等[26]分析傳統(tǒng) kefir發(fā)酵過(guò)程中微生物群落分布狀況,A、B、C分別為開(kāi)菲爾發(fā)酵20、25和30 d時(shí)微生物菌群組成。從圖中可以看出,發(fā)酵20 d時(shí) Leu.mesenteroides subsp.mesenteroides占26.9%,Lc.lactis subsp.lactis占32.4%,此外還含有40.4% 的 Zygosaccharomyces sp.。 到 25d 時(shí),Lb.fermentum占80.5%,成為優(yōu)勢(shì)菌,還有15.3%的Lc.lactis subsp.lactis和少量的Cryptococcus humicolus(4.0%)。隨著發(fā)酵時(shí)間的延長(zhǎng),發(fā)酵 30 d時(shí)Lb.fermentum達(dá)到98.2%,占有絕對(duì)優(yōu)勢(shì)。Magalh?es等[27]將開(kāi)菲爾粒接種于糖水中在25℃發(fā)酵24 h,發(fā)現(xiàn) Lb.paracasei、Lb.parabuchneri和 Lb.kefiri在一直存在于發(fā)酵過(guò)程,Lb.casei和Lc.lactis在發(fā)酵初期存在,分別在12 h和18 h后又被重新檢測(cè)到。Leu.citreum在發(fā)酵12 h后才發(fā)現(xiàn),到24 h后檢測(cè)到Lb.paracasei subsp.tolerans和 Lb.buchneri。
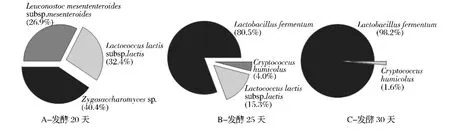
圖1 傳統(tǒng)kefir發(fā)酵過(guò)程中微生物群落分布狀況Fig.1 The average distribution frequency of the microbial population of traditional kefir production
2 食品乳酸菌生態(tài)學(xué)研究方法
食品微生態(tài)學(xué)研究方法主要包括以培養(yǎng)和鑒定技術(shù)獲取特征微生物的傳統(tǒng)微生物學(xué)方法,以微生物細(xì)胞結(jié)構(gòu)成分或代謝特征差異進(jìn)行鑒別的非培養(yǎng)的生理生化方法,基于核酸為微生物信息載體的分子生物學(xué)技術(shù)和以微生物代謝產(chǎn)物為信息對(duì)象的現(xiàn)代分析技術(shù)等。
2.1 傳統(tǒng)微生物學(xué)方法
傳統(tǒng)微生物學(xué)方法依據(jù)乳酸菌的生物學(xué)特征應(yīng)用選擇性培養(yǎng)基從傳統(tǒng)乳酸發(fā)酵食品中分離各種乳酸菌菌落,再經(jīng)過(guò)形態(tài)學(xué)和生理生化特征進(jìn)行分類鑒定,獲取乳酸菌菌相信息。Drosinos等[28]用MRS培養(yǎng)基從發(fā)酵香腸中分離出288株乳酸菌,通過(guò)形態(tài)學(xué)和生理生化鑒定 255株為 Lactobacillus,15株 Leuconostoc,18株為 Lc.lactis subsp.lactis和 E.faecium。Iacumin等[29]利用平板法分析意大利北部酵頭中微生物菌相構(gòu)成,結(jié)果發(fā)現(xiàn)乳酸菌數(shù)量在103~109CFU/g之間,酵母數(shù)量在102~107CFU/g范圍內(nèi),乳酸菌顯著高于酵母為優(yōu)勢(shì)菌群。
2.2 磷脂脂肪酸(PLFA)/脂肪酸甲酯(FAME)分析法
PLFA/FAME分析法是基于細(xì)胞組分水平研究微生物的方法,以微生物細(xì)胞膜中磷脂中脂肪酸的結(jié)構(gòu)多樣性和生物特異性為基礎(chǔ),作為標(biāo)記物揭示微生物的數(shù)量和菌群組成。目前應(yīng)用于發(fā)酵食品的研究相對(duì)較少,Lee等[30]利用微生物鑒定系統(tǒng)構(gòu)建了韓國(guó)泡菜中230株乳酸菌、8個(gè)種群的FAMEs指紋數(shù)據(jù)庫(kù),并對(duì)79株Leuconostoc進(jìn)行鑒定。
2.3 Biolog微平板分析法
Biolog微平板法是美國(guó)Biolog公司研發(fā)的自動(dòng)化鑒定微生物群落的方法,基于微生物對(duì)碳源底物利用的差異性比較分析微生物的群落構(gòu)成。Lee等[31]利用該方法分析韓國(guó)泡菜中乳酸菌的菌群構(gòu)成,結(jié)果表明獲得的75菌株均為L(zhǎng)euconostoc。
2.4 分子生物學(xué)技術(shù)
分子生物學(xué)技術(shù)主要包括特異性片段測(cè)序及分析技術(shù)、遺傳指紋圖譜分析技術(shù)、宏基因組分析技術(shù)等。
特異性片段測(cè)序及分析技術(shù)是利用通用引物擴(kuò)增特定基因片段后直接測(cè)序,主要是針對(duì)16S rRNA進(jìn)行序列分析。Kim等[32]將樣品用磷酸緩沖溶液稀釋,通過(guò)渦流和聲波處理等步驟,直接提取樣品中的DNA,并通過(guò)16S rRNA基因序列分析泡菜中細(xì)菌群落結(jié)構(gòu),發(fā)現(xiàn) Lactobacillus、Leuconostoc和 Weissella等乳酸菌為優(yōu)勢(shì)菌群。
遺傳指紋圖譜分析技術(shù)是采用凝膠電泳等方法對(duì)代表微生物群落結(jié)構(gòu)的核酸分子進(jìn)行分離,依據(jù)其遷移的差異構(gòu)建遺傳指紋圖譜。經(jīng)PCR對(duì)特定基因片段擴(kuò)增后,分析樣品中微生物的菌相構(gòu)成,如變性梯度凝膠電泳技術(shù)(PCR-DGGE)、基因組重復(fù)序列PCR技術(shù)(rep-PCR)、隨機(jī)擴(kuò)增多態(tài)性DNA(RAPD)技術(shù)和脈沖場(chǎng)凝膠電泳(PFGE)技術(shù)等。ZHANG等[33]應(yīng)用PCR-DGGE技術(shù)分析內(nèi)蒙古西部酵頭中乳酸菌群落構(gòu)成,通過(guò)條帶比對(duì),發(fā)現(xiàn)Lb.plantarum和 Lb.sanfranciscensis為優(yōu)勢(shì)菌群。Tran等[22]利用rep-PCR和PFGE技術(shù)獲取發(fā)酵香腸中乳酸菌的分子指紋圖譜,乳酸菌構(gòu)成分別為 Lb.plantarum(67.6%)、 P.pentosaceus (21.6%)、 Lb.brevis(9.5%)和 Lb.farciminis(1.4%)。Urso等[17]從意大利3種發(fā)酵香腸分離的乳酸菌中提取100 ng DNA,經(jīng)過(guò)RAPD-PCR分析,Lb.curvatus和Lb.sakei是這些香腸中共同菌株。
宏基因組分析技術(shù)選擇性提取環(huán)境中樣品的總DNA/RNA,通過(guò)構(gòu)建宏基因組文庫(kù)進(jìn)行高通量測(cè)序分析或篩選新的活性物質(zhì)。Jeong等[34]使用DNA快速抽提盒提取樣品中的DNA,經(jīng)過(guò)16S rRNA序列擴(kuò)增,通過(guò)焦磷酸測(cè)序技術(shù)分析泡菜中的微生物群落,結(jié)果發(fā)現(xiàn)加入紅辣椒粉的泡菜在發(fā)酵初期生物多樣性比未加紅辣椒粉的減少速度緩慢。Leite等[35]通過(guò)PCR-DGGE技術(shù)和焦磷酸測(cè)序技術(shù)分析巴西不同地區(qū)的3種開(kāi)菲爾粒的微生物多樣性和群落結(jié)構(gòu),結(jié)果表明 Lb.kefiranofaciens和 Lb.kefiri為優(yōu)勢(shì)菌群。Jung等[36]在泡菜發(fā)酵期間,通過(guò)熱酚法提取泡菜中的全部RNA并分離出mRNA,采用Illumina高通量得到泡菜發(fā)酵期間的轉(zhuǎn)錄文本,結(jié)果發(fā)現(xiàn) Leu.mesenteroides在早期發(fā)酵時(shí)期最為活躍,而Lb.sakei和W.koreensis在后發(fā)酵時(shí)期數(shù)量較多。
2.5 基于代謝產(chǎn)物的現(xiàn)代分析技術(shù)
代謝產(chǎn)物可間接反映食品中微生物的分布與演替情況,通過(guò)代謝產(chǎn)物分析獲取微生物種類及數(shù)量的相關(guān)信息。通常以色譜技術(shù)分離食品中微生物的代謝產(chǎn)物,以質(zhì)譜和核磁共振等技術(shù)進(jìn)行產(chǎn)物鑒定,實(shí)際工作中多采用分離與鑒定聯(lián)用技術(shù)。Weckx等[16]應(yīng)用GC-MS和HPLC-MS分析4種黑麥酵頭發(fā)酵過(guò)程中糖類、氨基酸及其相關(guān)代謝產(chǎn)物變化情況,來(lái)推測(cè)發(fā)酵微生物的演變過(guò)程。Jeong等[8]通過(guò)核磁共振技術(shù)分析韓國(guó)水泡菜中的游離糖變化,發(fā)現(xiàn)隨著游離糖的快速消耗,丙三醇和乙醇等產(chǎn)物迅速增加,以此判斷泡菜的質(zhì)量和產(chǎn)品成熟期。
由于食品中存在大量活的不可培養(yǎng)的微生物,傳統(tǒng)微生物學(xué)方法不能獲取全面真實(shí)微生物信息,非培養(yǎng)的生理生化方法受環(huán)境的影響,準(zhǔn)確率有待于提高。因此,目前分子生物學(xué)技術(shù)是全面獲取食品微生態(tài)學(xué)研究的主要手段。在食品微生態(tài)學(xué)研究中,應(yīng)在傳統(tǒng)微生物學(xué)和現(xiàn)代分子生物學(xué)獲取微生物菌群信息的基礎(chǔ)上,結(jié)合現(xiàn)代分析技術(shù)分析微生物的代謝產(chǎn)物獲取微生物及其代謝產(chǎn)物的全面信息。
3 展望
微生態(tài)學(xué)是一門新的學(xué)科主要用于土壤、海洋環(huán)境及人類和動(dòng)物腸道中微生物多樣性分析,用于傳統(tǒng)發(fā)酵食品處于起步階段,已用于傳統(tǒng)韓國(guó)泡菜、歐洲酵頭和發(fā)酵香腸、開(kāi)菲爾等食品。研究方法從傳統(tǒng)的分離培養(yǎng)技術(shù)、化學(xué)成分分析方法到應(yīng)用現(xiàn)代分子生物學(xué)技術(shù)和基于代謝組學(xué)的分析技術(shù)。本文以乳酸菌為主線分析傳統(tǒng)發(fā)酵食品中乳酸菌菌群的發(fā)生、發(fā)展與演替過(guò)程,闡明傳統(tǒng)乳酸發(fā)酵食品乳酸菌與原料之間、乳酸菌與他種微生物之間、乳酸菌菌群之間的相互作用關(guān)系,旨在探究發(fā)酵過(guò)程乳酸菌與產(chǎn)品品質(zhì)形成的內(nèi)在聯(lián)系,為提高我國(guó)傳統(tǒng)發(fā)酵食品的研究水平,提升應(yīng)用現(xiàn)代技術(shù)對(duì)傳統(tǒng)發(fā)酵食品的改造水平,達(dá)到縮短發(fā)酵周期、提高產(chǎn)品品質(zhì)和經(jīng)濟(jì)效益的目的。
[1] Codex Alimentarius Commission.Codex standard for kimchi.Codex Stan[M].Rome:Food and Agriculture Organization of the United Nations,2001:223.
[2] Lee J S,Heo G Y,Lee J W,et al.Analysis of kimchi microflora using denaturing gradient gel electrophoresis[J].International Journal of Food Microbiology,2005,102(2):143-150.
[3] Cho K M,Math R K,Islam S M,et al.Novel multiplex PCR for the detection of lactic acid bacteria during kimchi fermentation [J].Molecular and Cellular Probes,2009,23(2):90-94.
[4] Park J M,Shin J H,Lee D W,et al.Identification of the lactic acid bacteria in kimchi according to initial and overripened fermentation using PCR and 16S rRNA gene sequence analysis[J].Food Science and Biotechnology,2010,19(2):541-546.
[5] Jung J Y,Lee SH,Lee H J,et al.Effects of Leuconostoc mesenteroides starter cultures on microbial communities and metabolites during kimchi fermentation[J].International Journal of Food Microbiology,2012,153(3):378-387.
[6] HONG Y,YANG H S,CHANG H C,et al.Comparison of bacterial community changes in fermenting kimchi at two different temperatures using a denaturing gradient gel electrophoresis analysis[J].Journal of Microbiology and Biotechnology,2013,23(1):76-84.
[7] Jung H J,Hong Y,Yang H S,et al.Distribution of lactic acid bacteria in garlic(Allium sativum)and green onion(Allium fistulosum)using SDS-PAGE whole cell protein pattern comparison and 16S rRNA gene sequence analysis[J].Food Science and Biotechnology,2012,21(5):1 457-1 462.
[8] Jeong S H,Jung J Y,Lee S H,et al.Microbial succession and metabolite changes during fermentation of dongchimi,traditional Korean watery kimchi[J].International Journal of Food Microbiology,2013,164(1):46-53.
[9] Cho J,Lee D,Yang C,et al.Microbial population dynamics of kimchi,a fermented cabbage product[J].FEMS Microbiology Letters,2006,257(2):262-267.
[10] De Vuyst L,Neysens P.The sourdough microflora:biodiversity and metabolic interactions[J].Trends in Food Science & Technology,2005,16(1):43-56.
[11] De Vuyst L,Vancanneyt M.Biodiversity and identification of sourdough lactic acid bacteria[J].Food Microbiology,2007,24(2):120-127.
[12] Corsetti A,Settanni L,Chaves López C,et al.A taxonomic survey of lactic acid bacteria isolated from wheat kernels and non-conventional flours[J].Systematic and Applied Microbiology,2007,30(7):561-571.
[13] Robert H,Gabriel V,F(xiàn)ontagné-Faucher C.Biodiversity of lactic acid bacteria in French wheat sourdough as determined by molecular characterization using species-specific PCR[J].International Journal of Food Microbiology,2009,135(1):53-59.
[14] Moroni A V,Arendt E K,Bello F D.Biodiversity of lactic acid bacteria and yeasts in spontaneously-fermented buckwheat and teff sourdoughs[J].Food Microbiology,2011,28(3):497-502
[15] Settanni L,Ventimiglia G,Alfonzo A,et al.An integrated technological approach to the selection of lactic acid bacteria of flour origin for sourdough production[J].Food Research International,2013,54(2):1 569-1 578.
[16] Weckx S,Vander Meulen R,Maes D,et al.Lactic acid bacteria community dynamics and metabolite production of rye sourdough fermentations share characteristics of wheat and spelt sourdough fermentations[J].Food Microbiology,2010,27(8):1 000-1 008.
[17] Urso R,Comi G,Cocolin L.Ecology of lactic acid bacteria in Italian fermented sausages:isolation,identification and molecular characterization[J].Systematic and Applied Microbiology,2006,29(8):671-680.
[18] Bonomo M G,Ricciardi A,Zotta T,et al.Molecular and technological characterization of lactic acid bacteria from traditional fermented sausages of Basilicata region(Southern Italy)[J].Meat Science,2008,80(4):1 238-1 248.
[19] Cocolin L,Dolci P,Rantsiou K,et al.Lactic acid bacteria ecology of three traditional fermented sausages produced in the North of Italy as determined by molecular methods[J].Meat Science,2009,82(1):125-132.
[20]DanilovicˊB,JokovicˊN,PetrovicˊL,et al.The characterisation of lactic acid bacteria during the fermentation of an artisan Serbian sausage(Petrovská Klobása)[J].Meat Science,2011,88(4):668-674.
[21] Greco M,Mazzette R,De Santis E P L,et al.Evolution and identification of lactic acid bacteria isolated during the ripening of Sardinian sausages[J].Meat Science,2005,69(4):733-739.
[22] Tran K,May B K,Smooker P M,et al.Distribution and ge-netic diversity of lactic acid bacteria from traditional fermented sausage[J].Food Research International,2011,44(1):338-344.
[23] Simova E,Beshkova D,Angelov A,et al.Lactic acid bacteria and yeasts in kefir grains and kefir made from them[J].Journal of Industrial Microbiology and Biotechnology,2002,28(1):1-6.
[24] Nalbantoglu U,Cakar A,Dogan H,et al.Metagenomic analysis of the microbial community in kefir grains[J].Food Microbiology,2014,41:42-51.
[25] ZHOU J,LIU X,JIANG H,et al.Analysis of the microflora in Tibetan kefir grains using denaturing gradient gel electrophoresis[J].Food Microbiology,2009,26(8):770-775.
[26] Witthuhn R C,Schoeman T,Britz T J.Characterisation of the microbial population at different stages of Kefir production and Kefir grain mass cultivation[J].International Dairy Journal,2005,15(4):383-389.
[27] Magalh?es K T,Pereira G V M,Dias D R,et al.Microbial communities and chemical changes during fermentation of sugary Brazilian kefir[J].World Journal of Microbiology and Biotechnology,2010,26(7):1 241-1 250.
[28] Drosinos E H,Mataragas M,Xiraphi N,et al.Characterization of the microbial flora from a traditional Greek fermented sausage[J].Meat Science,2005,69(2):307-317.
[29] Iacumin L,Cecchini F,Manzano M,et al.Description of the microflora of sourdoughs by culture-dependent and culture-independent methods[J].Food Microbiology,2009,26(2):128-135.
[30] Lee J S,Chun C O,Kim H J,et al.Analysis of cellular fatty acid methyl esters(FAMEs)for the identification of Leuconostoc strains isolated from kimchi[J].Journal of Microbiology,1996,34(3):225-228.
[31] Lee J S,Chun C O,Hector M,et al.Identification of Leuconostoc strains isolated from kimchi using carbon-source utilization patterns[J].Journal of Microbiology,1997,35(1):10-14.
[32] Kim M,Chun J.Bacterial community structure in kimchi,a Korean fermented vegetable food,as revealed by 16S rRNA gene analysis[J].International Journal of Food Microbiology,2005,103(1):91-96.
[33] ZHANG J,LIU W,SUN Z,et al.Diversity of lactic acid bacteria and yeasts in traditional sourdoughs collected from western region in Inner Mongolia of China[J].Food Control,2011,22(5):767-774.
[34] Jeong S H,Lee H J,Jung J Y,et al.Effects of red pepper powder on microbial communities and metabolites during kimchi fermentation[J].International Journal of Food Microbiology,2013,160(3):252-259.
[35] Leite A M O,Mayo B,Rachid C,et al.Assessment of the microbial diversity of Brazilian kefir grains by PCRDGGE and pyrosequencing analysis[J].Food Microbiology,2012,31(2):215-221.
[36] Jung J Y,Lee S H,Jin H M,et al.Metatranscriptomic analysis of lactic acid bacterial gene expression during kimchi fermentation[J].International Journal of Food Microbiology,2013,163(2):171-179.

