口服精胺促進(jìn)哺乳仔豬腸道發(fā)育機(jī)制的初探
廖國(guó)周,樊月圓,王桂瑛,蘇子峰,王雪峰,畢保良, 潘洪彬,4,趙平,黃麗梅,程志斌,4*
(1.云南農(nóng)業(yè)大學(xué),昆明 650201;2.云南省畜產(chǎn)品加工工程技術(shù)研究中心,昆明 650201;3.大理學(xué)院農(nóng)學(xué)與生物科學(xué)學(xué)院,云南大理 671003;4.云南省動(dòng)物營(yíng)養(yǎng)與飼料科學(xué)重點(diǎn)實(shí)驗(yàn)室,昆明 650201)
口服精胺促進(jìn)哺乳仔豬腸道發(fā)育機(jī)制的初探
廖國(guó)周1,2,樊月圓1,王桂瑛2,蘇子峰3,王雪峰2,畢保良1, 潘洪彬1,4,趙平1,黃麗梅1,程志斌1,4*
(1.云南農(nóng)業(yè)大學(xué),昆明650201;2.云南省畜產(chǎn)品加工工程技術(shù)研究中心,昆明650201;3.大理學(xué)院農(nóng)學(xué)與生物科學(xué)學(xué)院,云南大理671003;4.云南省動(dòng)物營(yíng)養(yǎng)與飼料科學(xué)重點(diǎn)實(shí)驗(yàn)室,昆明650201)
試驗(yàn)通過(guò)血漿皮質(zhì)醇抑制模型初步探索精胺促進(jìn)哺乳仔豬腸道發(fā)育的機(jī)制。選取來(lái)自6窩的11日齡哺乳仔豬24頭進(jìn)行試驗(yàn)。試驗(yàn)采用隨機(jī)區(qū)組設(shè)計(jì),以窩別為區(qū)組,每頭仔豬為試驗(yàn)重復(fù),將同窩選取的4頭試驗(yàn)仔豬隨機(jī)分配到4個(gè)處理組。處理1組豬只口服生理鹽水和注射生理鹽水;處理2組口服精胺0.4 mmol·kg-1BW·d-1和注射生理鹽水;處理3組口服生理鹽水和肌肉注射甲雙吡丙酮5 mg·kg-1BW·d-1;處理4組注射甲雙吡丙酮5 mg·kg-1BW·d-1和口服精胺0.4 mmol·kg-1BW·d-1。試驗(yàn)結(jié)果表明,成功建立血漿皮質(zhì)醇模型;處理1~4組仔豬空腸黏膜麥芽糖酶比活力分別為118.5、195.3、88.3和144.2 U·g-1蛋白質(zhì)。處理2組麥芽糖酶比活力顯著高于處理1和4組(P<0.05),極顯著高于處理3組(P<0.01);處理1和4組麥芽糖酶比活力差異不顯著(P>0.05),但顯著高于處理3組(P<0.05)。結(jié)果表明,口服精胺通過(guò)刺激血漿皮質(zhì)醇的分泌促進(jìn)了幼齡仔豬腸道發(fā)育。
精胺;哺乳仔豬;腸道發(fā)育;初探
精胺存在于所有真核細(xì)胞和原核細(xì)胞中,在哺乳動(dòng)物細(xì)胞的增殖、增生和分化等生物過(guò)程中有重要生理作用,尤其是對(duì)幼齡哺乳動(dòng)物的小腸黏膜上皮細(xì)胞等快速增殖和分化起到重要作用[1]。大量研究及試驗(yàn)表明,口服精胺具有促進(jìn)幼齡仔豬腸道發(fā)育的作用,在養(yǎng)豬生產(chǎn)中具有巨大的應(yīng)用潛能[2-8]。然而,精胺促進(jìn)幼齡仔豬腸道發(fā)育的機(jī)制尚不明確。本試驗(yàn)設(shè)計(jì)皮質(zhì)醇抑制模型,初步探索精胺促進(jìn)哺乳仔豬腸道發(fā)育和成熟的機(jī)理。
1 材料與方法
1.1試驗(yàn)動(dòng)物
試驗(yàn)選取6頭“長(zhǎng)白×大白”妊娠母豬所產(chǎn)的6窩哺乳仔豬進(jìn)行試驗(yàn)。仔豬出生后6 h,每頭母豬窩產(chǎn)仔數(shù)統(tǒng)一為10頭。0 d定義為第1頭仔豬出生日,仔豬0~10 d維持正常的哺乳。哺乳11 d的早晨7:00~7:30,每窩選取6頭,體重最相近、健康狀況良好的仔豬共24頭(初始體重3.58±0.05 kg)進(jìn)行試驗(yàn)。
1.2精胺與甲雙吡丙酮
精胺為Sigma公司產(chǎn)品,精胺由0.9%生理鹽水配制成濃度50 μmol·mL-1的溶液。甲雙吡丙酮用生理鹽水配制成濃度10 mg·mL-1的溶液。
1.3飼糧組成
母豬的哺乳日糧按NRC(1998)營(yíng)養(yǎng)推薦量配制玉米-豆粕型粉料,日糧組成和營(yíng)養(yǎng)水平見(jiàn)附表。
1.4飼養(yǎng)管理
哺乳母豬采用單欄飼喂管理,欄圈面積為1.5× 2.1 m2,采用乳頭式飲水器自由飲水,哺乳日糧不限飼,飼喂時(shí)間為每天8:00和17:00。產(chǎn)仔舍的溫度控制在22±2℃,仔豬保溫箱通過(guò)加熱燈維持溫度32±2℃,產(chǎn)仔舍保持24 h光照。專(zhuān)門(mén)飼養(yǎng)員管理母豬采食情況,母豬采食后,料槽剩料和拋灑在地面的飼料立即清掃干凈,以防止仔豬采食。同時(shí),哺乳全期所有仔豬不提供補(bǔ)料。在3 d的試驗(yàn)期中,試驗(yàn)仔豬和母豬健康狀況良好。
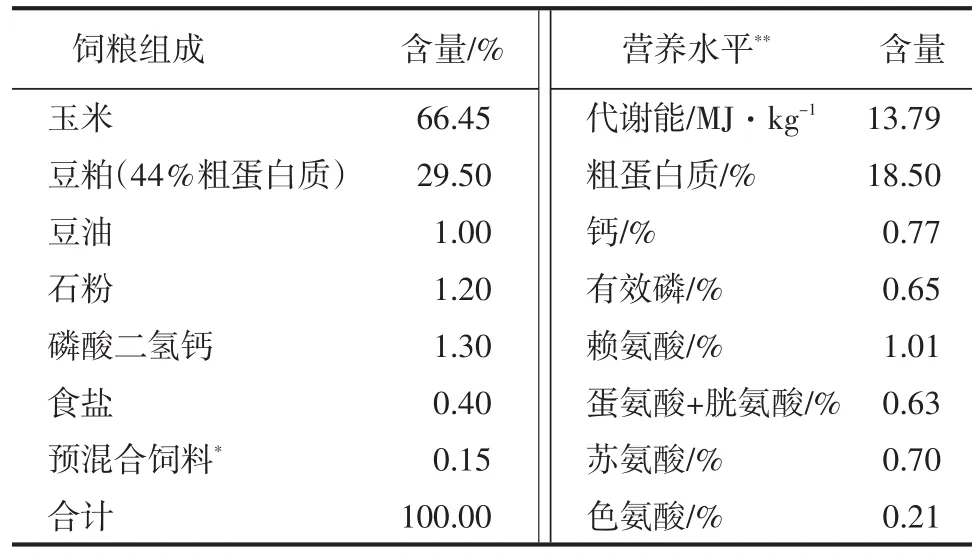
附表哺乳母豬日糧組成及營(yíng)養(yǎng)水平
1.5試驗(yàn)方法
試驗(yàn)采用隨機(jī)區(qū)組設(shè)計(jì),以窩別為區(qū)組,將同窩選取的4頭試驗(yàn)仔豬隨機(jī)分配到4個(gè)處理組。處理1組口服生理鹽水和注射生理鹽水;處理2組口服精胺0.4 mmol·kg-1BW·d-1和注射生理鹽水;處理3組口服生理鹽水和肌肉注射甲雙吡丙酮5 mg·kg-1BW·d-1;處理4組注射甲雙吡丙酮5 mg·kg-1BW·d-1和口服精胺0.4 mmol·kg-1BW·d-1。根據(jù)前期試驗(yàn)結(jié)果,試驗(yàn)選取口服精胺0.4 mmol·kg-1BW·d-1[2,4]。
參考Wu等的試驗(yàn)方法,仔豬皮質(zhì)醇抑制模型的建立方法具體如下,在11~13 d的早晨7:00,試驗(yàn)仔豬肌肉注射甲雙吡丙酮5 mg·kg-1BW·d-1,1 次·d-1,持續(xù)3 d[7]。13 d早晨7:00,試驗(yàn)操作結(jié)束后2 h,所有試驗(yàn)仔豬頸靜脈放血致死,采集靜脈血樣用于分析血漿皮質(zhì)醇濃度。血樣在4℃4 000 rpm離心15 min。采集仔豬空腸20 cm黏膜,分析麥芽糖酶和乳糖酶比活力。
1.6檢測(cè)方法
血漿皮質(zhì)醇使用放免法測(cè)定,在云南省動(dòng)物營(yíng)養(yǎng)與飼料重點(diǎn)實(shí)驗(yàn)室完成。二糖酶比活力的測(cè)定參考前期報(bào)道的方法[2-4]。
1.7統(tǒng)計(jì)分析
試驗(yàn)數(shù)據(jù)采用SPSS 11.0軟件進(jìn)行單因素方差分析,并進(jìn)行Student-Newman-Keuls多重比較。
2 試驗(yàn)結(jié)果
2.1血漿皮質(zhì)醇濃度
哺乳13 d血漿皮質(zhì)醇濃度見(jiàn)圖1。
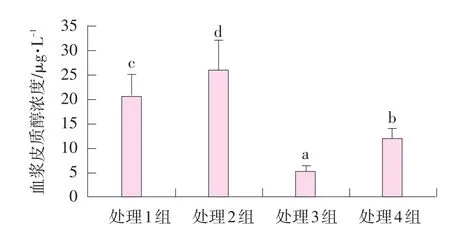
圖1 肌肉注射甲雙吡丙酮和口服精胺對(duì)哺乳仔豬血漿皮質(zhì)醇濃度的影響
由圖1可知,處理1~4組的皮質(zhì)醇濃度分別為20.5、25.8、5.1、12.1 μg·L-1。注射甲雙吡丙酮的處理組3和4仔豬血漿皮質(zhì)醇濃度極顯著低于處理1組(P<0.01);處理2組口服精胺仔豬血漿皮質(zhì)醇濃度顯著高于處理1組(P<0.05);處理4組血漿皮質(zhì)醇濃度極顯著高于處理3組(P<0.01)。
2.2空腸黏膜二糖酶比活力
空腸黏膜麥芽糖酶比活力見(jiàn)圖2。
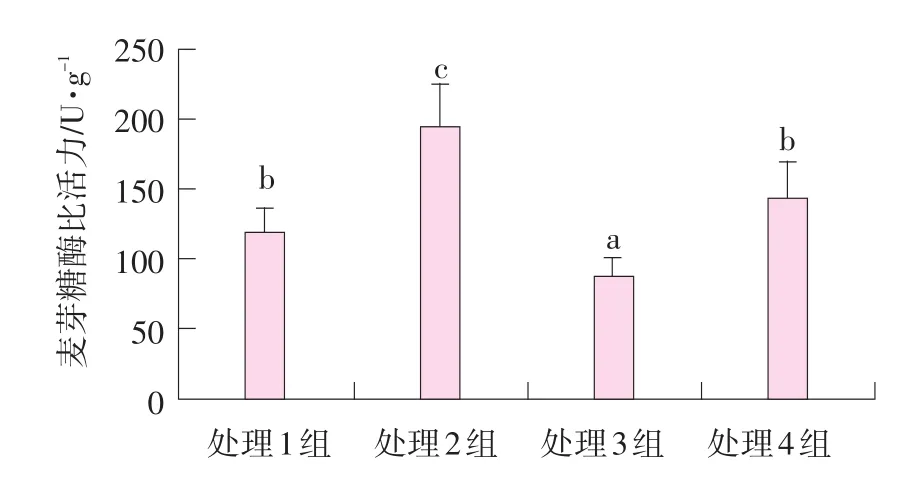
圖2 肌肉注射甲雙吡丙酮和口服精胺對(duì)哺乳仔豬空腸麥芽糖酶比活力的影響
由圖2可知,處理1~4組空腸黏膜麥芽糖酶比活力分別為118.5、195.3、88.3、144.2 U·g-1(腸黏膜蛋白)。處理2組仔豬空腸黏膜麥芽糖酶比活力顯著高于處理1和4組(P<0.05),極顯著高于處理3組(P<0.01);處理1和4組麥芽糖酶比活力顯著高于處理組3(P<0.05)。
空腸黏膜乳糖酶比活力見(jiàn)圖3。
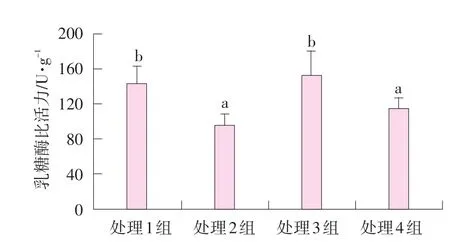
圖3 肌肉注射甲雙吡丙酮和口服精胺對(duì)哺乳仔豬空腸乳糖酶比活力的影響
由圖3可知,處理組1~4空腸黏膜乳糖酶比活力分別為143.7、95.8、153.2、115.2 U·g-1(腸黏膜蛋白)。處理1和3組仔豬空腸黏膜乳糖糖酶比活力差異不顯著(P>0.05),顯著高于處理2和4組(P<0.05),處理2和4組之間差異不顯著(P>0.05)。
3 討論
3.1皮質(zhì)醇抑制模型的建立
本試驗(yàn)結(jié)果表明,注射甲雙吡丙酮的處理組3 和4仔豬血漿皮質(zhì)醇濃度顯著低于處理1組(P<0.01),本試驗(yàn)?zāi)P团cWu等結(jié)果一致[7]。說(shuō)明本試驗(yàn)成功的建立了皮質(zhì)醇抑制模型,此模型適合用于研究口服精胺促進(jìn)哺乳仔豬腸道發(fā)育的機(jī)制。
處理2組仔豬血漿皮質(zhì)醇濃度顯著高于處理1組(P<0.01),說(shuō)明口服外源精胺激發(fā)了仔豬血漿皮質(zhì)醇分泌,這與Kaouass等用大鼠試驗(yàn)發(fā)現(xiàn)口服精胺提高血漿皮質(zhì)醇濃度的結(jié)果一致,表明精胺可能激發(fā)皮質(zhì)醇,間接促進(jìn)哺乳仔豬小腸的發(fā)育[9]。
同時(shí)注射甲雙吡丙酮和口服精胺的仔豬(處理4組)血漿皮質(zhì)醇濃度比處理組3仔豬血漿皮質(zhì)醇濃度高(P<0.01),但仍然顯著低于處理1組(P<0.05)。說(shuō)明在抑制皮質(zhì)醇模型下,口服精胺雖然顯著提高了仔豬血漿皮質(zhì)醇濃度,但血漿皮質(zhì)醇濃度不能恢復(fù)到正常哺乳仔豬的水平。
試驗(yàn)結(jié)果表明,口服外源精胺有促進(jìn)哺乳仔豬合成和分泌皮質(zhì)醇的作用。
3.2口服精胺促進(jìn)皮質(zhì)醇對(duì)腸道黏膜二糖酶的影響
大量研究表明,小腸黏膜二糖酶比活力是仔豬腸道發(fā)育的重要指標(biāo)之一[2,5]。血漿皮質(zhì)醇對(duì)幼齡大鼠、小鼠和仔豬小腸黏膜麥芽糖酶和蔗糖酶活性有重要的調(diào)控作用。處理3組注射皮質(zhì)醇抑制劑甲雙吡丙酮的仔豬空腸黏膜麥芽糖酶比活力顯著低于處理1組(P<0.05),說(shuō)明血漿皮質(zhì)醇的濃度降低會(huì)抑制仔豬空腸黏膜麥芽糖酶比活力。由此可見(jiàn),血液皮質(zhì)醇的正常生理濃度對(duì)幼齡哺乳動(dòng)物小腸正常發(fā)育是至關(guān)重要的。也證明本試驗(yàn)建立的皮質(zhì)醇抑制模型適合用來(lái)研究精胺刺激皮質(zhì)醇間接促進(jìn)腸道發(fā)育的作用機(jī)理。
處理4組仔豬同時(shí)口服精胺和注射甲雙吡丙酮,空腸黏膜麥芽糖酶比活力極顯著高于處理3組(P<0.01),與處理組1差異不顯著(P>0.05)。結(jié)果表明,在抑制血漿皮質(zhì)醇模型下,口服精胺使皮質(zhì)醇抑制仔豬的空腸黏膜麥芽糖酶比活力恢復(fù)到正常哺乳仔豬水平,這表明精胺作用空腸上皮細(xì)胞,提高麥芽糖酶比活力的直接作用機(jī)制。然而,處理4組空腸黏膜麥芽糖酶比活力與處理3組相比顯著提高(P<0.05),但仍未達(dá)到處理2組麥芽糖酶比活力水平。同樣口服精胺,處理4與2組相比,降低的空腸黏膜麥芽糖酶比活力是因?yàn)樵谄べ|(zhì)醇抑制模型下降低了血漿皮質(zhì)醇濃度,使口服精胺不能完全逆轉(zhuǎn)低水平血漿皮質(zhì)醇導(dǎo)致的麥芽糖酶比活力降低。由此可見(jiàn),從黏膜麥芽糖酶比活力數(shù)據(jù)說(shuō)明,精胺對(duì)小腸發(fā)育和成熟的促進(jìn)效果是通過(guò)激發(fā)血漿皮質(zhì)醇分泌實(shí)現(xiàn)的。
此外,圖3表明,在抑制血漿皮質(zhì)醇模型下,處理1組(正常皮質(zhì)醇濃度)和處理3組(抑制皮質(zhì)醇濃度)空腸乳糖酶比活力差異不顯著(P>0.05)。這一結(jié)果表明,血漿皮質(zhì)醇對(duì)乳糖酶無(wú)調(diào)控作用。這與Martin等、Arsenault等、Chapple等的試驗(yàn)結(jié)果一致,發(fā)現(xiàn)血漿皮質(zhì)醇濃度不影響乳糖酶比活力[10-12]。Morisset和Henning認(rèn)為,無(wú)論是豬還是大鼠,黏膜乳糖酶酶蛋白合成和乳糖酶比活力表達(dá)的調(diào)控機(jī)制與麥芽糖酶不同,血漿皮質(zhì)醇只能影響麥芽糖酶和蔗糖酶比活力,對(duì)黏膜乳糖酶比活力無(wú)顯著影響(P<0.05)[13-14]。小鼠小腸細(xì)胞體外培養(yǎng)試驗(yàn)也證實(shí)了這一點(diǎn)[11]。
4 結(jié)論
本試驗(yàn)通過(guò)皮質(zhì)醇抑制模型證明口服外源精胺刺激了血漿皮質(zhì)醇分泌,促進(jìn)了幼齡仔豬腸道發(fā)育,作用體現(xiàn)在小腸麥芽糖酶活性的提高上。
[1]Sabater-Molina M,Larqué E,Torrella F,et al.Effects of dietary polyamines at physiologic doses in early-weaned piglets[J].Nutri?tion,2009,25(9):940-946.
[2]姜自琴,廖國(guó)周,樊月圓,等.精胺對(duì)哺乳仔豬小腸黏膜二糖酶比活力的影響[J].飼料博覽,2014(9):1-5.
[3]程志斌,廖啟順,蘇子峰.豬乳中多胺濃度的研究進(jìn)展[J].飼料博覽,2010(5):8-11.
[4]程志斌,姜自琴,廖國(guó)周,等.口服精胺對(duì)哺乳仔豬小腸組織發(fā)育的影響[J].飼料工業(yè),2014,35(18):34-37.
[5]何余湧,鄒偉,劉曉蘭,等.妊娠后期母豬和仔豬補(bǔ)飼外源精胺對(duì)初生和28日齡仔豬腸道形態(tài)結(jié)構(gòu)及二糖酶活性的影響[J].動(dòng)物營(yíng)養(yǎng)學(xué)報(bào),2012,24(8):1 429-1 437.
[6]何余湧,鄒偉,王仁華,等.飼料中添加精胺對(duì)哺乳仔豬血液生化指標(biāo)及胃腸道發(fā)育的影響研究[J].飼料工業(yè),2012,33(9): 14-16.
[7]Wu G,Flynn N E,Knabe D A.Enhanced intestinal synthesis of polyamines from proline in cortisol-treated piglets[J].American Journal of Physiology-Endocrinology and Metabolism,2000,42 (2):395-402.
[8]王猛侯永清丁斌鷹,等.精胺對(duì)斷奶仔豬腸組織形態(tài)的影響[J].動(dòng)物營(yíng)養(yǎng)學(xué)報(bào),2007,19(4):366-371.
[9]Kaouass M,Sulon J,Deloyer P,et al.Spermine-induced preco?cious intestinal maturation in suckling rats:possible involvement of glucocorticoids[J].Journal of Endocrinology,1994,141(2):279-283.
[10]Martin G R,Henning S J.Relative importance of corticosterone and thyroxine in the postnatal development of sucrase and malt?ase in rat small intestine[J].Endocrinology,1982,111(3):912-918.
[11]Arsenault P,Ménard D.Comparative study of the effect of hydro?cortisone and thyroxine on suckling mouse small intestine in or?gan culture[J].Comparative Biochemistry and Physiology Part A: Physiology,1984,77(4):721-725.
[12]Chapple R P,Cuaron J A,Easter R A.Effect of glucocorticoids and limiting nursing on the carbohydrate digestive capacity and growth rate of piglets[J].Journal of Animal Science,1989,67 (11):2 956-2 973.
[13]Morisset J.Regulation of growth and development of the gastroin?testinal tract[J].Journal of Dairy Science,1993,76(7):2 080-2 093.
[14]Henning S J.Postnatal development:coordination of feeding,di?gestion,and metabolism[J].American Journal of Physiology-Gas?trointestinal and Liver Physiology,1981,241(3):199-214.
Primary Studies of Orally Administered Spermine on the Intestinal Development in Suckling Piglets
LIAO Guozhou1,2,FAN Yueyuan1,WANG Guiying2,SU Zifeng3,WANG Xuefeng2, BI Baoliang1,PAN Hongbin1,4,ZHAO Ping1,HUANG Limei1,CHENG Zhibin1,4*
(1.Yunnan Agricultural University,Kunming 650201,China; 2.Livestock Product Processing Engineering and Technology Research Center of Yunnan Province,Kunming 650201,China; 3.Department of Agriculture and Biological Science of Dali College,Dali 671003,Yunnan China; 4.Key Laboratory of Animal Nutrition and Feed Science of Yunnan Province,Kunming 650201,China)
The plasma cortisol inhibition model was established to primary studies of orally administered spermine on the intestinal development in suckling piglets.For three consecutive days,24 suckling piglets at 11 days of age were randomly assigned within litter to four groups with six animals each group and-1BW·d-1spermine and intramuscular injection of physiological saline), group 3(orally administered physiological saline and intramuscular injection of 5 mg·kg-1BW·d-1metyrapone),or group 4(orally administered 0.4 mmol·kg-1BW·d-1spermine and-1BW·d-1metyrapone).The data of plasma cortisol concentration showed that the cortisol inhibition model was suc?cessful in this study.The jejunum maltase specific activities of pigs were 118.5,195.3,88.3,144.2 U·g-1protein. The maltase specific activities of group 1 and 4 were identical,and were higher than that of group 3(P<0.01),and were lower than that of group 2(P<0.05).Collectively,the results showed that orally administered spermine induced young piglet intestinal maturation by stimulating the release of cortisol in plasma.
the intramuscular injection of 5 mg·kg
following treatments,group 1(orally administered physiological saline and intramuscular injection of physiological saline), group 2(orally administered 0.4 mmol·kg
spermine;suckling piglets;intestinal development;primary studies
S828;S852.21
A
1001-0084(2015)12-0001-04
2015-10-23
國(guó)家自然科學(xué)基金(31201830);云南省應(yīng)用基礎(chǔ)研究計(jì)劃項(xiàng)目(2011FB054)
廖國(guó)周(1978-),男,廣東江門(mén)人,博士,副教授,研究方向?yàn)閯?dòng)物營(yíng)養(yǎng)與畜產(chǎn)品科學(xué)。
副教授,E-mail:179783349@163.com。

