樹脂對普洱茶多糖的純化與分離
楊新河,黃建安,劉仲華,*,毛清黎
(1.湖北工程學院生命科學技術學院,湖北 孝感 432000;2.國家植物功能成分利用工程技術研究中心,湖南 長沙 410128)
樹脂對普洱茶多糖的純化與分離
楊新河1,2,黃建安2,劉仲華1,2,*,毛清黎1,2
(1.湖北工程學院生命科學技術學院,湖北 孝感 432000;2.國家植物功能成分利用工程技術研究中心,湖南 長沙 410128)
研究10 種樹脂對普洱茶多糖脫色和蛋白質去除的效果及DEAE-52纖維素離子交換樹脂對普洱茶多糖的分離效果。結果表明,D101樹脂適合于對普洱茶多糖同時脫色和蛋白質去除,當普洱茶多糖溶液體積為50 mL時,在pH 4、溫度50 ℃、料液質量濃度3.8 mg/mL、樹脂用量11 mL的條件下,普洱茶 多糖的脫色率為82.33%、蛋白質去除率為70.89%。DEAE-52纖維素離子交換樹脂分離經D101樹脂處理的普 洱茶多糖能得到6 個不同多糖級分。
樹脂;普洱茶;多糖;純化;分離
普洱茶是以云南省一定區域內的云南大葉種曬青毛茶為原料,經過后發酵加工成的散茶和緊壓茶。研究表明,普洱茶具有抗氧化、降血脂、降血糖、抗突變、防癌等功能[1-7],而茶多糖是其藥理作用的主要成分之一[8-13]。目前,普洱茶多糖的研究僅停留在粗茶多糖層面,幾乎不能確定其結構特征和評價其確切功效,因而開展普洱茶多糖的分離對深入進行普洱茶多糖化學結構和生物活性研究具有極其重要的意義。
目前,茶多糖的分離研究涉及到脫色、蛋白質去除和分級等方面。常用的多糖脫色方法有活性炭法、過氧化氫法和十六烷基三甲基溴化銨-正己醇-異辛烷法;蛋白質去除技術有鹽析法、等電點沉淀法、有機溶劑沉淀法和酶解法[14];常見的分級方法有沉淀法、超濾法和柱層析法[15-18]。其中脫色和蛋白質去除的上述方法均存在一些不足,如引起多糖的降解與結構破壞、有機溶劑殘留及效率低等,并且脫色和蛋白質去除分為兩步進行時工序繁鎖、多糖損失嚴重。而大孔吸附樹脂是一類有機高聚物吸附劑,具有良好的大孔網狀結構和較大的比表面積,主要應用于環保、醫藥工業、化學工業、食品工業等多個領域。其中,大孔樹脂已用于多種植物多糖脫色[19-23],但大孔樹脂同時脫除粗多糖中的色素和蛋白質的研究很少報道。本研 究探討大孔樹脂對普洱茶多糖脫色和蛋白質去除的效果,并采用兼有脫色功能的DEAE-52纖維素離子交換樹脂對普洱茶多糖進行分級,旨在為研究普洱茶多糖的結構與生物活性奠定基礎,也為研究其他富含多酚類化合物的植物原料經微生物發酵后提取的多糖脫色及蛋白質去除提供參考。
1 材料與方法
1.1 材料與試劑
龍潤普洱茶(2007年) 云南龍潤茶業集團;AB-8、S-8、NKA-9、D201×4及001×7樹脂 南開大學化工廠;聚酰胺 中國醫藥集團上海化學試劑公司;LSA-7樹脂 西安藍曉科技有限公司;D101樹脂 天津農藥廠;XAD-7HP和HP-20樹脂 日本三菱樹脂株式會社;纖維素DEAE-52陰離子交換樹脂 英國Whatman公司;D32透析袋 美國Bromma公司。其他試劑均為分析純。
1.2 儀器與設備
PHS-3TC型酸度計 上海天達儀器有限公司;SKY-200B型恒溫培養震蕩器 上海蘇坤實業有限公司;Rotavapor R-200型旋轉蒸發器 瑞士Büchi公司;SHB-Ⅲ型循環水真空泵 鄭州長城科工貿有限公司;SHIMADZU UV-2550型紫外-可見光分光光度計 日本島津公司;SMY-2000ST測色色差計 北京盛名揚科技開發有限責任公司;LD4-2A型低速離心機 北京醫用離心機廠;DHL-A電腦恒流泵、SZ-100自動收集器 上海滬西儀器廠;玻璃層析柱 長沙匯虹玻璃儀器有限公司。
1.3 方法
1.3.1 樹脂的預處理
工藝流程:陰(陽)離子交換樹脂→95%乙醇浸泡12 h→蒸餾水洗至流出液在試管中用水稀釋不渾濁→4% NaOH溶液(5% HCl溶液)浸泡4 h→蒸餾水洗至中性→5% HCl溶液(4% NaOH溶液)浸泡4 h→蒸餾水洗至中性。
吸附樹脂的預處理與陽離子交換樹脂相同。
1.3.2 樣品制備
稱取一定質量經石油醚脫脂的普洱茶干燥粉碎樣,放置浸提瓶中,加入25倍質量的蒸餾水,在90 ℃水浴鍋中浸提70 min,過濾,濾液濃縮至一定體積,加入95%乙醇使最終醇體積分數為80%,4 ℃冰箱中靜置12 h后以4 000 r/min離心10 min,取沉淀加適當水溶解,真空濃縮至無醇味,備用。
1.3.3 靜態吸附操作方法
量取5 mL經預處理的離子交換樹脂或吸附樹脂于250 mL三角瓶中,分別加入50 mL相同的普洱茶多糖溶液,30℃恒溫振搖24 h,振搖頻率120 r/min。振搖結束后,用濾紙過濾的方法將樹脂和茶多糖溶液分離,濾液定容至100 mL并調至與原多糖溶液相同的pH值,然后測定溶液與蒸餾水的總色差ΔE與蛋白質質量濃度,計算脫色率與蛋白質去除率。
1.3.4 動態吸附操作方法
取3 根玻璃層析柱,分別裝入經預處理的D101、HP-20及AB-8樹脂70 mL,按照2 BV/h流速各加入與靜態吸附相同的茶多糖溶液280 mL,按照0.5 BV/管收集并測定每管溶液與蒸餾水的總色差ΔE*,按照式(1)計算動態吸附率。上樣完畢,關閉柱子下端活塞0.5 h,接著用2 BV蒸餾水以2 BV/h的流速洗脫,合并水洗脫液與上樣收集的流出液,測定溶液與蒸餾水的總色差ΔE與蛋白質質量濃度,計算脫色率與蛋白質去除率。

1.3.5 D101樹脂靜態吸附色素的曲線
量取5 mL經預處理的D101樹脂于250 mL三角瓶中,加入50 mL普洱茶多糖溶液,恒溫振搖,振搖轉速120 r/min。每小時取1 mL溶液用于測定與蒸餾水的總色差ΔE,同時補充1 mL原液于三角瓶中,計算樹脂吸附不同時間的脫色率。
1.3.6 D101樹脂靜態吸附單因素試驗
1.3.6.1 溫度對D101樹脂脫色和蛋白質去除的影響量取5 份經預處理的樹脂5 mL,各加入相同質量濃度的茶多糖溶液50 mL,溫度分別設為20、30、40、50、60 ℃,恒溫振搖5 h,轉速120 r/min。振搖結束后,依照
1.3.3 節方法操作。
1.3.6.2 樹脂用量對D101樹脂脫色和蛋白質去除的影響
分別量取經預處理的樹脂3、5、7、9、11 mL,加入相同質量濃度的多糖溶液50 mL,50℃振搖5 h,轉速120 r/min。振搖結束后,依照1.3.3節方法操作。
1.3.6.3 pH值對D101樹脂脫色和蛋白質去除的影響
量取5 份經預處理的樹脂7 mL,分別加入預先調節好pH值為4.0、4.6、5.2、5.8、6.4的相同質量濃度的多糖溶液50 mL,50 ℃振搖5 h,轉速120 r/min。振搖結束后,依照1.3.3節方法操作。
1.3.6.4 料液質量濃度對D101樹脂脫色和蛋白質去除的影響
量取5 份經預處理的樹脂7 mL,分別加入質量濃度為0.24、0.48、0.95、1.90、3.80 mg/mL多糖及pH 5.2的溶液50 mL,50℃振搖5 h,轉速120 r/min。振搖結束后,依照1.3.3節方法操作。
1.3.7 D101樹脂靜態吸附正交試驗
根據單因素試驗結果,確定溫度、樹脂用量、pH值及料液質量濃度四因素的水平見表1,進行正交試驗全面考察4 個因素對D101樹脂脫除普洱茶多糖溶液中色素和蛋白質的影響,優化參數。

表 1 D101樹脂靜態吸附因素水平表Table 1 Variables and levels used in orthogonal array design for static adsorption of D101 resin
1.3.8 分析及計算方法
1.3.8.1 蛋白質測定及蛋白質去除率計算
蛋白質測定采用考馬斯亮藍G-250法[24],以牛血清白蛋白為標準品,線性回歸方程為ρ=231.35A—11.396,相關系數r=0.996 4,其中,ρ為以牛血清白蛋白計的蛋白質質量濃度/(μg/mL);A為吸光度。

式中:ρ前、ρ后分別為脫色前和脫色后蛋白質質量濃度/(μg/mL)。
1.3.8.2 色差值測定及脫色率計算[25]
調整待測茶多糖溶液pH值,用蒸餾水稀釋4倍,測定與蒸餾水的總色差ΔE。
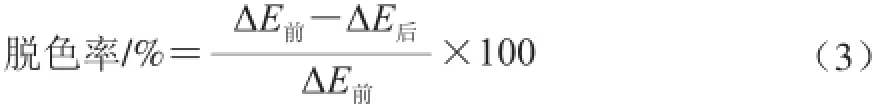
式中:ΔE前、ΔE后分別為脫色前、后溶液與蒸餾水的總色差值。
1.3.9 DEAE-52柱層析分離普洱茶茶多糖
準確稱取經D101樹脂脫色和脫蛋白質的多糖樣品2g,溶于20mL蒸餾水中,上DEAE-52柱(有效柱體積為120 mL),依次用1BV蒸餾水及0.1、0.2、0.3、0.5、1.0 mol/L NaCl溶液洗脫,控制流速為0.1 BV/h,按照5 mL/管收集并測定每管在280 nm波長處的吸光度,然后將樣品溶液按1∶5稀釋后用硫酸-苯酚法測定多糖的含量。以苯酚-硫酸法檢測280 nm波長處多糖的吸光度為縱坐標,以試管數目為橫坐標作DEAE-52色譜柱洗脫曲線圖。分別合并各主峰溶液,減壓濃縮至一定體積后用流水透析48 h,然后減壓濃縮透析袋內的多糖溶液,冷凍干燥得到多糖級分。
2 結果與分析
2.1 樹脂的初步篩選
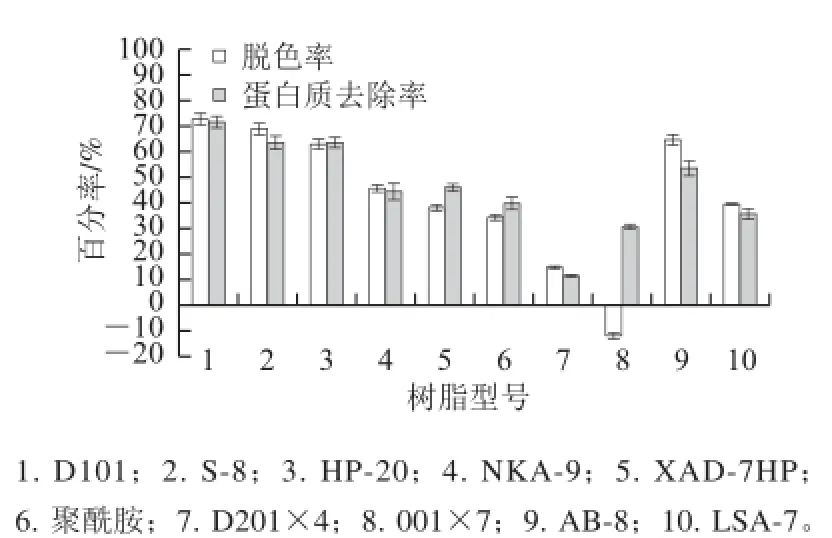
圖 1 樹脂靜態吸附對茶多糖脫色和蛋白質去除的效果Fig.1 Effect of static adsorption by different types of resins on decolorization and deproteinization
由圖1可知,10 種樹脂對普洱茶多糖中色素和蛋白質的吸附各不相同,其中D101、S-8、HP-20及AB-8樹脂對普洱茶多糖中色素和蛋白質的吸附能力較強,均能去除普洱茶多糖中60%以上的色素和50%以上的蛋白質,而其余6種樹脂的色素脫除率和蛋白質去除率均低于50%。這10種樹脂對普洱茶多糖中色素和蛋白質去除能力的差異受到樹脂的極性、比表面積、孔體積和平均孔徑、以及普洱茶多糖、蛋白質和色素的相對分子質量與極性等多重因素的綜合影響。圖1還表明,001×7陽離子交換樹脂不但沒有脫色效果,反而使普洱茶多糖的顏色加深,可能的原因是001×7陽離子交換樹脂與普洱茶多糖溶液中的物質交換基團后引起pH值的變化,促使更多的多酚氧化聚合成顏色較深的物質。
吸附后的樹脂用80%酒精解吸4 h,經測定樹脂解吸前、后吸附固形物質量后計算發現S-8吸附固形物的解吸率遠低于D101、HP-20和AB-8樹脂的解吸率,僅為 11.50%。由于S-8為極性樹脂,比表面積僅為100~200 m2/g, D101和HP-20樹脂均為非極性樹脂,比表面積分別為500~600 m2/g和600 m2/g,AB-8為弱極性樹脂,比表面積為480~520 m2/g,因而初步推測普洱茶多糖中色素和蛋白質的極性很強,能牢固地吸附在S-8樹脂上而不易被洗脫釋放出來,進而表明S-8樹脂再生十分困難,不宜用于普洱茶多糖的脫色和蛋白質去除。因此,選擇D101、AB-8及HP-20作進一步篩選。
2.2 3 種樹脂對茶多糖溶液中色素的動態吸附率

圖 2 3 種樹脂動態吸附茶多糖溶液中色素的效果Fig.2 Dynamic adsorption of pigments present in tea polysaccharide by three types of resins
由圖2可知,D101、AB-8及HP-20樹脂動態吸附普洱茶多糖溶液中的色素均隨上樣液體積的增加而呈現吸附能力下降的趨勢。其中第2管與第1管相比,吸附色素的能力下降十分明顯,D101、AB-8和HP-20分別下降了23.98%、28.38%和 24.24%,并且第2管的流出液中就含有較高的色素;從第3管開始,3種樹脂對色素的吸附率都低于70%;第6管時樹脂對色素的吸附率均不到60%。由此表明,樹脂動態吸附普洱茶多糖溶液中色素的效果欠佳。
由圖3與圖1可知,D101、AB-8和HP-20處理4 倍樹脂體積的普洱茶多糖溶液時脫色率和蛋白質去除率低且效果均不及靜態吸附法處理10 倍樹脂體積的普洱茶多糖溶液。依據實驗數據推理,3 種樹脂采用動態吸附法分別處理10 倍樹脂體積料液,則對多糖溶液脫色和蛋白質去除效果將遠不及靜態吸附法。綜合考慮,選擇D101樹脂采用靜態吸附法來脫除普洱茶多糖溶液中的色素與蛋白質。

圖 3 3 種樹脂對茶多糖溶液動態脫色和蛋白質去除的效果Fig.3 Effects of three types of resins on dynamic decolorization and deproteinization of tea polysaccharides
2.3 D101樹脂靜態吸附色素的曲線

圖 4 D101樹脂靜態吸附色素的曲線Fig.4 Static adsorption curve of D101 resin for pigments
由圖4可知,D101樹脂對普洱茶多糖中色素的脫除率隨時間延長而增加。當脫色時間在1~3 h內,脫色效果隨時間的延長而明顯增加,但從4 h延長至7 h,脫色率略有增加,意味著樹脂吸附色素在4~7 h接近飽和。這可能與吸附過程中色素的濃度降低和樹脂的有效吸附面積減少有關。考慮到脫色的時間效率及吸附時間過長會使多糖的保留率偏低,因此,靜態吸附色素的時間以5 h為宜。
2.4 D101樹脂靜態吸附單因素試驗結果
2.4.1 溫度對D101樹脂脫色與蛋白質去除的影響

圖 5 溫度對D101樹脂脫色和蛋白質去除的影響Fig.5 Effect of temperature on decolorization and deproteinization by D101 resin
據圖5,溫度對普洱茶多糖溶液的脫色和蛋白質去除有一定程度的影響。溫度在20~50 ℃范圍內,D101樹脂對茶多糖溶液的脫色率隨溫度的升高而增加,蛋白質去除率增加明顯;溫度為50 ℃與60 ℃相比,后者脫色率略高于前者,但蛋白質去除率明顯下降。可能是當溫度低于50 ℃時隨溫度升高樹脂功能基團活性增強,溶液的黏度下降,色素和蛋白質分子的擴散速率加快,從而樹脂吸附3 種分子的速率加快;當溫度超過50 ℃時,蛋白質同色素的結合力減弱,色素競爭性被樹脂吸附的能力強于蛋白質。綜合考慮脫色率、蛋白質去除率和操作溫度的控制,D101樹脂宜在30~50 ℃范圍使用。
2.4.2 樹脂用量對D101樹脂脫色與蛋白質去除的影響
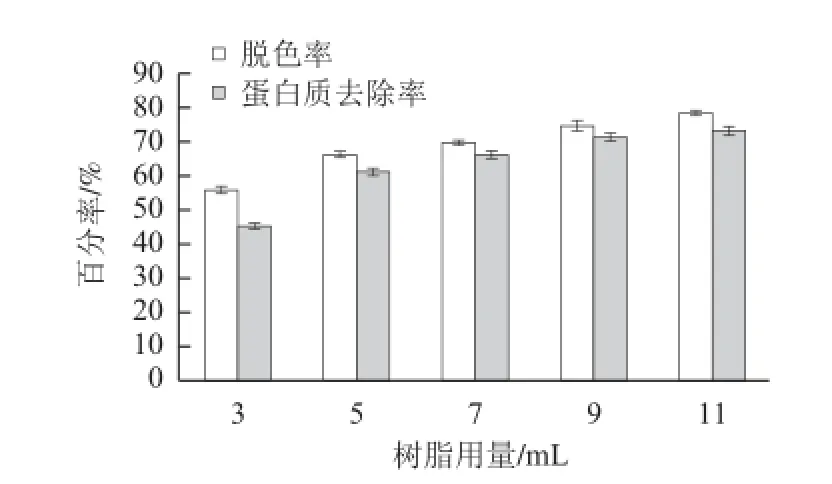
圖 6 樹脂用量對D101樹脂脫色和蛋白質去除的影響Fig.6 Effects of resin volume on decolorization and deproteinization by D101 resin
據圖6,樹脂用量在3~11 mL范圍內時,D101樹脂對茶多糖溶液的脫色率及蛋白質去除率隨樹脂用量的增加而提高,因為樹脂用量增加相當于單位體積溶液中用于吸附物質的樹脂總表面積增大,樹脂功能基團增多,提高了對色素和蛋白質的吸附量。當樹脂用量超過11 mL時,隨樹脂用量的繼續增加,脫色率和蛋白質去除率進一步增加的力度小,但會使多糖的保留率降低。因此,樹脂用量以不超過11 mL為宜。
2.4.3 pH值對D101樹脂脫色與蛋白質去除的影響

圖 7 pH值對D101樹脂脫色和蛋白質去除的影響Fig.7 Effect of pH on decolorization and deproteinization by D101 resin
據圖7,pH值在4.0~6.4范圍內時,D101樹脂對普洱茶多糖溶液的脫色率與蛋白質去除率隨pH值的降低而明顯升高,因為pH值的降低可能有更多的蛋白質處于等電點而沉淀析出,同時會使離子形式的色素更多地轉變為以分子形式存在而有利于樹脂的吸附。從脫色率及蛋白質去除率的綜合效果來看,pH值適宜在4.0~5.2范圍內。
2.4.4 料液質量濃度對D101樹脂脫色與蛋白質去除的影響

圖 8 料液質量濃度對D101樹脂脫色和蛋白質去除的影響Fig.8 Effect of sample concentration on decolorization and deproteinization by D101 resin
據圖8,多糖質量濃度在0.24~1.90 mg/mL范圍內,D101樹脂對普洱茶多糖溶液的脫色率和蛋白質去除率隨著質量濃度的增加而提高。而料液質量濃度1.90 mg/mL與3.80 mg/mL 相比較,前者脫色率略有降低,但蛋白質去除率增加了6.55%。從脫色率、蛋白質去除率、后續濃縮工序的能耗及效率等方面綜合評價,料液質量濃度宜控制在0.95~3.80 mg/mL范圍內。
2.5 正交試驗設計優化脫色與蛋白質去除的工藝條件
在單因素試驗基礎上,采用四因素三水平正交試驗法優化普洱茶多糖提取液的最佳脫色和蛋白質去除條件,試驗結果見表2。

表 2 普洱茶多糖溶液脫色與脫蛋白質的正交試驗設計與結果Table 2 Results of orthogonal array experiments for the optimization of resin adsorption conditions
由表2極差分析可看出,pH值對于脫色率的影響較大,樹脂用量次之,料液質量濃度對脫色率影響最小。溫度對于蛋白質去除率的影響較大,樹脂用量次之,pH值對蛋白質去除率影響最小。從數據分析確定的脫色和蛋白質去除條件相同,即溫度50 ℃、樹脂用量11 mL、pH 4.0、料液質量濃度3.8 mg/mL。
在此條件下進行進一步實驗的結果表明,普洱茶多糖溶液的脫色率可達到82.33%,蛋白質去除率為70.89%,優于正交組合表中各處理的結果,證明優化的條件是合理的。
2.6 纖維素DEAE-52陰離子交換樹脂分離普洱茶茶多糖

圖 9 普洱茶茶多糖在DEAE-52色譜柱上的洗脫曲線Fig.9 Elution curve of Pu-Erh tea polysaccharide on DEAE-52 column
采用DEAE-52柱層析對經D101樹脂脫色和脫蛋白質的茶多糖進行分離,依次經H2O和0.1、0.2、0.3、0.5、1.0 mol/L NaCl溶液梯度洗脫。從圖9可知,檢測多糖時,除了0.1 mol/L NaCl溶液洗脫收集的溶液呈現一個大峰和一個小峰有交叉之外(二峰視為單峰收集),其他濃度的洗脫劑均可獲得一單峰。第1個多糖峰對應的溶液在280 nm波長處有明顯的吸收峰,意味著該溶液可能含有糖與蛋白質的結合物,第2、3個多糖峰對應的溶液在280 nm波長處有一個很小的吸收峰,余下各多糖峰對應的溶液在280 nm波長處未見吸收峰。合并各主峰對應的收集液,減壓濃縮,透析48 h后袋內溶液減壓濃縮,冷凍干燥得到多糖級分,按照收集的先后順序依次命名為TPSⅠ、TPSⅡ、TPSⅢ、TPSⅣ、TPSⅤ和TPSⅥ。
3 討 論
普洱茶屬于后發酵茶,多酚氧化程度高,產生的氧化產物茶黃素、茶紅素、茶褐素為普洱茶色素。普洱茶中茶色素具有含量高,極性很大且存在部分與多糖及蛋白質結合的特點,完全不同于絕大多數植物多糖提取液中的色素,色素的脫除十分困難。通過預實驗發現活性炭對普洱茶多糖溶液幾乎沒有脫色效果;過氧化氫的脫色率約為45.2%,但考慮到過氧化氫有可能破壞多糖結構及引起普洱茶中簡單多酚氧化聚合成有顏色的物質而未作深入研究;傳統的Sevag法5 次蛋白質去除率僅為36.83%;溶液中終質量分數1%胰蛋白酶與Sevag法5 次相結合時蛋白質去除率為49%。因此,常用的多糖脫色和蛋白質去除方法均不適合于普洱茶多糖溶液的直接脫色與蛋白質去除。
本研究采用樹脂進行普洱茶多糖同步脫色和蛋白質去除,與常規的多糖脫蛋白、脫色方法相比,具有工序少、操作簡單、溶劑安全、處理量大、周期短等優點。夏瑋等[23]用高效凝膠過濾色譜測定了樹脂對多糖脫色前后的色譜圖,結果色譜圖形狀大致相同,只是不同部分峰高有一定程度的降低,樹脂對不同分子質量范圍的多糖都有一定吸附作用,不會專一性吸附凝膠過濾色譜峰中單峰對應的多糖,也不會破壞多糖的結構。因此,采用樹脂進行普洱茶多糖同步脫色和蛋白質去除不僅為后續研究普洱茶多糖的分離純化、結構與生物活性奠定了堅實的基礎,也為研究其他植物原料經微生物發酵后提取的多糖脫色和蛋白質去除提供了重要的技術參考。
此外,用纖維素DEAE-52樹脂分離經D101樹脂脫色和蛋白質去除的普洱茶多糖,得到6 個多糖級分,經透析、濃縮和冷凍干燥后根據顏色深淺和多糖含量高低,可優先選擇TPSⅠ和TPSⅡ用于進一步分離純化、結構表征與功效研究。本研究還表明D101樹脂對普洱茶多糖溶液中色素的吸附率高達82.33%,故可以對吸附的色素進行洗脫收集及進一步的分離純化、結構與藥理活性研究,也許將有助于深化茶葉科學的相關理論和深度開發普洱茶色素。
4 結 論
本實驗篩選出D101樹脂適合于對普洱茶多糖同時脫色和蛋白質去除,并優化了其對普洱茶多糖溶液脫色和蛋白質去除的條件:當普洱茶多糖溶液體積為50mL時,溫度50 ℃、樹脂用量11 mL、pH 4.0、料液質量濃度3.8 mg/mL。在此條件下普洱茶多糖溶液的脫色率高達82.33%,蛋白質去除率為70.89%。用纖維素DEAE-52陰離子樹脂分離經D101樹脂脫色和蛋白質去除的普洱茶多糖能得到6 個多糖級分。
[1] QIAN Z M, GUAN J, YANG F Q, et al. Identification and quantifi cation of free radical scavengers in Pu-erh tea by HPLC-DADMS coupled online with 2,2′-azinobis(3-ethylbenzthiazolinesulfonic acid) diammonium salt assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11187-11191.
[2] LU C H, HWANG L S. Polyphenol contents of Pu-Erh teas and their abilities to inhibit cholesterol biosynthesis in HepG2 cell line[J]. Food Chemistry, 2008, 111(1): 67-71.
[3] WU S C, YEN G C, WANG B S, et al. Antimutagenic and antimicrobial activities of Pu-Erh tea[J]. LWT-Food Science and Technology, 2007, 40(3): 506-502.
[4] 劉通訊, 譚夢珠. 不同儲存時間對普洱茶有機溶劑萃取物清除自由基活性的影響[J]. 現代食品科技, 2013, 29(10): 2372-2377.
[5] 揭國良, 何普明, 張龍澤, 等. 普洱茶提取物對高糖作用下人胚肺成纖維細胞的保護作用[J]. 食品科學, 2008, 29(4): 366-369.
[6] 郭剛軍, 彭春秀, 何享, 等. 云南普洱茶不同溶劑提取物抗氧化活性研究[J]. 熱帶作物學報, 2013, 34(1): 151-156.
[7] 周斌星, 孔令波, 李發志. 普洱茶(熟茶)不同發酵階段在制品降血脂效果的比較研究[J]. 中國農學通報, 2010, 26(18): 231-236.
[8] 方祥, 李斌, 陳棟, 等. 普洱茶功效成分及其品質形成機理研究進展[J].食品工業科技, 2008, 29(6): 313-316.
[9] 蔣成硯, 謝昆, 薛春麗. 普洱茶多糖增強免疫功能研究[J]. 江蘇農業科學, 2012, 40(1): 257-258.
[10] 周斌星, 孔令波, 陳軍賢. 普洱茶多糖的提取及降血糖的研究[J]. 中國農學通報, 2009, 25(15): 55-59.
[11] 陳朝銀, 葉燕, 熊向峰, 等. 普洱茶多糖的提取工藝及抗氧化活性研究[J]. 食品研究與開發, 2008, 29(4): 13-15.
[12] 龔加順, 陳文品, 周紅杰, 等. 云南普洱茶特征成分的功能與毒理學評價[J]. 茶葉科學, 2007, 27(3): 201-210.
[13] 吳文華, 吳文俊. 普洱茶多糖降血脂功能的量效關系[J]. 福建茶葉, 2006(2): 42-43.
[14] 李鳳玲, 何金環. 植物多糖的結構與分離純化技術研究進展[J]. 中國農學通報, 2008, 24(10): 276-279.
[15] 陳萍, 朱麗云, 金暉, 等. 茶多糖的分離制備及其對ALX模型小鼠的降糖作用研究[J]. 食品科技, 2013, 38(5): 194-196.
[16] 寇小紅, 江和源, 崔宏春, 等. 膜過濾綠茶多糖的系統分級純化及免疫活性分析[J]. 茶葉科學, 2008, 28(3): 172-180.
[17] 謝亮亮, 蔡為榮, 張虹, 等. 茶多糖的分離純化及其抗凝血活性[J].食品與發酵工業, 2012, 38(9): 191-195.
[18] 江和源, 陳小強, 寇小紅, 等. 茶多糖的分級純化及組成分析[J]. 茶葉科學, 2007, 27(3): 248-252.
[19] 肖麗霞, 于洪濤, 胡曉松. 香菇多糖的樹脂脫色工藝研究[J]. 食品與機械, 2011, 27(6): 241-244.
[20] 藍閩波, 郭晶, 趙紅莉, 等. 大孔吸附樹脂對厚樸多糖的脫色工藝研究[J]. 時珍國醫國藥, 2012, 23(5): 1219-1220.
[21] 楊強, 李新華, 王琳, 等. 銀杏果多糖的物化性質及抗氧化活性研究[J].現代食品科技, 2013, 29(10): 2395-2400.
[22] 廖春燕, 黃敏, 黃瑤, 等. 車前草多糖的脫色工藝研究[J]. 現代食品科技, 2012, 28(8): 1028-1030.
[23] 夏瑋, 呂慶, 張文清, 等. 大孔吸附樹脂脫色桑葉多糖的研究[J]. 食品與發酵工業, 2007, 33(2): 141-144.
[24] 劉小華, 張美霞, 于春梅, 等. 考馬斯亮藍法測定殼聚糖中蛋白的含量[J]. 中國交通醫學雜志, 2006, 20(2): 159-160.
[25] 侯雙菊. 黃精多糖的提取工藝及提取液樹脂法脫色的研究[D]. 合肥: 合肥工業大學, 2006.
Purifi cation and Separation of Pu-Erh Tea Polysaccharide by Resin
YANG Xinhe1,2, HUANG Jian’an2, LIU Zhonghua1,2,*, MAO Qingli1,2
(1. School of Life Science and Technology, Hubei Engineering University, Xiaogan 432000, China; 2. National Research Center of Engineering & Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China)
Among ten types of macroporous resins, D101 resin was selected as the best for the decolorization and deproteinization of Pu-Erh tea polysaccharides. When 50 mL of the sample at a concentration of 3.8 mg/mL, pH 4 was adsorbed by 11 mL of D101 resin 50 ℃, the decolorization rate was 82.33% and the removal rate of protein was 70.89%. Six polysaccharide fractions were obtained after subsequent DEAE-52 cellulose column chromatography.
resin; Pu-Erh tea; polysaccharide; purifi cation; separation
S571.1
A
1002-6630(2015)02-0019-06
10.7506/spkx1002-6630-201502004
2014-06-20
國家自然科學基金面上項目(31370692;31370691);湖北省自然科學基金面上項目(2014CFB573)
楊新河(1974—),男,副教授,博士,主要從事茶及功能食品研究。E-mail:hbxhyang@163.com
*通信作者:劉仲華(1965—),男,教授,博士,主要從事茶及功能食品研究。E-mail:lark-liu@163.com

