外顯子組測序技術對疑似魚鱗病患兒進行分子診斷的方法學研究
余蕾 張蕾 顧峻嫣 程明亮 黃林 夏曙華 程樹強 簡單 王荔平 孫朝琴 王焱 楊國珍
·技術與方法·
外顯子組測序技術對疑似魚鱗病患兒進行分子診斷的方法學研究
余蕾 張蕾 顧峻嫣 程明亮 黃林 夏曙華 程樹強 簡單 王荔平 孫朝琴 王焱 楊國珍
外顯子組測序是利用序列捕獲技術將全基因組外顯子區域DNA捕捉并富集后進行高通量測序的基因組分析方法,由于其具有對常見和罕見變異的高靈敏度,能發現外顯子區絕大部分疾病相關變異以及僅需對約1%的基因組進行測序等優點,使外顯子組測序成為鑒定孟德爾遺傳病致病基因最有效的策略,也被運用于復雜易感基因的研究和臨床診斷中[1]。本研究針對1例臨床上疑似魚鱗病的患兒,通過外顯子組測序實驗,檢測該患兒在遺傳水平上攜帶的突變,為臨床診斷和治療提供相關信息,并探討利用外顯子組測序作為臨床疑難雜癥輔助治療手段的可能性。
一、對象
患兒男,出生于2013年8月1日(剖宮產出生,其母產前5 d入院檢查持續尿蛋白+++,血清白蛋白較低,輸血漿不能糾正),體重2.4 kg,發育基本正常,全身皮膚硬,無彈性,火紅焦化狀脫皮;頭發呈卷曲碾碎感。顯微鏡下見頭發呈竹節狀,臨床診斷為火棉膠嬰兒(圖1)。除此癥狀之外,無其他異常,從外觀上看懷疑為魚鱗病。染色體和染色體微缺失檢查正常。父母體健,否認近親結婚,家族中未見類似患兒。
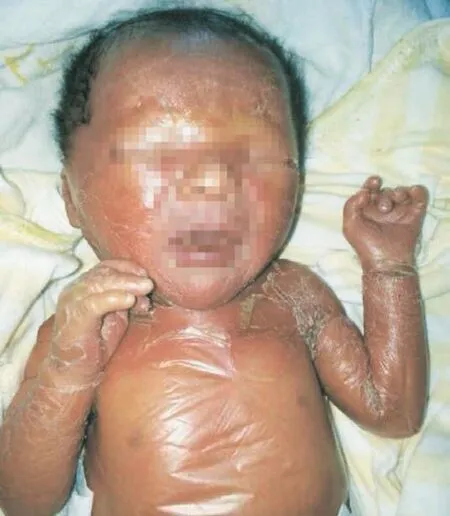
圖1 疑似魚鱗病患兒全身皮膚硬,無彈性,火紅焦化狀脫皮;頭發呈卷曲碾碎感
二、方法
1.試劑與儀器:QIAamp DNA Blood Mini Kit(德國Qiagen公司;貨號:51104),Gnomegen DNA-Seq Library Preparation Kit(美國Gnomegen公司;貨號:K02422),Gnome size selector(美國 Gnomegen公司;貨號:R02424L),PCR 儀(美國 ABI公司;型號:2720),Concentrator plus真空離心濃縮儀(德國eppendorf公司),小型高速離心機(德國eppendorf公司,型號:5418),實時定量PCR儀(德國eppendorf公司,型號:4376600),通用電泳儀(杭州匯爾儀器,型號:JY300C),渦旋儀(北京京輝凱業科技有限公司;型號:JHX24H),金屬浴(杭州瑞誠儀器有限公司;型號:DH100-1)。
2.血液提取及基因組DNA的純化、定量:取患兒EDTA抗凝全血2~3ml,提取DNA,DNA的純化采用QIAamp DNA Blood Mini Kit,按試劑盒說明書操作。電泳檢測基因組DNA的完整性。
3.外顯子捕獲:液相雜交法進行目標基因篩選:
(1)文庫制備:文庫構建采用Gnomegen DNA-Seq Library Preparation Kit,首先利用Covaris專利的自適應聚焦聲波(Adaptive Focused Acoustics,AFA)技術將樣品基因組DNA進行隨機打斷,獲得片段化DNA,斷裂要求:300~500 bp片段,以400 bp為中心峰值;然后對片段化的DNA進行末端修復和加dA尾,經過磁珠純化之后,在純化的DNA樣品中加入連接接頭,再次進行磁珠純化,然后對帶接頭的純化DNA樣品進行PCR擴增,對PCR產物進行磁珠純化后,制成300~500 bp片段文庫,-20℃保存備用。
(2)液相雜交、捕獲與洗脫:人工合成探針(圖2B),首先將擴增的DNA文庫樣品與制備好的探針Nimblegen SeqCap EZ Human Exome Library v3.0(帶生物素)加入適當的液相雜交體系中,經過47℃,72 h溫浴,雜交完成。然后用鏈霉親和素磁珠對雜交產物進行序列捕獲,將目標DNA(帶生物素)綁定到磁珠上。之后用3種洗脫緩沖液對磁珠進行洗脫,洗脫后的目標DNA溶液-20℃保存。
(3)篩選后文庫的擴增及純化:以洗脫后的目標DNA溶液為模板進行連接介導的PCR(Ligation.Mediated PCR,簡稱LM-PCR)擴增,對捕獲的目標基因進行富集。PCR產物經過Gnome size selector磁珠純化后,-20℃保存。
(4)qPCR法鑒定捕獲效率:經過捕獲的DNA,一般絕對數量較低,需要經過另一輪擴增才能產生用于高通量測序的樣品。將捕獲前后的DNA文庫通過內部參照序列的qPCR分析,可以判斷捕獲的效率及專一性。以PCR水為空白對照模板,擴增的DNA文庫為陽性對照模板,以擴增后的捕獲DNA為實驗組模板,選用4對引物進行qPCR SYBR Green實驗,通過比較捕獲組(CAP)和未捕獲組(NON)的Ct值來鑒定捕獲效率。
4.高通量測序:將捕獲富集并驗證的DNA文庫采用Illumina HiSeq 2000平臺測序,讀長為2×100 bp雙向測序,測序深度為>100×。
5.生物信息學分析:對于測序原始數據,首先采用fastqc軟件對數據質量做質控,然后采用bwa軟件與參考基因組hg19作比對,將比對結果去除重復片段并排序,接著采用GATK Indelrealigner對結果做重比對,然后采用GATK UnifiedGenotyper做變異檢測,得到snp和indel的信息,并過濾snp和indel得到可信的snp和indel。可信的snp和indel被用來做后續的annovar、sift和polyphen注釋,最后搜索OMIM數據庫,查看樣本疾病攜帶信息,并采用在線版HGMD 數據庫做了注釋[2-6]。
6.PCR擴增和sanger測序:再次以該患兒的基因組DNA為模板,針對檢測到的突變位點,采用PCR擴增的方法,對位點附近序列進行擴增,引物序列為正向引物:5′-AGCTCAATGTAGCCTTCATGA-3′,反向引物:5′-TGGCTAAC TCCCACATAATGAA-3′。反應條件為:94 ℃ 5min,94 ℃ 30 s,58℃1min,72℃30 s,30個循環,再72℃7min。對擴增所得PCR產物回收、純化之后,進行sanger測序。

圖2 液相雜交兩種探針的設計圖 2A:普通探針設計使得目標序列每個位點的覆蓋度為1~2×,且探針密度不夠高,導致有些區域的突變無法捕獲;2B:本研究設計的探針使得目標區域的每個位點都被多重覆蓋,且探針密度非常高,不同位置的突變都可以被捕獲
三、結果
對不明病因患兒的外顯子組測序的流程包括樣品收集及DNA提取,文庫制備和目標基因篩選,測序及數據分析3個模塊。
1.基因組DNA純化:針對血液樣本進行基因組DNA純化,電泳檢測結果顯示,DNA的完整性良好。Qubit定量結果顯示,該基因組DNA的質量濃度為130 mg/L,符合文庫構建的標準。
2.文庫構建和目標基因篩選:對純化好的基因組DNA進行文庫構建和目標基因篩選,對目標基因篩選后文庫進行qRT-PCR質檢,通常認為捕獲前后參照序列的富集倍數(2△Ct)超過30倍,即△Ct大于5時,便可以進入下一步高通量測序。結果(表1)顯示,血液樣品4對引物的△Ct值均大于7,表示目標序列均富集了135倍以上。
3.高通量測序及數據分析:對捕獲后的文庫進行上機測序和數據分析,結果顯示,該DNA樣品捕獲的目標區域大小為64 Mbp,符合人基因組外顯子區的大小。目標區域的測序深度(即測序得到的堿基總量與目標區域大小的比值)為106×,通常認為當測序深度在10~15×以上時,目標區域覆蓋度和測序錯誤率控制均得以保證。序列匹配時,發現有超過99.3%的高質量讀長被匹配到人類基因組參考序列(hg19)上,總共有超過98.6%的外顯子區域序列被覆蓋了4倍以上,超過97.4%的外顯子區域序列被覆蓋了10倍以上,超過95.0%的外顯子區域序列被覆蓋了20倍以上,超過90.5%的外顯子區域序列被覆蓋了30倍以上,超過83.8%的外顯子區域序列被覆蓋了40倍以上,超過75.9%的外顯子區域序列被覆蓋了50倍以上。
對該患兒的外顯子組測序共發現了172 639個SNP位點,20 434個插入/缺失位點,其中新的SNP位點為18 825個,新的Indels為6 890個。通過對這些突變位點進行致病性分析以及可能導致疾病的推測,共發現19個可能的致病突變(表2),其中位于第5條染色體上的SPINK5基因的第5外顯子保守區序列位點發生了非同義突變c.318G>A,導致了氨基酸的改變Asp-Asn,從而可能引起內瑟頓綜合征(Netherton syndrome)的發生。
內瑟頓綜合征的臨床特征為魚鱗病樣紅皮病、發干異常和特應性素質,出生時即出現紅斑,這些癥狀與本研究的患兒臨床癥狀類似。將臨床癥狀結合基因檢測結果,初步確定該患兒為攜帶SPINK5基因雜合突變G318A的內瑟頓綜合征患者。
4.序列驗證:經過PCR擴增,得到了380 bp的目的片段,電泳結果見圖3。對目的片段進行回收、純化、一代測序,結果顯示,該患兒的SPINK5基因確實存在G318A的雜合突變(圖4)。
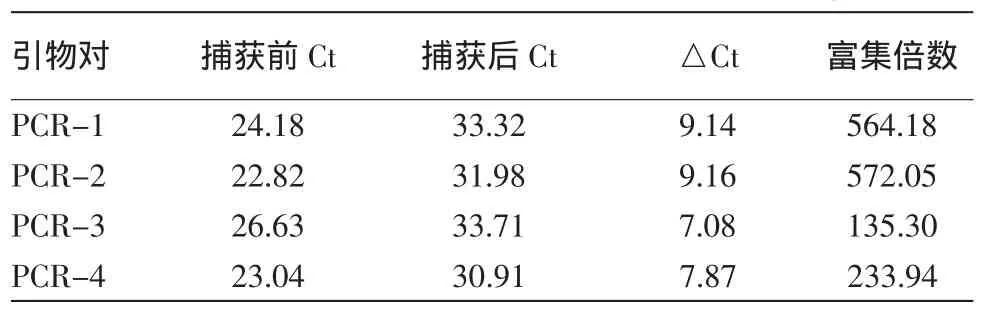
表1 捕獲后血液基因組DNA文庫的qRT-PCR QC結果
四、討論
2010年,Bilgüvar等[7]運用 NimbleGen 2.1M 芯片捕獲外顯子,并用Genome AnalyzerⅡ測序系統對1例患者測序,發現WDR62基因與腦皮質發育異常疾病相關,從而能解釋一系列的嚴重皮質畸形的癥狀,該研究提示,外顯子測序對具有遺傳異質性和診斷亞型困難的疾病有一定幫助。2011年,Worthey等[8]對1例臨床上難以診斷疾病的患兒進行全外顯子組測序,發現XIAP(X染色體的細胞凋亡抑制劑)基因上存在非同義突變,對基因功能和涉及代謝通路進行分析,結合患兒的臨床癥狀,最終確定該患兒所得疾病為難治性炎性腸病。
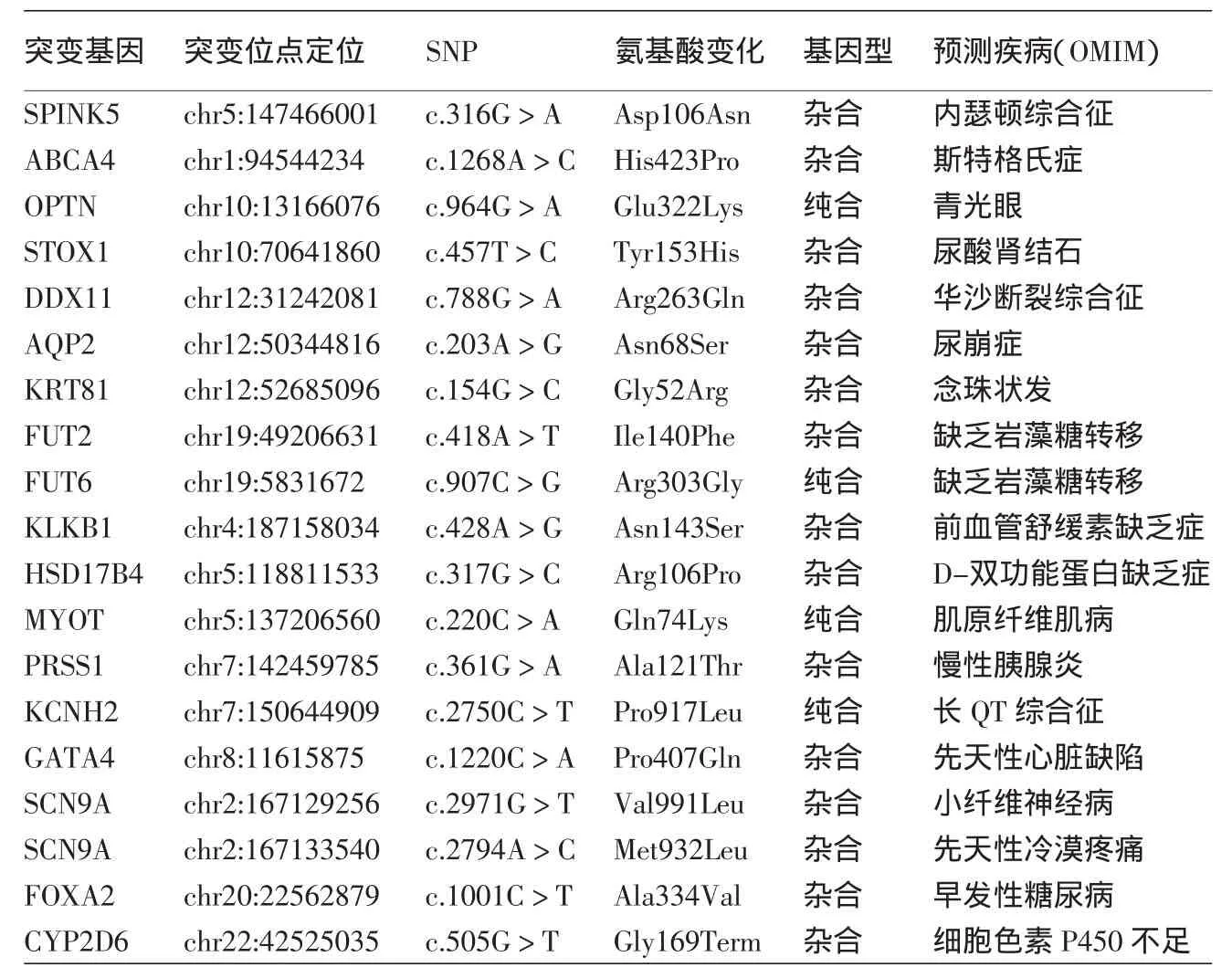
表2 疑似魚鱗病患兒的致病突變檢測結果
本研究針對1例臨床上無法準確判斷其病癥的疑似魚鱗病患兒,采用外顯子組測序技術,對患兒的血液樣本進行目標基因篩選、高通量測序及數據分析。外顯子組測序技術的難點在于探針的設計,要求探針設計在維持專一性的同時,能有效捕獲攜帶突變的片段。我們采用的是下面這種很多探針位置交錯,大量起始點不同的探針去雜交捕獲(由于探針是根據野生型正常序列設計,有突變序列的雜交效率低于正常序列,這種探針設計可以有效彌補這一缺陷)(圖2B),可以高效地捕獲發生變異的目標基因片段,定制過程中我們充分考慮了探針的密度和數量,并對雜交條件進行優化,最大可能發現更多的基因變異信息。
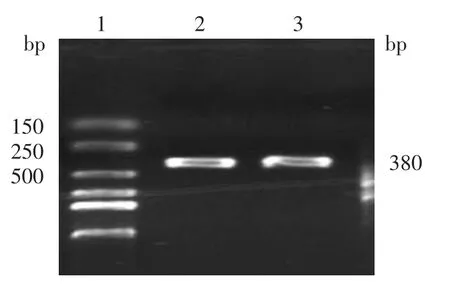
圖3 SPINK5(G318A)突變位點序列PCR擴增電泳結果 目的片段為380 bp

圖4 SPINK5(G318A)突變位點序列的sanger測序圖譜 對目的片段進行一代測序,發現SPINK5(G318A)確實存在G318A的雜合突變
外顯子測序的結果顯示,64 Mbp的目標基因長度(符合人外顯子的大小)、106×的測序深度、99.3%的目標區域覆蓋度以及有超過90.5%的目標區域被覆蓋了30倍以上,已有研究表明,30倍以上的覆蓋度就足夠發現低頻的SNP、插入/缺失等位點[9-16],因此這樣的測序深度和覆蓋度足夠發現發生頻率很低的突變位點,可以達到預期的目的。通過對測序所得的SNP位點和Indels進行基因功能注釋和致病性分析,發現一個已被確定的可以導致內瑟頓綜合征的致病突變:SPINK5(G318A)。
內瑟頓綜合征是由SPINK5(LEKTI)(皮膚激肽釋放酶級聯的一種主要抑制劑)中的突變造成的罕有常染色體隱性遺傳性皮膚病,絲氨酸蛋白酶激肽釋放酶(KLK)活性增加已經被證明是其臨床癥狀的成因[17]。有文獻證明,患有內瑟頓綜合征的患者在編碼LEKTI的SPINK5基因中出現了閱讀框偏移和無義突變[18-20],LEKTI為具有對抗多種 KLK(包括KLK5、6、7、13 和 14)的活性絲氨酸蛋白酶抑制劑[21-22],這類基因缺陷會導致抑制結構域的缺失,使在正常的皮膚生理學中起到關鍵作用的激肽釋放酶KLK蛋白活性增加,從而引起內瑟頓綜合征的發生。Chavanas等[23]總結了導致內瑟頓綜合征發生的SPINK5基因突變有13個。2012年,Zhang等[24]在1例中國成年內瑟頓綜合征的患者中發現了SPINK5基因的雜合突變G318A,并通過免疫組化技術檢測到擁有該突變的個體LEKTI的表達量明顯降低,從而確定SPINK5基因的雜合突變G318A為一新的導致內瑟頓綜合征發生的致病突變。從該疾病的致病機理可以推斷出,給內瑟頓綜合征患者補充絲氨酸蛋白酶抑制劑,理論上可以有效控制病癥,具體應用需要進一步的功能驗證和臨床試驗。
利用目標基因篩選技術,將全基因組外顯子區域的序列作為靶向基因,從基因組DNA中篩選出來并進行測序和分析,既可以大幅度降低測序成本,又能增加測序深度和檢測靈敏度,更重要的是,目前一致認為大部分功能變異都潛藏在外顯子中[25],有機會發現更多有價值的突變,因此全外顯子組測序的技術已成為現階段基因測序工作的重心。Biesecker等[26]在 Nature Genetics 發表評論:外顯子組測序使得醫學基因組學成為現實。我們的研究進一步證實了外顯子組測序技術作為臨床難以診斷疾病的輔助診療手段的可能性。相信隨著技術的發展、測序成本的降低以及后續分析手段的豐富,預期在不久的將來,外顯子測序會廣泛被運用到疾病的分子診斷,為臨床一些難以診斷的疾病提供一種新的診斷思路。
[1]張鑫,李敏,張學軍.全基因組外顯子測序及其應用[J].遺傳,2011,33(8):847-856.
[2]Li H,Durbin R.Fast and accurate long-read alignment with Burrows-Wheeler transform[J].Bioinformatics,2010,26(5):589-595.
[3]McKenna A,Hanna M,Banks E,et al.The Genome Analysis Toolkit:a MapReduce framework for analyzing next-generation DNA sequencing data[J].Genome Res,2010,20(9):1297-1303.
[4]DePristo MA,Banks E,Poplin R,et al.A framework for variation discovery and genotyping using next-generation DNA sequencing data[J].Nat Genet,2011,43(5):491-498.
[5]Wang K,Li M,Hakonarson H.ANNOVAR:functional annotation of genetic variants from high-throughput sequencing data[J].Nucleic Acids Res,2010,38(16):e164.
[6]Li H,Handsaker B,Wysoker A,et al.The Sequence Alignment/Map format and SAMtools[J].Bioinformatics,2009,25(16):2078-2079.
[7] Bilgüvar K,Oztürk AK,Louvi A,et al.Whole-exome sequencing identifies recessive WDR62 mutations in severe brain malformations[J].Nature,2010,467(7312):207-210.
[8]Worthey EA,Mayer AN,Syverson GD,et al.Making a definitive diagnosis:successfulclinicalapplication ofwhole exome sequencing in a child with intractable inflammatory bowel disease[J].Genet Med,2011,13(3):255-262.
[9]Gnirke A,Melnikov A,Maguire J,et al.Solution hybrid selection with ultra-long oligonucleotides for massively parallel targeted sequencing[J].Nat Biotechnol,2009,27(2):182-189.
[10]Ng SB,Turner EH,Robertson PD,et al.Targeted capture and massively parallel sequencing of 12 human exomes [J].Nature,2009,461(7261):272-276.
[11]Hedges DJ,Burges D,Powell E,et al.Exome sequencing of a multigenerational human pedigree [J].PLoS One,2009,4(12):e8232.
[12]Ng SB,Buckingham KJ,Lee C,et al.Exome sequencing identifies the cause of a mendelian disorder[J].Nat Genet,2010,42(1):30-35.
[13]Kim JI,Ju YS,Park H,et al.A highly annotated whole-genome sequence of a Korean individual[J].Nature,2009,460(7258):1011-1015.
[14]Baranzini SE,Mudge J,van Velkinburgh JC,et al.Genome,epigenome and RNA sequences of monozygotic twins discordant for multiple sclerosis[J].Nature,2010,464(7293):1351-1356.
[15]Roach JC,Glusman G,Smit AF,et al.Analysis of genetic inheritance in a family quartet by whole-genome sequencing[J].Science,2010,328(5978):636-639.
[16]Tewhey R,Warner JB,Nakano M,et al.Microdroplet-based PCR enrichment for large-scale targeted sequencing[J].Nat Biotechnol,2009,27(11):1025-1031.
[17]Geyer AS,Ratajczak P,Pol-Rodriguez M,et al.由SPINK5中的一個純合子的移碼突變產生的具有廣泛脫屑及發育停滯的內瑟頓綜合征[J].世界核心醫學期刊文摘(皮膚病學分冊),2005,(10):55.
[18]Chavanas S,Bodemer C,Rochat A,et al.Mutations in SPINK5,encoding a serine protease inhibitor,cause Netherton syndrome[J].Nat Genet,2000,25(2):141-142.
[19]Komatsu N,Takata M,Otsuki N,et al.Elevated stratum corneum hydrolytic activity in Netherton syndrome suggests an inhibitory regulation of desquamation by SPINK5-derived peptides [J].J Invest Dermatol,2002,118(3):436-443.
[20]Sprecher E,Chavanas S,DiGiovanna JJ,et al.The spectrum of pathogenic mutations in SPINK5 in 19 families with Netherton syndrome:implications for mutation detection and first case of prenatal diagnosis[J].J Invest Dermatol,2001,117(2):179-187.
[21] Borgo?o CA,Michael IP,Komatsu N,et al.A potential role for multiple tissue kallikrein serine proteases in epidermal desquamation[J].J Biol Chem,2007,282(6):3640-3652.
[22]Egelrud T,Brattsand M,Kreutzmann P,et al.hK5 and hK7,two serine proteinases abundant in human skin,are inhibited by LEKTI domain 6[J].Br J Dermatol,2005,153(6):1200-1203.
[23]Chavanas S,Bodemer C,Rochat A,et al.Mutations in SPINK5,encoding a serine protease inhibitor,cause Netherton syndrome[J].Nat Genet,2000,25(2):141-142.
[24]Xi-Bao Z,San-Quan Z,Yu-Qing H,et al.Netherton syndrome in one Chinese adult with a novel mutation in the SPINK5 gene and immunohistochemical studies of LEKTI [J].Indian J Dermatol,2012,57(4):265-268.
[25]Botstein D,Risch N.Discovering genotypes underlying human phenotypes:pastsuccesses formendelian disease,future approaches for complex disease [J].Nat Genet,2003,33 Suppl:228-237.
[26]Biesecker LG.Exome sequencing makes medical genomics a reality[J].Nat Genet,2010,42(1):13-14.
2014-03-27)
(本文編輯:周良佳 顏艷)
10.3760/cma.j.issn.0412-4030.2015.03.019
550004貴陽醫學院附屬醫院臨檢科遺傳室(余蕾、程明亮、黃林、夏曙華、程樹強、簡單、王荔平、孫朝琴、楊國珍);吳江匯杰生物科技有限公司(張蕾、顧峻嫣);美國Gnomegen公司(王焱)
楊國珍,Email:myy12004@163.com;王焱,Email:yan.wang@huijiebio.com

