血清前白蛋白在肝細胞癌患者肝切除術后復發風險評估中的應用
于里涵,謝 峰,鄭 濤,付 軍,閻 龍,楊甲梅
(第二軍醫大學附屬東方肝膽外科醫院特需治療一科,上海 200438)
肝細胞癌 (hepatocellular carcinoma,HCC)是我國常見的惡性腫瘤之一,肝切除手術是綜合治療中的關鍵環節,但術后肝癌復發仍是影響患者長期生存的主要因素。HCC手術切除后5年復發率可高達60%[1]。既往研究[2]證實:腫瘤大小、門靜脈癌栓、乙肝病毒DNA和肝硬化情況等因素與術后復發密切相關,為HCC患者的隨訪和抗復發治療提供了依據,但用于評估SHCC患者術后遠期療效的臨床指標仍不足。血清前白蛋白(prealbumin,PA)是肝切除手術前用于判斷患者術前營養和肝臟功能狀態的常用指標。近期研究[3-7]證實:在炎癥、創傷和腫瘤等狀態下,PA水平的降低與預后相關。本文作者回顧分析143例HCC患者的臨床及病理資料,探討PA在HCC患者肝切除術后復發評估中的應用及其臨床價值。
1 資料與方法
1.1 臨床資料 收集2007年3月—2008年2月在第二軍醫大學附屬東方肝膽外科醫院入院初次行肝癌根治性切除手術143例患者的資料。入組標準:術后病理診斷為HCC、肝內單發病灶、腫瘤直徑≤5cm;排除標準:年齡>70歲、術前影像學檢查提示肝外轉移灶、脈管癌栓。最終入組患者共143例。
143例患者中,男性126例,女性17例;年齡31~68歲,中位年齡50歲;乙型肝炎病毒表面抗原 (hepatitis B virus surface antigen,HBsAg)陽性127例 (88.8%),其中乙型肝炎病毒DNA(hepatitis B virus DNA,HBV-DNA)定量>1×103IU·mL-175例 (52.4%);術前甲胎蛋白(alpha-fetoprotein,AFP)>20μg·L-176 例(53.1%);術后 PA 水平下降 <43%共32例(22.4%),≥43%共111例 (77.6%);術后病理診斷為肝硬化患者78例 (52.4%);腫瘤直徑>3cm 58 例 (40.6%),≤3cm 85 例 (59.4%)。本組術前Child-Pugh分級,A級142例,B級1例。行規則性肝段切除或腫瘤局部切除,病理學檢查明確切緣陰性。術中入肝血流阻斷124例,平均阻斷時間15.5min,未阻斷19例,術中平均出血量221.2mL (30~900mL)。依據 Dindo等[8]樣本分析手術并發癥的結果,達到Ⅲ級以上為外科手術并發癥。
1.2 臨床指標和隨訪方法 于術前及術后第1和3天行空腹血清學檢查,包括PA、白蛋白(albumin,ALB)、 總 膽 紅 素 (total bilirubin,TBIL)、 谷 丙 轉 氨 酶 (alanine transaminase,ALT)、AFP、HBsAg及 HBV-DNA。收集術后病理結果,包括腫瘤大小、腫瘤包膜有無及是否并發肝硬化。術后出院患者通過再次住院或門診復查,以電話和書信隨訪。術后第1年開始每1個月隨訪1次,第2年每3個月隨訪1次,共3次,以后每6個月隨訪1次,直至復發或死亡。隨訪截至2011年12月31日,時間以月計,截至隨訪結束,共有1例患者失訪。以2種以上影像學檢查發現肝內新發實質性占位病變為術后復發標準。患者術后并發癥發生情況按Dindo等[8]制定的分級標準進行記錄,其中Ⅲ級并發癥為需要外科、內鏡科或放射科參與治療,Ⅳ級為引起器官功能障礙并危及生命的并發癥或需要入住重癥監護病房的情況,Ⅴ級為患者死亡。
1.3 統計學分析 采用SPSS 18.0統計學軟件對相關數據進行分析。血清PA、ALB、TBIL、ALT、AFP、HBsAg 和 HBV-DNA 水 平 以表示,組間比較采用t檢驗及單因素方差分析;計數資料樣本組間比較采用χ2檢驗。采用Kaplan-Meier法計算患者累計復發率,組間比較采用Log-rank檢驗,參考值范圍依據既往文獻[9]報道,腫瘤體積和PA下降率的參考值范圍由受試者工作特征曲線 (receiver operating characteristic curve,ROC)計算得出。
2 結 果
本組中出現Ⅲ級以上手術相關并發癥患者共11例,各類并發癥累計發生12次,包括需經皮置管引流的胸腔積液3例、術后中等量以上腹腔積液6例、需引流的肝創面積液1例、膽漏1例、創面出血再次手術1例。以是否出現術后并發癥分為并發癥組和無并發癥組。相關因素分析發現:與無并發癥組比較,并發癥組患者術后PA下降率明顯(P<0.05),術中失血量較大 (P<0.05),其余各項化驗指標比較差異均無統計學意義 (P>0.05)。見表1。
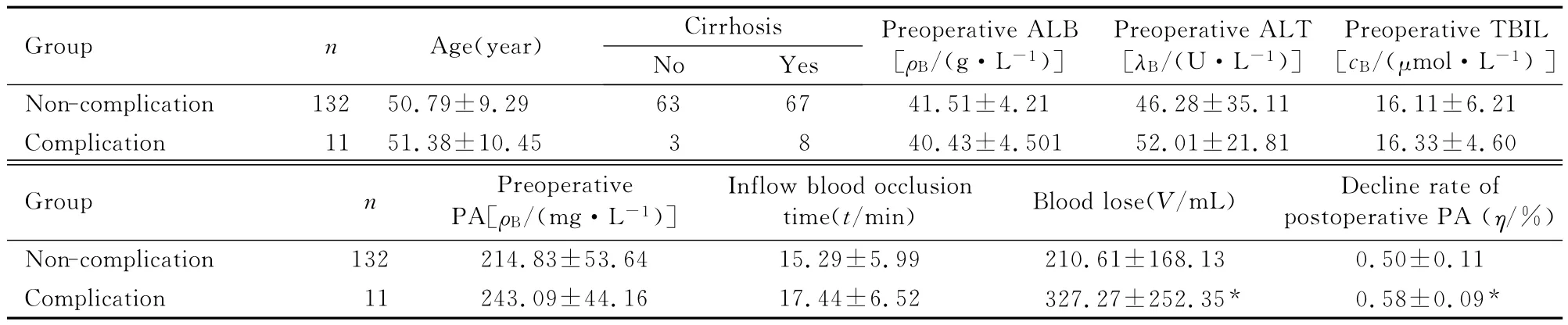
表1 術后并發癥相關因素分析Tab.1 Analysis on factors related to postoperative complications
本組患者總中位無瘤生存期 (DFS)43個月,其中64例患者出現腫瘤復發,總復發率為44.7%,1、2、3年累積復發率為29%、39%和49%。
肝癌復發相關因素分析顯示:HBV-DNA水平和術后PA下降率是與早期腫瘤復發密切相關的危險因素 (表2)。HBV-DNA<1×103IU·mL-1與HBV-DNA≥1×103IU·mL-1的患者比較,1、2、3年無瘤生存率分別為85%、77%、67%和67%、52%、47% (圖1);術后PA下降<43%與下降≥43%的患者1、2、3年無瘤生存率分別為91%、81%、64%和66%、55%、47%。見圖2。

圖1 HCC患者HBV-DNA水平與術后DFS的關系Fig.1 Relatioship between HBV-DNA level and DFS of HCC patients after operation
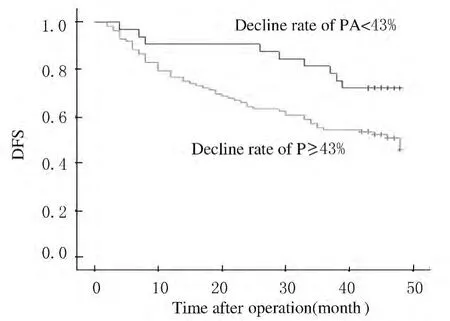
圖2 HCC患者PA下降率與術后DFS的關系Fig.2 Relationship between decline rate of PA and DFS of HCC patients after operation
3 討 論
早期診斷和治療是HCC防治中的重要環節,早期HCC患者行根治性手術效果較好[10],但仍會出現肝內復發影響預后[1]。HCC術后復發因素可能包括:腫瘤大小與數目;肝病背景,包括脂肪肝、肝硬化或HBV-DNA水平;手術質量,是否切緣陰性[11]。本研究入組病例均為單發、腫瘤直徑≤5cm且無脈管癌栓的HCC患者,在排除了腫瘤大、腫瘤多發和脈管癌栓等早期復發因素后,發現HBV-DNA水平及術后PA下降率與HCC患者預后有關。
慢性乙型肝炎病毒 (HBV)感染會導致肝纖維化和肝硬化,并與HCC的發生發展有密切關系 ,有大量的研究[12-13]證實:高HBV-DNA水平是除年齡、性別、肝纖維化程度等因素外HCC手術后復發的獨立風險因素。本研究得到類似的結果,術前HBV-DNA≥1×103IU·mL-1的患者,無瘤生存率明顯降低,即使為早期HCC患者,其3年無瘤生存率僅47%,提示高HBV-DNA水平是引起術后復發的重要因素。

表2 HCC患者術后復發相關因素分析Tab.2 Analysis on factors related with recurrence of HCC patients
惡性腫瘤患者經治療后,恢復情況與營養狀況及自身合成功能關系密切,這一點在消化系惡性腫瘤患者表現更為明顯[14]。PA是一種由肝細胞合成的血漿蛋白,半衰期短,在敏感性方面其臨床參考價值 超 過 ALB[15]。 研 究[15-16]證 實: 肝 細 胞 受 損時,PA質和量均降低,因此PA常用于肝炎、肝硬化和HCC等病程中肝臟儲備功能的診斷和肝臟功能恢復的療效判定。行肝切除手術的HCC患者,術前PA水平受營養狀況和慢性肝損傷共同影響,Huang等[17]通過臨床研究發現:患者術前低PA水平與術后并發癥、肝功能不全有關。本研究選取早期肝癌患者進行觀察,惡性腫瘤對肝功能的影響相對較小,且腫瘤體積較小,手術創傷減輕,因此術后均未發生肝功能不全,結果顯示:術前PA水平與術后并發癥關系不明顯,而在術后禁食同時按規范給予胃腸外高營養支持的條件下,PA下降率卻因人而異。本研究中術后出現并發癥患者,其PA下降率明顯升高,提示其肝功能儲備可能不足或營養欠缺。因此,PA下降率也許可作為評價肝臟合成功能的敏感指標。
合成不足或營養不良引起的蛋白水平低下會影響細胞介導的免疫功能,而機體抵抗炎癥和腫瘤的能力則相應減退[5]。PA作為體內重要的轉運蛋白,具有轉運甲狀腺素和維生素A的功能[3],在促進淋巴細胞成熟、維持人體免疫功能方面有重要作用,PA的降低可能會影響這一正常生理過程,Luo等[3]發現:肺結核病患者在藥物治療過程中,出現PA下降快速而回升緩慢的患者其預后不良,這與本文作者觀察到的HCC根治切除后PA降低的患者遠期療效類似,是否同時存在免疫功能下降因素,有待進一步研究。
綜上所述,高HBV-DNA水平是HCC復發的高危因素,PA下降率與手術的遠期預后有一定關系。
[1]Imamura H,Matsuyama Y,Tanaka E,et al.Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy [J].J Hepatol,2003,38 (2):200-207.
[2]Collette S,Bonnetain F,Paoletti X,et al.Prognosis of advanced hepatocellular carcinoma:comparison of three staging systems in two French clinical trials [J].Ann Oncol,2008,19 (6):1117-1126.
[3]Luo H,Zhu B,Gong L,et al.The value of serum prealbumin in the diagnosis and therapeutic response of tuberculosis:a retrospective study [J].PLoS One,2013,8 (11):e79940.
[4]Chen D,Bao L,Lu SQ,et al.Serum albumin and prealbumin predict the poor outcome of traumatic brain injury [J].PLoS One,2014,9 (3):e93167.
[5]Kawai H,Ota H.Low perioperative serum prealbumin predicts early recurrence after curative pulmonary resection for non-small-cell lung cancer [J]. World J Surg,2012,36 (12):2853-2857.
[6]Fujii T,Sutoh T,Morita H,et al.Serum albumin is superior to prealbumin for predicting short-term recurrence in patients with operable colorectal cancer [J].Nutr Cancer,2012,64 (8):1169-1173.
[7]Lourenco P,Silva S,Frioes F,et al.Low prealbumin is strongly associated with adverse outcome in heart failure [J].Heart,2014,100 (22):1780-1785.
[8]Dindo D,Demartines N,Clavien PA.Classification of surgical complications:a new proposal with evaluation in a cohort of 6336patients and results of a survey [J].Ann Surg,2004,240 (2):205-213.
[9]Tateishi R,Yoshida H,Matsuyama Y,et al.Diagnostic accuracy of tumor markers for hepatocellular carcinoma:a systematic review [J].Hepatol Int,2008,2 (1):17-30.
[10]Dong W,Zhang T,Wang ZG,et al.Clinical outcome of small hepatocellular carcinoma after different treatments:a meta-analysis[J].World J Gastroenterol,2014,20 (29):10174-10182.
[11]Tung-Ping PR,Fan ST,Wong J.Risk factors,prevention,and management of postoperative recurrence after resection of hepatocellular carcinoma [J].Ann Surg,2000,232 (1):10-24.
[12]Qu LS,Jin F,Huang XW,et al.High hepatitis B viral load predicts recurrence of small hepatocellular carcinoma after curative resection [J].J Gastrointest Surg,2010,14 (7):1111-1120.
[13]Sohn W,Paik YH,Kim JM,et al.HBV DNA and HBsAg levels as risk predictors of early and late recurrence after curative resection of HBV-related hepatocellular carcinoma [J].Ann Surg Oncol,2014,21 (7):2429-2435.
[14]Bozzetti F,Gianotti L,Braga M,et al.Postoperative complications in gastrointestinal cancer patients:the joint role of the nutritional status and the nutritional support [J].Clin Nutr,2007,26 (6):698-709.
[15]Saito M,Seo Y,Yano Y,et al.Short-term reductions in non-protein respiratory quotient and prealbumin can be associated with the long-term deterioration of liver function after transcatheter arterial chemoembolization in patients with hepatocellular carcinoma [J]. J Gastroenterol, 2012,47 (6):704-714.
[16]Chang WT,Ker CG, Hung HC,et al.Albumin and prealbumin may predict retinol status in patients with liver cirrhosis[J].Hepatogastroenterology,2008,55 (86/87):1681-1685.
[17]Huang L,Li J,Yan JJ,et al.Prealbumin is predictive for postoperative liver insufficiency in patients undergoing liver resection [J].World J Gastroenterol,2012,18 (47):7021-7025.

