西爾斯山羊草(Aegilopssearsii)α-醇溶蛋白編碼基因的克隆及原核表達
劉國娟,馬信,尹華燕,孫鑫,杜旭燁,王宏偉,李安飛,陳呈濤,孔令讓*
1.山東農業大學農學院/作物生物學國家重點實驗室,山東泰安271018
2.山東省新泰市天寶鎮農業技術推廣站,山東新泰271200
西爾斯山羊草(Aegilopssearsii)α-醇溶蛋白編碼基因的克隆及原核表達
劉國娟1,馬信1,尹華燕1,孫鑫1,杜旭燁1,王宏偉1,李安飛1,陳呈濤2,孔令讓1*
1.山東農業大學農學院/作物生物學國家重點實驗室,山東泰安271018
2.山東省新泰市天寶鎮農業技術推廣站,山東新泰271200
醇溶蛋白是小麥加工品質的重要影響因素,主要決定面團的粘性和延展性。根據酸性條件下遷移率的不同,可將醇溶蛋白分為α-,β-,γ-,ω-醇溶蛋白。α-醇溶蛋白占貯藏蛋白的15%~30%,是含量最豐富的一類貯藏蛋白,同時,α-醇溶蛋白中含有一些致敏性的毒性多肽。克隆西爾斯山羊草α-醇溶蛋白基因,并進行序列分析,通過構建原核表達載體,使其在大腸桿菌中誘導表達融合蛋白,并通過切膠純化法,獲得純度較高的目的蛋白。根據α-醇溶蛋白基因編碼區保守序列設計引物,通過PCR擴增克隆得到α-醇溶蛋白基因并進行序列分析。將目的基因KC421089連到表達載體pEASY-E1上,在大腸桿菌BL21(DE3)中經IPTG誘導表達,獲得表達的融合蛋白。通過切膠純化法,獲得純度較高的目的蛋白。從小麥近緣植物西爾斯山羊草(Aegilops searsii)中首次克隆了7個α-醇溶蛋白編碼基因,它們的編碼區長度分布在849~954 bp之間,可編碼282~317個氨基酸。通過與已發表的其它物種的α-醇溶蛋白氨基酸序列進行多重比對分析,發現這些基因都具有α-醇溶蛋白編碼基因典型的結構特點,同時還存在著堿基的缺失、插入以及SNPs。在克隆目的基因的基礎上,本研究還通過大腸桿菌體外表達和切膠純化方法,獲得了純度較高的目的蛋白,實現了該基因的表達。克隆了7個α-醇溶蛋白基因序列,登錄號為KC421089的基因可在原核系統中成功表達,并通過切膠純化法獲得目的蛋白,為進一步利用西爾斯山羊草改良小麥加工品質奠定了基礎。
α-醇溶蛋白;西爾斯山羊草;序列分析;原核表達
醇溶蛋白是小麥種子中的主要貯藏蛋白之一,約占小麥胚乳貯藏蛋白總量的50%~60%[1],是影響小麥加工品質的重要因素。在酸性電泳中,根據遷移率大小可將其分為α-,β-,γ-,ω-醇溶蛋白[2,3]。其中,α-醇溶蛋白占小麥籽粒總蛋白的15~30%[4-6],平均分子量為31 kD,主要由位于第六同源染色體群短臂上的Gli-2(Gli-A2,Gli-B2和Gli-D2)位點控制[7]。
乳糜瀉(Celiac disease,CD)又稱為小麥麩質過敏,是小麥誘發的一種特殊過敏癥狀,臨床表現為腸黏膜損害和繼發性吸收不良并伴有頑固腹瀉、體重下降、營養不良、骨質疏松癥、貧血、乏力、手足抽搐等癥狀,嚴重影響食品安全和人類健康[8]。α-醇溶蛋白基因編碼的氨基酸序列中含有能夠誘發CD的毒性多肽序列,這些多肽序列與病人的T細胞結合會產生小腸粘膜損傷和吸收不良癥狀。朱西平等根據推導氨基酸序列所具有的四種CD多肽結構,對普通小麥品種中克隆的α-醇溶蛋白基因進行染色體定位,并用中國缺-四體對該染色體定位方法進行驗證[9]。目前,對普通小麥中CD多肽的研究已有些報道,并確認了一系列的毒性多肽,但是關于二倍體材料中CD抗原多肽的研究還相對較少。
對基因功能研究的方法主要有轉基因、體外表達、基因沉默等。原核表達是一種重要的體外表達模式,在基因功能研究方面發揮了重要作用。Claudia等[10]和Ferrante等[11]利用E.coli表達系統實現了普通小麥γ-醇溶蛋白基因的原核表達,并通過體外摻粉實驗對表達產物進行了體外功能驗證。由于α-醇溶蛋白序列具有較高的多態性,對蛋白的純化及表達技術提出了較高的要求,因此對其進行體外功能鑒定的研究尚處于起步階段,有必要對其進行進一步的研究。
西爾斯山羊草是小麥近緣種,是小麥育種改良的重要資源,本研究旨在從西爾斯山羊草中克隆出α-醇溶蛋白的編碼基因,并通過原核表達初步驗證該基因功能,為今后進一步利用西爾斯山羊草改良小麥面粉加工品質奠定分子基礎。
1 材料與方法
1.1 材料來源
西爾斯山羊草Y2131(Aegilops searsii,SsSs,2n=2x=14),由中國農業科學院作物科學研究所提供。
1.2 基因組DNA提取
采用CTAB法從西爾斯山羊草的幼葉中進行植物總DNA的提取[12]。
1.3 基因的克隆及序列分析
根據GenBank公布的α-醇溶蛋白基因的保守序列,設計引物擴增編碼區全長,引物序列為,P1:5'-ATG AAG ACC TTT CTC ATC CTT G-3',P2:5'-TCA GTT RGT ACC RAA GAT GCC-3'。利用在線軟件http://web.expasy.org/translate/進行氨基酸的翻譯,并利用MEGA 5.0軟件進行系統發育樹的構建;同時,在利用DNAMAN軟件進行序列比對分析的基礎上,辨識CD毒性多肽的識別區域(參照朱西平等的方法進行[8])。
1.4 原核表達與純化
根據目的基因的完整編碼區,設計一對引物擴增不含有信號肽編碼序列的ORF,引物序列為,P3:5'-GCA GTT AGA GTT CCA GTG CCA-3',P4:5'-TCA GTT RGT ACC RAA GAT GCC-3',將目的片段回收純化后連接到pEASY-E1載體上,轉化至Trans1-T1感受態細胞中,并進行菌液測序。對測序正確的菌液進一步提取質粒DNA,并將重組質粒轉化到大腸桿菌BL21(DE3)感受態細胞中,挑取單克隆,經菌落PCR驗證正確后進行誘導表達,然后通過切膠純化法得到目的蛋白[13,14]。
2 結果與分析
2.1 α-醇溶蛋白的克隆及序列分析
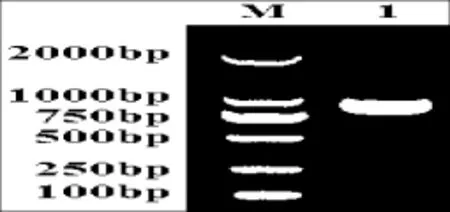
圖1 西爾斯山羊草α-醇溶蛋白基因的PCR擴增Fig.1 PCR amplification of the α-gliadin gene from Aegilops searsii M:DL2000;1:Y2131
利用一對保守引物P1和P2,對西爾斯山羊草基因組DNA進行擴增,得到約1000 bp左右的目的條帶(圖1),經測序共獲得7個基因,通過在Genbank中的在線搜索,結果顯示它們與已知的α-醇溶蛋白基因具有很高的相似性,同時與已報道的基因在序列上存在一定差異,表明本試驗得到的α-醇溶蛋白編碼基因均為新的α-醇溶蛋白基因。隨后,將這些基因序列提交至Genbank(登錄號:KC421084-KC421090)。對核苷酸序列編碼的氨基酸序列分析發現核苷酸序列長度為849-954 bp(表1),編碼氨基酸數目為282~317個,等電點具有較高的多態性。通過與已發表的α-醇溶蛋白序列進行多重比對分析(圖2),這些基因都具有α-醇溶蛋白編碼基因典型的結構特點[15],并且都具有6個半胱氨酸殘基,同時還存在著堿基的缺失、插入以及SNPs。
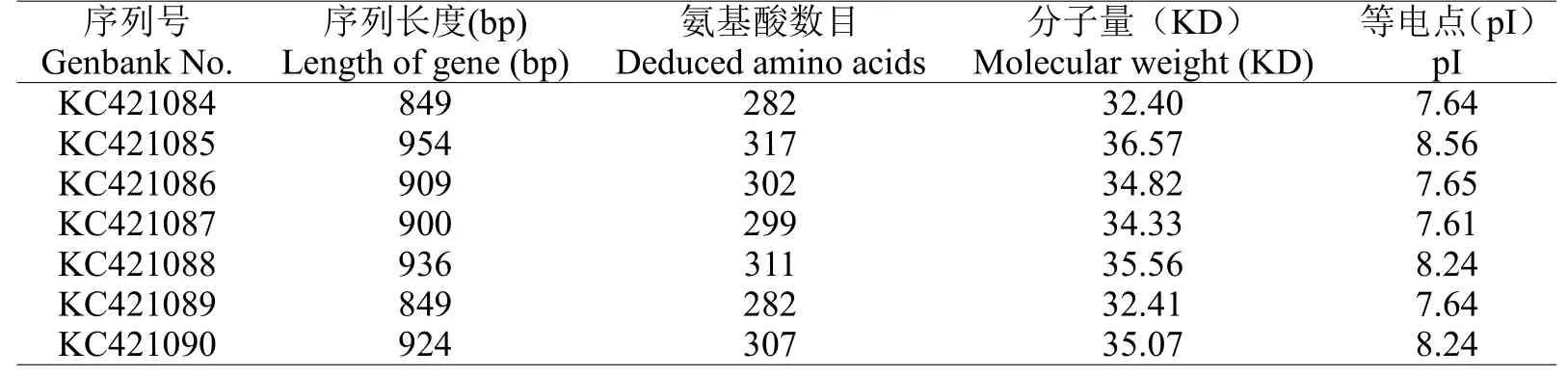
表1 西爾斯山羊草α-醇溶蛋白的特征分析Table 1 Characterization of 7 novel α-gliadin from Aegilops searsii

圖2 西爾斯山羊草α-醇溶蛋白基因序列與斯卑爾脫小麥的AJ130948,圓錐小麥的DQ140351,栽培一粒小麥的DQ401698的推導氨基酸序列比較注:△表示保守的半胱氨酸殘基,方框中的序列為glia-α毒性多肽Fig.2 The deduced amino acid sequences of Aegilops searsii α-gliadin genes compared with Triticum spelta derived sequence AJ130948; Triticum turgidum derived sequence DQ140351 and Triticum monococcum derived sequence DQ401698Note:△represents conserved cysteine residues.The boxed letters are glia-α toxic epitope
2.2 CD毒性多肽的識別與分析
研究表明,在α-醇溶蛋白中共含有4種毒性多肽,分別為glia-α9,glia-α20,glia-α,glia-α2,它們的分布存在基因組特異性。A基因組編碼的α-醇溶蛋白含有glia-α9和glia-α20,B基因組編碼的α-醇溶蛋白不含有或者僅含有glia-α,而來源于D基因組編碼的α-醇溶蛋白含有三種或者全部4種毒性多肽[6]。對本實驗中獲得的α-醇溶蛋白的毒性多肽進行分析,發現它們都只含有glia-α毒性多肽(表2),符合B染色體編碼的α-醇溶蛋白的特征。

表2 西爾斯山羊草α-醇溶蛋白具有的T細胞抗原表位數量及類型Table 2 Number and type of the four T cell stimulatory toxic epitopes in the α-gliadin from Aegilops searsii
2.3 α-醇溶蛋白聚類分析
將克隆得到的核苷酸序列和Genbank中具有α-醇溶蛋白完整編碼閱讀框的序列進行同源比對,構建Neighbor-joining樹(圖3)。結果顯示,共形成了4個大的分支,分別是A基因組、D基因組、Ss基因組和B基因組編碼的α-醇溶蛋白基因。其中,有兩個Ss基因組基因和D基因組基因親緣關系較近,此外,大多數來源于Ss基因組的α-醇溶蛋白與來源于小麥B基因組的α-醇溶蛋白親緣關系相對較近,但是,二者卻位于兩個不同的分支。
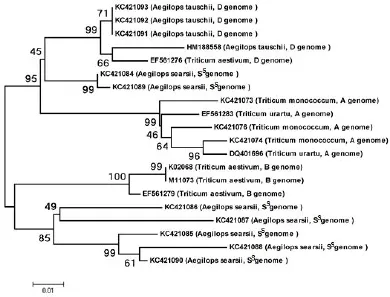
圖3 α-醇溶蛋白基因的系統進化分析Fig.3 Phylogenetic analysis of α-gliadin genes.
2.4 基因的誘導表達與檢測
將登錄號為KC421089的重組質粒轉入宿主菌BL21(DE3)中,挑取單克隆培養,培養物按一定比例接種于選擇培養基,當OD600達到0.6時,加入IPTG誘導劑,然后在37°C條件下誘導表達10 h。用蛋白提取液提取總蛋白進行SDS-PAGE檢測,結果表明,在18.8~35KD之間有一條誘導出的明顯的蛋白條帶,與預測的蛋白分子量大小基本吻合。隨后將其進行切膠純化,得到純度較高的目的蛋白(圖4)。目的蛋白的成功誘導表達及純化,為研究西爾斯山羊草α-醇溶蛋白基因對小麥加工品質的效應奠定了理論基礎。
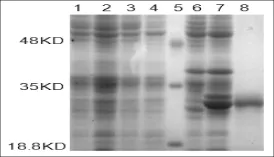
圖4 誘導表達產物和純化產物的SDS-PAGE鑒定分析注:1:未誘導的BL21(DE3);2:誘導后的BL21(DE3);3:未誘導的轉化空載體的菌株;4:誘導的轉化空載體的菌株; 5:Marker;6:轉化重組質粒后未經誘導的菌株;7:轉化重組質粒經誘導的菌株;8:純化的目的蛋白Fig.4Analysis of expressed and purified proteins by SDS-PAGENote:1:Protein of BL21(DE3)without induction;2:Protein of BL21(DE3)induced by IPTG;3:BL21(DE3)with pEASY-E1 without induction;4: BL21(DE3)with pEASY-E1 induced by IPTG;5:Protein molecular weight marker;6:Protein of recombinant plasmid without induction;7:Protein of recombinant plasmid induced by IPTG;8:Purified protein.
3 討論
小麥面筋中常常含有對乳糜瀉病人具有毒性的多肽,這些多肽通過激活人體內免疫系統的T細胞,使人體產生一定的炎癥,從而影響人們的健康。目前,對預防CD的最有效措施是嚴格避免攝入含致敏源的食品。前人研究表明,面筋中含有的CD毒性多肽的種類和數量越多,CD的發病率也越高[16]。Van Herpen等人研究表明,在小麥B基因組中克隆到的α-醇溶蛋白基因序列一般不含有毒性多肽[6],而在本實驗中克隆獲得的來源于Ss基因組的序列都含有glia-α毒性多肽,α-醇溶蛋白中的毒性多肽在Ss基因組和小麥B基因組上存在較大差異,因此,在利用該材料進行小麥新品種培育時,應避免含有毒性多肽α-醇溶蛋白的引入。
前人研究表明,烏拉爾圖小麥是小麥A基因組的供體,粗山羊草是小麥D基因組的供體[17],而關于小麥B基因組的供體目前還沒有定論。一般認為擬斯卑爾脫山羊草單獨或與其近緣植物共同作為小麥B基因組的供體[15]。本研究結果表明,栽培一粒小麥和烏拉爾圖小麥親緣關系較近,粗山羊草與小麥D基因組親緣關系較近,而來源于西爾斯山羊草的α-醇溶蛋白與來源于小麥B基因組的α-醇溶蛋白盡管表現出一定的同源性,但卻分布在兩個不同的分支(圖3),說明Ss基因組可能沒有參與小麥B基因組的進化過程。
蛋白的體外表達為小麥種子貯藏蛋白的功能研究提供了一條有效途徑[11]。蛋白體外摻粉實驗需要將外源的醇溶蛋白添加到基礎面粉中,然后用揉混儀進行測定即可得知其對小麥品質的影響,為研究醇溶蛋白對面粉加工品質的影響提供了更快速、更簡便的途徑。目前,雖然通過克隆獲得了大量的醇溶蛋白基因,但是對其進行功能驗證的研究還相對較少。本研究通過大腸桿菌原核表達以及切膠純化的方法,獲得了純度較高的目的蛋白,初步實現該目的基因的表達,所獲得的表達產物可用于后續的體外摻粉實驗,驗證其對面粉加工品質的影響。
4 結論
4.1 α-醇溶蛋白基因的克隆和序列分析
本研究首次從西爾斯山羊草中克隆得到7個α-醇溶蛋白基因,登錄號分別為KC421084-KC421090;序列分析表明,這7個基因序列都具有α-醇溶蛋白基因家族的結構特征,并且都含有6個半胱氨酸殘基(圖2),系統進化分析表明,栽培一粒小麥和烏拉爾圖小麥親緣關系較近,粗山羊草與小麥D基因組親緣關系較近,而來源于西爾斯山羊草的α-醇溶蛋白與來源于小麥B基因組的α-醇溶蛋白盡管表現出一定的同源性,但卻分布在兩個不同的分支。
4.2 α-醇溶蛋白基因的原核表達
將登錄號為KC421089的西爾斯山羊草α-醇溶蛋白基因與原核表達載體連接,并成功地在大腸桿菌中實現了表達,獲得了與理論值相符的融合蛋白。此外,本實驗還通過切膠純化法獲得了純度較高的目的蛋白,對研究西爾斯山羊草α-醇溶蛋白基因的品質效應提供了理論參考。
[1]郝春燕,李建國,李雅軒,等.小麥醇溶蛋白基因克隆研究進展[J].首都師范大學學報,2006(2):67-70
[2]Shewry P R,Halford N G,Lafiandra D.Genetics of wheat gluten proteins[J].Advances in Genetics,2003(49):111-184
[3]Wieser H.Chemistry of gluten proteins[J].Food Microbiology,2007(24):115-119
[4]Chen F,Xu C,Xia G,et al.A new alpha-gliadin gene family for wheat breeding:somatic introgression line II-12 derived from Triticum aestivum and Agropyron elongatum[J].Molecular Breeding,2008(22):675-685
[5]Gu Y Q,Crossman C,Kong X Y,et al.Genomic organization of the complex alpha-gliadin gene loci in wheat[J]. Theoretical andApplied Genetics,2004(109):648-657
[6]Van Herpen,Goryunova S V,et al.Alpha-gliadin genes from theA,B,and D genomes of wheat contain different sets of celiac disease epitopes[J].BMC Genomics,2006(7):1-13
[7]Metakovsky E V,Akhmedov M G,Sozinov A A.Genetic analysis of gliadin-encoding genes reveals gene clusters as well as single remote genes[J].Theoretical andApplied Genetics,1986(73):278-285
[8]Chiara B,Diana S,Armin A.Celiac disease:from gluten to autoimmunity[J].Autoimmunity Reviews,2008(7):644-650
[9]朱西平,李鑫,李雅軒,等.普通小麥及近緣粗山羊草α-醇溶蛋白基因的克隆、定位與進化分析[J].作物學報,2010,36(4):580-589
[10]Claudia G,Benitez C,Hélène R,et al.Cloning,bacterial expression,purification and structural characterization of N-terminal-repetitive domain of γ-Gliadin[J].Protein Expression and Purification,2006(46):358-366
[11]Ferrante P,Masci S,D'Ovidio R,et al.A proteomic approach to verify in vivo expression of a novel α-gliadin containing an extra cysteine residue[J].Proteomics,2006(6):1908-1914
[12]Stein N,Herren G,Keller B.A new DNA extraction method for high-throughput marker analysis in a large-genome species such as Triticum aestivum[J].Plant Breeding,2001(4):354-356
[14]高慎陽,查恩輝,王珅,等.一種“高性價比”切膠純化原核表達蛋白的方法[J].中國農學通報,2010,26(22):24-26
[15]于在江,馬學恩,周建華.切膠純化表達蛋白包涵體的可行性分析[J].生物技術,2007,17(3):46-48
[16]Anderson O D,Litts J C,Greene F C.The α-gliadin gene family:Ⅰcharacterization of ten new wheat α-gliadin genomic clones,evidence for limited sequence conservation of flanking DNA,and southern analysis of the gene family[J].Theoretical andApplied Genetics,1997(95):50-58
[17]Koining F.Celiac disease:quantity matters[J].Seminars in immunopathology,2012(4):541-549
[18]曹亞萍.小麥的起源、進化與中國小麥遺傳資源[J].小麥研究,2008,29(3):1-10
Cloning and Prokaryotic Expression of α-Gliadin Genes from Aegilops searsii
LIU Guo-juan1,MA Xin1,YIN Hua-yan1,SUN Xin1,DU Xu-ye1,WANG Hong-wei1,LI An-fei1,CHEN Cheng-tao2,KONG Ling-rang1*
1.Agronomy College,Shandong Agricultural University/State Key Laboratory of Crop Biology,Taian 271018,China
2.Agriculture Technology Generalization Station of Tianbao Town Xintai City Shandong Province,Xintai 271200,China
Gliadins are the major influence factors of wheat processing quality,which determine dough extensibility.On the basis of the electrophoretic mobility by acidic polyacrylamide gel electrophoresis,gliadin can be separated into α-,β-,γ-and ω-gliadin.Among them,α-gliadins are the most abundant and accounted for 15%~30%of the wheat storage proteins.On the other hand,α-gliadins can cause different diseases.The present study aimed at cloning and analyzing the α-gliadin genes from Aegilops searsii,expressing it in E.coli and obtaining high purified proteins.The α-gliadin genes were amplified by PCR and then inserted the gene KC421089 into pEASY-E1.The recombinant plasmids were expressed in the E.coli BL21(DE3)and then the purified proteins were obtained by cutting the gel slices.Seven novel α-gliadin genes were cloned from Aegilops searsii.Their length of the open reading frames ranged from 849-954bp,encoding the putative proteins with 282-317 amino acid residues,respectively.A BLAST search showed that these sequences have the typical structure of α-gliadin genes and SNPs and In/Dels.Moreover,the target proteins were expressed by E.coli and highly purified proteins were obtained by cutting the gel slices.Seven novel α-gliadin genes were cloned from Aegilops searsii,and the gene KC421089 were expressed by E.coli and highly purified proteins were obtained by cutting the gel slices.This study laid a good foundation for wheat quality improvement.
α-gliadin;Aegilops searsii;Sequence analysis;prokaryotic expression
S5
A
1000-2324(2015)03-0321-05
2014-04-12
2014-05-07
國家轉基因專項“優質轉基因小麥新品種培育(2011ZX08002004-003)
劉國娟(1987-),女,在讀碩士研究生,主要從事小麥及其近緣植物品質相關基因克隆及功能驗證.E-mail:liuguojuan0814@126.com
*通訊作者:Author for correspondence.E-mail:lkong@sdau.edu.cn

