鎂、鋁合金的腐蝕與防護
馬安博
(西安航空職業技術學院,陜西西安710089)
自然界絕大多數的物質都有變成氧化物或是形成穩定化合物的傾向,除了金、鉑等貴金屬外,自然界中甚少有純金屬存在。因此,從礦石或是氧化物中提煉完成所需的工程材料,例如:鐵、銅、鋁、鎂時,它們就開始有了回歸到穩定狀態的趨勢,在環境許可下,它們會再度變為金屬化合物,這種現象可認為是發生腐蝕的基本原因。這些環境的基本因素有:水分、溫度,或是酸、堿、鹽等化學物質。
腐蝕危害遍及日常生活和幾乎所有行業,包括冶金、化工、能源、礦山、交通、機械、航空航天、信息、農業、食品、醫藥、海洋開發、基礎設施等。因此研究與解決金屬腐蝕問題與防止污染、減輕公害、保證人類健康生存等密切相關。腐蝕給人們帶來了巨大的經濟損失,造成了災難性的事故,消耗了寶貴的自然資源。
1 腐蝕的定義
有關腐蝕的定義有不同的說法。埃文斯認為:金屬腐蝕是金屬從元素態轉變為化合態的化學變化及電化學變化。方坦納認為:金屬腐蝕是金屬冶金的逆過程(圖1 示)。尤力格認為:物質(或材料)的腐蝕是物質(或材料)受環境介質的化學、電化學的作用而被破壞的現象[1]。目前,一致認可的定義是:材料腐蝕是材料受其周圍環境介質的化學、電化學和物理作用下引起失效破壞的現象。金屬腐蝕是金屬與周圍環境(介質)之間發生化學或電化學作用而引起的破壞或變質,如鐵在自然界的腐蝕。非金屬腐蝕是非金屬材料由于在環境介質的化學、機械和物理作用下,出現老化、龜裂、腐爛和破壞的現象(圖2 示)。如涂料和橡膠由于陽光(老化)和化學物質作用引起開裂、鼓泡等現象。這是由于化學鍵在紫外線作用下斷裂而導致失效。
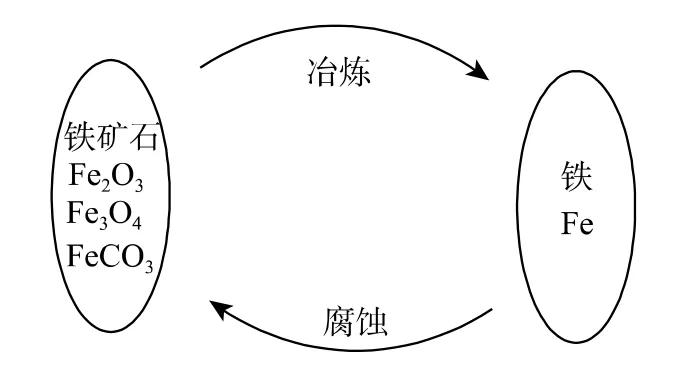
圖1 金屬腐蝕與金屬冶金的關系Fig.1 Relationship of metal corrosion and metallurgy
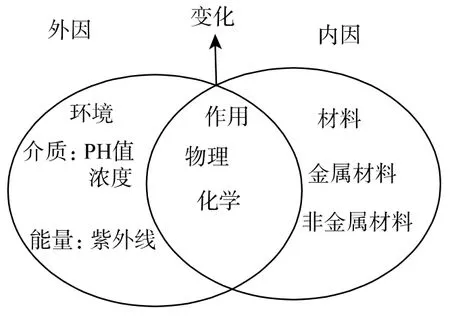
圖2 材料腐蝕與環境因素的關系Fig.2 Relationship of corrosion and environmental factors
人類很早都開始了對腐蝕及防護技術的研究。早在兩千多年前,我們中華民族就創造了與現代鉻酸鹽(或重鉻酸鹽)鈍化處理相似的防護技術。金屬腐蝕現象的解釋是首先從金屬的高溫氧化開始的。16 世紀50年代,俄國科學家羅蒙諾索夫指出,沒有外界空氣進入,燒灼過的金屬重量仍保持不變,并證明金屬的氧化是金屬與空氣中最活潑的氧氣所致。1830年,德拉李夫在有關鋅的硫酸溶液的研究中,第一次明確地提出了有關腐蝕的電化學特征的觀點(微電池理論)。1881年,卡揚捷爾研究了酸金屬溶解的電化學本質。20 世紀初確立了腐蝕歷程的基本電化學規律。我國的腐蝕與防護科技工作是在新中國成立之后獲得了很大的發展[2]。
2 腐蝕的基本原理
2.1 電化學腐蝕原理
金屬材料與電解質溶液相互接觸時,在固/液相界面上將發生有自由電子參加的氧化還原反應,導致接觸面處的金屬變為金屬離子、絡合離子而溶解或者生成氫氧化物和氧化物等穩定化合物,從而破壞了金屬材料的性能,這個過程稱為電化學腐蝕。腐蝕原電池的工作原理如圖3 示[3]。
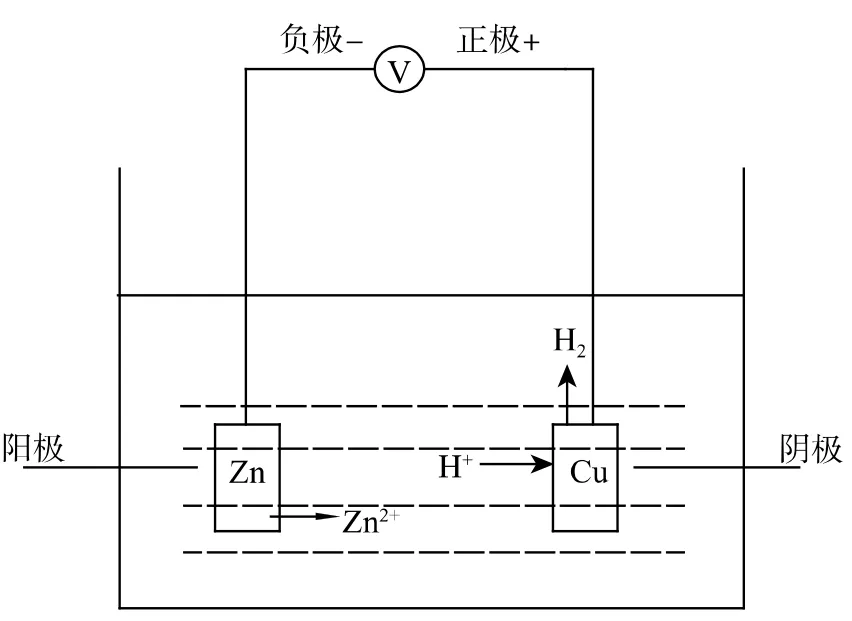
圖3 腐蝕原電池示意圖Fig.3 Schematic diagram of galvanic corrosion
產生電子的反應叫氧化反應;消耗電子的反應叫還原反應。由此可見,腐蝕原電池實質上是一個短路原電池,即電子回路短接,電流不對外做有用功,且只能導致金屬材料的破壞。一個腐蝕電池必須包括陽極、陰極、電解質溶液和外電路四部分。
2.2 高溫氧化和熱腐蝕
金屬的高溫腐蝕是金屬在高溫下與環境中的氧、硫、氮、碳等發生反應導致金屬的變質或破壞的過程。由于金屬腐蝕是一個金屬失去電子的氧化過程,因此金屬的高溫腐蝕也常常廣義地被稱為高溫氧化。熱腐蝕是指金屬材料在高溫工作時,基體金屬與沉淀在表面的熔鹽(主要為Na2SO4)及周圍氣體發生的綜合作用而產生的腐蝕現象;金屬發生熱腐蝕的特征如圖4 所示[4]。腐蝕產物的外層為疏松的氧化物和熔鹽;次內層為氧化膜;氧化膜下為硫化物。
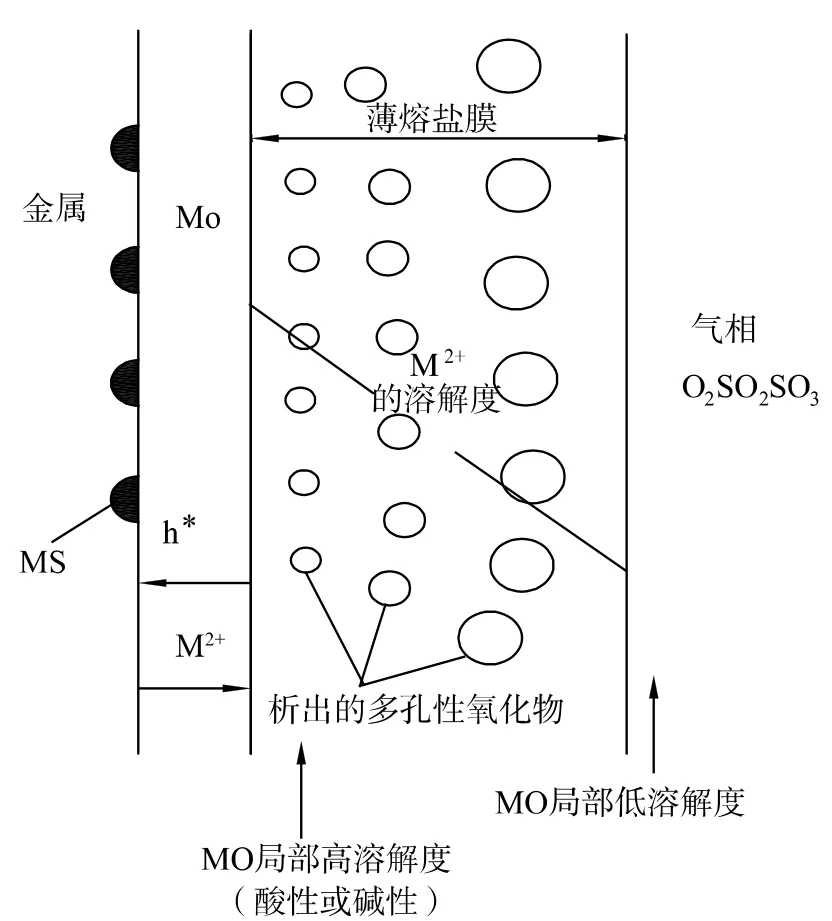
圖4 金屬熱腐蝕示意圖Fig.4 Schematic diagram of metal thermal corrosion
根據產生熱腐蝕的溫度不同,可將它分為高溫熱腐蝕和低溫熱腐蝕兩類。高溫熱腐蝕是指溫度超過鹽膜的熔點的熱腐蝕,此時沉積的鹽膜處于熔融狀態,通過氧化膜的裂紋和孔硫化基體金屬,加速金屬的氧化,其典型的纖維組織是由于形成硫化物而耗盡基體中參與反應的元素。低溫熱腐蝕是指發生在溫度低于鹽膜熔點的熱腐蝕。這時雖然從溫度上鹽膜未達到熔點,但是由于金屬的硫化物的熔點較低,容易生成熔點更低的金屬-金屬硫化物共晶體,同樣使表面局部鹽膜成為熔融狀態,加速了腐蝕。
3 鋁鎂合金微弧氧化對耐蝕性能的影響
對鎂鋁合金的防腐保護包括表面改性和防護性膜層或涂層。表面改性主要是指離子注入和激光處理兩種方法;防護性的膜層或涂層包括電沉積涂層、轉化膜、陽極極化、氫化物涂層、有機涂層和氣相沉積[5]。
下面以鎂合金為例,在以鎂合金為主耗材之一的輕量化制造已引起相關產業高度關注,但由于鎂的電極電位很低,在潮濕氣氛中與其它高電位金屬接觸時,極易產生接觸腐蝕,而鎂合金的電極電位更低,更易產生腐蝕[6];同時,由于金屬表面不平整,存在由雜質構成的陰極相,因此在潮濕的氣氛中極易發生電化學反應,形成點腐蝕,所以鎂合金在生產實踐中的應用受到很大限制。鎂合金作為結構材料或殼體材料時,不可避免要與其它金屬材料相接觸,發生連接腐蝕,必須采取可靠的表面防護措施。
通常所說的接觸腐蝕就是指連接腐蝕,即在腐蝕介質環境(可以為大氣、電解液、潮濕環境等)下,材料由于接觸致使材料失去原有的性能與表面形態所形成的腐蝕。接觸腐蝕中基體材料與附著物或不同電位材料的直接接觸或電連接,形成電偶對或形成狹窄縫隙是接觸腐蝕的前提條件。按照腐蝕機理來分,接觸腐蝕包含電偶腐蝕、縫隙腐蝕以及電偶腐蝕與縫隙腐蝕共同作用三種情況。
由于鎂合金中通常含有較多電極電位較高的重金屬等組元(特別是Fe、Cu、Ni),而且鎂及其合金在實際應用中經常與其它高電位金屬(如鋼、銅等)接觸,產生縫隙或電極電位差,易形成腐蝕電池,發生電偶腐蝕或縫隙腐蝕。實際應用中常常忽視鎂合金組合件的電偶腐蝕而造成的災難性破壞已成為鎂合金結構應用的障礙。例如,在海洋環境中,電偶腐蝕除了可加速鎂合金構件腐蝕外,還可誘發點蝕、縫隙腐蝕、應力腐蝕等工程中更嚴重的腐蝕破壞。通常鎂基體中與陰極相鄰的局部區域都會產生嚴重腐蝕,陰極可能是外部與鎂合金相接觸的其它金屬,也可能是鎂合金內的第二相或雜質。在鹽水環境中,通過嚴格控制雜質含量如Fe、Ni、Cu及Fe-Mn 比可以減輕內部腐蝕,提高鎂合金抗腐蝕性能。
為了避免鎂合金發生嚴重的接觸腐蝕,必須采取如下措施:(1)選擇與鎂電化學相容的異金屬或在鎂基體上鍍一層與鎂電化學相容的金屬;(2)采用適當的表面處理對鎂和異金屬進行保護;(3)異金屬加絕緣的墊圈或填充填料,避免出現封閉回路;(4)設計合理的結構,避免“大陰極小陽極”的結構;(5)在封閉化合物或底漆中加入鉻酸鹽,抑制微電池作用。
目前采取的防腐措施主要是通過微弧氧化工藝處理鎂、鋁合金制品,使其表面生成一層與基體以冶金方式結合的氧化鎂或氧化鋁為主的陶瓷層,陶瓷制的高硬度、高阻抗和高穩定性滿足鎂合金抗高溫腐蝕、連接(電偶)腐蝕、擦傷腐蝕及鋁合金防海水腐蝕、高溫熱蝕和改善耐磨等性能要求。
[1]肖紀美,曹楚南. 材料腐蝕學原理[M]. 北京:化學工業出版社,2002.
[2]何業東,齊慧濱. 材料腐蝕與防護概論[M].北京:機械工業出版社,2005.
[3]趙麥群. 金屬的腐蝕原理與測試技術[M]. 機械工業出版社.
[4]王登峰. 高電位鎂犧牲陽極的研究[D]. 太原理工大學碩士學位論文,2006.
[5]張榮發,單大勇,陳榮石,等. 微弧氧化在提高鎂合金耐蝕性上的應用[J]. 材料工程,2007.
[6]張志富. 鎂合金的腐蝕與防護的研究[D]. 西北工業大學碩士學位論文,2004.

